负载槲皮素的大麦醇溶蛋白纳米纤维的制备及性质
2017-12-07玛丽哈巴拜克来
玛丽哈巴·拜克来 管 骁 刘 静 李 森 吴 雪
(上海理工大学医疗器械与食品学院1,上海 200093) (上海海事大学信息工程学院2,上海 200135)
负载槲皮素的大麦醇溶蛋白纳米纤维的制备及性质
玛丽哈巴·拜克来1管 骁1刘 静2李 森1吴 雪1
(上海理工大学医疗器械与食品学院1,上海 200093) (上海海事大学信息工程学院2,上海 200135)
利用静电纺丝技术,制备了不同载药量的槲皮素/大麦醇溶蛋白载药纳米纤维膜体系,以期成功开发一种功能活性物质的缓释体系。扫描电镜结果显示槲皮素分子很好地分散于大麦醇溶蛋白分子中,随着槲皮素质量分数的增加,纤维直径逐渐降低。X射线衍射结果表明槲皮素几乎以无定形状态存在于纤维中,负载量过高时,有部分未溶解槲皮素晶体析出。利用差示扫描量热仪和傅里叶变换红外光谱仪测试载药纤维膜的结构特征,结果表明槲皮素和大麦醇溶蛋白之间存在相互作用。体外释放试验结果表明大麦醇溶蛋白纳米纤维可实现槲皮素缓释12 h。由此表明本研究开发的大麦醇溶蛋白纳米缓释系统具有良好的应用价值。
大麦醇溶蛋白 槲皮素 静电纺丝 纳米纤维 表征
静电纺丝是一个简单而有效的制造纳米纤维的技术,它基于将高电压两端连接于含有聚合物溶液的注射器针头和导电接收端[1],以其低耗并能够连续生产纳米级纤维,而受到广泛研究。电纺得到的纳米纤维具有比表面积大、均一性高、孔隙率高且孔径之间连通性好等优良性能,同样是一种方便的技术用以将生物活性物质负载进纤维以获得多功能纳米纤维膜[2-3]。静电纺纳米纤维膜被认为在许多领域都将有巨大的应用潜力,如医药、过滤、化妆品、食品工业等[4]。
由于静电纺纤维材料主要是合成聚合物,造成其在食品、农业和其他相关领域发展缓慢。在最近几年中,可生物降解、可再生和具有良好生物相容性的天然聚合物,如蛋白质、糖类和脂类作为电纺天然功能性纳米纤维材料引起了人们的重视。这些再生纳米纤维材料可能是无毒、可食用和可消化的。
蛋白质是构成人体的重要组成部分,安全无毒性、生物相容性好,是作为药物缓释载体的优良选择[5]。蛋白质的电纺先前已有过相关的研究报导,但由于制得的纳米纤维膜较差的拉伸强度和耐水性,在很大程度上制约了其应用。谷物醇溶蛋白的研究引起了人们广泛的兴趣,其作为电纺的天然聚合物材料,可以用于制造具有成本效益的纳米纤维。大麦醇溶蛋白是大麦中的主要贮存蛋白,是从大麦中提取的疏水性蛋白质,可从淀粉加工副产物、啤酒酒糟中大量获得,然而,很少在人类食品中使用。主要由于其非极性氨基酸残基含量高,导致其在水中溶解度低造成的。但是,这些分子特性使醇溶蛋白成为天然的耐水、耐油性材料。除了良好的生物降解性和生物相容性外,醇溶蛋白还具有低亲水性、良好的弹性和成膜性。
槲皮素是被广泛使用的黄酮类物质之一。它存在于许多食物和植物中,如苹果、茶、荞麦和洋葱等。槲皮素由于其生物化学活性引起了科学界的兴趣,如消炎、抗过敏、预防癌症和用于治疗前列腺慢性感染,同时还可以用于提高耐力和运动性能。但是,由于其水溶性较差、光、氧不稳定性,限制了其使用[6]。
通过包封技术,活性物质的有效特性可以得到保护。在最近的研究中,通过电纺技术包封抗氧化剂和益生菌,说明电纺作为多功能的微米和纳米封装技术制造功能性食品或作为药物递送载体具有巨大的潜力。电纺在包封中最具有吸引力的优点在于它不需要苛刻的实验条件,无论是温度还是使用的溶剂,其形成的包封纤维尺寸小,并具有高包封率。将药物溶于聚合物纺丝溶液中,纺丝过程中,由于溶剂的快速挥发,药物将以极小的颗粒存在于聚合物纤维中。超细纤维作药物的载体,具有很高的比表面积,可以提高药物在水中的溶解速率,尤其是水中溶解度较低的药物,从而大大提高了药物的生物利用率。静电纺丝制备的纳米纤维可以用作亲水性药物或憎水性药物的载体,并且可以通过调节纤维或支架的形态、多孔性和成分比例等来控制药物的释放速度。
前期研究了电纺大麦醇溶蛋白制备微米纳米级结构的可行性,并优化制备条件。然而,还鲜有利用大麦醇溶蛋白纳米纤维作为生理活性物质载体材料方面的研究。在本试验中,槲皮素作为模型功能性成分,研究使用静电纺丝作为一种封装技术,制备和表征大麦醇溶蛋白/槲皮素复合纳米纤维,分析加入不同质量分数的槲皮素对大麦醇溶蛋白纳米纤维结构和性质的影响。运用扫描电镜(SEM)观察制备载药纤维的形貌,分析药物与纤维结合的方式。利用傅里叶变换红外光谱仪(FTIR)测试载药纤维膜的结构特征,分析药物化学性质的变化。运用热重分析仪(TGA)和差示扫描量热仪(DSC)分析药物和载药纤维的热学性能及相互作用关系。运用 X-ray 衍射仪(XRD)来分析药物在纤维中的分布状态,并分析其药物释放性能。本研究的目的是提高大麦资源、难溶性药物的生物利用度,并起到缓控释放的作用,开辟了活性物质保护载体材料的新途径。
1 材料与仪器
1.1 材料与试剂
大麦醇溶蛋白(纯度92.6%):自制;槲皮素(纯度≥98%):上海融禾医药科技发展有限公司;正己烷、无水乙醇、异丙醇、冰醋酸、氢氧化钠、磷酸二氢钾、氯化钠,均为分析纯:国药集团化学试剂有限公司。
1.2 主要仪器和设备
静电纺丝机:实验室自组装;WFJ7200型可见分光光度计:龙尼柯(上海)仪器有限公司;Quanta x50 FEG 扫描电镜:FEI公司;Nicolet 6700傅里叶变换红外光谱仪:美国Thermofisher公司;J-20XP冷冻离心机:BECKMAN COULTER公司;Millrock Laboratory Series冻干机:Millrock Technology公司; D/Max 2000 PC全自动X射线衍射仪;热重分析仪PYRIS1 TGA:美国珀金埃尔默仪器公司;差式扫描量热仪Q2000:美国TA公司;DZF-6050电热真空干燥箱:上海精宏实验设备有限公司。
2 试验方法
2.1 大麦醇溶蛋白/槲皮素纳米纤维膜的制备
纺丝液的配制:将一定质量的大麦醇溶蛋白粉末溶于冰乙酸配制成浓度为15%(m/V)大麦醇溶蛋白乙酸溶液,将质量分数为5%、10%、15%(相比于大麦醇溶蛋白粉末质量)的槲皮素加入蛋白溶液中,磁力搅拌完全溶解至均一液体。
纳米纤维膜的电纺制备:静置数分钟后取 5 mL 溶液加入进样器中利用静电纺丝机进行电纺,将注射器水平固定在注射泵上,直流高压电源正极连接到注射器上的针头,负极与接地铝箔片接收集相连。电纺参数:纺丝速率1.0 mL/h;接收距离13 cm;纺丝电压15 kV。室温下连续收集纤维膜至一定厚度后取下,置于真空干燥箱中干燥以备用。
2.2 纳米纤维膜形貌表征及性质测试
形貌观察:电纺丝纤维的形态通过场发射扫描电子显微镜进行分析。样品分析前进行喷金处理。电镜加速电压15kV,基于所得SEM图像,使用Image J 软件测量所制备的纤维直径,每个样品中至少测量50根纤维并取平均值。
傅里叶变换红外光谱分析:试样纳米纤维经压片后进行衰减全反射傅里叶变换红外光谱分析,波数范围为400~4 000 cm-1,分辨率为4 cm-1。
热重分析法:用热重分析仪(TGA)测定槲皮素和电纺纤维的热性能。在氮气保护下使用PYRIS1 TGA设备(25 mL/min的速率)以10 ℃/min的加热速率从50 ℃升至600 ℃的进行TGA分析。
差示扫描量热法:称取大约 4~5 mg大麦醇溶蛋白纳米纤维、槲皮素-大麦醇溶蛋白复合纳米纤维进行差示扫描量热分析。条件为:用氮气为氛(静态),以空铝盒作为参比,升温速率为10 ℃/min,从室温加热到250 ℃。
物理形态分析:利用X射线衍射仪(XRD)对槲皮素以及槲皮素-大麦醇溶蛋白电纺丝纤维的物理状态进行了研究。以CuKa射线(λ=1.54 nm)为靶材,功率为40 mV、300 mA,扫描速度为5(°)/min,2θ的扫描范围为5°~60°。
2.3负载槲皮素大麦醇溶蛋白纳米纤维的释放行为
称取负载不同质量分数槲皮素的大麦醇溶蛋白纳米纤维膜各10 mg,平行称取3组。将上述纳米纤维膜放入到装有 50 mL PBS 缓冲溶液 (pH=7.4)的锥形瓶中,锥形瓶放置在恒温水浴(37 ℃) 摇床中,转速设为 100 r/min,在设定的时间间隔内取 1.0 mL 的释放液,在并补加1.0 mL PBS 缓冲溶液到锥形瓶,保持体积恒定,在槲皮素的最大吸收波长375 nm处测定吸光值,再对应标准曲线方程计算药物浓度及释药量,然后计算累积释药百分率并作累积释药曲线。
3 结果与讨论
3.1 大麦醇溶蛋白/槲皮素复合纤维形貌分析
图1为不同含量槲皮素的大麦醇溶蛋白静电纺纳米纤维扫描电镜照片。在扫描电镜照片中几乎观察不到槲皮素的结晶颗粒,这表明,槲皮素大部分被包埋在纤维内部,也有部分与纤维均匀共混。负载槲皮素质量分数为5%、10%、15%复合纳米纤维的平均直径分别为1 088、1 076、854 nm,结果表明随着槲皮素含量的增加,复合纳米纤维的平均直径变得越来细,随着槲皮素含量的增加,纤维直径分布范围变大。可能是由于槲皮素的加入增加了溶液的电导率,增加了喷射流表面电荷密度,从而使喷射流载有更多的电荷,导致电纺射流不稳定鞭动,喷射细流被高度拉伸从而产生更细的纤维,另一方面如果电荷太多,分布不匀将会出现黏连和分支。
随着槲皮素含量的增加,纤维膜颜色加深;在扫描电镜照片中,制得的是光滑均匀的纤维,确定了在电纺过程中没有发生相分离,槲皮素良好地分散于纤维中,部分被包埋在纤维的内部,部分与纤维共混。

图1 不同含量槲皮素的大麦醇溶蛋白/槲皮素静电纺纳米纤维的SEM照片
3.2 复合纤维红外光谱分析
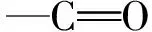
学生写作语言的形成,不仅是来自于其平时的语文知识积累,同时也是其生活经验的一种积累。著名作家老舍、莫言等人的文章中,之所以具有着深厚的生活韵味,就是其平时对生活中的点滴感悟而形成的一种醇厚语言形式。这也进一步说明了实际生活对于丰富学生写作语言的重要性。在平时的教学中,教师应当善于引导学生对于自身生活的一种总结与感悟,这样可以有效的让学生写作语言富有生活情怀,提高文章的深度。
负载槲皮素的大麦醇溶蛋白红外光谱图如图2中b~d所示,观察到槲皮素的特征峰几乎都发生了转移、强度降低。在载药纤维中属于槲皮素的在1 243、1 200、1 167cm特征吸收峰强度也有不同,明显随着槲皮素在载药纤维中的比例增加,这些吸收峰逐渐增强。

注:a大麦醇溶蛋白纳米纤维,b 5%,c 10%,d 15%,e 槲皮素。图2 大麦醇溶蛋白纳米纤维及不同含量槲皮素的大麦醇溶蛋白/槲皮素静电纺纳米纤维傅里叶红外光谱图
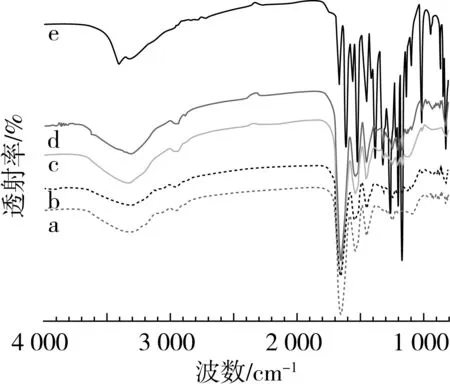
图3为槲皮素和电纺纤维的X射线衍射图案。槲皮素XRD衍射谱图中存在许多尖峰,表明在衍射角为2θ时,槲皮素是具有一定晶型的晶体材料,在6.3°、10.8°、12.5°、23.9°等地方出现特征衍射峰。为了观察电纺过程对槲皮素和大麦醇溶蛋白物理状态的影响,将大麦醇溶蛋白和槲皮素粉末以100∶15的比例混合并进行扫描,物理混合物在10.8°、12.6°、27.4°出现特征衍射峰,表明槲皮素在混合物中依然以结晶状态存在,并没有形成新的物理状态。
大麦醇溶蛋白的图案为宽的衍射峰,表明其为无定形态,静电纺丝后槲皮素衍射峰消失,表明槲皮素分子由结晶态变为无定形态药物,与载体之间发生了一定的复合作用,槲皮素和大麦醇溶蛋白分子间存在相互作用,若没有相互作用,则每种成分会在衍射峰图中显示出自己的晶区特征峰,不会有峰叠加的效果。然而,当电纺纤维负载质量分数为15%的槲皮素时,存在部分强度较低的槲皮素晶体衍射峰,也许这是由于过量的槲皮素不能完全溶解在溶剂系统中造成的, Kayaci等[12]的研究中也有类似结果。
注:a大麦醇溶蛋白粉末,b 大麦醇溶蛋白纳米纤维,c 5%,d 10%,e 15%,f 槲皮素。图3 大麦醇溶蛋白粉末、纳米纤维及不同含量槲皮素的大麦醇溶蛋白/槲皮素静电纺纳米纤维X射线衍射图
3.3 复合纤维热性能分析
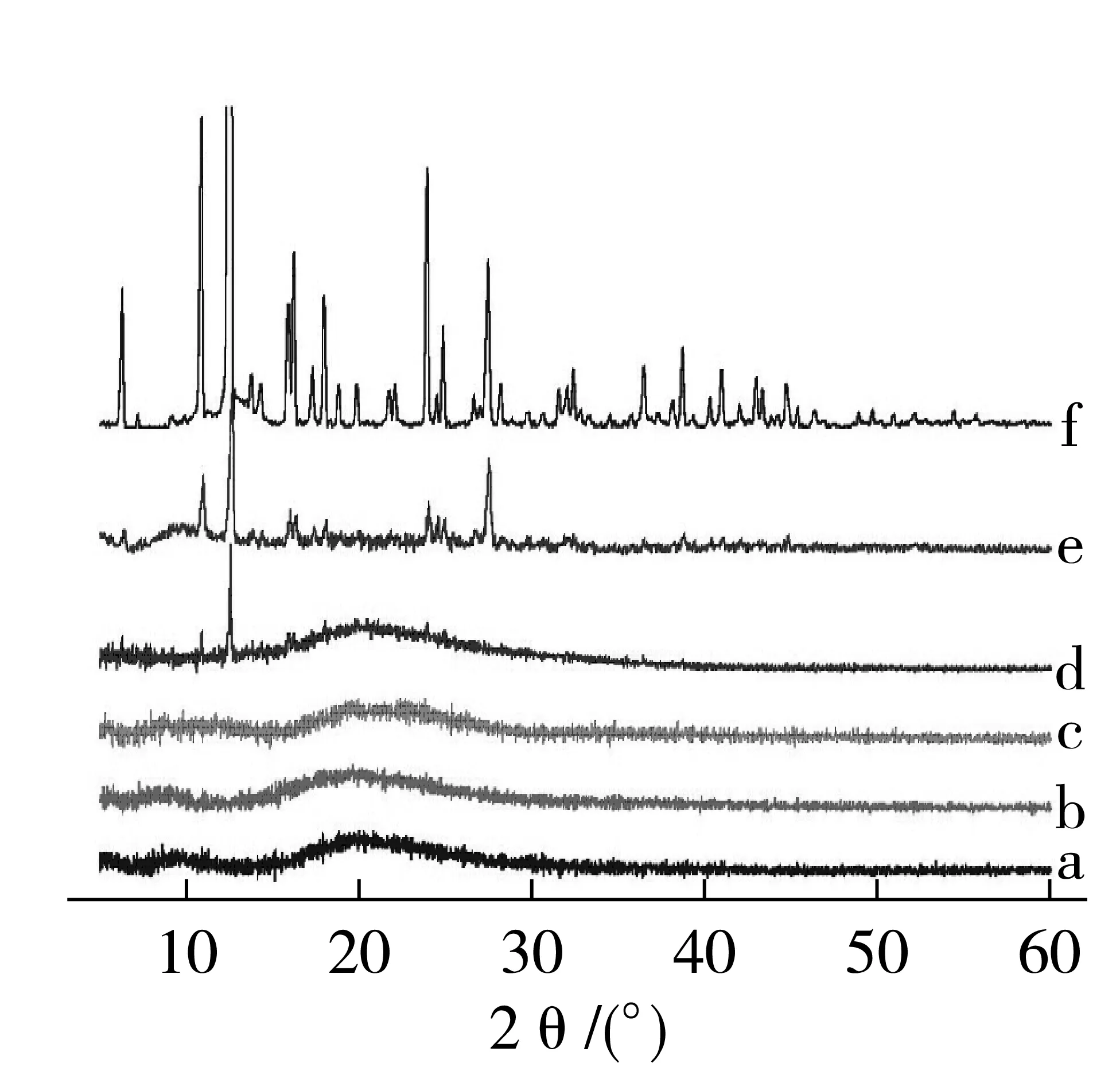
图4为槲皮素和载药复合纤维的热重(thermogravimetric TG)和微分热重(derivative thermogravimetric DTG)曲线,从图4可以看到槲皮素热重曲线上出现了2个失重峰,第1次失重出现在102 ℃附近,此时的失重多是水分蒸发引起的,356 ℃处的失重峰为槲皮素的分解引起的。可以从图中获悉槲皮素在50~600 ℃的总失重率为70%,而在290~400 ℃范围内失重率达到45%,说明槲皮素失重主要是在此范围,通过DTG的峰形可以进一步确定槲皮素开始热分解的温度在300 ℃之前。纯大麦醇溶蛋白纳米纤维曲线表明其主要失重发生在250~410 ℃范围内,跟蛋白质降解有关,由DTG曲线可知大麦醇溶蛋白分解温度约为325 ℃。
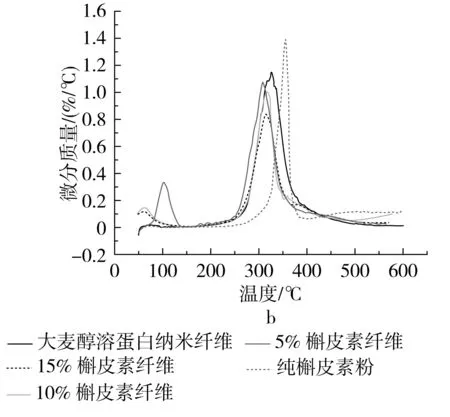
图4 大麦醇溶蛋白纳米纤维及不同含量槲皮素的大麦醇溶蛋白/槲皮素静电纺纳米纤维热重(TGA)和微分热重(DTG)曲线
负载槲皮素的大麦醇溶蛋白复合纤维质量损失随着槲皮素质量分数的增加而减少,可能是由于槲皮素比例的增加,其与蛋白质之间相互作用增加,难以分解,因此残留的质量也就更多,导致了较高的稳定性。负载槲皮素的大麦醇溶蛋白纳米纤维降解温度与纯大麦醇溶蛋白纳米纤维相比稍有降低。
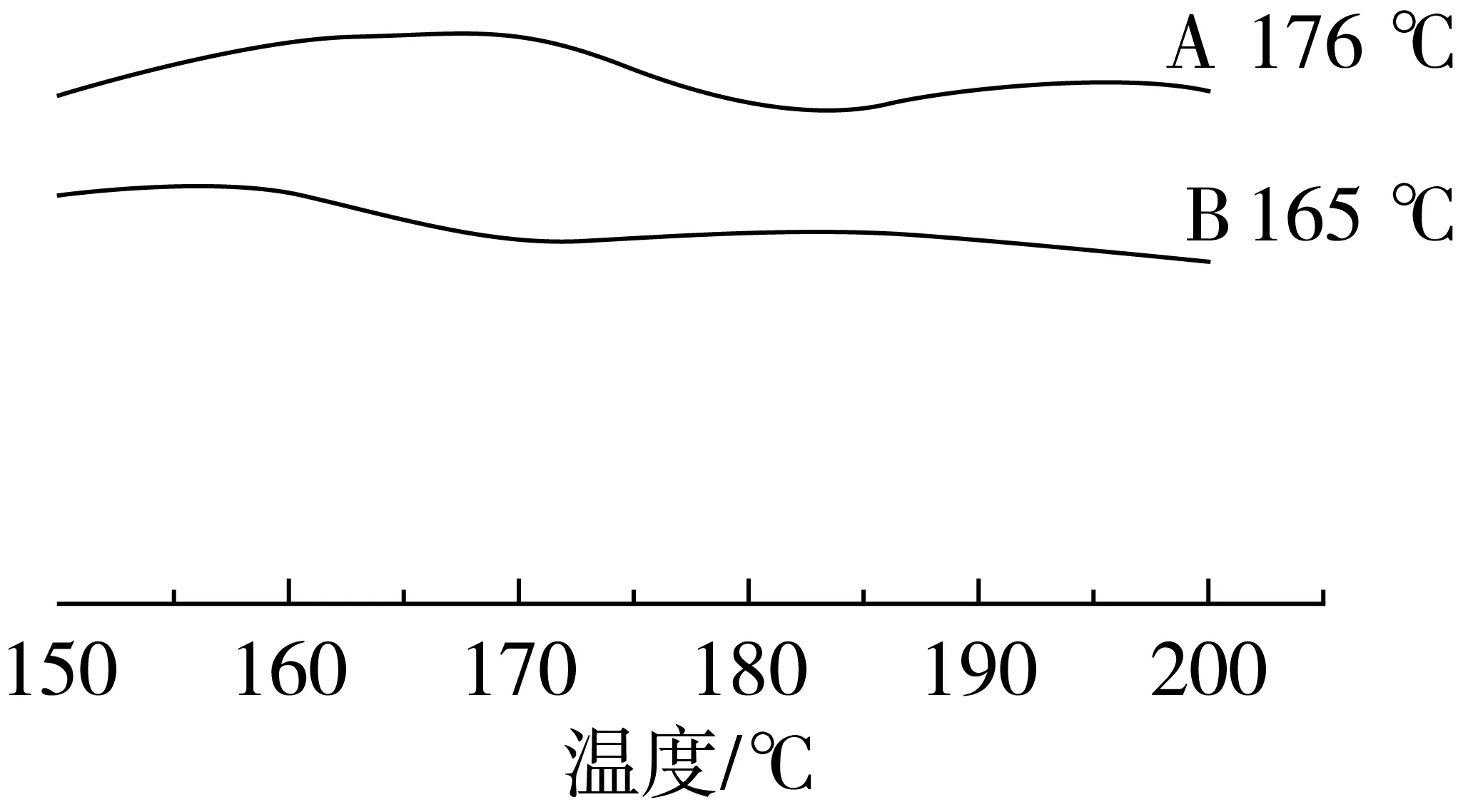
图5 大麦醇溶蛋白纳米纤维及10%含量槲皮素的大麦醇溶蛋白/槲皮素静电纺纳米纤维差示扫描量热(DSC)曲线
差示扫描量热法在高分子热行为研究中得到广泛应用。玻璃化转变温度是高分子的链段从运动到冻结或反之的一个转变温度,链段的运动是通过主链的内旋转来实现的,显然玻璃化转变温度取决于聚合物的柔顺性。
槲皮素与大麦醇溶蛋白之间产生了氢键作用。在形成槲皮素-大麦醇溶蛋白纳米纤维以后,体系的玻璃化转化温度由176 ℃降低到165 ℃,这可能是由于槲皮素作为一种低分子质量的化合物,在聚合物高分子链之间起到了连接作用,减少了肽链之间的联系,促进了肽链的流动性[15]。因此,可以推论槲皮素分子化地分散在大麦醇溶蛋白基质中。
3.4 复合纳米纤维释放性能研究
研究了所制备的含有槲皮素的大麦醇溶蛋白纳米纤维的体外药物释放性能,由于静电纺丝过程中几乎没有药物损失,近似认为所制备的载药纤维中药物理论含量与实际含量相同。以药物质量分数为5%、10%、15%的载药纤维b、c和d为研究对象,进行了体外药物释放试验。
图6为槲皮素在 37℃下的释放曲线,前1 h 3种载药纤维的药物释放速率远大于后面的释放速率,具有初期突释效应。释放总量分别为 55.1%、 61.1%、73.7%。随着纤维膜中含量的增加,药物的初期突释效应也变得明显。所有曲线都表现出一定的突释现象,可能是纳米纤维表面吸附的药物分子溶解在缓冲溶液中,最终导致测试开始时存在一个快速释放期。另外,随着载药量增加,释药速率和累积释药百分率均依次增大,3种药物均呈现此规律。一是因为载药量大的纤维单位体积内药物含量多,纤维内药物浓度大,药物扩散浓度梯度大,这就更有利于纤维上的药物扩散溶解到释放介质中。二是因为载药量大的纤维,纤维直径减小,所以其比表面积增大,纤维与缓冲溶液的接触面积增大,所以药物释放量增多。

注:a 5%,b 10%,c 15%。图6 复合纤维中槲皮素体外释放曲线
由于纤维膜在水中是逐渐溶胀的,槲皮素无论是以分子水平分散在载体中,还是以固体颗粒形式存在,释放是由纤维膜在水中的溶胀控制的。而大麦醇溶蛋白纳米纤维膜具有较高的比表面积,以固体溶液或极小的晶体颗粒形式存在于其中的槲皮素,扩散路径相对较短,与释放介质的接触面积大,释放速率都较高。药物释放的速率随着药物含量的增加而增大。
通过数学模拟,发现载药量不同的复合纤维药物释放规律都是相同的,即符合Peppas模型。载药量为5%、10%、15%的拟合方程分别为Q=57.7t0.17(R2=0.96),Q=64.4t0.15(R2=0.92),Q=75.9t0.12(R2=0.87)。
一般认为,当n≤0.43时,药物的释放机理为 Fick 扩散;当 0.43
即开始释放较快,后期释放较慢。开始释放快是由于药物在纤维表面有分布,通过扩散的方式释放出来,后期释放慢,是由于分布在纤维内部的药物要克服聚合物分子链的阻碍才能到达缓冲液中,其释放速度自然不会太快。
4 结论
应用静电纺丝技术,以槲皮素为模型药物,以大麦醇溶蛋白为载体高分子材料,制备出载药量不同的槲皮素/大麦醇溶蛋白载药纳米纤维膜。SEM结果显示药物分子很好地分散于大麦醇溶蛋白分子中,随着槲皮素质量分数的增加,纤维直径逐渐降低。当载药量过高时,有少许晶体析出。DSC和傅里叶变换红外光谱仪测试载药纤维膜的结构特征,表明槲皮素和大麦醇溶蛋白之间存在相互作用。XRD结果表明槲皮素几乎以无定形状态存在于纤维中,负载量过高时,有部分未溶解晶体析出。体外释放试验结果表明大麦醇溶蛋白纳米纤维有明显的初期突释现象,随着槲皮素质量分数提高突释现象更明显,对释放曲线进行拟合,表明载药纳米纤维最符合Peppas模型,释放药物特征最符合扩散机制。
[1]Torres-Giner S, Gimenez E, Lagaron J M. Characterization of the morphology and thermal properties of Zein Prolamine nanostructures obtained by electrospinning [J]. Food Hydrocolloids, 2008, 22:601-614
[2]Neamnark A, Ratana R, Supaph P. Electrospinning of hexanoyl chitosan[J]. Carbohydrate Polymers, 2006(66):298-305
[3]Stegemann J P, Kaszuba S N, Rowe S L. Review: Advances in vascular tissue engineering using protein-based biomaterials [J]. Tissue Engineering, 2007, 13 (11): 2601-2613
[4]Chan G, Mooney D J. New materials for tissue engineering: towards greater control over the biological response [J]. Trends Biotechnology, 2008, 26 (7): 382-392
[5]Nieuwland M, Geerdink P, Brier P, et al. Food-grade electrospinning of proteins [J]. Innovative Food Science and Emerging Technologies, 2014,24:128-134
[6]Zhang L M, Yang X, Li Shan, et al. Preparation, physicochemical characterization and in vitro digestibility on solid complex of maize starches with quercetin [J]. LWT-Food Science and Technology, 2011,44(3), 787-792
[7]谢孟峡,刘媛. 红外光谱酰胺Ⅲ带用于蛋白质二级结构的测定研究[J]. 高等学校化学学报,2003, 24(2):226-231
Xie M X, Liu Y. Studies on AmideⅢ infrared bands for the secondary structure determination of proteins[J]. Chemical Journal of Chinese Universities,2003, 24(2):226-231
[8]邢本刚, 梁宏. FT-IR在蛋白质二级结构研究中的应用进展[J]. 广西师范大学学报, 1997,15(3):46-48
Xing B G, Liang H. Progress of fourier transform ation infrared spectroscopy research on secondary structures of proteins[J]. Journal of Guangxi Normal University, 1997,15(3):46-48
[9]王守文,黄光琳, 马洪,等. 聚乙烯醇辐射损伤的红外光谱研究[J]. 化学研究与应用,1999,11(4):374-377
Wang S W,Huang G L,Ma H, et al. A study on radiat ion dam age of poly( vinyl alcohol) by infrared spectroscopy[J]. Chemical Research and Application, 1999, 11(4): 374-377
[10]Subramanian S, Sampath S. Adsorption of zein on surfaces with controlled wettability and thermal stability of adsorbed zein films[J]. Biomacromolecules, 2007, 8(7): 2120-2128
[11]Gupta D, Venugopal J, Mitra S, et al. Nanostructured biocomposite substrates by electrospinning and electrospraying for the mineralization of osteoblasts[J]. Biomaterials, 2009, 30(11): 2085-2094
[12]Kayaci F, Uyar T. Electrospun zein nanofibers incorporating cyclodextrins[J]. Carbohydrate Polymer, 2012, 90(1):558-568
[13]Neo Y P, Ray S, Jin J, et al. Encapsulation of food grade antioxidant in natural biopolymer by electrospinning technique: a physicochemical study based on zein-gallic acid system[J]. Food Chemistry, 2013, 136(2):1013-1021
[14]Aceituno-Medina M, Mendoza S, Lagaron J M,et al Development and characterization of food-grade electrospun fibers from amaranth protein and pullulan blends[J]. Food Research International, 2012,54(1), 667-674
[15]管骁,刘静,殷婷, 等. 复合纳米颗粒中白藜芦醇-大麦醇溶蛋白相互作用研究[J].光与光谱学分析,2016,36(1):163-168
Guan X, Liu J, Yin T, et al. Study on the interaction in resveratrol-hordein nanoparticle[J]. Spectroscopy and Spectra Analysis,2016,36(1):163-168
[16]袁伟栋,孙进,何仲贵. 格列吡嗪缓释微丸的制备及体外释放度考察[J].中国药剂学杂志,2009, 7(6):409-416
Yuan W D, Sun J, He Z G.Preparation and in-vitro release of glipizide sustained-releasepellets[J]. Chinese Journal of Pharmaceutics,2009, 7(6):409-416.
Preparation and Characterization of Quercetin-Loaded Hordein Electrospun Fibers
Malihaba Baikelai1Guan Xiao1Liu Jing2Li Sen1Wu Xue1
(School of Medical Instrument and Food Engineering, University of Shanghai for Science and Technology1, Shanghai 200093) (College of Information Engineering, Shanghai Maritime University2, Shanghai 200135)
Hordein nanofibers loaded with quercetin were successfully prepared by using an electrospinning process in this study. Different amount of quercetin was incorporated into the fibers to develop an encapsulating system for functional ingredient delivery using electrospinning technique. SEM micrographs showed that a homogeneous and defect-free structure of the composite nanofibers was obtained. With the increase of the quercetin content, the diameter of nanofibers decreased gradually. X-ray diffraction analysis suggested that quercetin presented in the composite nanofibers was in an amorphous state. Some undissolved quercetin crystal maybe precipitated when excess content happened. Attenuated total reflection-fourier transform infrared (ATR-FTIR) indicated that the interaction between quercetin and hordein exists. The thermal behavior of quercetin-hordein was investigated using thermogravimetric analyses (TGA), and different thermal stability of the fabricated complex before and after the quercetin incorporation was attested.Invitrorelease assay ensure the efficiency of the developed fibers in sustaining the release of quercetin up to 12 h. This study confirmed the possibility of incorporation of quercetin in the production of bio-nanofibers that will have good potential in multi-purpose applications.
hordein, quercetin, electrospinning, nanofiber, characterization
TS17
A
1003-0174(2017)11-0137-07
上海市自然科学基金(14ZR1419200)
2017-04-07
玛丽哈巴·拜克来,女,1994年出生,本科,食品科学
管骁,男,1979年出生,副教授,食品生物纳米材料
