硅胶柱分离纯化亚麻木脂素工艺的研究
2017-12-07杨宏志周亚男
杨宏志 周亚男
(黑龙江八一农垦大学食品学院,大庆 163319)
硅胶柱分离纯化亚麻木脂素工艺的研究
杨宏志 周亚男
(黑龙江八一农垦大学食品学院,大庆 163319)
依据薄层层析法确定了硅胶柱层析纯化亚麻木脂素的最佳洗脱液为以氯仿、甲醇、醋酸和水的比例为8:4:0.5:0.5组成的体系;硅胶柱上样浓度最佳值为15 mg/mL,洗脱流速为1.0 mL/min分离效果最好;在上述条件下,得到亚麻木脂素纯度可以达到80.13%;检测结果显示:亚麻木脂素粗品经硅胶柱纯化后,通过薄层层析检测显示出现亚麻木脂素单一点,HPLC检测表明经硅胶柱纯化后出现单一峰且其保留时间与标准品保留时间相同,说明纯化后纯度较高。
硅胶柱,分离纯化,亚麻木脂素,工艺
亚麻分为油用亚麻和纤用亚麻。我国油用亚麻主要分布在华北等地,主产区是内蒙古、甘肃、宁夏、河北、山西、陕西、和新疆。我国年种植亚麻50万hm2左右,产量约48万t,在世界排名第二[1-3]。
木脂素主要为开环异落叶松树脂酚二葡萄糖苷(SDG),Bakke等[4]首次从亚麻籽中将亚麻木脂素分离出来。木脂素是一类由双分子苯丙素合成的天然酚类化合物,绝大多数通过侧链β-碳原子聚合而形成。木脂素广泛分布于植物界及多种食物之中,尤其是在整粒的谷物和豆类之中,一般以植物的木质部与树脂中存在的较多,故称为木脂素。尽管许多植物和食物中都含有木脂素,但在亚麻籽中的含量最高,达到6.35 mg/g湿基[5]。
木脂素已经显示出具有抗癌的特性,对早期结肠癌和乳腺癌具有预防作用,并且对肾功能障碍具有潜在的疗效。对绝经妇女而言,木脂素还可降低其血清低密度脂蛋白(LDL)胆固醇的密度,并可减缓更年期综合症[6-7]。
柱层析分离的对象主要是中等分子质量的物质,尤其是复杂的天然物质,这类物质的极性范围很大,对于性质相近的物质,柱层析能够提供很好的分离效果[8]。
柱层析对于制备分离有较大的灵活性和方便性,并且具有分离高、制备量大、成本低等优点,便于放大和实现自动控制。此外,柱层析常用的洗脱剂通常易于挥发,因此也易于从含有欲分离组分的馏分中将其去除[9-10]。
本研究将经过超声波辅助提取得到的木脂素粗提取液分离出来,选择硅胶做柱材,进行柱层析分离纯化其中的SDG,通过对洗脱速度、上样浓度等洗脱条件的考察,最终得出最佳洗脱工艺。
1 材料与设备
1.1 试剂和材料
原料:亚麻木脂素提取物(其中SDG质量分数为34.37%)
SDG(纯度95%)标准品:成都邦成生物工程公司;氯仿、甲醇、冰醋酸、磷钼酸、乙醇、NaOH、盐酸:分析纯,天津大茂化学试剂厂
1.2 试验设备
T6型紫外-可见分光光度计:北京普析通用仪器公司;PC-2250高效液相色谱:天津兰博科技有限公司;DK-450B型电热恒温水浴锅:上海森信试验仪器有限公司;SG2型pH计:上海梅特勒-托利多仪器有限公司;R-200真空旋转蒸发仪、V-500真空泵:BÜCHI;L104型电子天平:Mettler Toledo;层析柱(Ф1.6 cm×20 cm)、层析柱Ф2.0 cm×30 cm:上海精科实业有限公司;硅胶G层析板:青岛海洋有限公司;薄层色谱展开缸XY:上海信谊仪器厂;MLS-3202真空冷冻干燥机:SANYO Electric CO.Ltd;YY1-3系列大孔柱层层析硅胶:青岛裕民源硅胶试剂厂。
2 试验方法
2.1 硅胶的预处理试验
2.1.1 柱材选择
因为硅胶分离具有重复性较好,可再生的特点,作为分离纯化的介质非常合适。硅胶是一种极性不可溶物,利用硅胶吸附层析可以分离非极性、极性等组分。当混合物质通过硅胶时,由于极性物质和荷电物质与硅胶结合紧密,留在柱子上,非极性物质则直接通过柱子,因此非极性物质所需洗脱时间短,极性物质的所需洗脱时间长。非极性物质选用氯仿洗脱液,极性较大的物质可用甲醇洗脱,要进行有效的分离可采用混合溶剂作为洗脱液[11]。
2.1.2 硅胶的活化
本试验采用YY1-3系列大孔柱层层析硅胶,平均孔径12~18 nm,孔容1.05~1.25 mL/g,比表面240~300 m2/g。含水量关系硅胶的活性,由于水的极性大,易于与硅胶活性中心结合以降低活性,因此含水量越高,活性越低。活性太高的物质难以挣脱硅胶吸附,活性太低会造成分离能力的下降,对于不同的体系,需要使用不同活性的硅胶,通过改变含水量来改变硅胶的活性,达到体系的目的。
本试验采用在105 ℃下脱水活化12 h,活化后的硅胶装入干燥器中,封存72 h后备用的硅胶的活化方法。
2.2 柱层析系统的组装试验
2.2.1 装柱
已活化好的硅胶,加入适量氯仿浸泡过夜。用玻璃棒搅拌硅胶,使之悬浮于氯仿中,成为糊状,浆状。然后将浆状料沿着层析柱壁慢慢地倾倒入层析柱中,边搅拌边加,一次加完,利于硅胶沉降。此时注意不要产生气泡,倾倒至离柱顶5 cm处,停止加料,关上活塞,夹住硅胶管,防止柱内液体流出,静止一夜,让硅胶完全沉降。操作时,保证液面不低于硅胶的床层顶面,使用前要对层析柱进行检查,有纹路,有气泡都必须重新装柱[12]。
2.2.2 柱平衡
用洗脱液以一定的流速淋洗硅胶柱,流速应低于层析时所需的流速,在平衡过程中逐渐加大流速。将流出洗脱液,经紫外检测仪检测,检测信号采集基线稳定,说明硅胶柱达到平衡,方可使用。
2.2.3 上样
硅胶柱达平衡后,吸取适量亚麻木脂素粗提浓缩溶液,缓慢加载硅胶床层顶面,一定要尽量减少对床层扰动。
2.2.4 洗脱和收集
上样后打开流出口,让样品渗入硅胶床内,当样品液面与硅胶床表面相平时,加入洗脱液冲洗管壁,使之全部进入硅胶床内,以一定速度洗脱,在流出口选用小试管进行收集,每管10 mL,将收集的洗脱液逐一进行紫外检测器检验。
2.2.5 溶剂回收
将洗脱液浓缩后得到溶剂收集到一起,向其中加入一定量的水充分振荡,利用分液漏斗进行静止分层,下层为氯仿相,上层为甲醇和水的混合相。氯仿沸点61~62 ℃,甲醇沸点为64.7 ℃,将静止分层的两相分别进行旋转蒸发,收集流出液,可以重复使用[13]。
2.3 柱层析洗脱试验的确定
2.3.1 洗脱溶剂的选择
依据薄层层析(TLC)展开剂的展开原则,分别选择,氯仿、甲醇(8:4)体系,氯仿、甲醇、醋酸(8:4:0.5)体系,氯仿、甲醇、醋酸、水(8:4:0.5:0.5)体系,乙酸乙酯、甲醇、水(4:1:5)体系和正丁醇、醋酸、水(6:4:1)5种体系对亚麻木脂素标品和亚麻木脂素提取液进行展开。通过比较样品中的化合物在薄层层析板上的位置用比移值Rf确定最佳展开剂,从而确定硅胶柱层析的最佳洗脱液。
2.3.2 上样浓度的选择
按照确定的最佳洗脱剂,流速控制在2.0 mL/min,进样体积为5 mL,考察了不同浓度的亚麻木脂素上样的柱层析效果。
2.3.3 洗脱流速的选择
按照确定的最佳洗脱剂,亚麻木脂素以一定的浓度进样,进样体积为5 mL,在25 ℃下考察了洗脱剂流速分别为0.5、1.0、1.5、2.0、2.5、3.0、4.0 mL/min时的层析效果。
2.4 柱层析洗脱液的检测
2.4.1 硅胶薄层层析法
按照确定的最佳洗脱剂进行展开,展开方法:用毛细管吸取样品液在距层析板底约1.5 cm处点样,使样点直径不大于0.5 cm,晾干样点后放入装有层析溶剂的层析缸中,盖上层析缸盖,展开约1 h,待溶剂前缘行进至层析板前缘约1 cm处层析结束,取出薄板,用电吹风去除板上剩余溶剂;显色方法:干燥的层析板上,喷5%磷钼酸醇溶液后,吹干,在105 ℃烘烤2 min,亚麻木脂素斑点成蓝紫色,通过和亚麻木脂素标品的比移值相比对,确定样品中的亚麻木脂素。
2.4.2 亚麻木脂素的HPLC分析
2.4.2.1 色谱条件
色谱柱,Hypers(R)ODS2反相柱(柱规格,φ 4.6 mm×250 mm填料:C18)
检测波长:280 nm
柱温:25 ℃
流速:1 mL/min
进样量:20 μL
采用乙腈水(含0.1%的醋酸)体系,洗脱梯度为:
t=0~5 min, B:95%~85%,
t=5~25 min, B:85%~70%,
t=25~40 min, B:70%~30%
A乙腈,B为含有0.1%的醋酸的水。
2.4.2.2 进样
精密吸取样品溶液20 μL,按上述色谱条件进样。测定保留时间和峰面积。
2.4.2.3 计算
对所得样品图谱和亚麻木脂素的标品图谱对比保留时间。参照标准曲线标准曲线:y=422 739x+9 634,R2=0.992 9,求出样品溶液中亚麻木脂素的含量。
将紫外检测器UV 280 nm检测分离的亚麻木脂素组分,绘制淋洗曲线中的峰值的进行薄层层析定性检测,将收集到亚麻木脂素含量较高的小试管中的洗脱液合并,减压浓缩,冷冻干燥。冻干后再用甲醇溶解进行HPLC检测,并计算含量,换算纯度和产率。
SDG的产率=C1/C2×100%
(1)
式中:C1为柱层析后得到亚麻木脂素的量;C2为上样液中亚麻木脂素的含量。
SDG的纯度=S1/S2×100%
(2)
式中:S1为柱层析后测定亚麻木脂素的质量;S2为柱层析后经冷冻干燥得亚麻木脂素的质量。
3 试验结果与分析
3.1 柱层析洗脱试验的试验结果
3.1.1 最佳洗脱剂的确定
氯仿、甲醇(8:4)体系,氯仿、甲醇、醋酸(8:4:0.5)体系,氯仿、甲醇、醋酸、水(8:4:0.5:0.5)体系,乙酸乙酯、甲醇、水(4:1:5)体系和正丁醇、醋酸、水(6:4:1)5种体系的展开结果表明,分别对亚麻木脂素标品和亚麻木脂素提取液进行展开。通过比较样品中的化合物在薄层层析板上的位置用比移值Rf确定最佳展开剂,从而确定硅胶柱层析的最佳洗脱液。结果表明,各种展开剂的比移值Rf在0.24~0.45之间,其中以氯仿、甲醇、醋酸和水的比例为8:4:0.5:0.5的洗脱剂对应的比移值Rf最大,为0.45,因而是薄层层析的最佳展开剂,因此,选定该体系为本试验的洗脱剂。
3.1.2 上样浓度的选择
以氯仿、甲醇、醋酸和水的比例为8:4:0.5:0.5作为洗脱剂,流速控制在2.0 mL/min,上样浓度分别为10、15、20 mg/mL分别进样,进样体积为5 mL。淋洗曲线如图1所示。



图1 不同上样浓度的淋洗曲线
由图1可看出上样浓度过高都不利于不同组分物质的分离,上样浓度超过15 mg/mL时不能将组分很好的分离,上样浓度达到20 mg/mL时不能将目标组分亚麻木脂素与其他组分分开,上样浓度过低洗脱洗脱液中含量过低不利于检测和回收,所以选用上样浓度为15 mg/mL。
淋洗曲线的第二峰位置的洗脱液回收,通过薄层层析的定性检测可以确定是亚麻木脂素,HPLC定性检测结果与薄层层析定性检测结果一致。通过式(1)、式(2)计算出产率和纯度(见表1)。

表1 上样浓度对亚麻木脂素柱层析分离的影响
由表1可以看出随着上样质量浓度的提高,纯度下降。是由于质量浓度升高,样品中与亚麻木脂素极性相近的各组分的层析柱峰形部分重叠,当上样质量浓度大于15 mg/mL,硅胶柱吸附饱和,洗脱曲线拖尾严重,纯度和产率都下降到较低值,这样达不到纯化的要求。考虑到在实际生产中希望在保证产品分离纯度和产率的条件下处理尽量多的样品,选择亚麻木脂素的上样浓度为15 mg/mL。
3.1.3 洗脱流速的选择
以氯仿、甲醇、醋酸和水的比例为8:4:0.5:0.5作为洗脱剂,上样浓度为15 mg/mL,进样体积为5 mL,流速分别控制在1.0、2.0、3.0 mL/min。淋洗曲线如图2所示。
由图2可知在洗脱流速在1.0、2.0 mL/min均能很好的将亚麻木脂素分离,流速为1.0 mL/min分离效果最好,当洗脱流速增加到3.0 mL/min出现拖尾,致使亚麻木脂素与其他组分不能得以分离,选择洗脱流速1.0 mL/min分离效果最好。
同样将淋洗曲线的第二峰位置的洗脱液回收,通过薄层层析的定性检测可以确定是亚麻木脂素,HPLC定性检测结果与薄层层析定性检测结果一致。通过式(1)、式(2)计算出产率和纯度(见表2)。

表2 洗脱速率对亚麻木脂素柱层析分离的影响
由表2可以看出当洗脱液流速为1 mL/min时,纯度和产率都较高,分离所需的时间相对较长,当流速增大至3.0 mL/min时,两相间的浓度难以分配平衡也导致分离效果不佳,拖尾明显,且洗脱剂耗量较大。从要求较高纯度和产率的角度选择洗脱流速为1 mL/min最为合适。

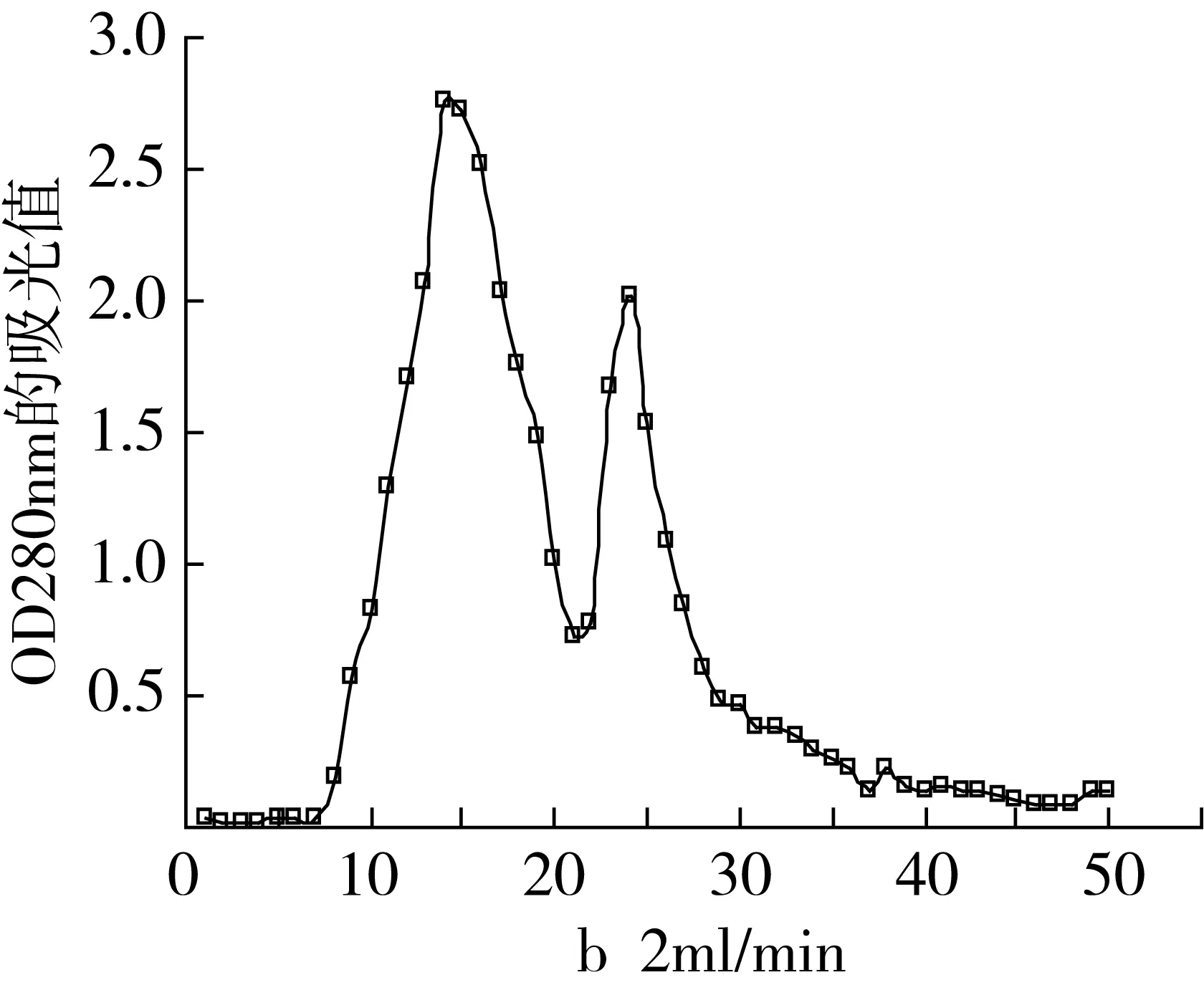

图2 不同流速的淋洗曲线
3.2 硅胶柱层析分离亚麻木脂素的检测结果分析
3.2.1 硅胶薄层层析法
图3为纯化前和纯化后亚麻木脂素的鉴定结果,图3中1、2为纯化前样品的薄层展开点,3为亚麻木脂素标品的薄层展开点,4为经硅胶柱层析后得到的亚麻木脂素的展开点。从图3中可以看出,亚麻木脂素粗品经硅胶柱层析后,通过薄层层析检测时,为亚麻木脂素单一点,说明得到是纯度较高的亚麻木脂素。

图3 薄层层析鉴定的结果
3.2.2 HLPC的检测结果
高效液相色谱的图谱如图4~图6所示。
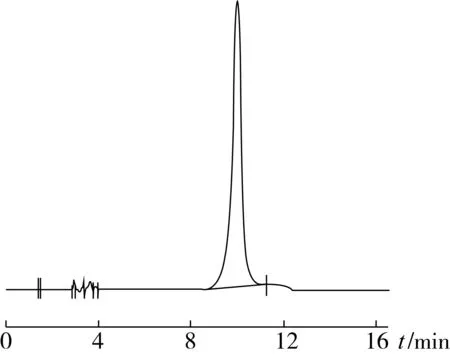
图4 亚麻木脂素SDG标准品的图谱

图5 亚麻木脂素粗提液的HPLC图谱
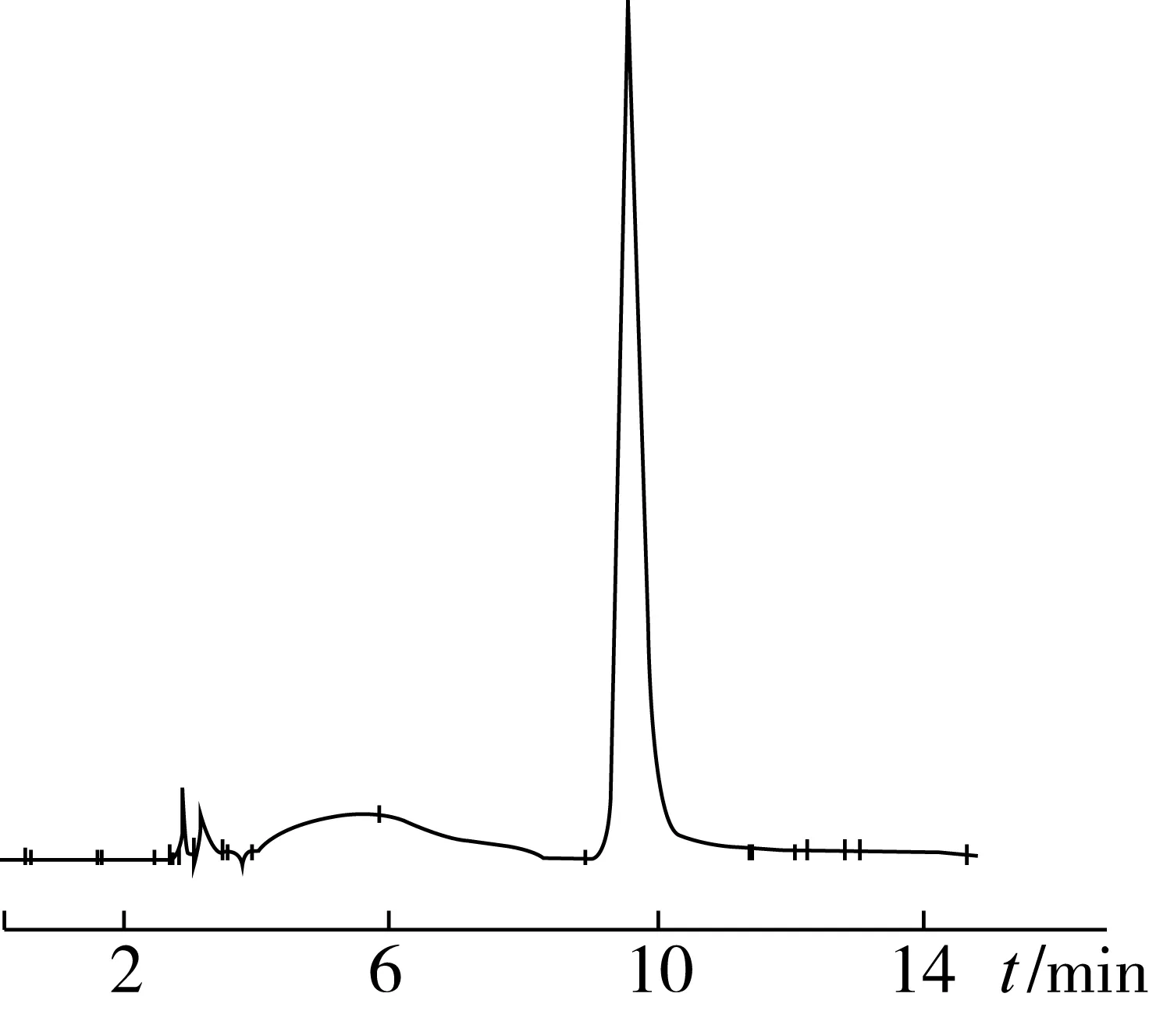
图6 硅胶纯化的亚麻木脂素的HPLC图谱
从图4~图6中可以看出,亚麻木脂素粗提液经硅胶柱纯化后出现单一峰,其保留时间与标准品保留时间相同,说明纯化后纯度较高,这与薄层层析的鉴定结果一致。
在最佳上样质量浓度为15 mg/mL,洗脱速度为1.0 mL/min条件下,将亚麻木脂素粗提液分离,得到亚麻木脂素洗脱液,减压蒸发,冷冻干燥,纯度可以达到80.13%。
4 结论
4.1 依据薄层层析法,通过比较样品中的化合物在薄层层析板上的位置用比移值Rf确定最佳展开剂,从而确定硅胶柱层析的最佳洗脱液。结果表明,以氯仿、甲醇、醋酸和水的比例为8:4:0.5:0.5的洗脱剂对应的比移值Rf最大,为0.45,因而是薄层层析的最佳展开剂,因此,选定该体系为本试验的洗脱剂。
4.2 硅胶柱上样浓度过高不利于不同组分物质的分离,上样浓度超过15 mg/mL时不能将组分很好的分离,上样浓度达到20 mg/mL时不能将目标组分亚麻木脂素与其他组分分开,上样浓度过低洗脱洗脱液中含量过低不利于检测和回收,所以选用上样浓度为15 mg/mL。
4.3 硅胶柱洗脱流速在1.0、2.0 mL/min均能很好的将亚麻木脂素分离,流速为1.0 mL/min分离效果最好,当洗脱流速增加到3.0 mL/min出现拖尾,致使亚麻木脂素与其他组分不能得以分离。
4.4 亚麻木脂素粗品经硅胶柱层析后,通过薄层层析检测时,为亚麻木脂素单一点,说明得到是纯度较高的亚麻木脂素;HPLC检测结果表明,亚麻木脂素粗提掖经硅胶柱纯化后出现单一峰,其保留时间与标准品保留时间相同,说明纯化后纯度较高,这与薄层层析的鉴定结果一致。
[1]胡鑫尧.亚麻种子及麻屑的综合利用[J].中国麻业科学,2003,25(5):235-238
Hu Xinyao.Comprehensive Utilization of Flax(Linum Usitatissimum L.)Seed and Residue[J].Plant fiber and products,2003,25(5):235-238
[2]张金.胡麻籽的营养保健价值与产业前景[J].中国食品工业,2006(3):33-34
Zhang Jin.The Nutrition and Health Care Value of Benne Seed and Its Industry Outlook[J].China Food Industry,2006(3):33-34
[3]陈海华.亚麻籽的营养成分及开发利用[J].中国油脂,2004,29(6):72-75
Chen Haihua.Nutrient components and utilization of flaxseed[J].China Oils and Fats,2004,29(6):72-75
[4]Bakke JE,Klostman HJ.A new diglucoside from flaxseed[J].Proc N Dakota Acad Sci,1956(10):18-21
[5]Simona Mihaela Nemes,Valerie Orsat.Evaluation of a microwave-assisted extraction method for lignan quantification in flaxseed cultivars and selected oil seeds[J].Food Anal.Methods,2012(5):551-563
[6]Andreas Degenhardt,Saskia Habben,Peter Winterhalter.Isolation of the lignan secoisolariciresinol diglucoside from flaxseed(LinumusitatissimumL.)by high-speed counter-current chromatography[J].Journal of Chromatography A,2002.943(2):299-302
[7]M Imran,N Ahmad,FM Anjum,et al.Potential protective properties of flax lignan secoisolariciresinol diglucoside[J].Nutrition Journal,2015:14(1):1-7
[8]MacDonald R C,Rempas S P.Dry column chromatography[J].Journal of Chromatography,1977(131):157-168
[9]吕裕赋,杨亦文,吴平东.大豆磷脂胆碱在硅胶柱中的色谱特性[J].浙江大学学报:工学版,2006,40(7):1267-1271
Lü Yubin,Yang Yiwen,Wu Dongping.Behavior of soybean phospetidylcholine in silica-gel liquid chromatography[J].Journal of Zhejiang University(Engineering Science),2006:40(7):1267-1271
[10]M Janiak,A Slavova-Kazakova,V Kancheva et al.Sephadex LH-20 column chromatography of the hydrolysed lignan macromolecule of flaxseed.Bulgarian chemical communications[J],2014,46(3):640-644
[11]上海国药集团编著.试剂手册[M].上海科技出版社,2000:1159-1162
Shanghai National Pharmaceutical Group.Handbook of reagents[M].Shanghai Scientific and Technical Publishers,2000:1159-1162
[12]田亚平.生化分离技术[M].化学工业出版社,2006:116-117
Tian Yaping.Biochemical Separation Technique[M].Chemical Industry Press,2006:116-117
[13]Stephen H,Stephen T.Solubilities of Inorganic and Organic Compounds[M].Volume Part I.New York:Pergamon Press,1963,370.
The Technology of Separation and Purification of Flaxseed Lignans by Silica Gel Column
Yang Hongzhi Zhou Yanan
(Heilongjiang Bayi Agricultural University,Daqing 163319)
On the basis of thin layer chromatography to determine the optimum purification eluate of flax lignan was using chloroform methanol,acetic acid and water system with a ratio of 8:4: 0.5: 0.5 for the silica gel column chromatography;with the sample concentration of 15 mg/mL,flow rate of 1 mL/min as the best separation parameters,flax lignan purity can reach 80.13% in the above conditions;test results showed that:the crude flax lignan purified by silica gel column,display a single point tested by thin-layer chromatography,HPLC assay showed that purified lignan by silica gel column appeared a single peak and had the same retention time with the standard product.It showed that the purity was higher after purification.
silica gel column,separation and purification,flaxseed lignans,technology
TS222
A
1003-0174(2017)11-0117-06
时间:2017-10-24 16:40:48
网络出版地址:http://kns.cnki.net/kcms/detail/11.2864.TS.20171024.1640.002.html
黑龙江省普通高等学校骨干教师创新能力资助计划项目(1151G032)
2017-05-16
杨宏志,男,1963年出生,教授,农产品加工及贮藏工程
