透性化细胞海藻糖合成酶的制备及其催化合成海藻糖的工艺优化
2017-12-06赵倩如王凯峰郭玉欣周佳海
刘 念,高 振,赵倩如,王凯峰,郭玉欣,江 凌,周佳海
(1.南京工业大学 食品与轻工学院,江苏 南京 211800;2.南京工业大学 生物与制药工程学院,江苏 南京 211800;3.南京工业大学 2011学院,江苏 南京 211800;4.中国科学院 上海有机化学研究所 生命有机化学国家重点实验室,上海 200032)
透性化细胞海藻糖合成酶的制备及其催化合成海藻糖的工艺优化
刘 念1,高 振2,赵倩如3,王凯峰3,郭玉欣3,江 凌1,周佳海4
(1.南京工业大学 食品与轻工学院,江苏 南京 211800;2.南京工业大学 生物与制药工程学院,江苏 南京 211800;3.南京工业大学 2011学院,江苏 南京 211800;4.中国科学院 上海有机化学研究所 生命有机化学国家重点实验室,上海 200032)
笔者以麦芽糖为底物,开展经渗透细胞技术处理得到的透性化细胞海藻糖合成酶催化制备海藻糖的新工艺开发。首先,对比不同透性化试剂对异源表达海藻糖合成酶的大肠杆菌工程菌的透性化处理效果,发现使用硫酸粘杆菌素时海藻糖合成酶的催化转化率高达64.6%,是传统超声破碎的2.63倍;其次,通过参数优化获得硫酸粘杆菌素透性化处理的最佳条件,即:1.5 g/L的硫酸粘杆菌素在30 ℃下处理60 min,得到的海藻糖合成酶活性最高,为5 209 U/mL;最后,利用透性化处理后的大肠杆菌工程菌进行全细胞催化制备海藻糖工艺研究,结果表明:以质量分数25%的麦芽糖为底物,在pH 7.5、30 ℃条件下,获得海藻糖的转化率为65.6%;进一步通过离心收集细胞进行反复催化试验,在20批次之后,转化率仍维持在62.5%,显示了良好的应用前景。
海藻糖;硫酸粘杆菌素;透性化处理;全细胞催化
海藻糖(trehalose)是一种无醛基的非还原性二糖,由两个葡萄糖分子通过α,α-1,1-糖苷键相连接[1]。海藻糖具有很强的热稳定性,口感优于蔗糖,在体内缓慢代谢,是糖尿病患者的新一代食糖替代品;并且该糖具有优良的抗逆保护功能,素有“生命之糖”的美誉,在食品、化妆品、农业和医药等领域都有着重要的应用[2-5]。海藻糖的生产方法主要有微生物抽提法、发酵法和酶转化法等[6],其中,海藻糖合成酶(trehalose synthase,TreS,EC 5.4.99.16)催化麦芽糖一步转化合成海藻糖的酶法工艺因操作简单、原料成本低廉及催化过程不需要消耗高能物质等优点备受青睐[7-11]。
海藻糖合成酶属于胞内诱导型酶,传统的提取工艺是先将细胞进行破碎,经过分离纯化后才能使用。而分离纯化过程操作困难、设备投资大,限制了海藻糖在工业中的应用[12]。近年来,全细胞催化(whole-cell catalysis)技术[13-14]的出现为解决这一胞内酶催化问题提供了一种新思路。在全细胞催化过程中,酶的稳定性高,催化效率高,可重复批次进行底物催化反应,省去了制酶过程的繁琐程序,使得生产成本大大降低。例如Zheng等[15]通过对比无水乙醇、乙二胺四乙酸(EDTA)和氯仿对大肠杆菌工程菌的渗透效果,最终确定以2%的氯仿透性化处理20 min效果最佳,海藻糖的转化率达到55.4%。
硫酸粘杆菌素(colistin sulfate)是一种具有抗菌活性的生物表面活性剂,最早在杆属多粘芽孢杆菌变种粘菌素(Bacilluspolymyxavar.colistinus)的培养基中被发现,对革兰氏阴性菌有较强的抗菌作用,作为饲料添加剂在饲料工业中已被广泛采用[16]。
本文中,笔者针对目前生产海藻糖的方法,在实验室已经构建的异源表达TreS的大肠杆菌工程菌基础上,探索一种更加高效的全细胞催化合成海藻糖的方法,以期为实现海藻糖的工业化生产提供新思路。笔者通过对比硫酸粘杆菌素、EDTA、氯仿和无水乙醇对表达海藻糖合成酶的大肠杆菌工程菌的透性化处理效果,以获得最佳的透性试剂,并对其处理细胞的浓度、温度和时间进行参数优化,进而进行全细胞催化制备海藻糖工艺研究,以期获得最佳的工艺条件。
1 材料与方法
1.1 实验菌种
异源表达海藻糖合成酶的重组大肠杆菌BL21工程菌(EscherichiacoliBL21),由笔者所在实验室成员构建保存[7]。
1.2 主要试剂
葡萄糖、麦芽糖、海藻糖,德国Sigma公司;酵母粉、蛋白胨,英国OXOID公司;氨苄青霉素、异丙基-β-D-硫代半乳糖苷(IPTG),生工生物工程(上海)股份有限公司;硫酸粘杆菌素,Ruibio公司。
1.3 主要设备
SW-CJ-1B(U)型生物净化工作台,苏州净化有限公司;HYL-A型恒温摇床,太仓市强乐实验设备厂;GA88-II型超声破碎仪,无锡上佳生物科技有限公司;UltiMate 3000型戴安高效液相色谱仪,美国Dionex公司;RI-101型示差折光检测器,Shodex公司。
1.4 主要溶液及培养基的配制
IPTG(1 mmol/L):2 g IPTG溶于10 mL无菌水,水滤膜过滤除去杂菌,在-20 ℃贮存。
LB液体培养基(g/L):酵母粉5,蛋白胨10,NaCl 10。
LB固体培养基(g/L):酵母粉5,蛋白胨10,NaCl 10,琼脂20。
1.5 实验方法
1.5.1 菌种活化
在LB固体培养基中(含50 mg/L的氨苄青霉素(Amp)),采用划线法培养菌种12 h,获得重组大肠杆菌BL21的单菌落。挑取单菌落,在加氨苄的LB液体培养基中进行菌种活化, 在37 ℃、200 r/min条件下活化12 h。
1.5.2 重组大肠杆菌的诱导
接种体积分数1.5%活化的菌液到新的LB液体培养基(含50 mg/L的Amp)中,在37 ℃、200 r/min条件下培养。在培养1 h后,每隔2 h取2 mL菌液进行OD600的测定,在OD600达到0.6~0.8时加入诱导剂。在锥形瓶中,加入诱导剂IPTG,使其终浓度为0.8 mmol/L,在37 ℃、200 r/min的摇床中诱导8 h。
1.5.3 传统超声法破碎细胞
诱导结束后,使用50 mL离心管,在4 ℃、6 000 r/min条件下离心10 min后弃上清。用0.04 mol/L、pH 7.4的磷酸盐缓冲液(PBS)重悬底细胞,重复操作2次,离心后得到重组大肠杆菌的湿菌体。将湿菌体用等体积的PBS重悬,在冰浴条件下进行超声破碎(工作时间4 s,间隔时间4 s,总工作时间5 min),破碎后在4 ℃、6 000 r/min条件下离心10 min,上清液用于合成海藻糖。
1.5.4 制备通透性的重组大肠杆菌
分别加入相同浓度的硫酸粘杆菌素、氯仿、无水乙醇和EDTA对湿菌体进行处理,并做空白对照。处理条件:30 ℃、200 r/min的摇床中处理60 min。在200 r/min条件下,考察不同浓度的硫酸粘杆菌素、不同的处理温度和时间对细胞通透性的影响。处理后的菌液在6 000 r/min离心10 min后弃上清,用PBS洗涤2次,并用1/2体积的PBS重悬,使菌体浓度固定在10%。
1.5.5 测定酶活
称取5.4 g麦芽糖,用100 mL的PBS溶解,使其终浓度为150 mmol/L。用移液枪取200 μL的细胞悬浮液和800 μL的麦芽糖溶液,在2 mL离心管中混匀,每组做3个平行样品。让该1 mL体系在25 ℃条件下反应30 min,对其进行煮沸处理,灭酶10 min。冷却后,在6 000 r/min条件下离心10 min,取上清液,用于海藻糖含量的测定。酶活力单位的定义:在25 ℃条件下,每1 min生成1 nmol海藻糖所消耗的海藻糖合成酶的量为1个酶活力单位。
1.5.6 全细胞催化反应
在最佳透性化处理细胞的基础上,称取30.0 g麦芽糖,用PBS溶解定容到100 mL,使其终浓度为30%。10 mL的通透性处理细胞悬浮液和40 mL质量分数30%的麦芽糖底物装于250 mL锥形瓶中,每组做3个平行样品。让该反应体系在30 ℃、200 r/min条件下反应24 h,对其进行煮沸处理,灭酶10 min,并探究pH、反应温度和底物浓度对全细胞催化反应的影响。转化率的计算见式(1)。

(1)
1.5.7 高效液相色谱法(HPLC)测定产物和底物
使用HPLC测定样品的产物、底物和副产物。测定条件是V(乙腈)∶V(水)=8∶ 2组成流动相,流速为0.6 mL/min,层析柱为氨基柱(柱温35 ℃),选择ShodexRI101视差折光检测器。配制麦芽糖、葡萄糖和海藻糖的质量浓度分别是1、2、3、4和5 g/L的标准品溶液,用0.22 μm的过滤膜除去杂质,装入专用的自动进样瓶中,HPLC进行分析。
2 结果与讨论
2.1 不同透性化试剂对大肠杆菌工程菌进行透性化处理效果的对比
在细胞悬浮液中分别加入相同浓度的硫酸粘杆菌素、无水乙醇、氯仿和EDTA,在30 ℃、200 r/min条件下对重组大肠杆菌进行通透处理60 min。反应结束后,测定上清液中的海藻糖含量,并与传统超声破碎法进行对比,结果如图1所示。

图1 不同透性试剂处理对海藻糖转化率的影响Fig.1 Effects of permeabilization treatment on the conver-sion yield of trehalose by various reagents
由图1可知:经过传统超声破碎得到的海藻糖转化率仅有24.6%,而经过透性化处理的细胞进行催化反应得到的海藻糖转化率最高是64.6%,是传统超声破碎的2.63倍。这不仅大大提高了转化效率,同时避免了细胞破碎过程中酶使用效率不高、酶易失活及分离纯化压力大等缺点[15]。
使用未经过透性化处理的细胞进行催化反应,海藻糖的转化率仅为0.9%,这是因为细胞膜对反应体系的传质起天然屏障作用;同时说明,用不同化学试剂处理均能对细胞的通透性产生影响,只是效果有所不同。例如,利用无水乙醇和EDTA处理时的海藻糖转化率很低,可能是因为二者对细胞的破坏性较大、毒性强,直接导致酶活丧失,没有海藻糖的生成;而氯仿和硫酸粘杆菌素可以作用在细胞壁和细胞膜的脂类结构,尤其是溶解了细胞膜上的磷脂层,增加了细胞的通透性,海藻糖的转化率高[17]。但是,氯仿是化学试剂,对人体有害,存在食品安全隐患,用它处理细胞过程也容易造成环境污染,更会增加海藻糖的后续分离的压力。因此,选用硫酸粘杆菌素作为透性化处理的试剂,不仅催化效率高、无污染,而且安全性能好,适合工业化生产[18]。
2.2 通透性处理重组大肠杆菌实验参数的优化
2.2.1 通透性处理试剂的最佳浓度
在25 ℃、200 r/min条件下,用不同浓度0.8、1.0、1.2、1.4、1.6、1.8和2.0 g/L的硫酸粘杆菌素处理重组大肠杆菌60 min,结果如图2所示。

图2 硫酸粘杆菌素质量浓度对细胞通透性的影响Fig.2 Effects of colistin sulfate concentrationson cell permeability
由图2可知:随着硫酸粘杆菌素质量浓度的进一步增加,细胞的通透性增大,有利于小分子物质的进出,提高酶催化反应的效率;但是,随着硫酸粘杆菌素浓度的增加,细胞的活力下降,这可能是因为细菌细胞膜的磷脂分子表面的负电荷和硫酸粘杆菌素所带的正电荷形成静电吸附,扰乱了脂质和质膜蛋白的排列顺序,进而破坏了细胞膜的有序结构,使得菌体溶解,失去了细胞膜的保护作用,从而使海藻糖合成酶的活性大大降低[15]。
2.2.2 通透性处理的最佳时间
在25 ℃、200 r/min条件下,在细胞悬浮液中加入1.5 g/L的硫酸粘杆菌素对重组大肠杆菌进行通透处理,处理时间分别是0、30、60、90、120和150 min,结果如图3所示。
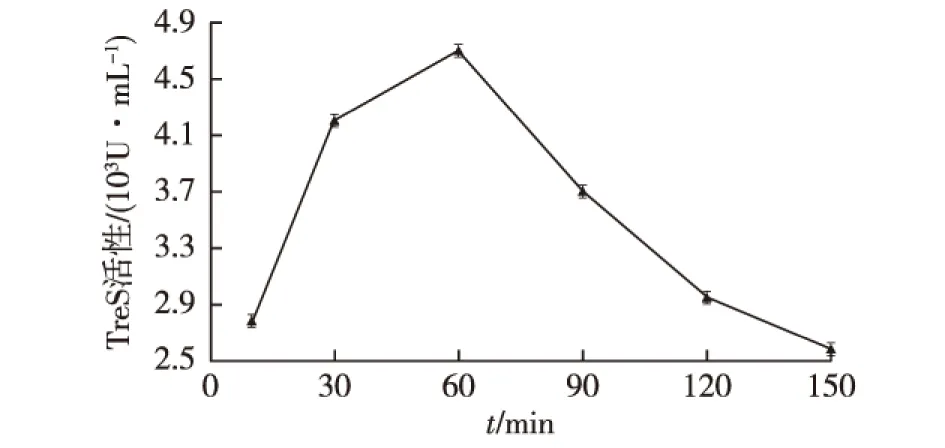
图3 硫酸粘杆菌素处理时间对细胞通透性的影响Fig.3 Effects of colistin sulfate treatment timeon cell permeability
由图3可知:随着处理时间的延长,细胞的通透性加大,进而使得细胞活力提高。随后,由于处理时间继续延长,细胞活力反而下降,这是因为细胞膜表面和硫酸粘杆菌素形成的离子通道激增,使得渗透压改变,水会进入细胞内,细胞发生溶胀破裂,部分海藻糖合成酶会从细胞中释放出来,使得胞内检测到的酶活有所下降[15]。
2.2.3 通透性处理的最适温度
在200 r/min条件下,在细胞悬浮液中加入1.5 g/L的硫酸粘杆菌素,对重组大肠杆菌进行通透性处理60 min,处理温度分别是25、28、30、35和40 ℃,结果如图4所示。
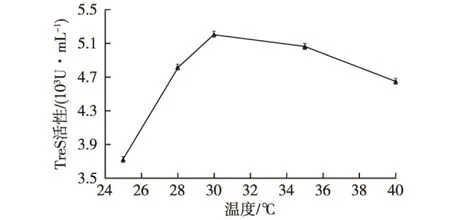
图4 处理温度对细胞通透性的影响Fig.4 Effects of colistin sulfate treatment temperatureon cell permeability
由图4可知:随着处理温度的升高,海藻糖合成酶的活性迅速增加,最高酶活达5 209 U/mL。这是因为适当地提高温度可以使酶的活性变高。但随着温度的升高,酶活下降,其原因可能是较高的处理温度会使蛋白质失活和细胞膜脂质发生位移,导致酶失活[19]。
2.3 全细胞催化工艺条件的优化
2.3.1 全细胞催化的最佳pH
利用透性化处理后的大肠杆菌工程菌,在30 ℃、200 r/min条件下,用PBS溶液配制pH分别为6.0、6.5、7.0、7.5和8.0的30%(质量分数)麦芽糖溶液作为底物,进行全细胞催化反应24 h。反应结束后,测定该上清液中的海藻糖含量,以确定全细胞反应的最佳pH,结果如图5所示。
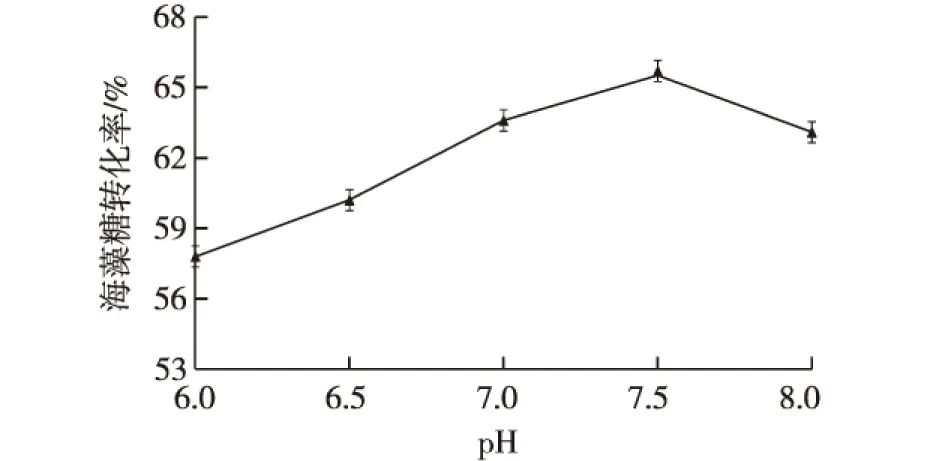
图5 pH对海藻糖转化率的影响Fig.5 Effects of pH on the conversion yield of trehalose
由图5可知:当反应pH在7.5时,海藻糖的转化率可以达到65.7%,是海藻糖合成酶催化反应的最适值。当pH过高或过低时都不利于海藻糖合成酶的催化,这是由于pH影响着酶蛋白的等电点和空间结构,合适的pH能够高效促进酶分子的催化效率[20]。
2.3.2 全细胞催化的最佳温度
利用透性化处理后的大肠杆菌工程菌,在200 r/min条件下进行全细胞催化反应24 h。底物是PBS配制的pH 7.5、质量分数30%的麦芽糖溶液,实验温度分别为15、20、25、30、35、40和45 ℃,反应结束后,测定该上清液中的海藻糖含量,以确定全细胞反应的最佳温度,结果如图6所示。
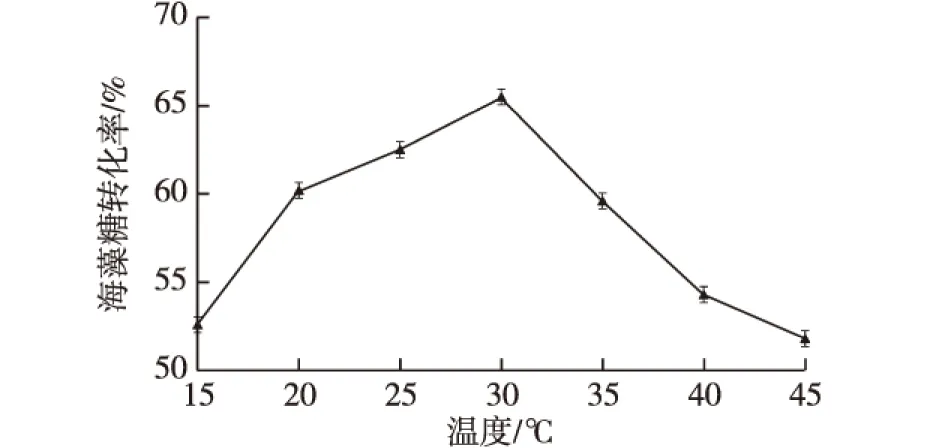
图6 温度对海藻糖转化率的影响Fig.6 Effects of temperature on the conversionyield of trehalose
由图6可知:随着温度的升高,海藻糖的转化率升高。当温度达到30 ℃时,转化率最高达到65.5%;而后随着温度的进一步升高,转化率反而下降。这是因为温度对酶活的影响使得海藻糖产量迅速下降。最终选择30 ℃作为全细胞催化反应的最适温度。本工艺采用的催化温度与产酶发酵温度相同,对于全细胞催化十分有利,保证细胞活性的同时,便于发酵工段和催化工段的快速衔接,缩短了生产间歇时间,进一步提高了生产效率。
2.3.3 全细胞催化的最佳底物浓度
利用透性化处理后的大肠杆菌工程菌,在30 ℃、200 r/min条件下进行全细胞催化反应24 h。底物是PBS配制的质量分数分别为20%、25%、30%、35%和40%的麦芽糖溶液(pH 7.5)。反应结束后,测定该上清液中的海藻糖含量,以确定全细胞反应的最佳底物浓度,结果如图7所示。

图7 麦芽糖底物浓度对海藻糖转化率的影响Fig.7 Effects of substrate concentration on theconversion yield of trehalose
由图7可知:随着麦芽糖浓度的增加,海藻糖的转化率先上升后下降,这说明高浓度的底物浓度会对全细胞催化反应有抑制的趋势,同时降低海藻糖的产量和转化率。因此,选用25%的麦芽糖质量分数为最佳底物质量分数。目前已公开报道的同类研究中,催化底物麦芽糖的初始质量分数大都在5%~10%[15],相比而言,本研究采用的高底物浓度有利于提高海藻糖的整体工艺生产强度[19]。
2.4 全细胞催化的重复使用批次考察
为了考察重组大肠杆菌细胞内海藻糖合成酶的酶活保持能力,把重组大肠杆菌离心收集重复使用,考察每批反应体系中海藻糖的转化率。用PBS配制pH为7.5的25%麦芽糖溶液为底物,在30 ℃、200 r/min条件下,每批次反应24 h,共考察20批次,结果如图8所示。
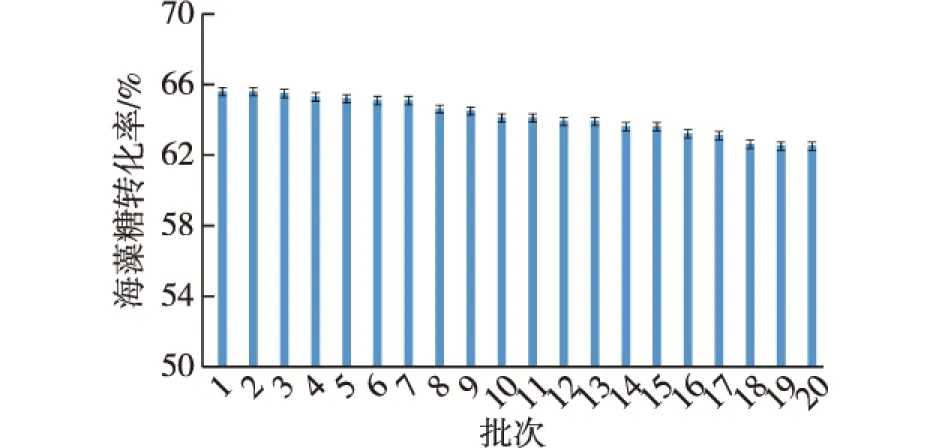
图8 全细胞催化反应的使用批次考察Fig.8 The using batch of the whole cell catalysis
由图8可知:海藻糖的转化率基本保稳定略降的趋势。首批转换率最高为65.6%,该转化率与已公开报道的最高的TreS催化的底物转化率的水平相当(60%~70%)[7-8]。然而,全细胞催化20批次后,还可以保留62.5%的较高转化率,高于部分同行研究的转化率[21]。
3 结论
本文中,笔者通过对比无水乙醇、氯仿、EDTA和硫酸粘杆菌素4种透性试剂对表达海藻糖合成酶的大肠杆菌工程菌的处理效果,发现使用硫酸粘杆菌素时海藻糖的转化率高达64.6%,是传统超声破碎的2.63倍。经过氯仿处理的海藻糖转化率能达到46.9%,但是由于氯仿的毒害作用,限制其在食品行业的应用;其次,通过参数优化获得硫酸粘杆菌素透性化处理的最佳条件,即:1.5 g/L的硫酸粘杆菌素在30 ℃条件下处理60 min,得到的海藻糖合成酶活性最高,为5 209 U/mL;最后,利用透性化处理后的大肠杆菌工程菌进行全细胞催化制备海藻糖工艺研究,结果表明:以质量分数25%的麦芽糖为底物,在pH 7.5、30 ℃条件下,获得的海藻糖转化率为65.6%;进一步通过离心收集细胞进行反复催化试验,在20批次之后,转化率仍维持在62.5%,显示了良好的应用前景。
[1] EROGLU A,RUSSO M J,BIEGANSKI R,et al.Intracellular trehalose improves the survival of cryopreserved mammalian cells[J].Nat Biotechnol,2000,18(2):163-167.
[2] SCHIRAL D C,DI L I,DE R M.Trehalose production:exploiting novel approaches[J].Trends Biotechnol,2002,20(10):420-425.
[3] ZHANG R,PAN Y T,HE S,et al.Mechanistic analysis of trehalose synthase fromMycobacteriumsmegmatis[J].J Biolog Chem,2011,286(41):35601-35609.
[4] OHTAKE S,WANG Y J.Trehalose:current use and future applications[J].J Pharm Sci,2011,100(6):2020-2053.
[5] CHUNG S K,RYU S I,LEE S B.Characterization of UDP-glucose-4-epimerase fromPyrococcushorikoshii:regeneration of UDP to produce UDP-galactose using two-enzyme system with trehalose[J].Bioresour Technol,2012,110:423-429.
[6] SONG X,TANG S,JIANG L,et al.Integrated biocatalytic process for trehalose production and separation from maltose[J].Ind Eng Chem Res,2016,55(40):10566-10575.
[7] LIANG J,HUANG R,HUANG Y,et al.Cloning,expression,properties,and functional amino acid residues of new trehalose synthase fromThermomonosporacurvataDSM 43183[J].J Mol Catal B:Enzymatic,2013,90:26-32.
[8] JIANG L,LIN M,ZHANG Y,et al.Identification and characterization of a novel trehalose synthase gene derived from saline-alkali soil metagenomes[J].PLoS ONE,2013,8(10):e77437.
[9] WANG T,JIA S,DAI K,et al.Cloning and expression of a trehalose synthase fromPseudomonasputidaKT2440 for the scale-up production of trehalose from maltose[J].Can J Microb,2014,60(9):599-604.
[10] LI N,WANG H,LI L,et al.Integrated approach to producing high-purity trehalose from maltose by the yeastYarrowialipolyticadisplaying trehalose synthase (TreS) on the cell surface[J].J Agric Food Chem,2016,64(31):6179-6187.
[11] CHEN P T,CHIANG C J,CHEN Y T,et al.Strategy for stable and high-level expression of recombinant trehalose synthase inEscherichiacoli[J].J Agric Food Chem,2012,60(23):6063-6068.
[12] ZHOU Y,YUAN Q,GAO H L,et al.Production of trehalose by permeabilizedMicrococcusQS412 cells[J].J Mol Catal B:Enzymatic,2006,43:137-141.
[13] DE CARVALHO C C C R.Enzymatic and whole cell catalysis:finding new strategies for old processes[J].Biotech Adv,2011,29(1):75-83.
[14] PARK J H,LEE S H,CHA G S,et al.Cofactor-free light-driven whole-cell cytochrome P450 catalysis[J].Angew Chem Int Ed,2015,127(3):983-987.
[15] ZHENG Z,XU Y,SUN Y,Et al.Biocatalytic production of trehalose from maltose by using whole cells of permeabilized recombinantEscherichiacoli[J].PLoS ONE,2015,10(10):e0140477.
[16] JUNG D H,JUNG J H,SEO D H,et al.One-pot bioconversion of sucrose to trehalose using enzymatic sequential reactions in combined cross-linked enzyme aggregates[J].Bioresour Technol,2013,130:801-804.
[17] CATANIA C,AJO-FRANKLIN C M,BAZAN G C.Membrane permeabilization by conjugated oligoelectrolytes accelerates whole-cell catalysis[J].RSC Adv,2016,102(6):100300-100306.
[18] 崔怀言,江凌,张文婧,等.采用可视化方法通透性处理大肠杆菌细胞生产海藻糖合成酶[J].食品与发酵工业,2014,40(6):8-12.
[19] LI Y,WANG Z,FENG Y,et al.Improving trehalose synthase activity by adding the C-terminal domain of trehalose synthase fromThermusthermophilus[J].Bioresour Technol,2017,DOI:10.1016/j.biortech.2017.05.189.
[20] WU T T,LIN S C,SHAW J F.Integrated process for the purification and immobilization of recombinant trehalose synthase for trehalose production[J].Process Biochem,2011,46(7):1481-1485.
[21] COLLA E,PEREIRA A B,HERNALSTEENS S,et al.Optimization of trehalose production byRhodotoruladairenensis,following a sequential strategy of experimental design[J].Food Bioprocess Technol,2010,3(2):265-275.
(责任编辑 管珺)
Optimizationoftrehalosesynthesisbywholecellcatalysisandpreparationoftrehalosesynthasefrompermeablecells
LIU Nian1,GAO Zhen2,ZHAO Qianru3,WANG Kaifeng3,GUO Yuxin3,JIANG Ling1,ZHOU Jiahai4
(1.College of Food Science and Light Industry,Nanjing Tech University,Nanjing 211800,China; 2.College of Biotechnology and Pharmaceutical Engineering,Nanjing Tech University,Nanjing 211800,China;3.College of 2011,Nanjing Tech University,Nanjing 211800,China;4.State Key Laboratory of Bioorganic and NaturalProducts Chemistry,Shanghai Institute of Organic Chemistry,Chinese Academy of Sciences,Shanghai 200032,China)
Maltose is used as the substrate to synthesize trehalose using a novel whole-cell catalysis strategy with trehalose synthase expressed inside the cells ofEscherichiacoli.First,comparing the effect of different permeability agents on recombinedE.coli,we found that the conversion rate of trehalose reached 64.6% with colistin sulfate, 2.63 times higher than that of traditional ultrasonic crushing method.Second,we optimized parameter of permeation treatment.Results show that the highest activity of trehalose synthase was 5 209 U/mL when using 1.5 g/L colistin sulfate as the permeability agent,reacting for 60 min at 30 ℃.Last, the conditions for the whole-cell catalytic reaction were investigated as well.The conversion rate of trehalose was 65.6% at pH 7.5 and 30 ℃,with 25% maltose as the substrate.The conversion rate of trehalose almost kept stable and remained 62.5% even after 20 batches,which showed a good application prospect.
trehalose; colistin sulfate; permeability treatment; whole-cell catalysis
10.3969/j.issn.1672-3678.2017.06.010
2017-08-30
国家自然科学基金联合基金(U1603112);生命有机化学国家重点实验室开放课题(SKLBNPC15429);江苏省高校自然科学研究面上项目(14KJB530002);江苏省博士后科研资助计划(1401009A)
刘 念(1994—),男,天津宝坻人,研究方向:食品科学;江 凌(联系人),研究员, E-mai:jiangling@njtech.edu.cn
TQ925
A
1672-3678(2017)06-0068-06
