盐酸氢吗啡酮静脉自控镇痛用于儿童术后镇痛效果的回顾性分析
2017-12-06王聪朱昌茂王茂钱巍张咸伟
王聪 朱昌茂 王茂 钱巍 张咸伟
·论著·
盐酸氢吗啡酮静脉自控镇痛用于儿童术后镇痛效果的回顾性分析
王聪 朱昌茂 王茂 钱巍 张咸伟
目的探讨盐酸氢吗啡酮用于儿童术后静脉自控镇痛(PCA)的临床应用效果。方法全麻术后接受48小时氢吗啡酮静脉自控镇痛的病人280例,年龄1~14岁,收集急性疼痛服务小组(acute pain service,APS)术后随访数据,包括术后4~8小时(T1)、10~14小时(T2)、22~26小时(T3)、46~50小时(T4)四次随访时病人的疼痛评分、用药剂量、PCA按压次数、镇静评分、不良反应、处理措施,以及T4时刻病人和家属满意度。结果1~7岁儿童术后4次随访的FLACC(The Faces,Legs,Activity,Cry and Consolability Scale,0~100)疼痛评分为(7.89±11.01)、(8.58±9.83)、(6.27±6.54)、(2.58±5.14);8~14岁儿童4次随访静止VAS评分为(6.99±6.58)、(3.74±7.17)、(3.86±6.71)、(1.89±4.17),活动VAS评分为(14.40±9.24)、(9.46±10.39)、(7.73±9.66)、(8.27±7.94);各随访时刻Ramsay镇静评分为2,48小时内恶心呕吐率为8.22%,无呼吸抑制、过度镇静、皮肤瘙痒等不良反应,术后镇痛满意度为5。结论盐酸氢吗啡酮PCA用于儿童术后镇痛效果良好,不良反应发生率低。
氢吗啡酮; 儿童; 术后镇痛; 病人自控镇痛
儿童术后疼痛是一个广泛存在并被低估的问题。儿童对疼痛感知和镇痛需求差异大,量化疼痛困难,药效学和药动学与成人不同,对镇痛药物如阿片类药物引起的呼吸抑制等不良反应更加敏感,给药剂量把控困难,部分家长对药物不良反应忧虑多,使儿童术后镇痛不足广泛存在[1]。非甾体抗炎药(nonsteroidal antiinflammatory drugs,NSAIDs)镇痛效能有限、阿片类如吗啡不良反应多,导致儿童应用受限。氢吗啡酮是吗啡衍生物,为μ受体激动剂,镇痛效果为吗啡的5~7倍,临床主要用于癌痛和术后中、重度疼痛的治疗[2-3]。氢吗啡酮不良反应发生率低于吗啡[4],有适用于儿童术后镇痛的潜能。我们对盐酸氢吗啡酮用于儿童全麻术后经静脉病人自控镇痛(patient-controlled analgesia,PCA)的效果和安全性进行回顾性分析。
对象与方法
一、对象
2016年1月~12月全身麻醉下行手术治疗的病人280例,术后接受48小时盐酸氢吗啡酮静脉PCA治疗。
纳入标准:(1)美国麻醉医师协会(American Society of Anesthesiologists,ASA)分级Ⅰ~Ⅱ;(2)年龄1~14岁;(3)术后使用盐酸氢吗啡酮静脉PCA。
排除标准:(1)患有先天性、遗传性疾病;(2)全麻联合神经阻滞;(3)术后随访资料不全。
280例病人中,男性159例,女性121例。一般情况和手术类型见表1。

表1 280例病人一般情况
二、方法
1.手术麻醉方法:病人入室后常规监测脉搏氧饱和度、血压、心电图,建立静脉通路;麻醉诱导采用七氟醚,舒芬太尼或芬太尼,异丙酚或依托咪酯,罗库溴铵或顺式阿曲库铵,气管插管或喉罩后行机械通气。麻醉维持采用七氟醚、异丙酚和瑞芬太尼,间断给予肌松药物。手术结束前约10~15分钟停止七氟醚吸入、异丙酚和瑞芬太尼输注,待病人清醒,自主呼吸充分恢复后拔除气管导管或喉罩,送至恢复室。
2.术后镇痛方法:术后镇痛由我院急性疼痛服务小组(acute pain service,APS)整体负责,实行24小时值班制。给予儿童盐酸氢吗啡酮静脉PCA术后镇痛。PCA泵内药物组成:盐酸氢吗啡酮注射液0.15 mg/kg加入0.9%的氯化钠注射液100 ml配制。PCA药物剂量、参数设置见表2。手术结束后由麻醉医生直接连接并开启PCA泵,镇痛持续48小时。由 APS成员进行术后4~8小时(T1)、10~14小时(T2)、22~26小时(T3)、46~50小时(T4)时段的四次随访,记录生命体征、PCA参数和不良反应;评估儿童疼痛情况,若出现镇痛不良,调整PCA参数,或给予曲马多、地佐辛补救镇痛,等待10~20分钟后再次评估镇痛效果;若出现术后恶心呕吐,则调节PCA参数或给予镇吐药物,记录随访的干预措施,随访结束后APS成员直接将数据录入数据库。
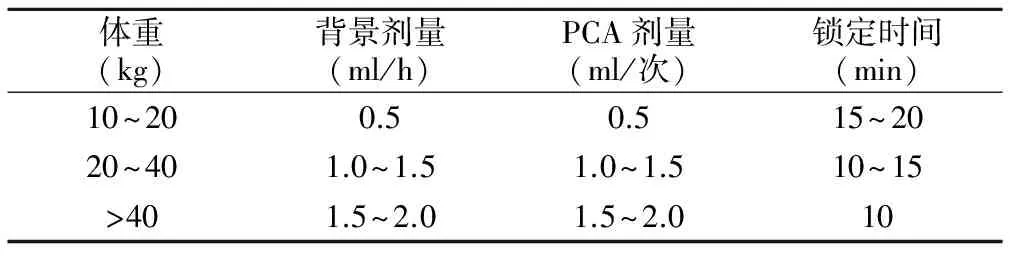
表2 PCA参数设置
3.分析评价方法:(1)疼痛评估:记录儿童术后T1、T2、T3和T4随访时的疼痛评分、用药剂量、PCA按压次数。因低龄儿童难以清楚理解和描述VAS疼痛评分,因此依据疼痛评分方法分为1~7岁和8~14岁两个年龄段。1~7岁儿童采用FLACC(The Faces,Legs,Activity,Cry and Consolability Scale)疼痛评估法,根据病人面部、肢体、活动、哭闹、家属反映可安慰性,评估有无疼痛和疼痛程度(每一项按照程度定义为0~20分,5项指标叠加为0~100分,0分无痛,100分最痛);8~14岁儿童采用VAS(Visual analogue scale,0~100)评估。评分<30为轻度疼痛,40~60为中度疼痛,70~100为重度疼痛。以疼痛评分大于40分为镇痛不良。(2)镇静评估:记录Ramsay镇静评分(1分:焦虑;2分:安静合作;3分:嗜睡;4分:睡眠,可唤醒;5分:深睡,唤醒迟钝;6分:深睡,唤之不醒)。评分≥5为过度镇静。(3)不良反应:恶心或呕吐、瘙痒、过度镇静(Ramsay评分为5或6分)、呼吸抑制(SpO2< 90%,或呼吸频率<10次/分)等。(4)干预方式:如补救镇痛、调节PCA参数、镇吐处理等。(5) 满意度:病人或家属对镇痛效果的满意程度(1~5分,1分不满意,5分非常满意)。
三、统计学处理
结 果
1.术后镇痛效果:1~7岁儿童术后随访,T1时刻镇痛不良发生率为2.99%,T2、T3时刻发生率均为1.49%,T4时刻为0。8~14岁儿童术后随访,根据VAS静止评分,T1时刻镇痛不良发生率为0.47%,其余时刻为0;根据VAS活动评分,T1、T2、T3和T4各时刻发生率分别为2.35%,1.41%,0.47%,0.47%。镇痛不良病人,随访人员调整PCA参数或给予曲马多、地佐辛补救镇痛后,疼痛得到有效缓解。术后镇痛的满意度为5。接受PCA的病人术后各随访时刻疼痛评分、PCA按压次数、药物用量见表3和表4。
2.不良反应:术后48小时随访期间,病人恶心呕吐发生率为8.22%;调整PCA参数或给予镇吐治疗后,可见明显好转。未有记录呼吸抑制、皮肤瘙痒等不良反应发生。病人各随访时刻Ramsay镇静评分为2,无过度镇静发生,见表5。T1、T2随访时,APS人员行干预措施(调节PCA参数、补救镇痛、镇吐等处理措施)的概率分别为3.93%和6.43%。

表3 1~7岁病人术后镇痛情况

表4 8~14岁病人术后镇痛情况
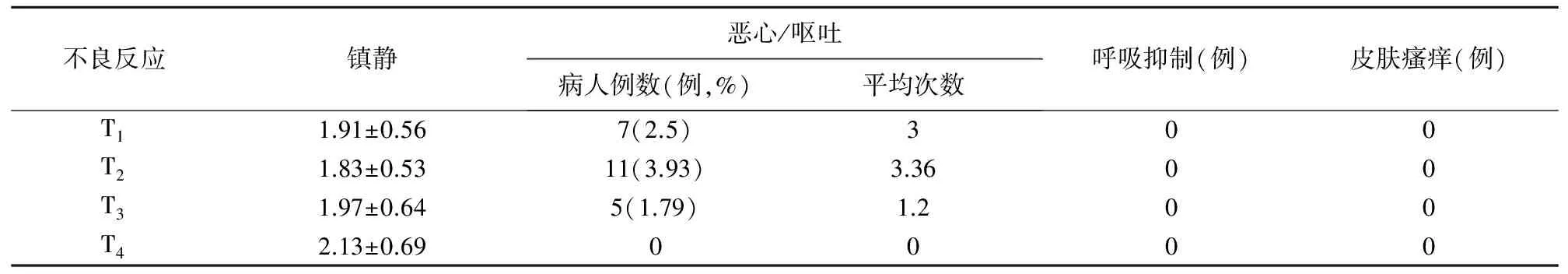
表5 不良反应发生情况
讨 论
儿童严重的术后疼痛是导致并发症甚至死亡的重要原因。儿童围术期的恐惧、焦虑也会进一步放大术后疼痛。术后疼痛可能是他们一生中经历的最严重的疼痛[5]。未经充分治疗的严重疼痛具有显著的长期影响,可能比成人更严重。
吗啡PCA常用于儿童术后镇痛,但不良反应发生率较高,恶心或呕吐发生率达30.0%~40.0%,瘙痒发生率为10.0%~80.0%[6]。氢吗啡酮是一种半合成的吗啡衍生物,静脉给药后5~10分钟起效,10~20分钟达峰值,维持3~4小时,镇痛效果是吗啡的5~7倍[3]。在PCA 10分钟的自控给药间隔内,氢吗啡酮能迅速达到镇痛峰值。氢吗啡酮起效快,镇痛效果强,适合儿童的镇痛药物更应关注药物不良反应[7]。针对不良反应而言,氢吗啡酮的呼吸抑制发生率低于吗啡,因为氢吗啡酮通过血脑屏障的消除半衰期是28分钟,吗啡为166分钟,较快的血脑屏障药物消除能显著降低呼吸抑制的发生[8-9]。此外,氢吗啡酮经肝脏葡萄糖苷转化为无活性的代谢产物氢吗啡酮-3-葡糖苷酸和双氢异吗啡-3-葡糖苷酸,经尿液排出,而不产生吗啡的代谢产物吗啡-6-葡糖苷酸(morphine-6-glucuronide,M6G),从而减少了因M6G蓄积而产生的肾功能损害、呼吸抑制和过度镇静等其他不良反应[10]。同时,氢吗啡酮不引起组胺释放,是哮喘儿童或具有组胺释放相关问题(例如瘙痒)的病人的良好选择[11]。有研究表明,与吗啡比较,氢吗啡酮可提高病人正面情绪反应[12]。总之,氢吗啡酮具有起效迅速、镇痛效果强、不良反应少等适用于儿童术后镇痛的特点。 也有文献报道,与等效剂量的吗啡比较,氢吗啡酮有相似的或稍微少的不良反应[13-14],但研究人群多为大龄儿童(≥8岁)或青少年。本研究中,纳入了低龄儿童应用氢吗啡酮PCA的效果。两年龄段儿童应用氢吗啡酮PCA术后48小时内疼痛评分均较低,镇痛不良反应发生率低,给予补救镇痛后疼痛可得到有效缓解。PCA随访期间,病人恶心呕吐发生率为8.22%,低于吗啡的发生率。未发生呼吸抑制、过度镇静、皮肤瘙痒等不良反应。
PCA是8岁或超过8岁儿童的常用术后镇痛方法[13]。有学者认为,标准的管理方案可以使阿片药物PCA在7岁以下儿童术后中、重度疼痛中取得满意的效果[15]。本研究中术后T1和T2随访中,APS团队人员调节PCA参数的概率为3.93%和6.43%,根据病人情况调节PCA参数,及时处理并发症,提高了盐酸氢吗啡酮PCA用于儿童术后镇痛效果,降低不良反应,提高病人和家属满意度。APS随访管理制度对儿童术后静脉PCA提供更安全的保障,特别是7岁以下低龄儿童。
综上所述,盐酸氢吗啡酮PCA显示出其用于儿童术后镇痛的优势,镇痛效果良好,不良反应发生率低,病人及家属满意度高。
[1] Brasher C,Gafsous B,Dugue S,et al.Postoperative pain management in children and infants:an update[J].Paediatr Drugs,2014,16(2):129-140.
[2] Hong D,Flood P,Diaz G.The side effects of morphine and hydromorphone patient-controlled analgesia[J].Anesth Analg,2008,107(4):1384-1389.
[3] Jeleazcov C,Saari TI,Ihmsen H,et al.Population pharmacokinetic modeling of hydromorphone in cardiac surgery patients during postoperative pain therapy[J].Anesthesiology,2014,120(2):378-391.
[4] Hermens JM,Ebertz JM,Hanifin JM,et al.Comparison of histamine release in human skin mast cells induced by morphine,fentanyl,and oxymorphone[J].Anesthesiology,1985,62(2):124-129.
[5] Verghese ST,Hannallah RS.Acute pain management in children[J].J Pain Res,2010,(3):105-123.
[6] Hudcova J,McNicol E,Quah C,et al.Patient controlled opioid analgesia versus conventional opioid analgesia for postoperative pain[J].Cochrane Database Syst Rev,2006,(4):D3348.
[7] Mahajan C,Dash HH.Procedural sedation and analgesia in pediatric patients[J].J Pediatr Neurosci,2014,9(1):1-6.
[8] Vandenbossche J,Richarz U,Richards HM.Repeat-dose steady-state pharmacokinetic evaluation of once-daily hydromorphone extended-release(OROS((R))hydromorphone ER)in patients with chronic pain[J].J Pain Res,2012,5:523-533.
[9] Vandenbossche J,Richards HM,Lu CC,et al.Dose proportionality and pharmacokinetics of extended-release(OROS(R))hydromorphone:a phase 1,open-label randomized,crossover study in healthy Taiwanese subjects[J].Int J Clin Pharmacol Ther,2014,52(3):217-226.
[10] Wright AW,Mather LE,Smith MT.Hydromorphone-3-glucuronide:a more potent neuro-excitant than its structural analogue,morphine-3-glucuronide[J].Life Sci,2001,69(4):409-420.
[11] Felden L,Walter C,Harder S,et al.Comparative clinical effects of hydromorphone and morphine:a meta-analysis[J].Br J Anaesth,2011,107(3):319-328.
[12] Rapp SE,Egan KJ,Ross BK,et al.A multidimensional comparison of morphine and hydromorphone patient-controlled analgesia[J].Anesth Analg,1996,82(5):1043-1048.
[13] Karl HW,Tyler DC,Miser AW.Controlled trial of morphine vs hydromorphone for patient-controlled analgesia in children with postoperative pain[J].Pain Med,2012,13(12):1658-1659.
[14] Maxwell LG,Kaufmann SC,Bitzer S,et al.The effects of a small-dose naloxone infusion on opioid-induced side effects and analgesia in children and adolescents treated with intravenous patient-controlled analgesia:a double-blind,prospective,randomized,controlled study[J].Anesth Analg,2005,100(4):953-958.
[15] Ousley R,Burgoyne LL,Crowley NR,et al.An audit of patient-controlled analgesia after appendicectomy in children[J].Paediatr Anaesth,2016,26(10):1002-1009.
Patient-controlledintravenousanalgesiawithhydromorphoneforpostoperativepaininchildren:aretrospectiveanalysis
WANGCong,ZHUChangmao,WANGMao,etal.
(DepartmentofAnesthesiology,TongjiHospital,TongjiMedicalCollege,HuazhongUniversityofScienceandTechnology,Wuhan430030,China)
ObjectiveTo explore the clinical efficacy of intravenous patient-controlled analgesia(PCA)with hydromorphone for postoperative pain in children.MethodsThe clinical data,280 children receiving surgery under general anesthesia with postoperative intravenous PCA with hydromorphone for 48 hours from January to December 2016,were collected by acute pain service(APS)at 4~8 hour(T1),10~14 hour(T2),22~26 hour(T3),46~50 hour(T4)after surgery.Pain scores,opioid consumption,sedation score,adverse reactions,intervening measures and patient or parent satisfaction were recorded during the intravenous PCA follow-up course.ResultsAt T1,T2,T3and T4after surgery,patients of 1 to 7 years old FLACC cores(The faces,legs,activity,cry and consolability scale,0~100)were(7.89±11.01),(8.58±9.83),(6.27±6.54),(2.58±5.14),respectively; patients of 8 to 14 years old VAS scores at rest were(6.99±6.58),(3.74±7.17),(3.86±6.71),(1.89±4.17),and were(14.40±9.24),(9.46±10.39),(7.73±9.66),(8.27±7.94)during movement; Ramsay sedation score was 2,the incidence of nausea and vomiting was 8.22%,there were no respiratory depression,excessive sedation and pruritus,and the patient or parent satisfaction with postoperative analgesia was 5.ConclusionPCA with hydromorphone is safe and effective in postoperative pain therapy with moderate side effects in children.
hydromorphone; children; postoperative analgesia; patient-controlled analgesia
10.3969/j.issn.1005-6483.2017.11.022
430030 武汉,华中科技大学同济医学院附属同济医院麻醉科
张咸伟,Email:ourpain@163.com
2017-04-23)
杨泽平)