响应面法优化人参-仙人掌果酒的发酵工艺
2017-12-06乔梦丹戴雨霖韩铭鑫文连奎
乔梦丹,王 微,贺 阳,戴雨霖,韩铭鑫,文连奎,郑 飞,越 皓*
(1.长春中医药大学 吉林省人参科学研究院,吉林 长春 130117;2.吉林农业大学 食品科学与工程学院,吉林 长春 130118)
响应面法优化人参-仙人掌果酒的发酵工艺
乔梦丹1,王 微1,贺 阳2,戴雨霖1,韩铭鑫1,文连奎2,郑 飞1,越 皓1*
(1.长春中医药大学 吉林省人参科学研究院,吉林 长春 130117;2.吉林农业大学 食品科学与工程学院,吉林 长春 130118)
该研究以人参及仙人掌果为原料制作果酒,考察发酵条件对仙参果酒的影响。在单因素试验基础上,选取酵母接种量、发酵温度、初始pH值为影响因子,以酒精度为响应值,应用中心组合Box-Behnken试验和响应面分析法,模拟得到二次多项式回归方程的预测模型,进行响应面分析。结果表明,经优化后的仙参果酒最佳工艺条件为酵母接种量1‰,发酵温度24℃,pH值4.0,在此条件下仙参果酒的酒精度为11.67%vol,感官评分达96分。其中含有总皂苷(93.76±0.86)mg/100 mL和总花青素(10.66±0.39)mg/100 mL。
果酒;发酵工艺;酒精度;感官评分;人参皂苷;花青素
人参是五加科植物人参(Panax ginseng)的干燥根,其主要含有人参皂苷、多糖、氨基酸、蛋白质等有效成分[1-3]。目前,已有大量研究证实人参具有抗氧化、抗疲劳、抗肿瘤、降血糖血脂、促进脂肪代谢、增强免疫力等功效[4-6],其作为新资源食品以来,广泛应用于食品领域。仙人掌果为仙人掌科植物仙人掌的果实,果肉微酸甜,含有丰富的微量元素、蛋白质、氨基酸、维生素、多糖类、黄酮类物质、三萜化合物等营养物质,具有行气活血、祛湿退热、提高免疫力、清除自由基等作用[7-9]。
据统计,当代社会超过70%的人处于亚健康状态。因此,低度保健酒或果酒是目前备受欢迎的保健食品之一,其针对于亚健康人群,能够提高机体免疫力或增加免疫器官和细胞的活性。仙参果酒是以人参和仙人掌果为原料发酵而成的,是富含人参皂苷和花青素等活性成分的低度发酵酒。本研究在前期对仙参果酒进行了功能性试验研究,结果表明其具有较强的体内抗氧化活性和增强免疫力作用。因此,将仙参果酒开发为保健食品,具有广阔的应用前景,能够满足市场的需求。本试验以人参和仙人掌果为原料,通过单因素试验及响应面法优化发酵条件的最佳工艺参数,为仙参果酒的产业化生产提供参考。
1 材料与方法
1.1 材料与试剂
仙人掌果:海南富汇达农业开发有限公司;人参(五年生):吉林省抚松县万良人参市场;矢车菊-3-O-葡萄糖苷标准品(纯度为98%):南京森贝伽生物科技有限公司;人参皂苷Re标准品(批号:110754-201626,纯度为92.3%):中国食品药品检定所;香草醛:上海盈公生物技术有限公司;氢氧化钠、葡萄糖、冰醋酸、盐酸、无水乙醇、甲醇、正丁醇、香草醛、高氯酸、冰醋酸(均为分析纯):北京化工厂;甲基红、酚酞、次甲基蓝:天津市大茂化学试剂厂;双蒸水:实验室自制。
1.2 仪器与设备
SPX-150S-II生化培养箱:上海新苗医疗器械制造有限公司;Centrifuge 5804R型离心机:Eppendonf公司;HH-8型数显恒温水浴锅:常州智博瑞仪器制造有限公司;M200PRO多功能酶标仪:北京世贸远东科学仪器有限公司;BP211D型电子分析天平:上海天平仪器厂。
1.3 方法
1.3.1 工艺流程

1.3.2 操作要点
混合浆液的制备:取洁净的鲜人参加3倍量的水,榨汁;另取新鲜完好且成熟的仙人掌果去皮去刺后,加入2倍量的水榨汁,两者以1∶2比例混合,备用;
成分调整:加入适量蔗糖调整糖度,加入柠檬酸调节pH值;
酵母活化:将酿酒酵母加入5%葡萄糖溶液中,混合均匀,35℃恒温水浴中活化30 min;
发酵:向混合浆液中接种活化后的酵母菌,搅拌均匀,在恒温培养箱中发酵,每隔24 h测定残糖量,当残糖量、酒精度持续3 d保持不变时,发酵结束;
过滤澄清:采用孔径为100~200nm的无机陶瓷膜过滤设备滤过残渣;
调配:对澄清处理过的仙参果酒的糖度以及酸度进行适当的调配。
1.3.3 仙参果酒发酵工艺优化试验
(1)发酵条件的单因素试验
试验对酵母接种量(0.5‰、0.7‰、0.9‰、1.1‰、1.3‰、1.5‰)、发酵温度(15℃、18℃、21℃、24℃、27℃)和初始pH值(3.0、3.3、3.6、3.9、4.2)因素进行优选,以酒精度及感官评分为考察指标,考察3个发酵条件对仙参果酒发酵的影响[10-11]。
(2)响应面法优选发酵工艺
在单因素试验基础上,以酒精度(Y)为响应值,采用3因素3水平的响应面法进行仙参果酒发酵工艺条件的优化[12-13]。以Design-Expert V8.0.5软件对试验进行回归分析,确定发酵的最优工艺参数。响应面试验因素与水平见表1。

表1 果酒发酵工艺优化响应面试验设计因素与水平Table 1 Factors and levels of response surface methodology for fruit wine fermentation conditions optimization
1.3.4 测定方法
(1)理化指标
酒精度测定:采用蒸馏比重法[14];总糖含量:斐林试剂滴定法[15];总酸测定:酸碱滴定法[16];pH值测定:酸度计法[17]。
(2)感官评分
选择20名食品专业的人员,分别对仙参果酒的色泽、香气、口感、状态进行感官评分,满分为100分[8],感官评分标准见表2。

表2 果酒感官评分标准Table 2 Sensory evaluation standards of fruit wine
(3)总花青素的测定
精密称取矢车菊-3-O-葡萄糖苷标准品约10mg于10mL量瓶中,用0.1%盐酸-80%乙醇(15∶85,V/V)溶解并定容,摇匀,作为标准品储备液。分别精密量取标准品储备50 μL、100 μL、150 μL、200 μL、250 μL,加0.1%盐酸-80%乙醇(15∶85,V/V)定容至10mL。以相应试剂作为空白试剂,于波长535nm处测定吸光度值。以吸光度值(Y)对花青素质量浓度(X)作线性回归,绘制标准曲线,得到回归方程和相关系数。精密量取仙参果酒10 mL溶液,40℃水浴挥干,0.1%盐酸-80%乙醇(15∶85,V/V)溶解于100mL量瓶中,稀释并定容,摇匀,即得样品溶液。按上述方法测得吸光度值,代入标准曲线中求得样品中总花青素的质量浓度,并计算含量。
(4)总皂苷的测定
精密称取人参皂苷Re标准品约10 mg于10 mL量瓶中,用甲醇溶解,稀释,并定容,摇匀,作为标准品储备液。分别精密量取标准品储备液60 μL、80 μL、100 μL、120 μL、140 μL置于具塞试管中,60℃水浴挥干,加5%香草醛冰醋酸溶液0.2 mL,高氯酸0.8 mL,摇匀,使残渣全部溶解,60℃水浴加热10 min,冷却,加冰醋酸5.0 mL,以相应试剂作为空白试剂,于波长560 nm处测定吸光度值。以吸光度值(Y)对总皂苷含量(X)作线性回归,绘制标准曲线,得到回归方程和相关系数。精密量取仙参果酒5 mL溶液,60℃水浴挥干,加10 mL的蒸馏水溶解后,同体积水饱和正丁醇萃取4次,合并上层液,60℃水浴挥干,加甲醇溶解于5 mL量瓶中,稀释并定容,摇匀,精密吸取100 μL置于具塞试管中,按上述方法显色并测得吸光度值,代入标准曲线中求得样品中总皂苷的含量。
2 结果与分析
2.1 单因素试验
2.1.1 酵母接种量对仙参果酒发酵的影响
在温度24℃,pH值3.9的条件下,考察不同酵母接种量对发酵过程中的酒精度和感官评价的影响,结果见图1。
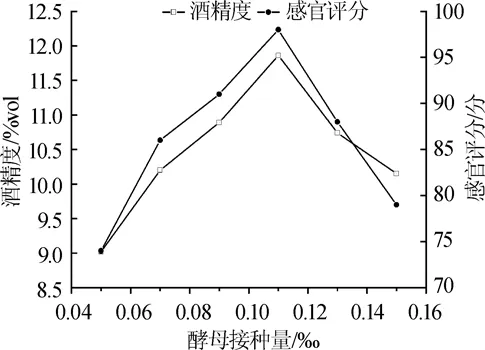
图1 酵母接种量对果酒酒精度和感官评分的影响Fig.1 Effect of yeast inoculum on alcohol content and sensory score of fruit wine
由图1可知,随着酵母接种量的增加,酒精度和感官评分均呈先升高后降低的趋势,当酵母接种量为1.1‰时,仙参果酒的酒精度和感官评分均达到最佳值,分别为11.86%vol、98分。继续增加酵母接种量,仙参果酒的酒精度和感官评分开始下降。因此,仙参果酒发酵酵母接种量选择在1.1‰为宜。
2.1.2 发酵温度对仙参果酒发酵的影响
在酵母添加量1.1‰,pH值3.9的条件下,考察不同温度对发酵过程中的酒精度和感官评价的影响,结果见图2。

图2 发酵温度对果酒中酒精度和感官评价的影响Fig.2 Effect of fermentation temperature on alcohol content and sensory score of fruit wine
由图2可知,随着发酵温度的升高,酒精度和感官评分均呈快速升高后降低的趋势,当发酵温度为24℃时,仙参果酒的酒精度和感官评分均达到最大值,分别为12.11%vol、96分。而此后继续升高发酵温度,测得此时仙参果酒的酒精度及感官评分随发酵温度的升高而下降,这可能是因为发酵温度过高,发酵速度过快,破坏了仙参果酒的整体感官质量,表现为仙人掌果香和酒香不足,有异味,口感粗糙有少量沉淀。因此,选择仙参果酒的发酵温度为24℃为宜。
2.1.3 初始pH对仙参果酒发酵的影响
在酵母添加量1.1‰,温度24℃的条件下,考察pH值对发酵过程中的酒精度和感官评价的影响,结果见图3。
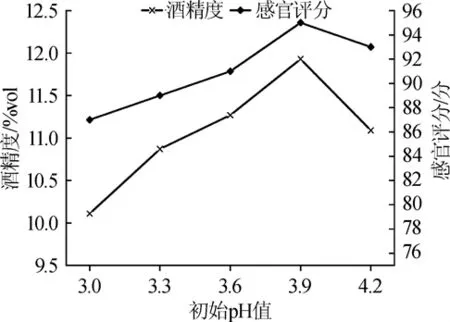
图3 pH对果酒酒精度和感官评分的影响Fig.3 Effect of pH on alcohol content and sensory score of fruit wine
由图3可知,随着仙参果酒的初始pH值升高,酒精度和感官评分均呈现先升高后降低的趋势。当初始pH值为3.9时,仙参果酒的酒精度和感官评分均达到最大值,分别为11.93%vol、95分,此时感官评分达95分。因此,选择仙参果酒的初始pH值为3.9[14]。
2.2 响应面试验优化仙参果酒发酵工艺
2.2.1 仙参果酒发酵响应面试验
在单因素试验基础上,选取酵母添加量(A)、发酵温度(B)、初始pH(C)为3个因素,以酒精度(Y)为响应值,采用3因素3水平的响应面试验考察各发酵条件对仙参果酒发酵结果的影响,结果见表3。

表3 果酒发酵工艺优化响应面试验设计与结果Table 3 Results and analysis of response surface experiments for fruit wine fermentation conditions optimization
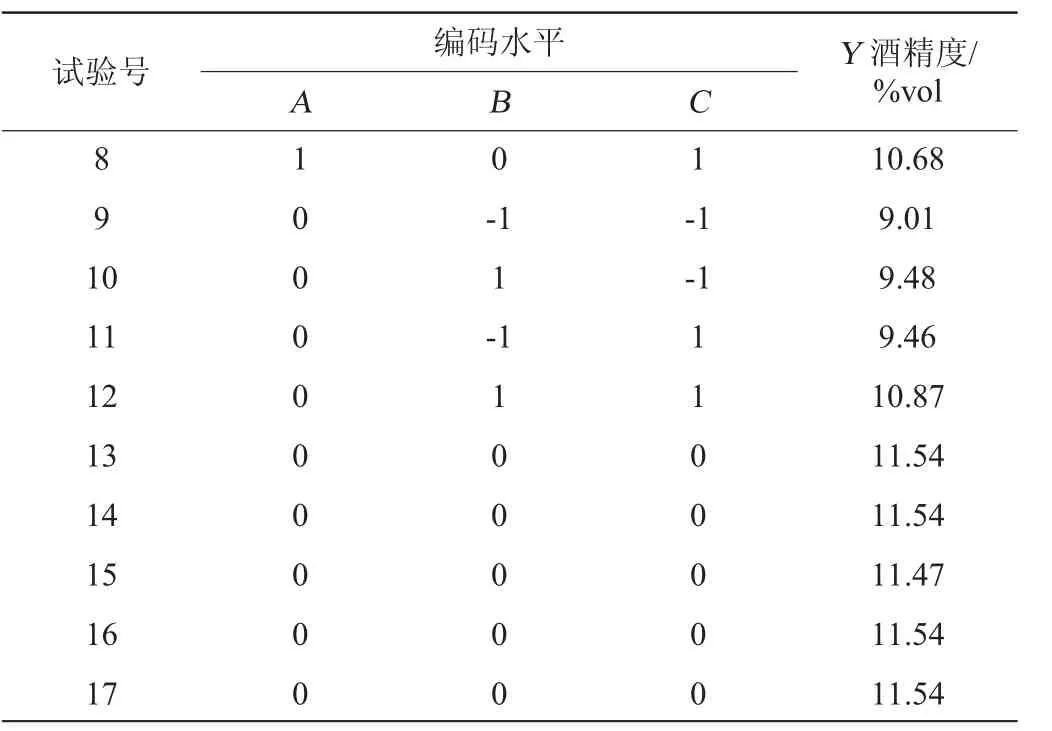
续表
2.2.2 响应面模型建立及显著性分析
通过Design-Expert.V 8.0.6软件对表3中酒精度(Y)进行数据分析,得到回归模型:Y=11.37+0.33A+0.53B+0.42C+0.062AB-0.065AC-0.23BC-0.62A2-0.88B2-0.78C2

表4 响应面试验结果方差分析及显著性检验Table 4 Variance analysis and significance test of response surface experiments results
由表4可知,响应面优化拟合出的方程回归项模型的P值<0.000 1,且失拟项P值0.285 6>0.005,说明本试验所得仙参果酒的酒精度与3个变量的二次回归方程高度显著,可以很好地进行响应值的预测,且拟合得到的回归模型的方程相关系数R2=99.2%,模型调整复相关系数R2adj=0.981 8,说明本试验所建立的回归模型拟合度良好。变异系数(coefficient of variation,CV)=1.29%,表明试验数值具有较高的精密度和可靠性[18-20]。将酒精度作为响应值,方程一次项系数A、B、C,交互项BC和二次项系数A2、B2、C2均具有极显著性(P<0.01)。
通过Design-Expert.V8.0.6软件获得三维响应面和等高线,能够直观地反映出各个因素及其相互作用对试验结果的影响。由图4可知,随着酵母接种量和发酵温度的升高,仙参果酒中的酒精度呈现先升高再下降的抛物线趋势,且两者等高线呈椭圆形状,含有极值,坡度较大,说明这两种因素交互作用显著;而随着酵母接种量和初始pH值的增加或随着发酵温度和初始pH值的增加,仙参果酒中的酒精度的变化趋势同样呈现先升高后降低的趋势,其等高线均呈椭圆状,含有极值,坡度较大。因此,认为酵母接种量、发酵温度、初始pH值这三因素之间,两两交互作用均极显著(P<0.01)。
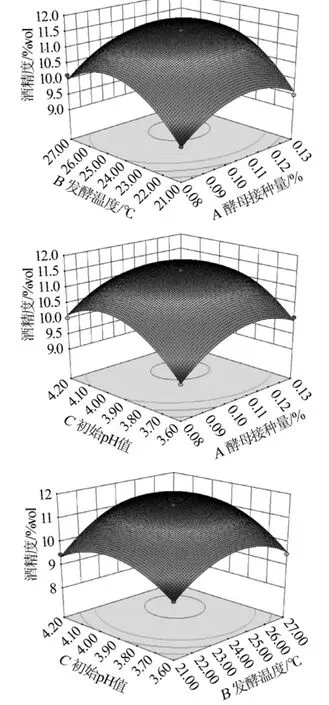
经过Design-Expert.V 8.0.6软件对模型的优化,得到仙参果酒的最佳发酵工艺条件:酵母接种量1.09‰,发酵温度23.88℃,初始pH值4.01,此发酵条件下发酵后的仙参果酒酒精度达11.79%vol。
2.2.3 发酵工艺条件的验证
为了验证模型预测理论值的准确性和真实性,同时为了方便实际操作,将最佳发酵工艺的条件调整为酵母接种量1‰,发酵温度24℃,初始pH值4.0,在此优化条件下进行3次平行性试验,得到仙参果酒的酒精度平均值为(11.67±0.13)%vol。而此条件下的仙参果酒在外观上清澈透亮有光泽,呈紫红色,在香味上,有清香的仙人掌果香和浓郁的酒香,在口感方面也十分纯正爽口,感官评分达96分,结果与预测值相差甚小。因此,采用响应面法优化的仙参果酒的发酵工艺条件准确合理,具有极强的应用价值。
2.3 仙参果酒中功能成分的含量
以矢车菊-3-O-葡萄糖苷标准品的质量浓度(X)为横坐标,吸光度值(Y)为纵坐标,进行线性回归,得回归方程为Y=35.099X-0.000 9,相关系数R=0.999 8,表明矢车菊-3-O-葡萄糖苷标准品质量浓度在0.0049~0.024mg/mL范围内呈良好的线性关系。以人参皂苷Re标准品的含量(X)为横坐标,吸光度值(Y)为纵坐标,进行线性回归,得回归方程为Y=2.3588X-0.0048,相关系数R=0.9997,表明人参皂苷Re标准品含量在0.0553~0.1292mg/mL范围内呈良好的线性关系。
取最佳发酵工艺的条件下制得的仙参果酒,进行6次平行性试验的测定,结果见表5。

表5 果酒中功能成分的含量Table 5 Content of functional components in fruit wine
由表5可知,得到仙参果酒的总花青素、总皂苷含量的平均值分别为(10.66±0.39)mg/100mL、(93.76±0.86)mg/100 mL。
3 结论
通过单因素试验,以酒精度和感官评分为考察指标,确定了酵母接种量、发酵温度和初始pH值对仙参果酒发酵的影响趋势。通过响应面试验,以酒精度为考察指标,优化仙参果酒的发酵工艺,确定了仙参果酒最佳发酵工艺条件为酵母接种量1‰,发酵温度24℃,pH值4.0,在此发酵条件下,酒精度达11.67%vol。此时,仙参果酒中酒精度最优,发酵所得的人参仙人掌果保健酒的酒香浓郁,风味典型性明显,总花青素和总皂苷含量分别为(10.66±0.39)mg/100mL、(93.76±0.86)mL/100 mL,是一种营养丰富的保健型果酒。
[1]秦 禹,孔 波,万丽梅.人参的化学成分及药理作用[J].人参研究,1995(1):14-16.
[2]郭常升,连 奎.响应面法优化人参超微粉碎工艺参数[J].食品研究与开发,2016,37(20):126-131.
[3]黎 阳,张铁军,刘素香,等.人参化学成分和药理研究进展[J].中草药,2009,40(1):164-166.
[4]王海南.人参皂苷药理研究进展[J].中国临床药理学与治疗学,2006,11(11):1201-1206.
[5]SHI Q,HAO Q,BOUISSAC J,et al.Ginsenoside Rd fromPanax notoginsengenhances astrocyte differentiation from neural stem cells[J].Life Sci,2005,76(9):983-995.
[6]LIAN X Y,ZHANG Z,STRINGER J L.Protective effects of ginseng components in a rodent model of neurodegeneration[J].Ann Neurol,2005,57(5):642-648.
[7]严奉伟,汤维东,雷泽湘,等.仙人掌果酱生产工艺研究[J].食品研究与开发,2005,26(1):87-89.
[8]董文明,付晓萍,焦凌梅.仙人掌山楂饮料的研制[J].饮料工业,2013,16(2):600-603.
[9]马丹雅,赵 晶,姚 晶,等.仙人掌果红色素提取工艺及其稳定性研究[J].食品工业科技,2012,33(23):214-217.
[10]曲 迪.响应面法优化桦树液酒发酵工艺[J].食品研究与开发,2016,37(23):124-128.
[11]李文新,陈计峦,唐凤仙,等.响应面法优化黑枸杞-葡萄复合果酒发酵工艺的研究[J].中国酿造,2017,36(5):187-191.
[12]王卫东,黄德勇,郑 义,等.响应面优化黄桃果酒发酵工艺[J].食品安全质量检测学报,2015(3):809-814.
[13]高辰哲,姜 帆,王艳菲,等.响应面法优化红树莓酒发酵工艺[J].中国酿造,2016,35(12):108-112.
[14]中华人民共和国质量监督检验总局,中国国家标准化管理委员会.GB/T 15038—2006葡萄酒、果酒通用分析方法[S].北京:中国标准出版社,2007.
[15]TRUONG V,DEIGHTON N,THOMPSON R T,et al.Characterization of anthocyanins and anthocyanidins in purple-fleshed sweetpotatoes by HPLC-DAD/ESI-MS/MS[J].J Agr Food Chem,2010,58(2):404-410.
[16]毛建霏,付成平,郭灵安,等.可见分光光度法测定紫甘薯总花青素含量[J].食品与发酵科技,2010,46(2):101-104.
[17]蒲立柠,陈光静,阚建全.响应面试验优化青稞麸皮薏仁红曲霉发酵工艺[J].食品科学,2017,38(2):264-270.
[18]ZHAO Q,KENNEDY J F,WANG X,et al.Optimization of ultrasonic circulating extraction of polysaccharides fromAsparagus officinalisusing response surface methodology[J].Int J Bioll Macromol,2011,49(2):181-187.
[19]WANYUAN K,LAI H M.Effects of reaction conditions on the physicochemical properties of cationic starch studied by RSM[J].Carbohyd Polym,2009,75(4):627-635.
[20]SABZALI A,GHOLAMI M,SADATI M A.Enhancement of benzene biodegradation by variation of culture medium constituents[J].Nucleic Instrum Method Physics Res,2009,31(21):439-447.

QIAO Mengdan1,WANG Wei1,HE Yang2,DAI Yulin1,HAN Mingxin1,WEN Liankui2,ZHENG Fei1,YUE Hao1*
(1.JiLin Ginseng Academy,Changchun University of Chinese Medicine,Changchun 130117,China;2.College of Food Science and Engineering,Jilin Agricultural University,Changchun 130118,China)
TS262.7
0254-5071(2017)11-0170-05
10.11882/j.issn.0254-5071.2017.11.037
2017-08-22
吉林省中医药科技项目(2017161)
乔梦丹(1992-),女,硕士研究生,研究方向为药品新剂型的研究与开发。
*通讯作者:越 皓(1977-),男,研究员,博士,研究方向为天然产物成分分析。
