成都地区足月新生儿胎盘铅镉元素的分布特点*
2017-12-05刘丽筠赵洪玥刘瀚旻曾红燕
刘丽筠,姚 强,赵洪玥,朱 婧,谢 亮,邓 莹,刘瀚旻,曾红燕,代 礼,,△
(1.四川大学华西第二医院出生缺陷与相关妇儿疾病教育部重点实验室,成都 610041;2.四川大学华西第二医院妇产科,成都 610041;3.四川大学华西公共卫生学院卫生检验系,成都 610041;4.四川大学华西第二医院中国出生缺陷监测中心,成都 610041)
成都地区足月新生儿胎盘铅镉元素的分布特点*
刘丽筠1,姚 强2,赵洪玥3,朱 婧3,谢 亮1,邓 莹4,刘瀚旻1,曾红燕3,代 礼1,2,4△
(1.四川大学华西第二医院出生缺陷与相关妇儿疾病教育部重点实验室,成都 610041;2.四川大学华西第二医院妇产科,成都 610041;3.四川大学华西公共卫生学院卫生检验系,成都 610041;4.四川大学华西第二医院中国出生缺陷监测中心,成都 610041)
胎盘;铅;镉;石墨炉原子吸收光谱法
重金属如铅、镉等非生命活动所需,且具有生殖毒性和发育毒性。研究证实宫内铅、镉暴露是胎儿生长受限、小于胎龄儿、流产、早产的危险因素[1-2];铅暴露还与儿童神经功能发育、学习能力障碍有关[3];孕妇职业铅暴露可增加胎儿神经管畸形、唇腭裂的风险[4]。近半个世纪以来,胎盘重金属元素含量被广泛应用于生物监测和病因关联研究中;但目前国际上还没有形成统一规范的暴露评价方案或标准操作流程,在取样方法、位置、样品预处理等方面尚存在争议[5-6]。本研究采集了健康足月新生儿胎盘不同位置的绒毛组织样品,分析不同采样位置间元素分布的特点,为相关研究提供参考。
1 资料与方法
1.1一般资料 研究对象为2016年5-7月在四川大学华西第二医院足月妊娠产妇所娩出的新生儿胎盘。男13例、女17例,孕周37~41周,平均38.8周;出生体质量2 370~3 850 g,平均体质量3 273.3 g;胎盘质量426~761 g,平均质量为586.8 g;产妇年龄26~38岁,平均31.1岁。产妇及新生儿入选条件:产妇在成都城区居住1年以上,无铅、镉职业暴露,为非吸烟者;新生儿无宫内发育迟缓,经检查无出生缺陷。
1.2方法
1.2.1样品收集 征得产妇或家属知情同意,在胎盘娩出后1 h内收集包膜完整、无破损、无缺失的胎盘共计30例。先用生理盐水冲洗干净胎盘表面的血液及血块,再用钛刀、钛镊清除胎盘胎儿面的羊膜和绒毛膜板;以脐带切口平面脐静脉所指为12点钟方向把胎盘胎儿面分为左、右区,于左区中心位置1/4半径(A点)和右区中心位置3/4半径处(B点)分别取约5 g绒毛小叶组织(湿重)置于专用冻存管,立即放入液氮罐中,而后转运至-80 ℃冰箱中保存备用。
1.2.2试剂与仪器
1.2.2.1试剂 硝酸(优级纯)、过氧化氢(分析纯)、胶体钯基体改进剂、超纯水。国家铅标准液1 000 μg/mL和镉标准液1 000 μg/mL。
1.2.2.2仪器与设备 主要仪器有万分之一电子天平、低温冷冻干燥仪(德国Christ ALPHA 1-2LD)、微波消解仪(成都奥勒普 APL MD6CN-H)、原子荧光光度计(北京吉天AFS-8230)、原子吸收分光光度计(美国Perkin Elmer PinAAcle 900T)。
1.2.2.3标准溶液配制 配制铅标准中间液(10.0 μg/mL)、铅标准使用液(50.0 mg/L),使用前将铅标准使用液(50.0 mg/L)稀释为0、10.0、20.0、30.0、50.0 mg/L的铅标准曲线工作液。采用同样操作流程分别配制了镉标准中间液(10.0 μg/mL)、镉标准使用液(5.0 mg/L)及浓度为0、1.0、2.0、3.0、5.0 mg/L标准曲线工作溶液。
1.2.3检测步骤
1.2.3.1样品预处理 准确称取一定量冷冻干燥后的样品于微波消解罐中,加入5 mL硝酸、1 mL过氧化氢,按80 ℃ 20 min、120 ℃ 30 min、160 ℃ 20 min的程序进行微波消解;冷却后用纯水转移定容至10 mL比色管中待测;同时做消解空白。
1.2.3.2样品测定 按表1程序用石墨炉原子吸收分光光度计同时测定标准液和样品溶液,采用标准曲线法定量。铅测定时光谱仪波长为283.31 nm,镉测定时光谱仪波长为228.80 nm;狭缝0.7 nm,取样体积10 μL,基体改进剂体积5 μL,自动进样器进样。
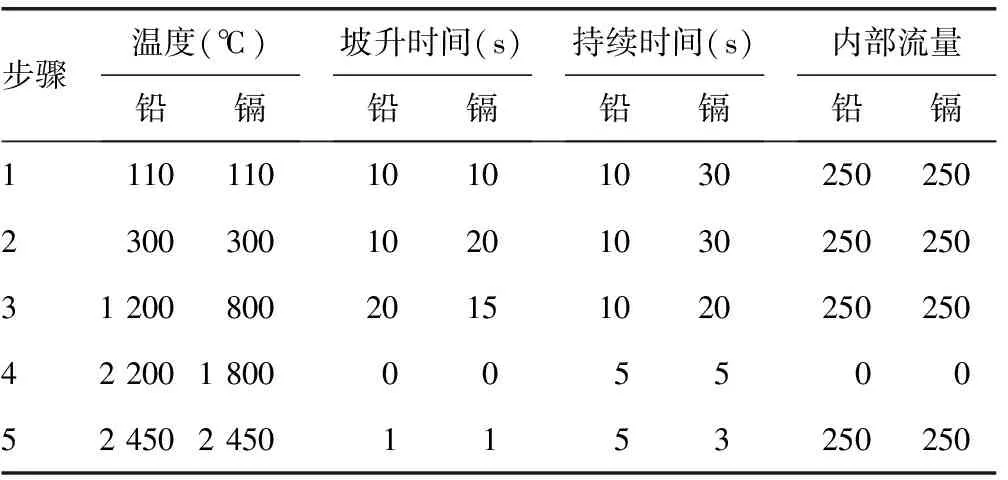
表1 铅和镉测定的炉程序
1.2.3.3实验室质量控制 在样品正式测量前和测量过程中使用标准液优化检测条件,获得稳定结果后,才检测正式样品。测定过程中抽取部分样品平均分成2个独立编码的样品插入检测序列中,监督平行样的一致性。本研究中检测方法的精密度、加标回收率均能满足分析要求(表2)。

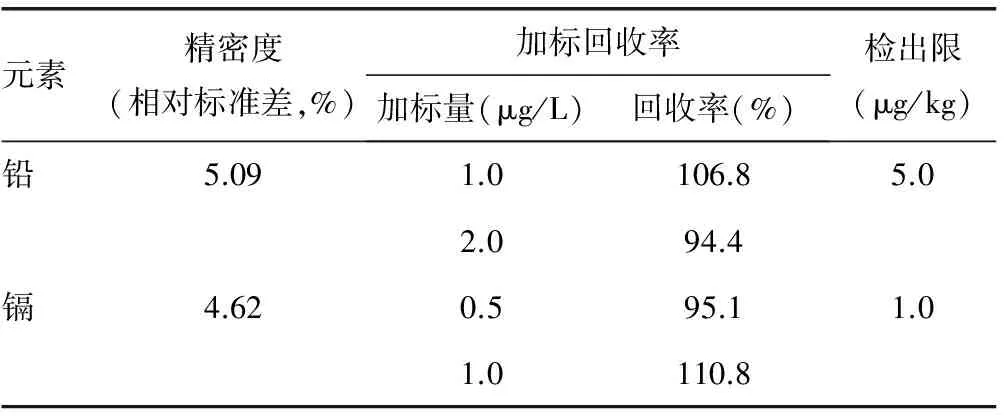
表2 铅和镉含量检测的方法学指标
2 结 果
2.1胎盘不同取样位置元素含量的检测结果 不同取样位置胎盘组织铅镉含量的检测结果见表3。胎盘胎儿面绒毛组织中铅镉两种元素的检出率均为100%。取样位置A的铅含量5.0~328.0 μg/kg,平均91.5 μg/kg;镉含量10.0~185.0 μg/kg,平均66.7 μg/kg。取样位置B的铅含量13.0~320.0 μg/kg,平均88.9 μg/kg;镉含量13.0~149.0 μg/kg,平均64.8 μg/kg。A点的铅镉含量高于B点,但差异无统计学意义(P>0.05)。
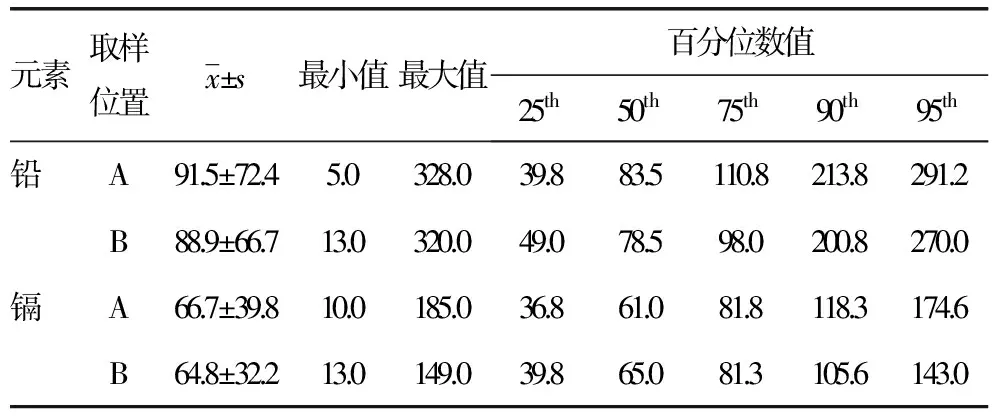
表3 不同取样位置胎盘组织铅镉含量的检测结果(μg/kg)
25th、50th、75th、95th、95th:表示相应的百分位数值
2.2胎盘不同取样位置间元素含量的比较 表4显示了积差相关和秩相关分析结果,A点和B点胎盘组织的铅含量呈显著正相关,相关系数分别为0.98和0.97。A点和B点镉含量的相关性也差异有统计学意义(P<0.05),直线相关系数和秩相关系数分别为0.90和0.96。见表4。
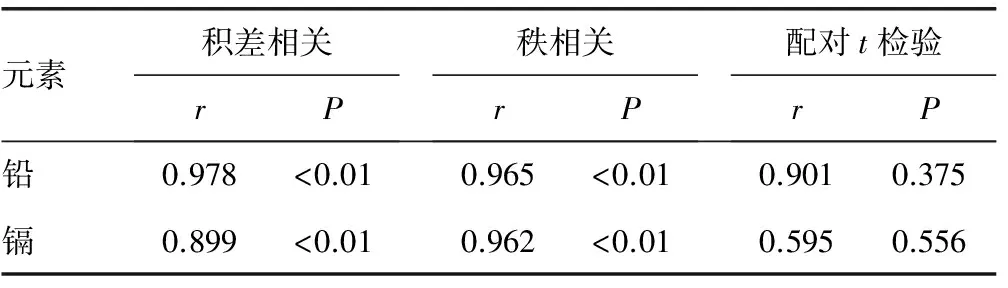
表4 不同取样位置胎盘组织铅镉含量的相关分析和配对t检验结果
3 讨 论
胎盘环境污染物含量能反映胎儿内暴露水平及母体的外暴露水平。宫内重金属暴露与不良妊娠结局的关联研究是近年来围生医学和流行病学研究的热点[1,7-10]。目前学术界还没有就其标准化应用达成共识,直接影响了研究结果的准确性和结论的可比性[5-6]。既往研究关于胎盘预处理和冻存样品的应用基本一致,认为胎盘预处理、清除表面液体及冷冻均可改变铅镉含量[11];争论的焦点在于:(1)铅镉等重金属元素在胎盘不同位置的分布是否一致,是否需要均一化处理? (2)胎盘不同类型的组织中重金属含量有无差别?(3)采用样品干重还是湿重来计算元素含量?实际上,这些因素对胎盘重金属元素含量有不同程度的影响[5-6]。Lagerkvist等[12]认为胎盘不同部位铅镉含量差别明显,其他研究则认为含量没有差别[4,13],均一化样品反而增加污染概率。元素含量在胎盘不同组织中差别明显,合体滋养层铅含量更高[14],而胎膜面镉含量较低[15]。
本研究中胎盘干重铅镉含量变动在5~328 μg/kg及10~185 μg/kg;A点靠近脐带根部,其绒毛小叶组织的铅镉含量稍高于靠近边缘的B点,但差异无统计学意义(P>0.05);同一胎盘不同位置的绒毛小叶组织其干重铅镉含量高度相关,相关系数分别为0.98和0.97。冻存样品水分含量会发生变化,以往研究应用干重和湿重含量的各占一半[6];为了便于比较,有研究直接使用固定的干湿重比来计算含量。本研究中样品的干湿重含量比变动在5.3~10.2 kg,与已有报道基本一致[6]。直接检测新鲜组织样品在大样本人群研究中的可行性低,干重含量可以消除其他因素的影响,更为合理。考虑到胎盘重金属含量的组织差异性,本研究仅采集了绒毛小叶进行检测,石墨炉原子吸收光谱法对痕量元素的检测敏感度和稳定性高,本研究结果基本能够反映成都地区足月新生儿胎盘中铅镉含量情况。值得注意的是,这些结果远高于上海[6]、北京地区[16]正常新生儿胎盘中的铅镉含量,也高于国外其他研究报道[6,17]。Falcon等[18]发现40.6%不良妊娠结局中胎盘干重铅含量超过120 μg/kg,而Llanos等[9]报道胎盘干重铅含量超过210 μg/kg与胎儿宫内生长受限有关。Kippler等[4]认为胎盘干重镉含量超过110 μg/kg会损害胎盘营养素转运功能,影响胎儿发育。本研究中胎盘干重铅含量超过210 μg/kg和镉含量超过110 μg/kg占10%。可见,继续探索重金属宫内暴露相关的不良健康效应引起重视。
成人机体中有毒重金属元素可来源于各种环境污染,但胎儿的唯一来源是母体。母体暴露水平的高低和胎盘对不同重金属的转运功能都会影响胎盘元素含量。母亲居住在重污染区或孕期吸烟其新生儿胎盘铅镉含量较高[6]。胎盘铅镉含量还受母体和胎盘金属硫蛋白基因调控[19],胎盘镉含量高达母体血液的10倍[20]、脐带血的100倍[21];相反的是,母体外周血和脐带血铅水平远远高于胎盘[6]。重金属元素除了通过胎儿血液作用于靶器官,还能干扰胎盘功能,影响生化代谢过程,如抑制胎盘抗氧化。从这个角度来说,胎盘重金属元素含量是一种可靠的内暴露指标,规范的暴露评价方法有利于获得稳定可靠的结果,且便于不同研究结果的横向比较[22]。
在规范胎盘预处理、取样位置、组织类型和检测过程的基础上,本研究结果表明胎盘中心区域(1/4~3/4半径)处取样的绒毛小叶组织干重铅镉含量稳定,能够代表该区域内的平均水平,可作为可靠的重金属宫内暴露标记物用于大样本流行病学研究。胎盘样品在宫内暴露评价中具有非常重要的应用价值[5,22],目前国内外还缺乏相应的标准化操作技术指南,研究结果可为相关研究提供参考。
[1]Scaal M,Schweinsberg F,Kaiserling E.Mercury concentrations in fetuses with malformations[J].Zentralbl Hyg Umweltmed,1998,201(4/5):413-421.
[2]Baranowska I.Lead and cadmium in human placentas and maternal and neonatal blood (in a heavily polluted area) measured by graphite furnace atomic absorption spectrometry[J].Occup Environ Med,1995,52(4):229-232.
[3]Zagrodzki P,Zamorska L,Borowski P.Metal (Cu,Zn,Fe,Pb) concentrations in human placentas[J].Cent Eur J Public Health,2003,11(4):187-191.
[4]Kippler M,Hoque AM,Raqib R,et al.Accumulation of cadmium in human placenta interacts with the transport of micronutrients to the fetus[J].Toxicol Lett,2010,192(2):162-168.
[5]Taylor CM,Golding J,Emond AM.Lead,cadmium and mercury levels in pregnancy:the need for international consensus on levels of concern[J].J Dev Orig Health Dis,2014,5(1):16-30.
[6]Esteban-Vasallo MD,Aragones N,Pollan M,et al.Mercury,cadmium,and lead levels in human placenta:a systematic review[J].Environ Health Perspect,2012,120(10):1369-1377.
[7]Ahamed M,Mehrotra PK,Kumar P,et al.Placental lead-induced oxidative stress and preterm delivery[J].Environ Toxicol Pharmacol,2009,27(1):70-74.
[8]Klapec T,Cavar S,Kasac Z,et al.Selenium in placenta predicts birth weight in normal but not intrauterine growth restriction pregnancy[J].J Trace Elem Med Biol,2008,22(1):54-58.
[9]Llanos MN,Ronco AM.Fetal growth restriction is related to placental levels of cadmium,lead and arsenic but not with antioxidant activities[J].Reprod Toxicol,2009,27(1):88-92.
[10]Zhang YL,Zhao YC,Wang JX,et al.Effect of environmental exposure to cadmium on pregnancy outcome and fetal growth:a study on healthy pregnant women in China[J].J Environ Sci Health A Tox Hazard Subst Environ Eng,2004,39(9):2507-2515.
[11]Khera AK,Wibberley DG,Dathan JG.Placental and stillbirth tissue lead concentrations in occupationally exposed women[J].Br J Ind Med,1980,37(4):394-396.
[12]Lagerkvist BI,Sandberg S,Frech W,et al.Is placenta a good indicator of cadmium and lead exposure[J].Arch Environ Health,1996,51(5):389-394.
[13]Piasek M,Blanusa M,Kostial K,et al.Placental cadmium and progesterone concentrations in cigarette smokers[J].Reprod Toxicol,2001,15(6):673-681.
[14]Reichrtova E,Dorociak F,Palkovicova L.Sites of lead and nickel accumulation in the placental tissue[J].Hum Exp Toxicol,1998,17(3):176-181.
[15]Milnerowicz H.Metalloproteins in human placenta and fetal membranes in non-smoking and smoking women[J].Acta Biochim Pol,1993,40(1):179-181.
[16]Jin L,Zhang L,Li Z,et al.Placental concentrations of mercury,lead,cadmium,and arsenic and the risk of neural tube defects in a Chinese population[J].Reprod Toxicol,2013,35(1):25-31.
[17]Al-Saleh I,Shinwari N,Mashhour A,et al.Heavy metals (lead,cadmium and mercury) in maternal,cord blood and placenta of healthy women[J].Int J Hyg Environ Health,2011,214(1):79-101.
[18]Falcon M,Vinas P,Luna A.Placental lead and outcome of pregnancy[J].Toxicology,2003,185(1):59-66.
[19]Tekin D,Kayaalti Z,Aliyev V,et al.The effects of metallothionein 2A polymorphism on placental cadmium accumulation:Is metallothionein a modifiying factor in transfer of micronutrients to the fetus[J].J Appl Toxicol,2012,32(4):270-275.
[20]Roels H,Hubermont G,Buchet JP,et al.Placental transfer of lead,mercury,cadmium,and carbon monoxide in women.Ⅲ.Factors influencing the accumulation of heavy metals in the placenta and the relationship between metal concentration in the placenta and in maternal and cord blood[J].Environ Res,1978,16(1/3):236-247.
[21]Needham LL,Grandjean P,Heinzow B,et al.Partition of environmental chemicals between maternal and fetal blood and tissues[J].Environ Sci Technol,2011,45(3):1121-1126.
[22]Gundacker C,Hengstschlager M.The role of the placenta in fetal exposure to heavy metals[J].Wien Med Wochenschr,2012,162(9/10):201-206.
DistributioncharacteristicsofplacentalleadandcadmiumelementsamongfulltermneonatesinChengduarea*
LiuLijun1,YaoQiang2,ZhaoHongyue3,ZhuJing3,XieLiang1,DengYing4,LiuHanmin1,ZengHongyan3,DaiLi1,2,4△
(1.KeyLaboratoryofBirthDefectsandRelatedDiseasesofWomenandChildren(SichuanUniversity)ofMinistryofEducation,Chengdu,Sichuan610041,China;2.DepartmentofObstetricsandGynecology,WestChinaSecondHospital,SichuanUniversity,Chengdu,Sichuan610041,China;3.FacultyofHealthInspection,PublicHealthSchool,SichuanUniversity,Chengdu,Sichuan610041,China;4.NationalCenterforBirthDefectsMonitoring,WestChinaSecondHospital,SichuanUniversity,Chengdu,Sichuan610041,China)
placenta;lead;cadmium;heavy metals;graphite furnace atomic absorption spectrometry
目的调查足月新生儿胎盘不同取样位置样品的铅镉含量,探讨胎盘样品在宫内重金属暴露评价中的作用。方法收集四川大学华西第二医院2016年5-6月30个健康足月新生儿胎盘,以脐带横截面脐静脉为12点钟方向将胎盘子面分为左右两个部分,分别在左部1/4半径处(A点)和右部分3/4半径处(B点)采集绒毛小叶组织样品;应用石墨炉原子吸收光谱法检测样品铅镉含量,对A、B位置间元素含量进行相关分析和配对t检验。结果胎盘A点干重样品的平均铅、镉含量分别为91.8、66.7 μg/kg,B点干重样品相应的平均含量为88.9、64.8 μg/kg。两个部位的铅、镉含量均呈正相关,相关系数分别为0.98和0.97,且不同部位组织间的含量差异无统计学意义(P>0.05)。结论胎盘子面中心部分(1/4~3/4半径区域)绒毛小叶组织中铅镉含量基本一致,是评价宫内重金属暴露的可靠指标。
R172
A
1671-8348(2017)31-4336-03
10.3969/j.issn.1671-8348.2017.31.005
国家自然科学基金资助项目(81673257);四川省科技厅项目(2013SZ0179)。
刘丽筠(1989-),助理实验师,本科,主要从事出生缺陷与相关妇儿疾病研究。△
,E-mail:daili@scu.edu.cn。
ObjectiveTo investigate the lead and cadmium contents in different sampling sites from full term neonatal placenta and to explore the role of placental sample in the evaluation of intrauterine heavy metals exposure.MethodsThe placentas from 30 healthy full term neonates were collected from the West China Second Hospital of Sichuan University during May and June 2016.Each placenta fetal side was divided into the left and right parts with the umbilical vein in the umbilical cord cross-section as the 12 o′clock direction.The villus lobular tissue samples were taken from the 1/4 radius in left part (site A) and 3/4 radius in the right part (site B).The graphite furnace atomic absorption spectrometry was used to detect the lead and cadmium contents in the samples.The elements contents in the site A and B were performed the paired t-test and correlation analysis.ResultsThe mean contents of lead and cadmium in dry weight sample at placental site A were 91.8 and 66.7 μg/kg which at the site B were 88.9 and 64.8 μg/kg respectively.The lead and cadmium contents at these two sites presented the positive correlation,the coefficients were 0.98 and 0.97 respectively,whereas the difference in contents between the tissues from different placental sites had no statistical significance.ConclusionThe lead and cadmium contents of villus lobular tissue in the central part of placenta fetal side (1/4-3/4 radius area ) are basically consistent,which is a reliable indicator for evaluating the intrauterine heavy metals exposure.
2017-05-18
2017-07-01)
