大孔树脂吸附纯化茯苓多糖工艺研究
2017-12-02张洪坤
张洪坤
(山东商业职业技术学院食品药品学院,山东济南250103)
大孔树脂吸附纯化茯苓多糖工艺研究
张洪坤
(山东商业职业技术学院食品药品学院,山东济南250103)
以茯苓提取粗多糖为原料,考察7种大孔树脂纯化茯苓提取粗多糖的效果。通过静态吸附-洗脱试验结果表明,AB-8型大孔树脂对茯苓提取粗多糖的脱色率与多糖回收率均优于其它种类树脂。通过动态吸附-洗脱试验结果,得到最佳纯化茯苓提取粗多糖的工艺条件为:配制5.0 mg/mL的茯苓粗多糖提取液,以2 BV/h流速上样至柱体积为7 BV的AB-8型大孔树脂内吸附,随后采用5 BV的50%乙醇溶液,以2 BV/h流速洗脱。通过定量分析结果表明,在最佳纯化工艺条件下,茯苓提取粗多糖的脱色率达到85.2%,多糖回收率为75.4%。
大孔树脂;茯苓;多糖;纯化
茯苓(Poria cocos)是多孔菌科的卧孔菌属真菌,因具有渗湿利尿,和胃健脾,宁心安神的功效,而被广泛用于经典方剂[1-2]。茯苓除可供药用外,亦可被制成多种滋补保健食品,从而具有药食两用的特性[3-4]。茯苓主要化学成分为多糖和三萜类化合物,其中多糖比重占其干重的70%~90%,现代药理学证明茯苓多糖具有降糖、降脂、抗肿瘤、抗病毒、抗氧化、增强机体免疫等作用[5],然而茯苓提取粗多糖,通常混有色素等杂质,因此前人对其粗产物的纯化,进行了大量的研究[6-7],采取双氧水氧化法、金属络合法脱除色素,但上述纯化方法易出现多糖变性,且使得其它有害溶剂残留,因此不能实际有效提高目标产物的纯度。
大孔树脂吸附分离技术,综合机械筛分与化学吸附的优点,具有选择性好、稳定性高、干扰因素少、使用周期长、可重复循环利用等特点,被广泛应用于天然产物的分离与纯化[8-10]。本研究在茯苓多糖的提取工艺基础上,利用大孔树脂纯化提取的粗多糖,探究最佳纯化工艺,并釆用硫酸-苯酚法定量分析[11],从而为茯苓多糖下游产业的发展提供基础。
1 材料与方法
1.1 材料与仪器
茯苓:湖北恩施;AB-8、D101型大孔树脂:陕西蓝深特种树脂有限公司;NKA-9、X-5型大孔树脂:天津南开大学化工厂;HPD 300、HPD 600、DM 130 型大孔树脂:沧州宝恩生化制剂厂;其余化学试剂均为分析纯:国药集团化学试剂有限公司;试验用水为纯化水。
UV-2450紫外-可见分光光度计:日本岛津公司;AE224型电子天平:上海舜宇恒平科学仪器有限公司;878-A/B型高速多功能粉碎机:常州国华电器有限公司;5804R台式高速大容量离心机:艾本德中国有限公司;DZF-6020真空干燥箱:常州恒隆仪器有限公司;SHY-2A水浴恒温振荡器:常州国宇仪器制造有限公司。
1.2 方法
1.2.1 提取方法
茯苓粉碎,过60目筛备用。准确称取10.0 g茯苓过筛粉碎物,前后3次各加入500 mL水,煎煮过滤,合并滤液后减压浓缩,加入95%乙醇溶液静置过夜后,离心,分别用无水乙醇、丙酮、乙醚洗涤沉淀物,真空干燥即得茯苓提取粗多糖[12]。
1.2.2 树脂预处理
将大孔树脂浸泡于90%乙醇中24 h,充分溶胀后湿法装柱,后用90%乙醇反复冲洗,直至流出液与水混合(V液∶V水=1∶5)无白色浑浊出现,再用水洗至无乙醇气味,加入3%HCl浸泡3 h,用水洗至中性;再用3%NaOH溶液浸泡3 h,用水洗至中性,备用[14]。
1.2.3 静态吸附-洗脱
分别称取2.0 g 7种大孔树脂(D101、AB-8、NKA-9、X-5、HPD-300、HPD-600、DM 130型)于 100 mL 锥形瓶内,分别加入等浓度的茯苓多糖提取液50 mL,放置于恒温水浴振荡器中,静态吸附24 h后过滤,通过下式计算不同种类树脂对提取液中色素和多糖的静态吸附率。

式中:A0为提取液色素吸光度;Ae为吸附后滤液中色素吸光度;Q1为色素吸附率,%;m0为提取液多糖质量,mg;me为吸附后滤液中多糖质量,mg;Q2为多糖吸附率,%。
将吸附后的树脂置于锥形瓶内,加入50%乙醇30 mL,继续放置于恒温水浴振荡器中,洗脱24 h,过滤,通过下式计算7种大孔树脂静态吸附-洗脱后提取液中脱色率与多糖回收率。

式中:Ad为洗脱液色素吸光度;Dd为脱色率,%;md为洗脱液多糖质量,mg;R为多糖回收率,%。
1.2.4 单因素试验
1.2.4.1 提取液质量浓度对多糖吸附率影响
分别将 0.5、1.0、5.0、10.0、15.0g/mL 提取液,以 2BV/h上样流速,加入至5 BV树脂柱,以多糖吸附率为考察指标,观察提取液质量浓度对多糖吸附率影响。
1.2.4.2 上样流速对多糖吸附率影响
将 5.0 g/mL 提取液,分别以 1、2、3、4、5 BV/h 上样流速加入至5 BV树脂柱,以多糖吸附率为考察指标,考察上样流速对多糖吸附率影响。
1.2.4.3 树脂柱体积对多糖吸附率影响
将5.0 g/mL提取液,以2 BV/h上样流速,分别加入至 1、3、5、7、9 BV 树脂柱,以多糖吸附率为考察指标,观察树脂柱体积对多糖吸附率影响。
1.2.4.4 乙醇体积分数对脱色率影响
分别将10%、30%、50%、60%、70%的 7 BV 乙醇以2 BV/h流速对最佳吸附后的AB-8型大孔树脂进行洗脱,以脱色率为考察指标,观察乙醇体积分数对脱色率影响。
1.2.4.5 洗脱流速对脱色率影响
将 7 BV 50%乙醇分别以 1、2、3、4、5 BV/h 流速对最佳吸附后的AB-8型大孔树脂进行洗脱,以脱色率为考察指标,观察洗脱流速对脱色率影响。
1.2.4.6 乙醇用量对脱色率影响
分别将 1、3、5、7、9 BV 的 50%乙醇分别以 2 BV/h流速对最佳吸附后的AB-8型大孔树脂进行洗脱,以脱色率为考察指标,观察乙醇用量对脱色率影响。
1.2.5 色素检测
由于色素物质成分复杂,表征较为困难,难以确定色素的种类,因此采取可见光区平均脱色率法[13],对茯苓提取粗多糖溶液于200 nm~600 nm波长范围内扫描,分别取 250、300、350、400、450、500、550、600 nm 处吸光度,计算平均吸光度值,作为茯苓提取粗多糖溶液中色素的检测值,平行测定3次。
1.2.6 多糖含量检测
显色液配制:将50 mL浓硫酸与10 mL水配制成硫酸溶液后,加入0.6 g苯酚,搅拌均匀。
含量测定:以不同浓度含有显色剂的葡萄糖标准溶液为横坐标,490 nm处的吸光度为纵坐标,绘制标准曲线方程:A490=0.052 1C+0.037 4(r=0.999 9),准确称取1 g提取物完全溶于50 mL纯化水中,加入显色剂后,振荡混匀,移取1 mL样品溶液,以纯化水为空白对照,于490 nm处测定溶液中多糖的吸光度,根据标准曲线得到提取粗产物中多糖的含量,平行测定3次[11]。
2 结果与分析
2.1 粗产物含量
利用1.2.2与1.2.3所述检测方法,分别测定茯苓提取粗多糖中色素与多糖含量,结果见表1所示。

表1 茯苓提取粗产物中色素与多糖含量Table 1 The contention of polysaccharide and pigment of Poria cocos extract
2.2 不同树脂吸附-洗脱性能比较
不同种类树脂的静态吸附-洗脱性能比较见表2。
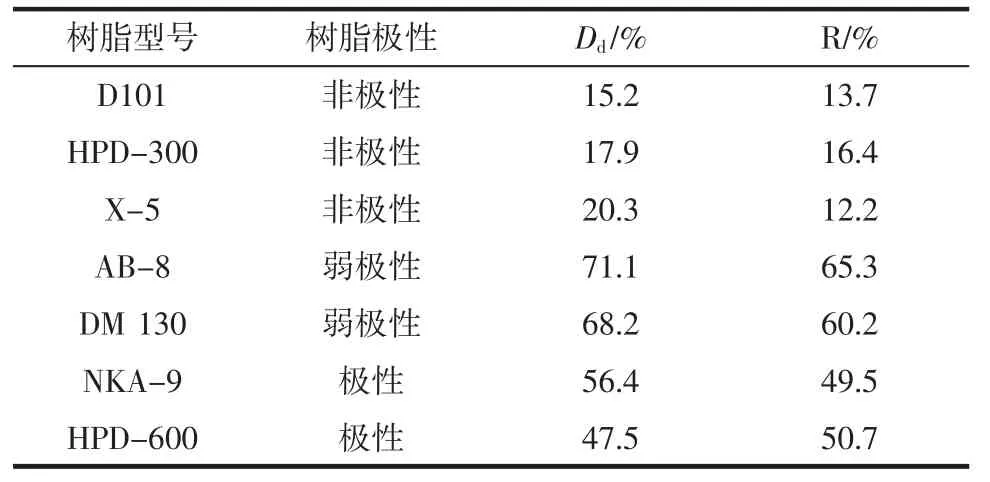
表2 不同种类树脂的静态吸附-洗脱性能比较Table 2 Comparison of static adsorption and desorption performance of different macroporous resins
从表2中可见,AB-8型大孔树脂的脱色率及多糖回收率均高于其它6种树脂,分别为71.1%和65.3%,这源于茯苓提取粗多糖中色素杂质多为弱极性化合物,易与AB-8型大孔树脂特殊的空间结构产生较强物理吸附作用,因此本研究选取AB-8型大孔树脂纯化茯苓提取粗多糖。
2.3 吸附动力学研究
根据2.2.2中静态吸附试验条件,在不同时间下测定静态下AB-8型大孔树脂的色素与多糖吸附率,绘制静态吸附动力曲线,见图1。

图1 AB-8型大孔树脂静态吸附动力曲线Fig.1 Static adsorption curve of AB-8 resin
吸附起始阶段,色素与多糖的吸附速率均较大,10 h左右多糖吸附趋于平缓,12 h后色素吸附趋于平衡,表明AB-8型大孔树脂静态饱和吸附茯苓提取粗产物中色素与多糖耗时较为合理。
2.4 吸附工艺研究
2.4.1 单因素试验结果
表3为吸附工艺研究单因素试验结果,提取液质量浓度为5.0 g/mL,上样流速3 BV/h,树脂柱体积为5 BV时,多糖吸附率达到各单因素变化最佳。

表3 单因素试验结果Table 3 Results of single factor experiment
2.4.2 正交试验
采用L9(34)正交试验法,以多糖吸附率为衡量指标,考察提取液质量浓度、上样流速和树脂柱体积对吸附效果的影响,根据单因素试验结果,相关因素水平见表4所示。按照表5试验条件,配制3种等体积不同质量浓度的茯苓多糖提取液,分别上样至预处理后的树脂柱中吸附,收集流出液,按照1.2.3所述方法测定流出液中多糖含量,照式(2)计算多糖吸附率,相关方差分析见表6所示。
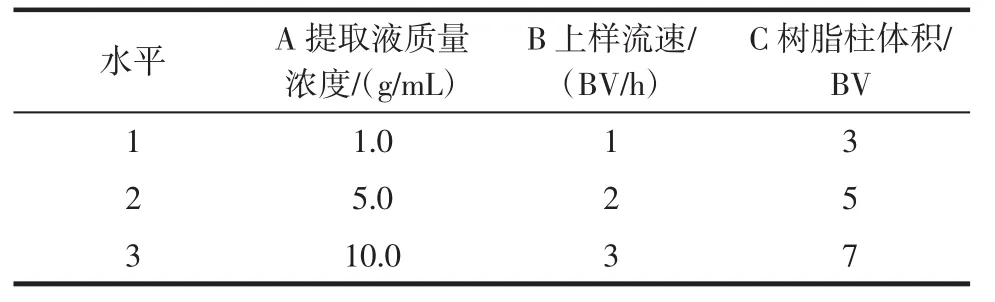
表4 正交试验因素水平Table 4 Table of the factorial experiment

表5 多糖吸附正交试验Table 5 Results of the orthogonal-test method of polysaccharide adsorption

表6 多糖吸附工艺方差分析Table 6 Analysis of variance for the polysaccharide adsorption factors
从表5与表6中结果可知,各因素对AB-8型大孔树脂吸附提取物中多糖效果的影响顺序为B>C>A,提取液上样流速对吸附效果影响显著,最佳吸附工艺条件为A2B2C3。降低上样流速有利于增长提取液与树脂的接触时间,同时树脂柱体积增大有助于避免多糖的饱和吸附提前,充分发挥其吸附性能,因此选择配制5.0 mg/mL的茯苓多糖提取液,以2 BV/h流速,上样至柱体积为7 BV的AB-8型大孔树脂内。
2.5 洗脱工艺研究
2.5.1 单因素试验结果
表7为吸附工艺研究单因素试验结果,乙醇体积分数为50 g/mL,洗脱流速2 BV/h,乙醇用量为5 BV时,脱色率达到各单因素变化最佳。

表7 单因素试验结果Table 7 Results of single factor experiment
2.5.2 正交试验
吸附后的树脂需洗脱,以脱除色素杂质,达到纯化粗多糖的目的,因此以脱色率为衡量指标,采用L9(34)正交试验法,考察洗脱剂乙醇体积分数、流速与用量对洗脱效果的影响,根据单因素试验结果,相关因素水平见表8所示。依照表9所述试验条件进行洗脱,收集9份洗脱液,利用1.2.2所述方法测定洗脱液色素吸光度,照式(3)计算脱色率,相关方差分析见表10所示。

表8 正交试验因素水平Table 8 Table of the factorial experiment

表9 洗脱工艺正交试验Table 9 Results of the orthogonal-test method of desorption factors

表10 洗脱工艺方差分析Table 10 Analysis of variance for the desorption factors
树脂表面吸附的多糖与色素均有可能被洗脱,二者在洗脱过程呈竞争关系,从表9和表10的结果分析可知,各因素对脱色率影响的顺序为A>C>B,最佳洗脱工艺条件为A2B2C1,乙醇浓度对洗脱效果影响最为显著,这因为乙醇体积分数越大,则洗脱剂极性愈小,愈不容易将色素从树脂表面洗脱,且减小洗脱剂体积有利于多糖被优先洗脱,从而确定洗脱工艺为:采用5 BV的50%乙醇溶液,以2 BV/h流速对吸附后的AB-8型大孔树脂进行洗脱。
2.6 最佳纯化工艺验证
采取正交试验法得到的最佳工艺纯化茯苓提取粗多糖,纯化前后的结果见表11所示。

表11 最佳纯化工艺验证Table 11 The results of optimum conditions verification
动态吸附-洗脱后,粗多糖的脱色率为85.2%,多糖回收率为75.4%,两项指标均优于其它条件组合。纯化后产物的多糖含量提高至1.33 mg/g,为纯化前的3.17倍。
3 结论
本研究探讨大孔树脂纯化茯苓粗多糖的最佳工艺条件,通过比较7种大孔树脂的静态吸附-洗脱效果,并结合树脂的静态吸附动力学,确定采用AB-8型大孔树脂纯化提取的粗多糖。采用正交试验获得最佳纯化工艺为:配制5.0 mg/mL的茯苓多糖提取液,以2 BV/h流速上样至柱体积为7 BV的AB-8型大孔树脂内吸附,随后采用5 BV的50%乙醇溶液,以2 BV/h流速洗脱。通过定量分析结果表明,在最佳纯化工艺条件下,茯苓粗多糖的脱色率达到85.2%,多糖回收率为75.4%,所得多糖含量为纯化前的3.17倍,从而明显改善目标产物纯度,为茯苓多糖下游产业的发展提供基础,但采用该纯化工艺后多糖回收率仍偏低,因此在后续工艺优化中将会进一步研究。
[1]金惠,赵英博,江维,等.茯苓药理作用及临床应用研究进展[J].湖北中医杂志,2008,30(4):59-61
[2]梁学清,李丹丹,黄忠威.茯苓药理作用研究进展[J].河南科技大学学报(医学版),2012,30(2):154-156
[3]李淑怡,顾采琴,周雪娥,等.茯苓薏仁爽的研制[J].现代食品科技,2013,29(6):1328-1332
[4]信维平.山药茯苓面包的研制[J].食品工业,2004(6):33-33
[5]张璐,刘强.茯苓多糖制备工艺及药理作用研究进展[J].中国实验方剂学杂志,2006,12(4):61-64
[6]李玲.多糖的分离、纯化与分析[J].新疆工学院学报,1996,17(2):128-132
[7]张晓娟,唐洁,梁引库,等.茯苓多糖的提取纯化及应用研究进展[J].时珍国医国药,2008,19(12):2946-2949
[8]李敏晶,范妍丽,郭丛俏,等.大孔树脂法吸附分离多棘海盘车多糖的研究[J].应用化工,2013,42(12):2213-2215
[9]任海伟,陈海秀,唐学慧,等.大孔树脂纯化薏苡多糖的研究[J].食品工业科技,2012,33(3):249-251
[10]于海宁,朱惊,刘研,等.大孔树脂法用于江篱多糖脱色的工艺研究与优化[J].浙江工业大学学报,2014,42(4):418-421
[11]徐光域,颜军,郭晓强,等.硫酸-苯酚定糖法的改进与初步应用[J].食品科学,2005,26(8):342-346
[12]颜军,陶涛,孙晓春,等.茯苓多糖的纯化及分子量测定[J].化学与生物工程,2011,28(3):88-90
[13]秦俊哲,程伟,杜军国.大孔树脂对桑黄多糖提取液中色素的吸附与解吸特性研究[J].陕西科技大学学报,2013,31(1):73-77
[14]游瑞云,黄雅卿,郑珊瑜,等.大孔树脂纯化茶皂素的工艺研究[J].应用化工,2016,45(1):64-66
Purification of Polysaccharides Extract from Poria cocos Using Macroporous Resin
ZHANG Hong-kun
(Institute of Food and Pharmacy,Shandong Institute of Commerce&Technology,Jinan 250103,Shandong China)
The seven types of macroporousresins were studied in order that observe effects of decolorizationand retention of polysaccharides in poria cocos extract.Through static adsorption and desorption experiment,AB-8 resin was found to be suitable for the purification of polysaccharides from poria cocos extract.By using dynamic adsorption and desorption experiments,the optimum purification conditions were obtained as follows:5.0 mg/mL poria cocos extract was loaded on the resin column which the volume was 7 BV at flow rate of 2 BV/h and eluted with 5 BV of 50%ethanol at flow rate of 2 BV/h.Under the optimum conditions,the resulting decolorization and polysaccharides retention rates of poria cocos extract was 85.2%and 75.4%,respectively.
macroporousresin;Poria cocos;polysaccharide;purification
10.3969/j.issn.1005-6521.2017.23.012
张洪坤(1974—),男(汉),讲师,硕士,研究方向:食品营养与检测。
2017-05-26
