热处理乳清浓缩蛋白乳化体系储藏稳定性研究
2017-12-02王超曹传爱蔡浚泽陈益春孔保华刘骞
王超,曹传爱,蔡浚泽,陈益春,孔保华,刘骞,*
(1.东北农业大学食品学院,黑龙江哈尔滨150030;2.北京三元食品股份有限公司,北京100163)
热处理乳清浓缩蛋白乳化体系储藏稳定性研究
王超1,曹传爱1,蔡浚泽2,陈益春1,孔保华1,刘骞1,*
(1.东北农业大学食品学院,黑龙江哈尔滨150030;2.北京三元食品股份有限公司,北京100163)
主要研究了以预加热的乳清浓缩蛋白(90℃,5 min)为稳定剂的菜籽油水包油型乳状液在储藏期间物理稳定性的变化。测定乳状液在整个储藏期间(0~14 d)的ζ-电势、粒径、絮凝指数、分层指数、流变特性以及蛋白质界面分布指标。研究结果表明,经过预加热的乳清浓缩蛋白相对天然乳清浓缩蛋白能够显著降低乳状液在整个储藏期间的物理稳定性,具体表现为较低的ζ-电势(p<0.05),以及较高的粒径、絮凝指数、分层指数和黏度(p<0.05)。此外,加热导致的乳清浓缩蛋白变性和聚集,能够显著增加其在乳状液界面蛋白膜表面的分布(p<0.05)。上述结果表明,预加热能够显著降低整个乳状液在储藏期间的物理稳定性,为乳清浓缩蛋白的预热处理在乳状液食品中的合理应用提供了理论依据。
乳清浓缩蛋白;预加热;水包油型乳状液;稳定性;界面分布
乳清作为乳酪或酪蛋白产品的副产物,是一种可利用的蛋白质来源。乳清蛋白包括β-乳球蛋白(β-Lg,约占总蛋白的50%~60%)和α-乳清蛋白(α-La,约占总蛋白的20%~25%)及免疫球蛋白、牛血清白蛋白、蛋白糖蛋白胨和其他次要蛋白质[1]。通常使用超滤的方法来浓缩蛋白质,得到乳清浓缩蛋白(whey protein concentrate,WPC)[2]。WPC的蛋白质含量从 30%到80%,此外还含有大量的乳糖、矿物质和脂肪[3]。WPC有很高的营养价值及诸如溶解性、搅打起泡性、成膜性、凝胶性等良好的功能特性,是重要的功能性食品原料[2,4]。此外,由于蛋白质分子中既含有极性氨基酸等亲水性基团又含有非极性氨基酸等疏水性基团,蛋白质的这种特殊的双亲结构使其具有表面活性,表现为乳化性及乳化稳定性,可以作为乳化剂[5]。乳化体系是由不混容的两相(一般为油和水)组成的非均相体系,其中一种以液滴(0.1 μm~100 μm)的形式(分散相)分散于另一相(连续相)中[6]。由于乳状液是非自发形成的热力学不稳定体系,按照热力学使整体系统能量趋于最小的说法,乳状液会迅速发生相分离以便使界面接触面积和自由能最小化,表现为絮凝、聚结、分层和奥斯瓦尔德熟化等各种机制[7]。因此,需要加入乳化剂以制备稳定的乳状液。一些具有“两亲”性的天然乳化剂(如蛋白质和多糖)分子,极性部分能很好的溶于水相,非极性部分则能较好的溶于油相[8],利用界面疏水作用迅速吸附于乳状液滴的表面,降低表面张力,此外,还能够在液滴表面形成保护膜,防止液滴聚集和絮凝,提高乳状液的稳定性[9]。蛋白质的乳化性与其表面疏水性和柔性密切相关。WPC属于球蛋白,研究表明,当其吸附于油-水界面时,球蛋白在乳状液界面层部分结构展开,暴露更多的非极性氨基酸,增强了表面疏水性,提高了乳状液的稳定性[10]。在实际生产加工过程中,蛋白质的乳化性常常会受到一些加工条件的影响,进而影响乳状液的稳定性。
热处理是食品加工过程中最常用的处理手段之一,会导致球蛋白的结构及功能发生一定的变化。热处理会诱导蛋白质界面疏水性和灵活性的改变,不仅会对蛋白质的聚集产生影响,还会影响蛋白质在油水界面的界面活性。而乳清蛋白在热处理过程中极易变性从而导致部分蛋白变性聚集,而影响其功能特性[11],WPC是热不稳定蛋白质,这主要是由于WPC包含着球状蛋白,在正常pH范围内,当热处理温度高于75℃时,β-Lg开始发生变性,暴露了位于α-螺旋内部的半胱氨酸,在二硫键、静电作用和疏水作用力的共同作用下使β-Lg分子相互聚集,从而形成结构致密的蛋白聚集体[12]。与此同时,针对预加热后的乳清浓缩蛋白对乳状液的影响方面的研究甚少。
因此,本实验主要研究加热预处理(90℃,5 min)是否对乳清浓缩蛋白作为稳定剂所制备的菜籽油水包油型乳状液的特性和物理稳定性产生影响,分析探讨整个乳状液在储藏期间的ζ-电势、粒径、絮凝指数、分层指数、流变特性和乳状液中蛋白质分配系数的变化趋势,为乳清浓缩蛋白在乳状液食品中的合理应用提供了理论依据。
1 材料与方法
1.1 材料与试剂
乳清浓缩蛋白(WPC-80,蛋白含量80%):北京银河路商贸有限责任公司;菜籽油:当地超市;叠氮钠、十二烷基磺酸钠硫酸(SDS)等均为分析纯;实验用水均为去离子水。
1.2 仪器
AL-104型精密电子天平:上海梅特勒-托利多仪器设备有限公;AM-1磁力搅拌器:北京鼎昊源实验仪器有限公司;DK-8B型电热恒温水浴锅:上海精宏实验设备有限公司;T18匀浆机:德国IKA公司;FPG12805型高压均质机:英国斯坦斯特德流体动力有限公司;FE20K型pH计:上海梅特勒-托利多仪器设备有限公司;Malvern Nano ZS型动态光散射仪:英国马尔文公司;Malvern 2000型激光粒度仪:英国马尔文公司;Allegra 64R型台式高速冷冻离心机:美国贝克曼库尔特有限公司;DHR-1动态剪切流变仪:美国TA公司。
1.3 方法
乳状液的制备:分散一定量的乳清浓缩蛋白(WPC)粉末于去离子水中,用磁力搅拌器在室温下至少搅拌1 h确保其充分溶解,配制成4%的蛋白分散液,同时加入0.01%的叠氮钠以抑制微生物的生长。将该WPC分散液等体积分成两份,其中一份于90℃水浴中加热5 min,拿出后迅速冷却到室温,表示为预加热乳清浓缩蛋白(Pre-heated whey protein concentrate,H-WPC)。取这两种处理的蛋白分散液90 mL分别与10 mL的菜籽油混合,用匀浆机于13 500 r/min匀浆2 min,制得粗乳状液。将得到的粗乳状液在40 MPa条件下进行均质,将均质液(新鲜乳状液)于4℃分别储藏 0、1、4、7、10、14 d,进行测量。
1.4 乳状液测定指标
1.4.1 ζ-电势
用Malvern Nano ZS型动态光激光粒度仪来表征乳状液滴的ζ-电势,为了避免多重散射效应,将均质后的乳状液用去离子水稀释到油相浓度的0.001%,接着将稀释后的乳状液置于两端具有电极的透明矩形比色皿中,然后将比色皿插入到有激光束通过其中的狭缝中。激光器提供光源以照射样品内的颗粒。当电场施加于比色皿时,激光粒度仪便可检测出颗粒的电泳迁移率,进而计算出液滴的ζ-电势[13]。
1.4.2 粒径
用粒度分布仪对新鲜乳状液滴和储藏一定时间的乳状液滴的粒径大小进行测量。具体步骤为:用去离子水或1%SDS溶液将样品的遮蔽度稀释到10%和20%之间,待体系稳定后进行测量。液滴大小用体积分数平均粒径(d4,3)表示。
1.4.3 分层指数
将25 mL乳状液置于垂直放置的带刻度的具塞玻璃管中,在室温条件下储藏 0、1、4、7、10、14 d,油相相对于周围的水相具有较低的密度,倾向于向上移动,而水相则在重力作用下向下层移动,因此乳状液在储藏期间会发生分层现象,上层为不透明的乳化层,下层为轻微混浊或透明的血清层。记录不同储藏时间血清层的高度(Hs)和乳状液的总高度(Ht)。
1.4.4 絮凝指数
新鲜或储藏一定时间乳状液滴的絮凝指数用以下公式进行计算:

式中:d4,3-water表示水作为分散剂的乳状液滴的d4,3,d4,3-water表示 1%SDS 作为分散剂的乳状液滴的d4,3。
在1.4.2.中分别用去离子水和1%SDS溶液稀释乳状液滴并测量了平均粒径(d4,3)。
1.4.5 流变特性
为了测定新鲜乳状液和储藏14 d的乳状液的流变特性,本试验采用具有平行板(平板直径为40 mm,间隙高度为0.5 mm)的DHR-1动态剪切流变仪,测量温度为25℃,。剪切流动试验中剪切速率由0.01 s-1到10 s-1。通过测量表观黏度对剪切速率的变化趋势来表征乳状液的流变特征。
1.4.6 乳化剂在水相及界面的分布
参照YU等[14]的方法测定新鲜乳状液和储藏14 d的乳状液中蛋白含量在各相的分布情况,取1 mL乳状液置于1.5 mL的离心管中,于25℃,15 000 g条件下离心45 min,用注射器小心吸取下层清液在相同条件下再次离心,小心吸取下层清液,并合并多个离心中的清液,合并后的清液过0.22 μm滤膜,使用Lowry等[15]的方法测定滤液的蛋白含量。
参考Hunag[16]等的方法计算蛋白在两相中的分配系数,公式如下:
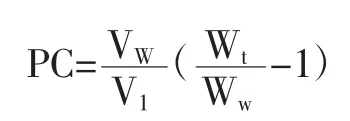
式中:Vw表示水的体积,mL;Vl表示油的体积,mL;Wt表示总蛋白含量,(mg/mL);Ww表示水相中的蛋白含量,(mg/mL);计算时所用油的密度(g/mL)为0.922;水相中的蛋白含量占总蛋白含量的比例为(Ww/Wt);界面上吸附的蛋白含量所占的比例等于总的蛋白含量与水相中蛋白含量之差。
1.5 数据统计分析
每个试验重复三次,结果表示为平均数±SD。数据统计分析采用Statistix 8.1(St Paul,MN)软件包中Linear Models程序进行,差异显著性(P<0.05)分析使用Tukey HSD程序。采用Sigmaplot11.0软件作图。
2 结果与分析
2.1 ζ-电势的变化
乳化体系是热力学不稳定体系,为了改善乳状液的稳定性,需要表面活性剂。食品中许多具有表面活性的物质(例如一些蛋白质分子、磷脂分子)一般都具有带电性,当这些具有表面活性的物质附着在水包油型乳状液的油-水界面膜上的时候,使得油滴表面的界面膜也具有一定的带电性。
根据DLVO理论,乳状液的稳定性一定程度上取决于乳状液液滴间吸引力(范德华力)和排斥力(例如静电,空间和水合力)的相对大小[17]。WPC及H-WPC稳定的乳状液的ζ-电势随储藏时间的变化趋势见图1。

图1 储藏时间对乳状液粒子ζ-电位的影响Fig.1 Effect of storage time on zeta potential of emulsion
ζ-电势表示的是悬浮颗粒表面的电动力学电荷的大小,并且表明乳液液滴之间的排斥力的强度,能够在一定程度上反映出乳化体系的稳定性。一般认为,当 ζ-电势为±0-10 mV,±10-20 mV 和±20-30 mV以及±30 mV时,分别表示胶体体系高度不稳定,相对稳定,中度稳定和高度稳定[18]。由图1可知,当pH 7.0时两种乳状液的ζ-电势为负值,说明乳状液滴表面所带的静电电荷为负,即吸附到油滴表面的蛋白质分子带负电荷,此外,伴随着储藏时间的逐步延长,不论是WPC还是H-WPC涂覆的乳状液滴,其ζ-电势的绝对值均呈下降趋势,WPC涂覆的液滴的电位从-41.8 mV显著降低到-29.1 mV(p<0.05),H-WPC稳定的液滴也从-41.4 mV 显著变为-26.3 mV(p<0.05),Yi[19]等的研究表明ζ-电势的绝对值越高,乳状液物理稳定性越高,即乳状液在贮藏期间可以抵抗聚集和絮凝的能力越强,因此ζ-电势绝对值的减小说明了乳状液滴间静电斥力的降低,即乳状液的稳定性随着储藏时间的增加呈逐渐下降的趋势。此外,ζ-电位的变化反映了蛋白质和表面组成的变化[20]。在同一储藏时间,WPC稳定的乳状液滴的ζ-电势与H-WPC涂覆的液滴相比有所增大,说明WPC稳定的乳状液滴表面所带的静电荷更多,WPC稳定的乳状液的物理稳定性更好。这是因为热处理会诱导蛋白质表面疏水性的变化。本试验中对WPC蛋白分散液进行90℃预处理导致β-Lg的变性,使原本位于球形蛋白内部的疏水性氨基酸残基暴露出来,增加了其表面疏水性,同时,乳清蛋白分子之间通过SH/S-S/S交换反应形成聚合物,从而导致乳状液的稳定性降低,表现为ζ-电势有所下降[21]。
2.2 粒径的变化
乳状液的粒径随储藏时间的变化情况见图2所示。
由图2可知,在同一储藏时间,H-WPC涂覆的液滴较WPC稳定的乳状液滴的粒径大,这是因为加热预处理WPC分散液导致其中的球状蛋白(如β-Lg,α-La)变性,变性能够影响蛋白质的三维结构,致使球状结构展开,暴露了先前隐藏的疏水性基团,从而引起蛋白质分子的聚集,不能有效的吸附到乳状液滴表面,使粒径的增大[22]。此外,乳状液的粒径随着储藏时间的增大有所增大,WPC和H-WPC稳定的新鲜乳状液的 d4,3分别为 1.56 μm 和 1.73 μm,经过 14 天的储藏后,其 d4,3分别增加到 1.97 μm 和 2.96 μm,但差异不显著(p>0.05)。
由于蛋白质的变性和聚集机制取决于加热的条件和化学环境,加热温度和pH是最重要的决定因素之一,因此,不同的处理温度和时间往往会对乳状液的稳定性产生不同的影响[23-24]。Dybowska[25]探究了不同加热温度对WPC分散液粒度分布的影响,结果表明未加热和加热至70℃的WPC分散体的粒度分布曲线几乎相同,随着加热温度的进一步提高,粒度分布曲线向具有更高粒径的方向移动。当预加热温度为80℃时,明显具有更高的平均粒径,最大聚集体达到1.28μm,90℃预处理可达到1.48 μm,而95℃为1.71 μm。即预热温度高于70℃时可导致WPC分散体的变性引起广泛的蛋白质聚集。Millqvist-Fureby[26]等将WPC在60℃~90℃条件下热处理1 000 s后制备乳状液,研究结果显示伴随着加热温度的增加乳液的液滴逐渐增大,并且乳状液的稳定性逐渐下降,这可能是由于加热处理后乳清蛋白表面活性减小,乳化的效率随着变性程度的增加而降低,从而导致液滴聚集。
2.3 分层指数(CI)的变化
由于乳化体系是非自发形成的热力学不稳定体系,在重力的作用下,存在密度差的分散相(油相)和连续相(水相)经过一段时间的贮藏会发生相分离,从而降低了乳状液的稳定性[27]。而CI是表征乳状液滴抗重力分离的稳定性的重要方法。CI能够在一定程度上反映乳状液滴的聚集程度,进一步衡量乳化体系的物理稳定性,CI越小,说明液滴抵抗重力的能力越强,乳状液越稳定[28]。
在0~14 d储藏期内,WPC和H-WPC稳定的乳状液滴的分层情况变化见图3。
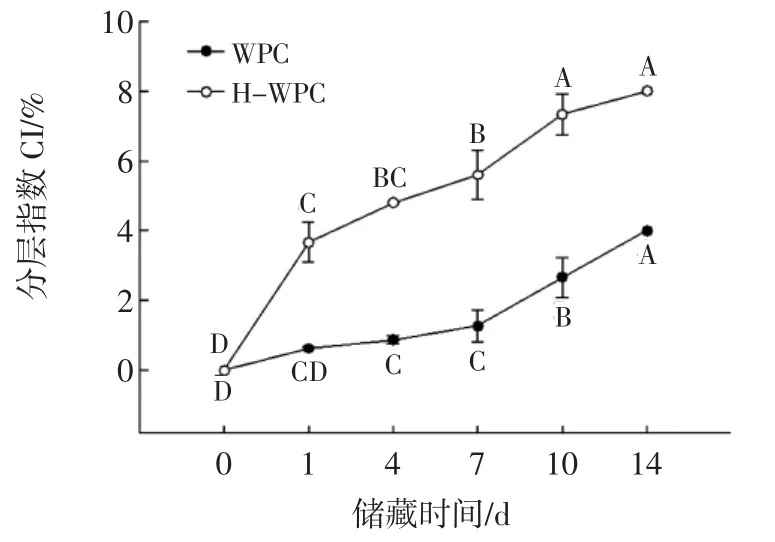
图3 储藏时间对乳状液粒子分层指数的影响Fig.3 Effect of storage time on creaming index of emulsion
由图3可知,新鲜制备的乳状液未发生分层现象,而在储藏期内,密度较低的油滴向上移动形成不透明的乳油层,且乳油层的不透明逐渐增大,而血清相则是浑浊状态,尽管乳油层和血清层的分界面不明显,但仍可以识别。随着储藏时间的逐渐延长,样品的分层指数(CI)呈逐渐增大的趋势,WPC制备的乳状液,CI从0%增大到4%,相对于H-WPC稳定的乳状液来说,分层较为缓慢,且当储藏时间相同时,WPC涂覆的液滴的CI较小,H-WPC稳定的乳状液其CI值在第14天达到最大7%,表明WPC经过高温预热处理后制备的乳状液的物理稳定性下降。
分散相的液滴粒径大小对分层指数具有显著影响,随着液滴粒径增大,乳状液分层变慢,乳状液更不稳定,反之亦然。乳清浓缩蛋白经过加热预处理后,暴露了更多疏水性的氨基酸残基,增加了其表面疏水性,导致液滴的粒径增大,从而使乳状液失稳,CI值增大[22]。此外,乳状液的分层行为还与界面膜的厚度有关,如果蛋白质吸附于界面的速度快于打开的速度,则会形成更厚的界面膜。然而,在90℃预热5 min的条件下,WPC变性程度较大,所以蛋白质吸附的速度小于展开的速度,降低了界面膜的厚度,从而降低了乳状液的物理稳定性。
2.4 絮凝指数(FI%)的变化
SDS是一种阴离子表面活性剂,能够吸附在液滴表面,通常在衍射分析期间,如存在SDS,SDS分子会置换吸附于油/水界面蛋白质并且诱导其与液滴之间的静电排斥作用,从而破坏原始的液滴聚集体[29]。因此,SDS能够降低桥接油滴的程度,但如果液滴聚结,则不会破坏聚集。当不存在SDS分子时,尽管稀释和搅拌可能破坏任何弱絮凝的液滴,但不会破坏强絮凝的液滴,因此该方法能够用来评价由于桥接机制形成的絮状物的稳定性[30]。
乳状液在0到14天的储藏期内絮凝指数(FI)的变化情况见图4。
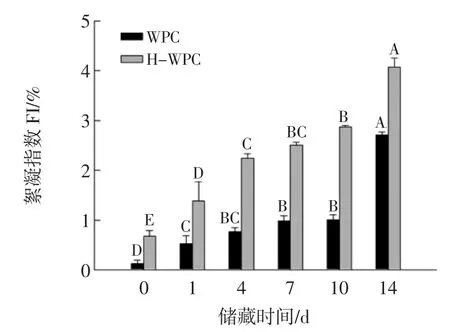
图4 储藏时间对乳状液粒子絮凝指数的影响Fig.4 Effect of storage time on flocculation index of emulsion
絮凝是导致乳状液失稳的主要机制之一。絮凝的发生通常基于乳状液滴之间的相互作用(例如静电排斥)。在净排斥相互作用的情况下,液滴吸附层之间的静电排斥作用能够防止絮凝,如果电荷减少,则静电斥力降低并且可能引起液滴絮凝[31]。因此,絮凝指数可作为衡量乳状液是否稳定的一个重要指标。由图4可知,伴随着储藏时间的延长,所有样品的FI均呈增大趋势,在第0天,WPC和H-WPC稳定的乳状液滴的FI分别为0.06%和0.77%,说明新鲜乳状液未有絮凝形成,乳状液较稳定。在第14天达到了最大,分别为2.77%和3.86%,说明两种乳状液在储藏期间均发生絮凝且絮凝程度逐渐增大,乳状液的稳定性降低。
静电排斥力对于稳定乳状液起到了关键作用,与上述分析可知,随着储藏时间的延长,吸附层的表面电荷减少,静电斥力降低,形成较大的聚集体,从而导致絮凝程度的增大,这与粒径和电势的测量结果一致。由于热处理导致WPC变性、聚集导致H-WPC制备的乳状液的FI显著高于(p<0.05)WPC制备的乳状液。这是研究结果表明,β-Lg经过加热后其表面疏水性增加,对于有利于液滴间的相互吸引作用,从而反应了乳状液稳定性的降低。热诱导引起絮凝的程度取决于诸多因素,如热处理时间及温度和未吸附的蛋白质浓度。形成的絮凝物通过吸附到不同液滴表面的蛋白质之间的疏水相互作用和共价二硫键结合在一起,WPC经过高温加热后暴露了更多的疏水作用基团,从而加剧了絮凝物的形成。
2.5 乳状液流变学特性
乳状液的物理稳定性与其流变性能密切相关[32]。乳状液中连续相的流变学性质、平均粒度及粒度分布、内部黏度等均能影响乳状液的流变特性。根据斯托克定律,乳液的乳化稳定性可以通过减小液滴粒径大小、增加连续相的黏度或最小化液滴和连续相之间的密度差异来改善[33]。
在第0天和第14天的表观黏度对剪切速率的变化情况见图5。
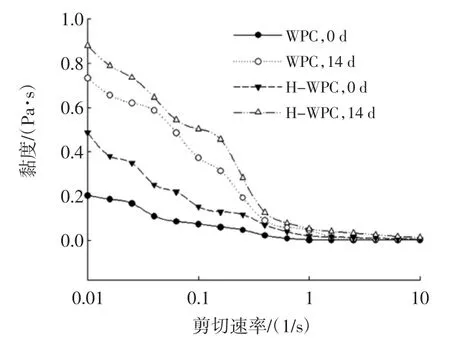
图5 剪切速率对乳状液粒子黏度的影响Fig.5 Effect of shear rate on the viscosity of emulsion
由图5可知,在剪切速率从0.01 s-1~1 s-1的变化范围内,所有样品均表现出假塑性行为,即曲线显示为剪切稀化行为(乳状液样品的表观粘度随着剪切速率的增大而减小)。乳状液滴表现为剪切稀化行为可能是由于剧烈的剪切而引起的结构的破坏,油滴之间的相互界面力可以解释这一点。在低剪切速率较低时,小的流体动力不能破坏使液滴聚在一起的界面力,并且乳状液显示出高的表观粘度。当剪切速率增加时,流体动力学力也随之增大从而破坏絮凝物,造成乳化体系中表观粘度的降低,实现在高剪切速率下的类似于牛顿流体[34]。此外,H-WPC制备的乳状液的表观粘度显著增大(p<0.05),而且所有样品在经过14 d的储藏后其表观粘度较新鲜制备的乳状液均有所增大,第14天达到最大值。这说明随着储藏时间的增加,乳状液滴粘度增大,这也与前文所述的乳状液滴在储藏期间粒径增大,表面电荷减小,液滴发生聚集,稳定性降低一致。Taherian等[35]的研究也表明,乳状液在储藏期间黏度的增加与液滴的絮凝有关,Peng等[36]通过对豌豆蛋白进行热预处理(90℃,30 min),也得到了类似的结论。
2.6 乳化剂在油水界面的分布
蛋白质吸附于油水界面上形成具有高粘弹性的界面膜,产生空间位阻和静电排斥以稳定乳状液,抵抗油滴的聚集絮凝等。蛋白质和界面之间的疏水相互作用是驱动蛋白质分子吸附于界面的主要作用力。因此,蛋白质分子表面的疏水性氨基酸残基越多,越利于吸附于界面。
乳状液储藏14天后WPC及H-WPC在水相及与油水界面的分布情况见表1。

表1 不同处理条件下乳化剂在水相中的分布情况Table 1 Partitioning of emulsifier in the aqueous solution under different treatment conditions
由表1可知,水相中WPC的含量比H-WPC的含量高,且两者差异显著(p<0.05)。经过加热预处理后,H-WPC分子在油水界面的分配系数(4.16)较WPC的分配系数高(1.52)。这是由于WPC经过高温加热预处理后,蛋白质分子打开,暴露了原本位于球状蛋白分子内部的疏水性氨基酸残基,增加了蛋白质分子的表面疏水性,因此,水相中蛋白含量减少,从而有利于蛋白质吸附到界面上,导致油水界面的分配系数增大。Peng等[36]对用热预处理(90℃,30 min)的豌豆蛋白稳定的乳状液进行,表明在相同的浓度,经过加热预处理的乳状液的蛋白吸附量要高于为加热的乳状液,这也与Li[37]等关于预加热的大豆蛋白乳状液吸附蛋白的百分比的高于未加热的蛋白乳状液这一结果一致。
3 结论
本试验主要针对加热预处理(90℃,5 min)是否能够对乳清浓缩蛋白作为稳定剂所制备的菜籽油水包油型乳状液的特性和物理稳定性产生影响进行了深入探讨。通过分析乳状液在储藏期间(0~14 d)的ζ-电势、粒径、絮凝指数、分层指数、流变特性的测定结果,发现经过预热处理的乳清浓缩蛋白能够显著降低乳状液在整个储藏期间的物理稳定性。另外,乳清分离蛋白在油水界面中的分布情况直接验证了预加热处理不利于促进乳状液物理稳定性的结果。因此,本试验为乳清浓缩蛋白的预热处理在乳状液产品中的合理应用提供了理论依据。
[1]HINES M E,FOEGEDING E A.Interactions of α-lactalbumin and bovine serum albumin with β-lactoglobulin in thermally induced gelation[J].Journal of Agricultural&Food Chemistry,1993,41(3):341-346
[2]耿浩,刘悦,梁新婷,等.热诱导对乳清浓缩蛋白和分离蛋白乳化性及稳定性的影响[J].中国食品学报,2016,16(8):71-77
[3]MULVIHILL D M,ENNIS M P.Functional Milk Proteins:Production and Utilization[M].Springer US:Advanced Dairy Chemistry-1 Proteins,2003:1175-1228
[4]杨赫鸿,刘骞,孔保华,等.美拉德反应中乳清分离蛋白特性的变化[J].食品科学,2012,33(23):98-102
[5]莫重文.蛋白质化学与工艺学[M].北京:化学工业出版社,2007:188-234
[6]FRIBERG S E,LARSSON K,SJÖBLOM J.Food emulsions[M]//Encyclopedia of Colloid&Interface Science.Boca Raton:CRC Press,2003
[7]LI X,LI K X,SHEN Y L,et al.Influence of pure gum on the physicochemical properties of whey protein isolate stabilized oil-in-water emulsions[J].Colloids and Surfaces A:Physicochemical&Engineering Aspects,2016(504):442-448
[8]HOFFMANN H,REGER M.Emulsions with unique properties from proteins as emulsifiers[J].Advances in Colloid and Interface Science,2014(205):94-104
[9]DALGLEISH D G.Food emulsions[M].New York:Marcel Dekker,1996:287-325
[10]CASTELAIN C,GENOT C.Conformational changes of bovine serum albumin upon its adsorption in dodecane-in-water emulsions as revealed by front-face steady-state fluorescence[J].Biochimica et BiophysicaActa(BBA)-General Subjects,1994,1199(1):59-64
[11]SETIOWATI A D,VERMEIR L,MARTINS J,et al.Improved heat stability of protein solutions and O/W emulsions upon dry heat treatment of whey protein isolate in the presence of low-methoxyl pectin[J].Colloids&Surfaces A Physicochemical&Engineering Aspects,2016(510):93-103
[12]VARDHANABHUTI B,FOEGEDING E A,MCGUFFEY M K,et al.Gelation properties of dispersions containing polymerized and native whey protein isolate[J].Food Hydrocolloids,2001,15(2):165-175
[13]CHO D,LEE S,FREY M W.Characterizing zeta potential of functional nanofibers in a microfluidic device[J].Journal of Colloid&Interface Science,2012,372(1):252-260
[14]YU C,XIONG Y L,JIE C.Antioxidant and emulsifying properties of potato protein hydrolysate in soybean oil-in-water emulsions[J].Food Chemistry,2010,120(1):101-108
[15]LOWRY O H,ROSEBROUGH N J,FARR A I,et al.Protein measurement with the Folin phenol reagent[J].Journal of Biological Chemistry,1951,193(1):265-275
[16]HUANG S W,FRANKEL E N,AESCHBACH R,et al.Partition of selected antioxidant in corn oil-water model system[J].Journal of Agricultural&Food Chemistry,1997,45(6):1991-1994
[17]BHATTACHARJEE S.DLS and zeta potential-What they are and what they are not?[J].Journal of Controlled Release,2016,235(10):337-351
[18]ESTEBAN P P,JENKINS A T,ARNOT T C.Elucidation of the mechanisms of action of Bacteriophage K/nano-emulsion formulations against S.aureus via measurement of particle size and zeta potential[J].Colloids and Surfaces B:Biointerfaces,2016,139(1):87-94
[19]YI J H,ZHU Z B,MCCLEMENTS D J,et al.Influence of aqueous phase emulsifiers on lipid oxidation in water-in-walnut oil emulsions[J].JournalofAgriculture&FoodChemistry,2014,62(9):2104-2111
[20]TANGSUPHOOM N,COUPLAND J N.Effect of surface-active stabilizers on the surface properties of coconut milk emulsions[J].Food Hydrocolloids,2009,23(7):1801-1809
[21]SOURDET S,RELKIN P,CÉSAR B.Effects of milk protein type and pre-heating on physical stability of whipped and frozen emulsions[J].Colloids&Surfaces B Biointerfaces,2003,31(1/4):55-64
[22]WONG D W,CAMIRAND W M,PAVLATH A E.Structures and functionalities of milk proteins[J].Critical Reviews in Food Science and Nutrition,1996,36(8):807-844
[23]ANEMA S G,LI Y.Association of denatured whey proteins with casein micelles in heated reconstituted skim milk and its effect on casein micelle size[J].Journal of Dairy Research,2003,70(1):73-83
[24]CORREDIG M,DALGLEISH D G.Effect of temperature and pH on the interactions of whey proteins with casein micelles in skim milk[J].Food Research International,1996,29(1):49-55
[25]DYBOWSKA B E.Whey protein-stabilized emulsion properties in relation to thermal modification of the continuous phase[J].Journal of Food Engineering,2011,104(1):81-88
[26]MILLQVIST-FUREBY A,ELOFSSON U,BERGENSTÅHL B.Surface composition of spray-dried milk protein-stabilised emulsions in relation to pre-heat treatment of proteins[J].Colloids&Surfaces B Biointerfaces,2001,21(1/3):47-58
[27]GÓMEZ-MASCARAQUE L G,LÓPEZ-RUBIO A.Protein-based emulsion electrosprayed micro-and submicroparticles for the encapsulation and stabilization of thermosensitive hydrophobic bioactives[J].Journal of Colloid and Interface Science,2016,465(1):259-270
[28]SETA L,BALDINO N,GABRIELE D,et al.The influence of carrageenan on interfacial properties and short-term stability of milk whey proteins emulsions[J].Food Hydrocolloids,2013,32(2):373-382
[29]SMULDERS P E A,CAESSENS P W J R,WALSTRA P.Emulsifying properties of β-casein and its hydrolysates in relation to their molecular properties[J].Food Emulsions&Foams Cambridge,1999:61-69
[30]THANASUKARN P,PONGSAWATMANIT R,MCCLEMENTS D J.Influence of emulsifier type on freeze-thaw stability of hydrogenated palm oil-in-water emulsions[J].Food Hydrocolloids,2004,18(6):1033-1043
[31]KIM H J,DECKER E A,MCCLEMENTS D J.Impact of protein surface denaturation on droplet flocculation in hexadecane oil-in-water emulsions stabilized by β-lactoglobulin[J].Journal of Agricultural&Food Chemistry,2002,50(24):7131-7137
[32]LI C,FU X,LUO F X,et al.Effects of maltose on stability and rheological properties of orange oil-in-water emulsion formed by OSA modified starch[J].Food Hydrocolloids,2013(32):79-86
[33]DEPREE J A,SAVAGE G P.Physical and flavour stability of mayonnaise[J].Trends in Food Science&Technology,2001,12(5):157-163
[34]MCCLEMENTS D J.Food Emulsions:Principles,Practice and Techniques[M]//Food emulsions:principles,practice,and Technique.Boca Raton:CRC Press,1999:223-224
[35]TAHERIAN A R,BRITTEN M,SABIK H,et al.Ability of whey protein isolate and/or fish gelatin to inhibit physical separation and lipid oxidation in fish oil-in-water beverage emulsion[J].Food Hydrocolloids,2011,25(5):868-878
[36]PENG W W,KONG X Z,CHEN Y M,et al.Effects of heat treatment on the emulsifying properties of pea protein[J].Food Hydrocolloids,2016(52):301-310
[37]LI F,KONG X Z,ZHANG C M,et al.Effect of heat treatment on the properties of soy protein-stabilised emulsions[J].International Journal of Food Science&Technology,2011(46):1554-1560
Effect of Preheated Whey Protein Concentrate on the Physical Stability of Oil-in-water Emulsions
WANG Chao1,CAO Chuan-ai1,CAI Jun-ze2,CHEN Yi-chun1,KONG Bao-hua1,LIU Qian1,*
(1.College of Food Science,Northeast Agricultural University,Harbin 150030,Heilongjiang,China;2.Beijing Sanyuan Foods Co.,Ltd.,Beijing 100163,China)
The effect of preheated treatment(90℃,5 min)on the physical stability of rapeseed oil-in-water emulsion of prepared by using whey protein concentrate as stabilizer were investigated.The changes trend of ζpotential,particle size,flocculation index,creaming index,rheological property and the partition coefficient of protein in the emulsion during the whole storage period(0-14 days)were measured.The results showed that the preheated treatment of whey protein concentrate could significantly reduce the physical stability of the emulsion during during the whole storage period compared with the natural whey protein concentrate (p< 0.05),especially the lower ζ-potential(p < 0.05),and higher particle size,flocculation index,creaming index and viscosity (p < 0.05).Furthermore,the denaturation and aggregation of whey protein concentrate caused by preheat-treated could significantly increase the distribution of the protein on the surface of the emulsion membrane(p < 0.05),thus confirming the physical stability of the emulsions.The results indicated that the thermal pretreatment significantly reduced the physical stability of the whole emulsion during storage and provided a theoretical basis for the rational application of whey protein concentrate in the emulsion-based food.
whey protein concentrate;preheated treatment;oil-in-water emulsion;stability;distribution of interface
10.3969/j.issn.1005-6521.2017.23.002
国家自然科学基金项目(31671788);东北农业大学“学术骨干”项目(16XG18)
王超(1993—),女(汉),硕士研究生,研究方向:畜产品加工。
*通信作者:刘骞(1981—),男,教授,博士生导师,博士。
2017-04-24
