陕西浓缩海红果汁中高渗酵母的分离鉴定
2017-12-02王虎玄蔺泽雪
王虎玄, 刘 婷, 马 原, 蔺泽雪, 刘 宁, 杨 辉
(陕西科技大学 食品与生物工程学院, 陕西 西安 710021)
陕西浓缩海红果汁中高渗酵母的分离鉴定
王虎玄, 刘 婷, 马 原, 蔺泽雪, 刘 宁, 杨 辉*
(陕西科技大学 食品与生物工程学院, 陕西 西安 710021)
为研究引起海红果浓缩汁污染腐败的高渗酵母,采用YPD高糖培养基对陕西海红果加工厂的海红果浓缩汁中的高渗酵母进行分离纯化,并从耐糖、耐酸及产气性方面对分离菌株的污染能力进行了研究;对分离菌株菌落形态和细胞形态特征进行了描述,并以26S rDNA序列构建系统发育树,确定了分离菌的遗传学位置;进一步研究了分离株在海红果浓缩汁中的生长情况.共获得4株酵母菌,两株为酿酒酵母 (Saccharomycescerevisiae),两株为鲁氏接合酵母(Zygosaccharomycesrouxii);鲁氏接合酵母(Z.rouxii)的耐糖性、耐酸性及产气性强于酿酒酵母(S.cerevisiae),并且鲁氏接合酵母能够在海红果浓缩汁中生长.结果表明: 鲁氏接合酵母具有较强的潜在污染能力,会对海红果浓缩汁质量造成威胁,需要加强控制.
浓缩海红果汁; 高渗酵母; 污染能力; 分离鉴定; 鲁氏接合酵母
0 引言
浓缩果汁由于具有高糖及高酸特性,因而表现出良好的微生物稳定性,已成为水果加工的重要途径.但一直以来有关高渗酵母污染浓缩果汁的事件时有发生,同时由于市售的果汁及饮料大多通过浓缩果汁稀释调配而来,因此其也存在着被高渗酵母污染的风险[1-4].高渗酵母至少能够在葡萄糖浓度为50%(w/v)环境下生长,污染果汁后可引起腐败变质,降低产品的质量,包括营养成分的破坏,pH值、气味的改变等,直接影响到产品的销量[5,6].大多数酵母菌可代谢糖类物质产生CO2,导致包装果汁胀包,甚至会引起爆炸,严重威胁消费者的身心健康,也给生产企业造成巨大的经济损失.近年来,海红果作为西北地区一种稀有的极具地方特色的水果,其营养价值和加工价值正逐步被人们所认知和了解[7].浓缩海红果汁因其高微生物稳定性的特性已逐渐成为海红果的主要加工途径,但因高渗酵母的污染导致产品的销售量下降.因此,对浓缩海红果汁中高渗酵母污染的研究刻不容缓,但目前国内外有关这方面的研究尚未见报道.
本文对来源于陕西省府谷县聚金邦农产品开发公司的浓缩海红果汁中高渗酵母进行分离纯化,对纯化后菌株进行耐糖、耐酸及产气性测定,进行菌落及细胞形态观察,并基于26S rDNA测序进行菌种鉴定,最后研究分离株在浓缩海红果汁中的生长情况,以证实分离株能够污染浓缩汁,为浓缩海红果汁加工中高渗酵母污染的控制提供技术支撑.
1 材料与方法
1.1 分离样品与培养基试剂
1.1.1 分离样品
海红果浓缩清汁,pH值3.4±0.1,可溶性固形物含量为(68±1)°Bx,从陕西省府谷县聚金邦农产品开发公司收集.
1.1.2 培养基及主要试剂
YPD培养基:葡萄糖20 g,蛋白胨20 g,酵母浸粉10 g,蒸馏水1 000 mL.如需固体培养基,加入琼脂粉20 g.
30%YPD培养基:葡萄糖300 g,蛋白胨20 g,酵母浸粉10 g,少量蒸馏水溶解后补加蒸馏水至1 000 mL.如需固体培养基,加入琼脂粉20 g.
30%葡萄糖溶液:葡萄糖300 g,少量蒸馏水溶解后补加蒸馏水至1 000 mL.
酵母基因组提取试剂盒(北京天根), 26S-D1/D2 rDNA扩增引物(北京华大),PCR试剂(TaqDNA 聚合酶、dNTP、缓冲液、MgCl2)(大连Takara),Marker(大连Takara),琼脂糖(美国Invitrogen).
1.2 主要仪器与设备
UV-2550 型紫外可见分光光度计,日本岛津公司;HC-3018R型台式冷冻离心机,安徽中科中佳科学仪器有限公司;CX31型显微镜,奥林巴斯公司;JA2003型电子天平,上海精密科学仪器有限公司;PTC-200型PCR仪,BIO-RAD公司;DY-A型电泳仪,上海康达仪器厂;Gel Doc XR型凝胶成像仪,BIO-RAD公司.
1.3 高渗酵母的分离纯化
用移液枪吸取10 mL浓缩海红果汁加入到含有90 mL无菌30% YPD 液体培养基的三角瓶后置于 28 ℃,120 r/min 摇床培养 48 h 进行菌体富集[1].然后采用无菌30%葡萄糖水对富集培养液进行连续梯度稀释,选取合适梯度稀释液后各取200μL于 30%YPD 固体培养基上进行涂布,28 ℃培养5~7 d.挑选具有典型酵母菌落特征的单菌落进一步反复划线纯化.纯化后的菌落在光学显微镜下进行形态观察和纯度检测,确认无杂菌后转接到 YPD斜面培养基上,28 ℃培养3 d后置于4 ℃冰箱保存备用.
1.4 耐糖性的测定
将20 mL无菌的葡萄糖浓度分别为500 g/L、550 g/L、600 g/L、650 g/L、700 g/L、750 g/L、800 g/L、850 g/L和900 g/L的YPD液体培养基置于三角瓶中,取处于对数生长期的酵母种子液200μL加入到上述培养液中,28 ℃,120 r/min 摇床培养48 h,取样测定其在600 nm下的吸光度[8].每组样品重复测定3次,使用SPASS软件对数据方差分析处理.
1.5 耐酸性的测定
将20 mL无菌的pH分别为1.5、2、2.5、3、4、5和6的YPD液体培养基置于三角瓶中,取处于对数生长期的酵母种子液200μL加入到上述培养液中,28 ℃,120 r/min 摇床培养48 h,取样测定其在600 nm下的吸光度.每组样品重复测定3次,使用SPASS软件对数据方差分析处理.
1.6 产气性的测定
将10 mL无菌的葡萄糖浓度分别为500 g/L和800 g/L的YPD液体培养基置于试管中,取处于对数生长期的酵母种子液100μL加入到上述培养液中,用杜氏小管观察代谢气体的生成量,28 ℃静置培养7天,每天观察杜氏管中的气体生成量.每组样品重复测定3次.
1.7 菌落及细胞形态观察
各分离株在YPD平板上涂布接种,28 ℃培养5 d后进行单菌落形态观察,并拍照.取处于对数生长期的菌液,在光学显微镜下观察菌株细胞形态.
1.8 分子鉴定
1.8.1 菌体总DNA提取
将菌株在YPD培养液中活化培养后,收集菌体.按照酵母基因组DNA提取试剂盒的说明书进行菌体总DNA提取.
1.8.2 26S rDNA PCR扩增
采用通用引物NL-1∶5′-GCATATCAATAAG-CGGAGGAAAAG-3′及NL-4∶5′-GGTCCGTGTT-TCAAGACGG-3′ 进行PCR扩增,引物由北京六合华大基因有限公司合成[9].扩增体系:总体积50μL,包括10μL模板,1μL上游引物,1μL下游引物,0.2μLTaqDNA 聚合酶,1μL dNTP,1.8μL MgCl2,5μL 10 × PCR 缓冲液,2.5μL DMSO,27.5μL 灭菌蒸馏水[10].PCR 反应程序:94 ℃ / 3 min(预变性);94 ℃ / 1 min变性,58 ℃ / 1 min 退火,72 ℃ / 2 min 延伸,36个循环;72 ℃ / 5 min 延伸.通过1.0% 琼脂糖凝胶电泳确认扩增的DNA片段,并将PCR扩增产物寄送至北京六合华大基因有限公司进行测序[10].获得的序列与GenBank数据库中序列进行Blast(http:∥www.ncbi.nlm.nih.gov/)比对,用 CLUSTAL-X软件进行序列比对,并用MEGA软件进行系统发育树构建[6].
1.9 分离菌株在浓缩海红果汁中生长能力的测定
准备20支试管,每只试管中加入5 mL浓缩海红果汁,100 ℃灭菌20 min.取处于对数生长期的酵母种子液200μL加入到无菌浓缩海红果汁中,28 ℃静置培养.每隔48 h取1支试管,用30%葡萄糖液进行连续梯度稀释,稀释液在30%YPD固体平板上进行涂布,28 ℃培养5~7 d 后进行菌落计数.每组样品重复测定3次.
运用DMFit软件中的Baranyi and Roberts 模型对菌落数(单位:lg CFU/mL)及培养时间(单位:d)进行拟合,根据拟合公式计算出各菌株生长曲线的潜在最大生长速率(μmax,lg CFU /(mL·d))及迟滞期(λ,d)[11].Baranyi and Roberts模型的简化形式为:
N=N0exp(-λμmax)[-1+exp(λμmax)+
exp(μmaxt)]
(1)
式(1)中:t—任意时刻,d;N—t时刻的微生物数,CFU/mL;N0—初始时刻的微生物数,CFU/mL;μmax—潜在最大生长速率,lg CFU/(mL·d);λ—迟滞期,d.
2 结果与讨论
2.1 分离株耐糖性测定
从浓缩海红果汁中分离高渗酵母,经纯化得到4株菌.菌株LT1和LT2具有相似的耐糖性,在葡萄糖浓度为500~650 g/L培养基中的生长速率随着糖浓度的增加受到显著抑制(plt;0.05).葡萄糖浓度进一步提高至700 g/L及以上时,生长被完全抑制(pgt;0.05).菌株LT3和LT4也表现出相似的耐糖性,在葡萄糖浓度为500~700 g/L培养基中的生长速率无显著差异(pgt;0.05).随着葡萄糖浓度的进一步提高(750~900 g/L),由于高糖的胁迫作用,其生长速率逐渐减弱(plt;0.05),表现出较强的耐糖性.由于LT1和LT2、LT3和LT4的耐糖性比较相似,图1中只列出LT1和 LT3 的耐糖曲线.
2.2 分离菌耐酸性测定
由于LT1和LT2、LT3和LT4的耐酸性比较相似,图2仅列出LT1和 LT3的耐酸曲线.可以看出,4株分离菌均可在pH为3~6的培养基中生长,且pH从6降到3对分离株的生长速率无显著影响(pgt;0.05).进一步降低pH至2.5,酸胁迫作用才体现出来,4株分离菌的生长被逐渐抑制(plt;0.05).此时,LT3的生长速率显著强于LT1,表现出较强的耐酸性(plt;0.05).进一步降低pH至2.0及以下,4株菌的生长均被完全抑制(pgt;0.05).

图1 分离菌株在葡萄糖质量浓度为500~900 g/L YPD液体培养基中的生长状况
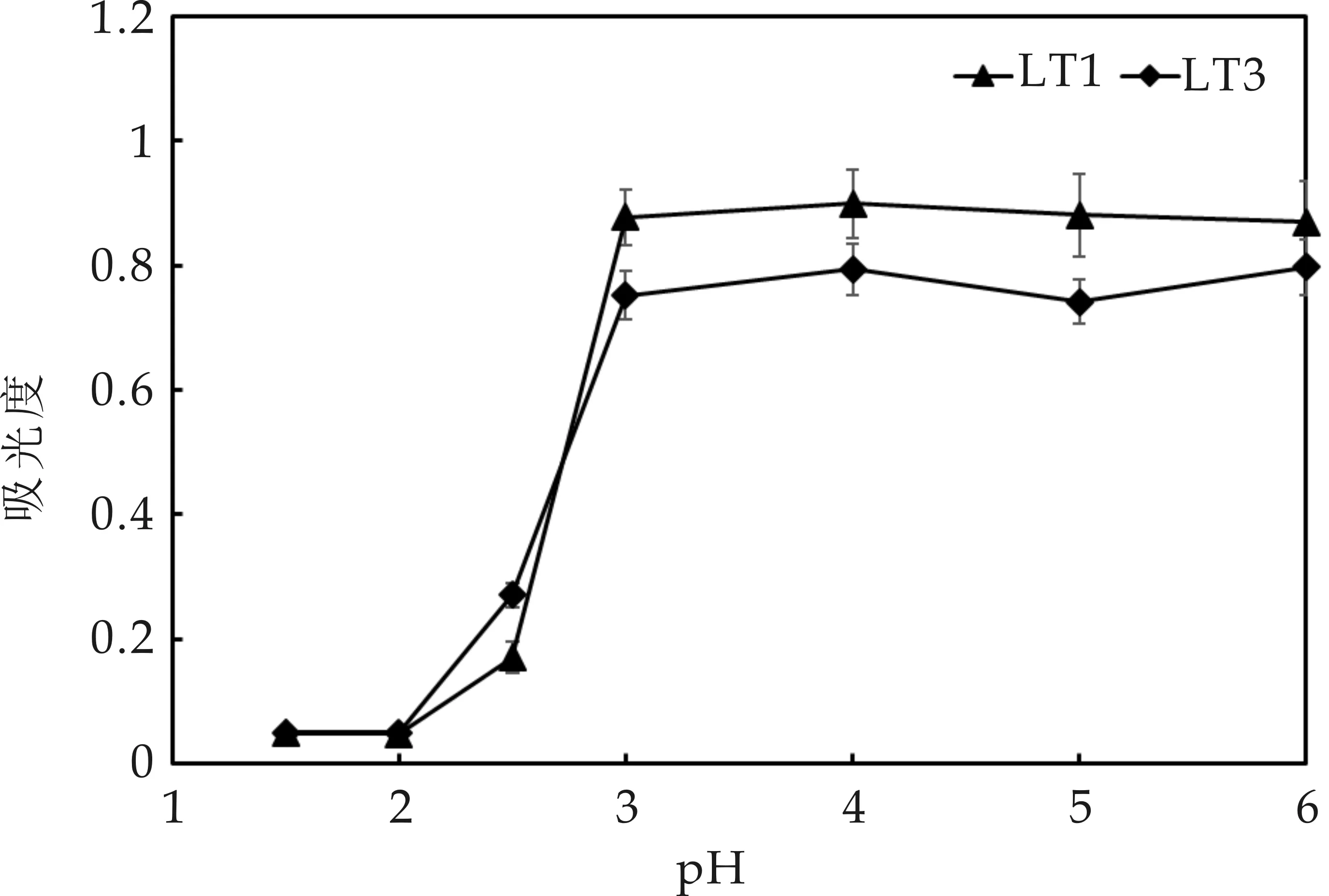
图2 分离菌株在pH为 1.5~6.0的 YPD 液体培养基中的生长状况
2.3 分离菌产气性测定
由表1可以看出,4株分离菌都能够24 h内在500 g/L葡萄糖环境中代谢产气,表现出较快的糖代谢速率.菌株LT3和LT4 是分离菌株中产气速度最快的酵母,24 h内代谢生成超过杜氏管2/3总体积的气体量.当葡萄糖浓度进一步提高至800 g/L时,菌株LT1和LT2的糖代谢被完全抑制,培养时间内无气体生成;菌株LT3和LT4的代谢由于受到高糖胁迫,产气速率有所减缓,48 h 内代谢生成超过杜氏管2/3总体积的气体量,表现出较强的耐糖性(如表2所示).
可以看出,菌株LT3和LT4具有较强的耐糖、耐酸及产气性,潜在污染能力较强,危害较大.这两株菌后续经分子鉴定为鲁氏接合酵母(Zygosaccharomycesrouxii).前人研究结果表明:鲁氏接合酵母是一种重要的腐败酵母,具有耐酸、耐弱酸防腐剂、耐高浓度糖并能够适应高浓度糖、代谢己糖生成 CO2的生理特性,是糖浆、蜂蜜及浓缩果汁等高糖食品及饮料的重要污染源[12,13].笔者也曾在浓缩苹果汁(可溶性固形物含量70 ° Brix;pH 3.5)中分离出鲁氏接合酵母,并证实其能够在浓缩苹果汁中生长[10].本文研究结果表明菌株LT3和LT4具有较强的耐糖、耐酸及产气性,与前人研究结果一致.

表1 分离菌株在50%(w/v)葡萄糖中产气结果
注: “+”表示产气量不超过杜氏管总体积1/3;“++”表示产气量介于杜氏管总体积1/3~2/3之间;“+++”表示产气量超过杜氏管总体积2/3.
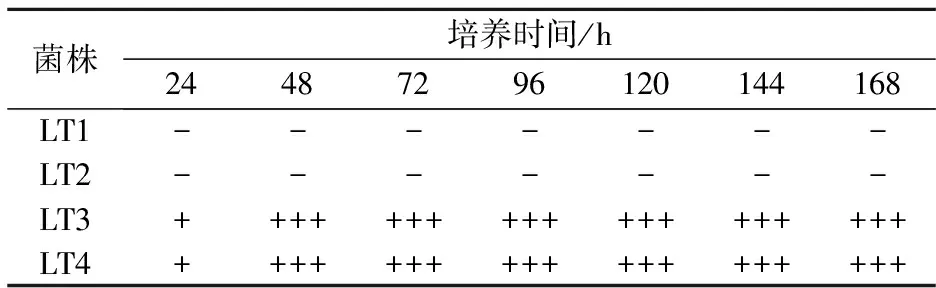
表2 分离菌株在80%(w/v)葡萄糖中产气结果
注: “-”表示无气体生成;“+”表示产气量不超过杜氏管总体积1/3;“++”表示产气量介于杜氏管总体积1/3~2/3之间;“+++”表示产气量超过杜氏管总体积2/3.
2.4 菌落形态及细胞形态观察
4株分离菌在YPD平板上培养5 d后其菌落形态均为白色或乳白色的圆形菌落.菌落表面光滑,湿润,边缘整齐,中心突起(如图3所示).显微镜下观察菌株细胞均为椭圆形,出芽生殖(如图4所示).
(a)LT1 (b)LT2

(c)LT3 (d)LT4

(a)LT1 (b)LT2

(c)LT3 (d)LT4
2.5 分子鉴定及系统进化树分析
采用BLAST工具对分离株与GenBank数据库中菌株的26S rDNA序列进行比对,并通过NJ(Neighbour-joining)法构建系统进化树,确定了分离菌株的系统发育地位.BLAST结果表明:菌株 LT1、LT2与酿酒酵母(Saccharomycescerevisiae)的亲缘关系最近,同源率分别为99.56%和99.85%;菌株LT3、LT4与鲁氏接合酵母(Z.rouxii)的亲缘关系最近,同源率分别为99.48%和99.82%(如表3所示).系统发育树结果表明:菌株LT1、LT2与酿酒酵母(S.cerevisiae)聚成一类,表现出相同的系统发育地位;菌株LT3、LT4与鲁氏接合酵母(Z.rouxii)具有相同的系统发育地位(如图5所示).结合序列比对和系统发育树分析结果,确定菌株LT1和LT2是酿酒酵母(S.cerevisiae),菌株LT3和LT4是鲁氏接合酵母(Z.rouxii).
分离得到的2株酿酒酵母(S.cerevisiae)与其余2株鲁氏接合酵母(Z.rouxii)相比不仅耐糖性较差,而且后续研究发现其无法在浓缩海红果汁中生长.笔者也曾在浓缩苹果汁中分离出热带假丝酵母(Candidatropicalis)并发现其无法在浓缩苹果汁中生长[10].推测酿酒酵母(S.cerevisiae)并不是浓缩海红果汁的固有污染微生物,而是一种偶然性污染微生物(分离操作环境中的酵母可能污染浓缩汁而被分离出来),其不能耐受浓缩汁的高渗胁迫,因而不会引起浓缩汁腐败变质.

表3 分离菌株与Genbank参考菌株的比对结果

图5 分离菌株26S r DNA序列系统发育树
2.6 分离株在浓缩海红果汁中生长情况
在28 ℃条件下,菌株LT1和LT2不能在浓缩海红果汁中生长,而菌株LT3和LT4能够生长.应用DMfit软件分别对菌株LT3和LT4在浓缩海红果汁中的生长曲线进行拟合,得到的生长曲线如图6所示.可以看出,拟合曲线基本反映了微生物生长趋势,先是迟滞期,然后进入对数期(曲线斜率增大),而后进入稳定期(斜率平稳).DMfit软件同时计算出了菌株LT3和LT4生长模型的几个参数:潜在最大生长速率(μm)、迟滞期(λ)、拟合曲线相关系数(R2)和标准误(SE),如表4所示.由表4可以看出,菌株LT3和LT4在浓缩海红果汁中的生长情况比较相似,μm与λ值都比较接近.其拟合曲线的R2都在0.99以上,标准误在0.14~0.16之间,说明两株菌的实验值与模型预测值拟合较好.
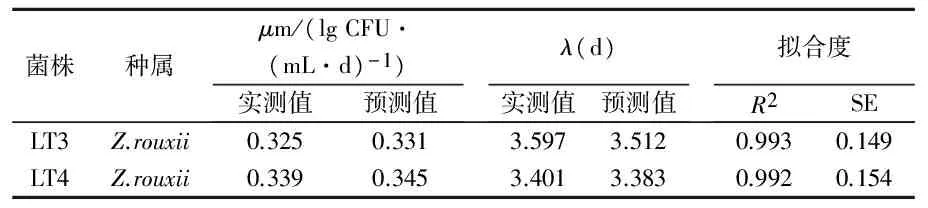
表4 28 ℃条件下分离菌株在浓缩海红果汁中的生长动力学参数及统计分析

(a) LT3
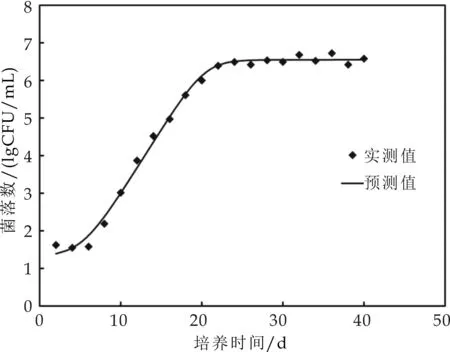
(b) LT4
目前国内外关于浓缩果汁中微生物污染的研究主要集中于嗜酸耐热菌(脂环酸芽孢杆菌),涉及高渗酵母的研究较少[14,15].一般来说,酵母对高温比较敏感,传统的巴氏杀菌技术很容易将其灭活,但浓缩果汁中高浓度糖类物质等成分能够显著增强酵母细胞的高温耐受性,对灭菌温度和时间提出较为苛刻的要求,考虑到浓缩汁工业化生产实际及杀菌成本经济性需要,生产企业很难满足上述要求,因而浓缩汁生产中高渗酵母的污染控制可能并不彻底[5,16].同时,由于生产设备的某些死角灭菌不彻底,浓缩汁灌装时与生产车间空气接触以及包装材料的卫生指标较差等因素也会导致高渗酵母污染浓缩汁.目前浓缩汁的终产品一般都采用无菌袋包装,包装袋内存在一定浓度的氧气,贮存和运输温度为常温,而常温及有氧条件都有利于高渗酵母的繁殖和生长,从而引起浓缩汁腐败变质.
3 结论
对陕西府谷县聚金邦农产品开发公司生产的浓缩海红果汁中高渗酵母进行了分离鉴定,得到4株高渗酵母,其中2株为酿酒酵母(S.cerevisiae),2株为鲁氏接合酵母(Z.rouxii).鲁氏接合酵母具有较强耐糖、耐酸及产气性,能够对浓缩海红果汁质量造成威胁,需加强控制.
[1] Combina M,Daguerre C,Massera A,et al.Yeast identi-fication in grape juice concentrates from argentina[J].Letters in Appled Microbiology,2008,46(2):192-197.
[2] Rojo M,Arroyo López F,Lerena M,et al.Effects of pH and sugar concentration inZygosaccharomycesrouxiigrowth and time for spoilage in concentrated grape juice at isothermal and non-isothermal conditions[J].Food Microbiology,2014,38:143-150.
[3] Wang H X,Hu Z Q,Long F Y,et al.Characterization of osmotolerant yeasts and yeast-like molds from apple orchards and apple juice processing plants in china and investigation of their spoilage potential[J].Journal of Food Science,2015,80(8):1 850-1 860.
[4] Rojo M,Palazzolo C,Cuello R,et al.Incidence of osmophilic yeasts andZygosaccharomycesrouxiiduring the production of concentrate grape juices[J].Food Microbiology,2017,64:7-14.
[5] Martorell P,Stratford M,Steels H,et al.Physiological characterization of spoilage strains ofZygosaccharomycesbailiiandZygosaccharomycesrouxiiisolated from high sugar environments[J].International Journal of Food Microbiology,2007,114(2):234-242.
[6] 王虎玄.浓缩苹果汁全产业链高渗酵母分离鉴定及电子鼻快速检测方法研究[D].杨凌:西北农林科技大学,2016.
[7] 陈梓齐.海红果大枣复合果酒生产工艺研究[D].西安:陕西科技大学,2016.
[8] 张淑娴.基于酿酒酵母原始株与乙醇适应株间的差异分析乙醇耐受性机制[D].北京:北京化工大学,2014.
[9] Kurtzman C P,Robnett C J.Three new insect-associated species of the yeast genus Candida[J].Canadian Journal of Microbiology,1998,44(10):965-973.
[10] 王虎玄,岳田利,胡仲秋,等.陕西浓缩苹果汁中高渗酵母的分离鉴定[J].农业机械学报,2015,46( 4) :246-251.
[11] Baranyi J,Roberts T A.A dynamic approach to predicting bacterial growth in food[J].International Journal of Food Microbiology,1994,23,277-294.
[12] Mira N P,Teixeira M C.Microbial mechanisms of tolerance to weak acid stress[J].Frontiers in Microbiology,2013,4:416-423.
[13] Vermeulen A,Marvig C,Daelman J,et al.Strategies to increase the stability of intermediate moisture foods towardsZygosaccharomycesrouxii:the effect of temperature,ethanol,pH and water activity with or without the influence of organic acids[J].Food Microbiology,2015,45:119-125.
[14] Yang Y,Yang Q,Ma X,et al.A novel developed method based on single primer isothermal amplification for rapid detection of Alicyclobacillus acidoterrestris in apple juice[J].Food Control,2017,75:187-195.
[15] Tremarin A,Brandão T R S,Silva C L M.Inactivation kinetics of Alicyclobacillus acidoterrestris in apple juice submitted to ultraviolet radiation[J].Food Control,2017,73:18-23.
[16] 李国良.浓缩苹果汁中耐高渗酵母的检测与控制技术[D].杨凌:西北农林科技大学,2012.
【责任编辑:蒋亚儒】
Characterizationofosmotolerantyeastinmalusmicromalusmakinojuiceconcentratefromshaanxiprovince
WANG Hu-xuan, LIU Ting, MA Yuan, LIN Ze-xue, LIU Ning, YANG Hui*
(School of Food and Biological Engineering, Shaanxi University of Science amp; Technology, Xi′an 710021, China)
In order to identify osmotolerant yeasts which are capable of causing spoilage for malus micromalus makino juice concentrate,the yeasts in malus micromalus makino juice concentrate collected from malus micromalus makino juice processing plants in Shaanxi province were isolated and purified by using YPD media containing high sugar content.The sugar-tolerance,acid-tolerance,and gas-production capability of each yeast isolate were assayed to evaluate the contamination potential.The colony and cell morphology were characterized and the phylogenetic tree based on 26S rDNA sequence analysis was constructed to determine the genetic location of isolates.A total of 4 yeast stains were isolated from concentrated juice,two of which were identified as strain ofSaccharomycescerevisiae,and all the other isolates belonged toZygosaccharomycesrouxii.All the isolated strains ofZ.rouxiidisplayed better sugar-tolerance,acid-tolerance,and gas-production capability than those isolates ofS.cerevisiae,and they were capable of growing in malus micromalus makino juice concentrate.The results suggested that strains ofZ.rouxiimight pose a threat to the quality of malus micromalus makino juice concentrate,and needed to be controlled in the production line.
malus micromalus makino juice concentrate; osmotolerant yeasts; contamination potential; isolation and identification;Zygosaccharomycesrouxii
2017-09-04
国家自然科学基金项目(31501443); 陕西省大学生创新创业训练计划项目(1337); 陕西科技大学博士科研启动基金项目(2016BJ-39)
王虎玄(1986-),男,陕西韩城人,讲师,博士,研究方向:食品腐败微生物检测与控制
杨 辉(1960-),男,陕西西安人,教授,博士生导师,研究方向:发酵工程和生物材料,yangh@sust.edu.cn
2096-398X(2017)06-00114-06
S182
A
