嗜水气单胞菌外膜蛋白原核表达及其免疫保护性研究
2017-12-02杨佳杰
刘 望, 杨佳杰, 杨 静, 薛 茜, 张 苗, 刘 欢
(陕西科技大学 食品与生物工程学院, 陕西 西安 710021)
嗜水气单胞菌外膜蛋白原核表达及其免疫保护性研究
刘 望, 杨佳杰, 杨 静, 薛 茜, 张 苗, 刘 欢*
(陕西科技大学 食品与生物工程学院, 陕西 西安 710021)
嗜水气单胞菌是我国水产养殖鱼类重要病原菌,抗生素防治易产生耐药性等问题,亟需开发新型防治手段.外膜蛋白OmpA和OmpTS是嗜水气单胞菌主要的免疫原蛋白,为了得到免疫效果更佳的亚单位疫苗,利用大肠杆菌将OmpA和OmpTS进行融合表达,并对表达产物进行纯化,检测其对斑马鱼的免疫保护效果.结果表明:成功扩增获得大小分别为1 032 bp和1 068 bp的OmpA和OmpTS基因序列,随后进行Overlap PCR,得到大小为2 100 bp的融合片段OmpA-OmpTS.成功构建重组表达质粒 pET28a-OmpA-OmpTS,将其转入BL21 ( DE3),重组蛋白的表达条件为:菌体培养2 h后添加IPTG 1 mM,16 ℃下培养16 h.经纯化后得到重组蛋白OmpA-OmpTS; 最后将OmpA-OmpTS蛋白与弗氏不完全佐剂(FIA) 混合免疫斑马鱼,免疫保护率可达82.1%,表明该融合蛋白可作为候选亚单位疫苗进行进一步的开发.
嗜水气单胞菌; 外膜蛋白; 原核表达; 免疫保护性
0 引言
嗜水气单胞菌(Aeromonashydrophila)是一种条件致病菌,主要存在于海水、淡水、河流、湖泊等水环境以及污泥、土壤、人类粪便中,是我国水产养殖鱼类爆发性传染病的主要病原[1],可以感染草鱼、鲤鱼、鲫鱼以及罗非鱼等多种水产养殖鱼类,此外,嗜水气单胞菌还可以感染人和动物等[2],能引发人类的中耳炎、败血症及创伤面感染、腹膜炎以及急性肠胃炎等疾病[3,4].
近年来,世界各地均陆续报道从食品、医疗用品以及急性胃肠炎患者粪便中检测出嗜水气单胞菌[5,6],在国外,嗜水气单胞菌已经被列入食品卫生检验的对象和医院腹痛腹泻病原菌检测的一项内容.因此,嗜水气单胞菌相关疾病的爆发不仅给水产养殖业造成巨大损失,还直接对人类健康造成了威胁,受到水产、兽医学界的重视[7].
目前,防治该病的主要方法仍是使用抗生素,但是随着抗生素的反复使用,细菌产生耐药性,抗菌治疗的效果不明显,导致患病鱼的平均死亡率达40%~50%,给水产养殖业造成了严重的经济损失.因此,寻找免疫保护性抗原是预防该病暴发的重要手段.
国内外学者已对嗜水气单胞菌进行了系统研究,发现嗜水气单胞菌可产生多种毒力因子,得到认可的毒力因子包括外毒素、胞外蛋白酶、脂多糖、外膜蛋白等.外膜蛋白(Outer membrane proteins,Omps)是存在于细菌外膜中所有蛋白的总称,在维持外膜结构、保证物质运输等方面有着重要作用[8].同时,由于其位于细胞的最外面而在细菌适应环境变化及致病性过程中亦扮演着重要角色.当细菌进入一个新的环境时,其外膜蛋白的合成会跟着变化[9].有许多研究结果表明,细菌的主要外膜蛋白的免疫原性很强,是重要的保护性抗原,利用致病菌的 OMP 做免疫原还可使鱼产生对不同血清型菌株感染的交叉保护力[10-12].
本研究选取嗜水气单胞菌外膜蛋白ompA 基因和ompTS 基因在大肠杆菌中进行融合共表达,分离和纯化,并与弗氏不完全佐剂(Freud′s incomplete adjuvant,FIA) 结合,考察其对斑马鱼的免疫保护效果,旨在为研制嗜水气单胞菌基因工程奠定基础.
1 材料与方法
1.1 材料
1.1.1 菌株与质粒
大肠杆菌DH5α、BL21(DE3)、嗜水气单胞菌LS01、表达质粒pET28a均由本实验时保存.pMD19T购自TaKaRa公司.
1.1.2 主要试剂和仪器
(1)主要试剂:LB培养基,购自上海生工生物工程有限公司;Taq DNA聚合酶、Pfu高保真聚合酶、蛋白质分子标准量Marker、DNA分子标准量Marker、DNA回收试剂盒及质粒抽提试剂盒,购自北京天根生化科技有限公司;T4DNA连接酶及限制性内切酶,购自TaKaRa公司.
(2)主要仪器:恒温培养箱,LRH-250,上海一恒科学仪器有限公司;摇床,THZ-C-1,太仓市仪器设备厂;PCR仪,MyCycler thermal cycler;核酸电泳仪,power PacTMHC,伯乐生命医学产品有限公司;凝胶成像系统,FR980,上海复日科技有限公司.
1.1.3 引物
表1为本研究中使用的引物,参照GenBank上公布的基因序列设计,由上海捷瑞生物工程有限公司合成.下划线为限制性内切酶识别位点.
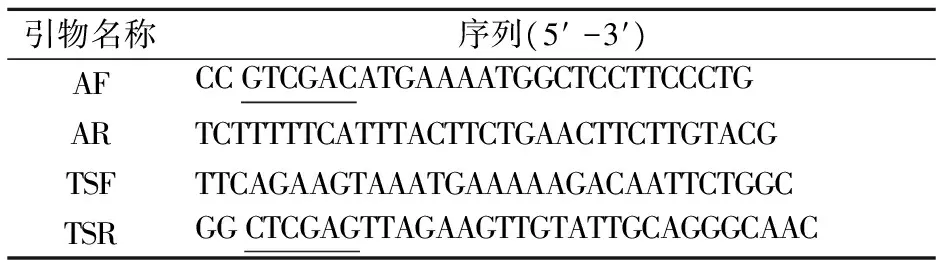
表1 实验中所使用的引物
1.2 方法
1.2.1 ompA和ompTS基因的克隆及ompA-ompTS融合基因的构建
将-80 ℃保存的嗜水气单胞菌接种于LB液体培养基,30 ℃ 恒温培养24 h,取1 mL 培养菌液按照天根细菌DNA提取试剂盒提取基因组DNA,以其为模板,分别利用引物对AF/AR和TSF/TSR进行基因扩增,分别克隆获得ompA和ompTS基因.PCR反应体系为 50μL: 2×Taq Master Mix 25μL,DNA 模板 3μL,上下游引物各3μL,补加 dd H2O 至 50μL.反应条件:94 ℃ 预变性4 min,94 ℃ 50 s,55 ℃ 30 s,72 ℃ 1 min,共30 个循环,最后 72 ℃延伸 7 min.反应产物以1% 琼脂糖凝胶电泳,凝胶成像系统检测扩增结果.随后以回收到的ompA和ompTS基因序列为模板,以引物对AF/TSR进行Overlap PCR,反应条件除延伸时间增加至2 min 钟外,其他条件同上.产物检验后割胶回收并用试剂盒纯化,最后以物质的量之比3∶1(插入片段/载体) 的比例克隆入pMD19-T 载体,转化大肠杆菌DH5α,在含氨苄青霉素( 100μg/mL) 的LB 平板上挑取含有重组质粒pMD19T-ompA-ompTS的阳性克隆,利用T载体通用引物M13进行菌落 PCR鉴定后进行基因测序.
1.2.2 重组表达质粒pET28a-ompA-ompTS的构建
分别对重组质粒pMD19T-ompA-ompTS和表达质粒pET28a进行质粒提取,并根据引物中设计的酶切位点,分别利用SalI和XhoI对所抽提的质粒进行双酶切消化,琼脂糖凝胶电泳分析并将酶切后的融合基因ompA-ompTS与表达质粒pET28a进行连接,转化大肠杆菌BL21( DE3),在含卡那霉素( 100μg/mL) 的LB 平板上挑取含有重组质粒pET28a-ompA-ompTS的阳性克隆,利用pET系列载体T7通用引物进行菌落 PCR鉴定后进行基因测序.
1.2.3 重组表达载体pET28a-ompA-ompTS在大肠杆菌中的表达和纯化
将构建好的含有重组表达质粒pET28a-ompA-ompTS的大肠杆菌BL21置于添加卡那霉素的LB培养基中过夜活化培养.次日按照体积比1∶100 加入到 1 mL同样的培养液中,37 ℃振荡培养.当菌种OD600达到0.6~0.8时,加入IPTG,不同温度下进行诱导表达,随后收集菌体进行SDS-PAGE分析.将诱导表达后以包涵体形式存在的融合蛋白进行超声破碎,沉淀用含2 mol/L尿素的包涵体洗涤液洗涤,洗涤后离心倒去上清,重复3次;再用含6 mol/L盐酸胍缓冲液溶解重组蛋白,将溶解后的溶液用0.45μm孔径的滤膜过滤,过滤后的溶液经 Ni柱亲和纯化,纯化的蛋白于4 ℃进行梯度尿素复性透析至PBS,复性产物经SDS-PAGE进行检测.
1.2.4 重组融合蛋白与弗氏不完全佐剂混合乳化
将纯化后的OmpA-OmpTS融合蛋白用PBS重悬,将其浓度调整至2 mg/mL,然后与弗氏不完全佐剂FIA按照1∶1的比例混合,在10 mL无菌注射器中进行乳化.乳化时先用移液器乳化5 min,然后用注射器反复推进,直至水相与油相完全融到一起,形成油包水的乳白色液滴.取一滴滴入水中,如果液滴不扩散则说明乳化完全,若扩散则需继续乳化.将乳化好的样品放4 ℃冰箱保存备用.
1.2.5 免疫
将健康斑马鱼随机分成4 组,其中2个组为免疫组(OmpA-OmpTS+FIA、OmpA-OmpTS),2个组为对照组 (FIA、PBS),每组20条,平行设置3组.亚单位疫苗OmpA-OmpTS免疫剂量为 2μg/g 鱼,与佐剂按照 1∶1 进行混合,每尾鱼背部肌肉注射配比好的佐剂疫苗,对照组注射等量的FIA或PBS.2 周后免疫组用等量的亚单位疫苗加强免疫一次(不包含佐剂).
1.2.6 攻毒试验
将嗜水气单胞菌LS01菌株接种于新鲜培养基中,于30 ℃过夜培养.以 7.5×107CFU/mL为攻毒浓度,每尾背部肌肉注射0.2 mL,攻毒后连续观察7 d,记录死亡情况.以相对保护率表示免疫效果: 相对保护率(RPS) = [1-( 免疫组死亡率/对照组死亡率)]×100% .
2 结果与讨论
2.1 ompA和ompTS基因的克隆与鉴定
以嗜水气单胞菌LS01基因组DNA为模板,用设计的引物对AF/AR和TSF/TSR分别进行PCR扩增,通过凝胶电泳分析发现,成功获得大小分别为1 032 bp和1 068 bp的ompA和ompTS基因片段(如图1所示).PCR产物纯化后构建T-A克隆进行测序,在 NCBI上进行序列比对分析,确定二者分别为嗜水气单胞菌OmpA和OmpTS蛋白编码基因的开放阅读框编码序列区,其编码的蛋白质分别包含345个和356个氨基酸残基.

图1 ompA和ompTS基因克隆PCR电泳图
2.2 序列同源性分析
新鲜的黄牛肉呈棕色或暗红,剖面有光泽,结缔组织为白色,脂肪为黄色,肌肉间无脂肪杂质;新鲜的绵羊肉,肉质较坚实,颜色红润,纤维组织较细,略有些脂肪夹杂其间,膻味较重;新鲜的山羊肉,肉色比绵羊的肉质厚、略白,皮下脂肪和肌肉间脂肪少,膻味较轻。
在对OmpA和OmpTS蛋白编码基因进行测序后,将两个基因编码的氨基酸序列分别与NCBI数据库中已登录的嗜水气单胞菌及其他气单胞菌属氨基酸序列进行比对分析:结果发现嗜水气单胞菌LS01的OmpA基因和OmpTS基因编码的蛋白与嗜水气单胞菌ATCC7966外膜蛋白OmpA和OmpTS的同源性为99% ,表明嗜水气单胞菌OmpA和OmpTS高度保守.同时,OmpTS与其他气单胞菌属(温和气单胞菌,豚鼠气单胞菌)中的OmpTS亦具有较高的保守性,同源度均达到82%以上.而OmpA与其它气单胞菌属中的OmpTS氨基酸组成的同源性亦可达到65%以上(如图2、图3所示).可见,OmpA和OmpTS不止在嗜水气单胞菌中具有较高的保守性,且在气单胞菌属中亦具有较高的保守性,因此,以这两种蛋白构建的亚单位疫苗可能对多种气单胞菌属的病原菌实现多效价的免疫保护作用.

图2 OmpA氨基酸序列同源性比对分析
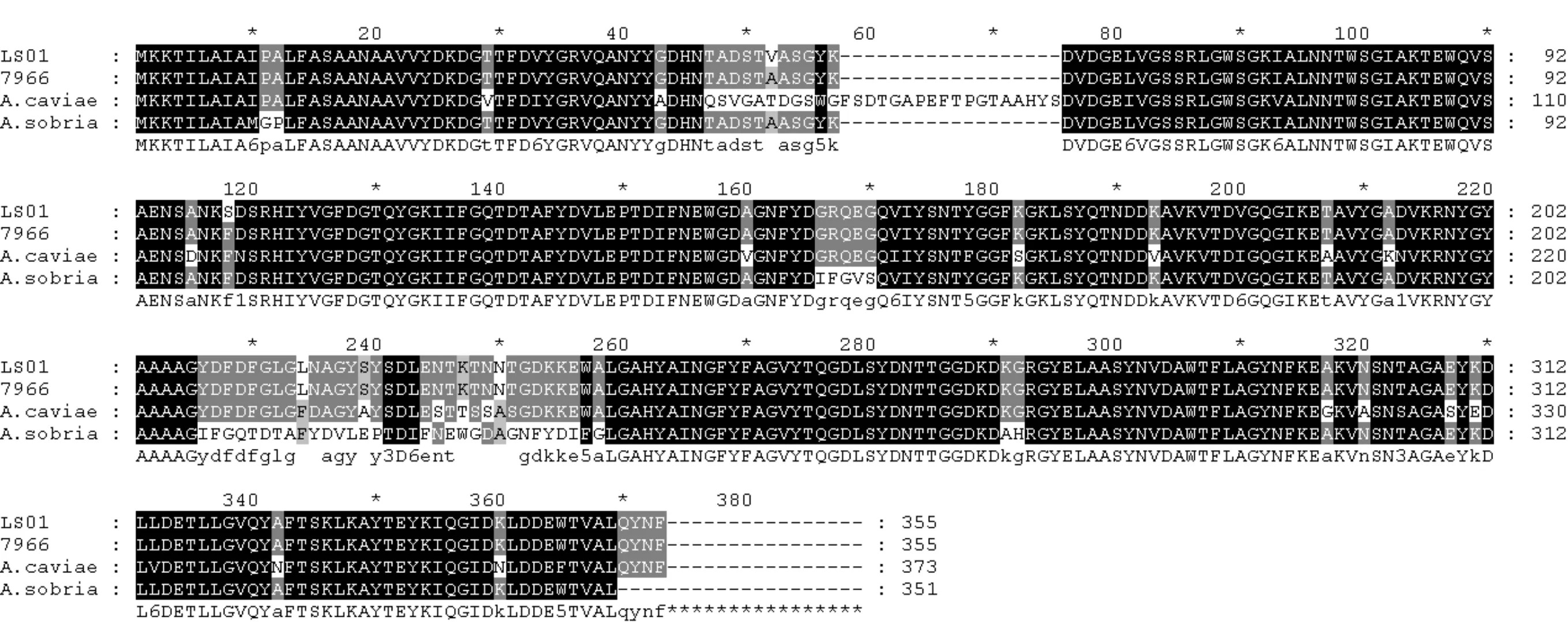
图3 OmpTS氨基酸序列同源性比对分析
2.3 融合基因ompA-ompTS的克隆
在成功克隆得到了嗜水气单胞菌LS01中外膜蛋白OmpA和OmpTS编码基因后,进一步地,通过Overlap PCR将OmpA和OmpTS编码基因进行融合连接.结果显示,以OmpA和OmpTS编码基因为模板,利用引物对AF/TSR成功扩增得到大小为2 100 bp的特异性DNA片段(如图4所示),对产物进行回收和测序后证实其为融合基因ompA-ompTS.

图4 ompA-ompTS融合基因 Overlap PCR电泳图
2.4 重组表达质粒pET28a-OmpA-OmpTS的构建及鉴定
克隆得到融合基因ompA-ompTS后,通过限制性内切酶消化后与表达质粒pET28a进行重组连接,并转化至宿主大肠杆菌BL21(DE3)中,于含有卡那霉素的抗性平板上培养,挑选克隆子,并利用pET28a表达载体通用引物进行菌落PCR验证,结果如图5所示.可以看到,挑选的7个克隆中有6个扩增得到大小为2 300 bp左右(即融合片段与通用引物在表达载体自身克隆片段之和)的特异性片段,即为阳性克隆,对其进行保种并进行测序分析,测序结果显示阳性克隆株中含有成功连接了融合片段ompA-ompT的重组表达质粒.
2.5 OmpA-OmpTS融合蛋白诱导表达分析
将pET28a-OmpA-OmpTS质粒转化大肠杆菌BL21( DE3) 得到 BL21/pET28a-OmpA-OmpTS重组菌,随后对其重组蛋白的表达条件进行了优化.结果发现重组表达菌株在培养2 h后添加IPTG 1 mM,16 ℃下培养16 h经诱导后,与未经诱导重组菌全蛋白电泳条带相比,在相对分子质量约80 kDa 处有一条表达量较高的蛋白条带,大小与OmpA-OmpTS融合蛋白相符,说明OmpA-OmpTS融合蛋白成功表达(如图6所示).

MW:蛋白质分子量标准;1:IPTG诱导后的pET28a/BL21;2:诱导16 h后的pET28a-ompA-ompTS/BL21;3:诱导前的 pET28a-ompA-ompTS/BL21 重组质粒
为了进行后续的免疫保护效果的测定,首先需要对重组表达蛋白进行分离纯化.将诱导表达后以包涵体形式存在的融合蛋白进行超声破碎,沉淀经洗涤后用盐酸胍缓冲液溶解重组蛋白,经 Ni柱亲和纯化的蛋白进行梯度尿素复性,随后SDS-PAGE 进行检测.结果显示,纯化后可获得大小约为80 kDa的目的蛋白(如图7所示).

图7 OmpA-OmpTS融合蛋白的纯化
2.7 融合蛋白OmpA-OmpTS免疫保护性分析

图8 嗜水气单胞菌攻毒斑马鱼累计死亡率
在利用纯化后的融合蛋白OmpA-OmpTS、混合FIA佐剂的融合蛋白以及对照分别对斑马鱼进行免疫后,用嗜水气单胞菌LS01进行鱼体攻毒实验.试验鱼攻毒后第1天便出现死亡,第2天开始,FIA和PBS对照组出现大量死亡的情况,而免疫组OmpA-OmpTS及OmpA-OmpTS+FIA组斑马鱼的死亡情况则明显减少(如图8所示) .PBS、FIA、OmpA-OmpTS和OmpA-OmpTS+FIA组连续观察7 d的累计死亡率分别为100%、93.33%、31.7%和16.7%.OmpA-OmpTS和OmpA-OmpTS+FIA组对于斑马鱼在抵抗嗜水气单胞菌攻毒时的相对保护率分别为68.3%和82.1%.可见,经融合蛋白OmpA-OmpTS免疫后的斑马鱼可以较好地抵制嗜水气单胞菌的侵染,具有较好的免疫保护效果.
3 结论
嗜水气单胞菌是水产养殖,尤其是淡水鱼类一种重要的条件致病菌,每年因其感染所引起的病害给我国水产养殖业造成了巨大的经济损失.传统的抗生素防治手段因易造成耐药性和药物残留等问题已被国家禁止在水产养殖过程中使用. 疫苗由于具有较好的免疫活性和环境友好等优点已成为目前病害防治领域研究的热点.很多研究表明,外膜蛋白具有良好的免疫原性,是研制基因工程疫苗的良好材料[13-15].
本研究选取pET28a作为表达载体,将通过Overlap PCR进行融合的两个外膜蛋白OmpA和OmpTS进行重组表达.成功获得可高效表达融合蛋白的重组表达质粒,通过对融合蛋白分离和纯化后获得融合蛋白OmpA-OmpTS,并对其进行斑马鱼免疫保护性实验,结果发现该融合蛋白OmpA-OmpTS在不添加佐剂时对斑马鱼的免疫保护率达到68.3%,与FIA佐剂混合后免疫保护率可达82.1%,可较好地抵御嗜水气单胞菌病害的发生.
本研究为嗜水气单胞菌亚单位疫苗的设计与开发奠定了一定的理论基础.但鉴于嗜水气单胞菌不同分离菌株间的毒力和致病性差异较大,该融合蛋白对斑马鱼的免疫保护效果只进行了针对LS01菌株攻毒的检测,而对于其它嗜水气单胞菌菌株的保护效果则需进一步的实验分析.同时,本研究只进行了两个外膜蛋白的融合表达,后续可进一步地筛选嗜水气单胞菌其它具有较高免疫原性的蛋白进行亚单位疫苗的构建,以期得到免疫效果更佳优良的疫苗.
[1] Vivas J,Carracedo B,Riano J,et al.Behavior of allAeromonashydrophilaaroA live vaccine in water microcosms[J].Appl Environ Microbiol,2004,70:2 702-2 708.
[2] 李文艳.嗜水气单胞菌相关毒力基因的研究进展[J].安徽农业科学,2001,39(9):5 060-5 064.
[3] 江金伦.一起由嗜水气单胞菌引起腹泻的调查[J].上海预防医学,2010,22(1):31-32.
[4] 黄 艳,韦小瑜,吴成梅,等.一起嗜水气单胞菌引起的食物中毒调查[J].中国食品卫生杂志,2012,24(4):391-393.
[5] 马群飞,陈伟伟,杨毓环.瓶装天然矿泉水嗜水气单胞菌污染情况调查[J].中国食品卫生杂志,2002,14(1):43-44.
[6] 崔树玉,温宪芹,赵克义,等.医疗用品中检出致病性嗜水气单胞菌的研究报告[J].中国卫生检验杂志,2005,15(8):923-924.
[7] Fang H M,Ge H,Sin Y M.Cloning characterization and expression ofAeromonashydrophilamajor adhesion[J].Fish Shellfish immun,2004,16:645-655.
[8] Liu J,Huang S X,Zhang Q J.Outer membrane proteins:key players for bacterial adaptation in host niches [J].Microb Infect,2002,4(3):325-331.
[9] Provenzano D,Lauriano C M,Klose K E.Characterization of the role of the ToxR-modulated outer membrane porins OmpU and OmpT in Vibrio cholerae virulence[J].J Bacteriol,2001,183(12):3 652-3 662.
[10] 周 宇,周秋白.嗜水气单胞菌防控技术研究进展[J].生物灾害科学,2012,35(2):126-133.
[11] 张 波,曾令兵,罗晓松,等.嗜水气单胞菌 3 种疫苗免疫的青鱼外周血免疫指标的变化[J].华中农业大学学报,2012,31(1):100-105.
[12] Rahman M H,Kawai K.Outer membrane proteins ofAeromonashydrophilainduce protective immunity in goldfish [J].Fish Shellfish Immunol,2000,10(4):379-382.
[13] 郑宗林,郑曙明,Delbert M G,等.嗜水气单胞菌外膜蛋白ompA 基因的原核表达及免疫保护性研究[J].淡水渔业,2015,45(5):3-10,28.
[14] 赵金平,段丽华,郭松林.鳗鲡病原菌外膜蛋白三联表达载体的构建、表达与表达产物的纯化[J].华中农业大学学报,2015,34(3):104-110.
[15] 刘 玮,倪 穗,邱军强,等.嗜水气单胞菌BYKAH2008AC株外膜蛋白和溶血素双基因的融合表达及免疫原性分析[J].生物学杂志,2012,29(4):17-21.
【责任编辑:陈佳】
TheprokaryoticexpressionandimmunoprotectionanalysisofoutermembraneproteinsofAeromonashydrophila
LIU Wang, YANG Jia-jie, YANG Jing, XUE Qian, ZHANG Miao, LIU Huan*
(School of Food and Biological Engineering, Shaanxi University of Science amp; Technology, Xi′an 710021, China)
Aeromonashydrophilais one of the important fish pathogen in China,and antibiotics treatment for this disease can cause the drug-resistance. Therefore,it′s an urgent need for developing new prevention methods now.In order to obtain the subunit vaccine with better immunoprotective effect,the two outer membrane proteins,OmpA and OmpTS were fusion expressed inEscherchiacoliand the products were purified and its protective efficiency on the zebra fish againstAeromonashydrophilawere tested.The results showed that the ompA (1 032 bp) and ompTS (1 068 bp) genes were successfully cloned and the fusion fragment,OmpA-OmpTS (2 100 bp),was obtained by overlap PCR.Then the recombinant expression plasmid,pET28a-OmpA-OmpTS,was constructed and introduced into the host strain,escherichia coli BL21 (DE3).The conditions for fusion protein expression were that with the addition of 1 mM IPTG after 2 h of the strain growth at 16 ℃ for 16 h.The recombinant protein,OmpA-OmpTS was purified and mixed with the adjuvant (FIA) to be injected to the zebra fish to test its protection effect againstAeromonashydrophila.The immunoprotectivity reached 87.5%,indicating that this fusion protein can be a candidate vaccine for further development.
Aeromonashydrophila; outer membrane protein; prokaryotic expression; immunoprotection
2017-08-10
国家自然科学基金项目(31301059); 陕西省科技厅自然科学基础研究计划面上项目(2017JM3010); 陕西省科技厅自然科学基础研究计划青年项目(2013JQ3011); 陕西省大学生创新创业训练计划项目(1326); 陕西科技大学博士科研启动基金项目(BJ12-24)
刘 望(1991-),男,陕西西安人,在读硕士研究生,研究方向:食源性病原微生物
刘 欢(1983-),女,陕西西安人,讲师,博士,研究方向:食源性病原微生物,liuhuan@sust.edu.cn
2096-398X(2017)06-0125-06
S917.1
A
