云南松种子发芽对温度和生长调节剂的响应
2017-12-01,,,,,,
, , , , , ,
(西南林业大学林学院, 云南 昆明 650224)
云南松种子发芽对温度和生长调节剂的响应
杨文君,李莲芳,汪亚愈,欧亚,凌莉芳,徐婷婷,吴思明
(西南林业大学林学院, 云南 昆明 650224)
为了解温度和GA3、IBA不同水平及其组合对云南松(Pinusyunnanensis)种子发芽的影响,采用L9(34)正交设计进行外源激素浸种后置于不同温度条件下的发芽实验。结果表明,不同处理组合种子的发芽率、发芽势、平均发芽时间和发芽指数分别为66.0%~86.0%、14.0%~29.3%、7.9~11.7 d和3.3~5.6粒/d,处理组合间此4项指标具有显著(p<0.05)或极显著(p<0.01)的差异。温度是影响种子发芽的主导因子,19.6 ℃提高种子发芽率。温度和GA3的不同水平对云南松种子发芽指标具有显著(p<0.05)或极显著(p<0.01)的差异影响,0.10 g/L的GA3溶液浸种促进种子发芽。GA3、IBA和温度的两两交互作用对发芽指标影响较为复杂,特定条件下对发芽指标的交互效应不同。
云南松; 种子; 发芽; 温度; 外源激素
云南松(Pinusyunnanensis),属松科(Pinaceae)松属的常绿针叶树种,高大乔木,是中国西南地区特有树种之一,也是构建云南省森林面积最大的乡土树种[1-2]。云南松具有适应性强、耐季节性干旱和贫瘠土壤的习性。云南松森林面积占云南省国土面积的29.98%,对云南的经济、社会和环境可持续发展具有不可替代的重要作用[2-4]。从20世纪70年代开始,大面积云南松天然林的逆向选择采伐,导致其森林质量降低、林分和林地退化等现象,形成大面积天然更新的低质低效次生林,此类林分必须通过人为干预方可实现有效地恢复其质量和产量,优质高效人工林培育是实现提高林分质量的重要途径之一。
壮苗培育是实现人工林优质高效培育目标的关键环节,种子发芽则是壮苗培育的必要过程和基础。适宜的温度和水分是影响种子发芽的关键因子[5-6]。因此,探索云南松种子发芽最佳温度,是云南松壮苗培育的重要技术措施之一。外源激素是与植物体内分泌激素具有相似生理和生物学效应的植物生长调节剂[7],吲哚丁酸(Indole-3-Butytric acid;IBA)是其中之一,具有提高发芽率的功效[8]。已有研究指出,低浓度的IBA促进云南松苗木的生长[9-13],但其对云南松种子发芽的研究较少。赤霉素与IBA类似,也是一种人工合成的植物生长调节剂,能打破种子休眠,促进种子发芽[14]。龚永尉等指出,0.10 g/L的GA3浸泡鹤望兰(Strelitziareginae)种子能明显提高其发芽率[15];张薇等[16]采用L9(34)正交设计开展IAA、GA3和IBA的发芽试验,结果发现,GA3具有促进云南松种子发芽的作用。本实验采用L9(34)正交设计,将GA3和IBA不同浓度溶液浸泡的云南松种子置于不同温度下开展发芽试验,了解温度和外源激素的不同水平及其组合对云南松种子发芽的影响,获得适宜云南松种子发芽的最佳温度及其与外源激素浸种促进种子发芽的溶液浓度组合,为该树种壮苗培育提供最佳温度或季节选择及GA3和IBA溶液浸种的科学依据。
1 材 料
云南松种子采自云南省宜良县禄丰村林场的尖山林区,种子的净度和千粒重分别为90.7%和17.16 g;GA3和IBA为分析纯的粉剂。实验于西南林业大学森林培育实验室的PQX-300 A型多段可编程人工气候箱内开展。播种容器为孔穴直径6 cm×深11 cm的穴盘;基质按森林土∶珍珠岩=1∶1的配比配制。实验期间,实验室昼夜温度在(17±2)℃~(23±2)℃之间。
2 实验内容及方法
实验包括温度(A)、GA3(B)和IBA(C)共3个因素,每因素设3个水平(表1)。根据设定的因素水平,采用L9(34)正交设计,并增加清水浸种(ck1,2 h)和不浸种(ck2)于室温发芽2个对照,共11个处理组合,每个处理组合播种10个孔穴,每穴播5粒种子,即每处理组合播种50粒种子,3次重复,共计播种1 705粒。
实验前1周用75%的酒精每隔2 d对人工气候箱进行消毒,连续消毒3次后密封5 d待用;基质在100 ℃烘箱内高温烘烤3 h,自然冷却后装入穴盘内备用。种子用纱布包裹浸泡于0.5%的高锰酸钾溶液消毒30 min后,清水冲洗干净,按实验设计于2种激素配制成的混合溶液中浸泡2 h,取出播种。
表1 实验的因素水平表

水平因 素A⁃温度(℃)B⁃赤霉素(g/L)C⁃吲哚丁酸(g/L)119.60.050.05223.00.100.10328.00.150.15
播种第5天种子开始发芽,每天观测种子发芽数,第19天发芽结束。根据每天的记录结果,计算每个处理组合的发芽率、发芽势、平均发芽时间和发芽指数。数据采用Excel 2003和SPSS 13.0软件进行整理和分析;若方差分析结果呈现显著或极显著的差异,则进一步采用Duncan’s法进行多重比较[17]。发芽指标采用以下公式计算:
发芽率(%)=n/N×100%;发芽势(%)=N0/N×100%;平均发芽时间(d)=∑Gt/Dt/n;发芽指数(粒/d)=∑(Gt/Dt)(式中,n为测定时间内正常发芽的种子数;N为置床的种子数;N0为日发芽种子数达到最高峰时正常发芽的种子数;n0为发芽后霉变或死亡的幼苗数;Gt为第t天正常发芽的种子数;Dt为与Gt相应发芽的天数)。
3 结果与分析
3.1 不同水平组合对种子发芽的影响
云南松种子不同处理组合的发芽率、发芽势、发芽指数及平均发芽时间分别为66.0%~86.0%、14.0%~29.3%、3.3~5.6粒/d和7.9~11.7 d(表2),处理组合间此4个指标呈现显著或极显著的差异(p发芽率=0.011<0.05,p发芽势=0.027<0.05,其余指标p≈0.000<0.01)。1) 处理组合1(温度19.6 ℃、0.05 g/L的GA3、0.05 g/L的IBA)、处理组合2(温度为19.6 ℃,0.10 g/L的GA3、0.10 g/L的IBA)、处理组合3(温度19.6 ℃、0.15 g/L的GA3、0.15 g/L的IBA)、处理组合5(温度为23.0 ℃、0.10 g/L的GA3、0.15 g/L的IBA)、处理组合10(室温,清水浸种)和处理组合11(室温,不浸种)的发芽率显著地高于处理组合6,最高的为处理组合2和处理组合5(86.0%);2) 处理组合2、处理组合3和处理组合10的发芽势显著地高于处理组合7(温度28.0 ℃、0.05 g/L的GA3、0.15 g/L的IBA)和处理组合9(温度28.0 ℃、0.15 g/L的GA3、0.10g/L的IBA),最高的为处理组合3(29.3%)的;3) 处理组合8(温度28.0 ℃、0.10 g/L的GA3、0.05 g/L的IBA)和处理组合10的发芽指数极显著地高于处理组合7,最高的为处理组合10(5.6粒/d);4) 处理组合8~11的平均发芽时间极显著地短于处理组合1,最短的为处理组合10(7.9 d)(表2)。不同GA3和IBA浓度混合溶液处理的云南松种子于不同温度条件下发芽,对发芽4个指标产生显著和极显著影响的结果,表明试验3个因素不同水平组合可改变云南松种子发芽过程和指标的高低,即通过此3个因素适宜水平组合可提高种子发芽性状。
表3 因素水平的极差分析

指标 极差值(R) 因子主次顺序 优水平 ABCB×C(主→次)ABC优处理组合发芽率(%)12.96.23.84.0A>B>B×C>CA1B2C1A1B2C1发芽势(%)8.25.10.44.4A>B>B×C>CA1B3C2A1B2C2平均发芽时间(d)1.61.10.71.4A>B×C>B>CA1B1C1A1B1C1发芽指数(粒/d)0.20.80.40.8B×C>B>C>AA3B2C2A3B2C2
表2 不同处理组合的种子发芽指标统计
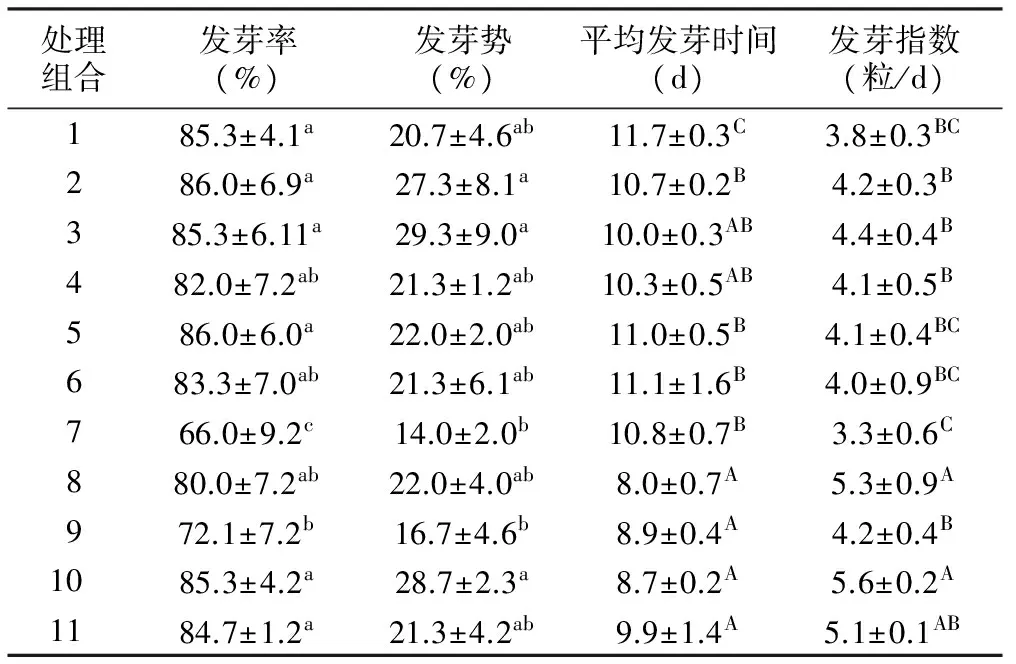
处理组合发芽率(%)发芽势(%)平均发芽时间(d)发芽指数(粒/d)185.3±4.1a20.7±4.6ab11.7±0.3C3.8±0.3BC286.0±6.9a27.3±8.1a10.7±0.2B4.2±0.3B385.3±6.11a29.3±9.0a10.0±0.3AB4.4±0.4B482.0±7.2ab21.3±1.2ab10.3±0.5AB4.1±0.5B586.0±6.0a22.0±2.0ab11.0±0.5B4.1±0.4BC683.3±7.0ab21.3±6.1ab11.1±1.6B4.0±0.9BC766.0±9.2c14.0±2.0b10.8±0.7B3.3±0.6C880.0±7.2ab22.0±4.0ab8.0±0.7A5.3±0.9A972.1±7.2b16.7±4.6b8.9±0.4A4.2±0.4B1085.3±4.2a28.7±2.3a8.7±0.2A5.6±0.2A1184.7±1.2a21.3±4.2ab9.9±1.4A5.1±0.1AB
3.2 影响种子发芽的主要因子及其优水平组合
温度是影响云南松种子发芽率、发芽势和平均发芽时间的主导因子(发芽率:A>B>B×C>C,发芽势:A>B>B×C>C,平均发芽时间:A>B×C>B>C,发芽指数:B×C>B>C>A),而GA3和IBA的交互作用是影响发芽指数的主导因素(表3)。发芽率和发芽势的优水平组合均为A1B2C1(GA3和IBA分别为0.10 g/L和0.05 g/L于19.6 ℃温度发芽的),平均发芽时间的则为A1B1C1(GA3和IBA分别为0.05 g/L和0.05 g/L于19.6 ℃发芽的),发芽指数的是A3B2C2(GA3和IBA分别为0.10 g/L和0.10 g/L于28.0 ℃发芽的),其中发芽势和平均发芽时间的理论优水平组合出现于试验中,但与实际最高的处理组合不一致,可能是因素水平间的交互作用影响引起的;其余2个指标的理论优水平组合未在试验中出现(表3),原因与发芽势和平均发芽时间相同或正交设计为部分实验造成的。
3.3 各因素的水平对发芽性状的影响
温度的不同水平对云南松种子的发芽率和平均发芽时间具有极显著的差异影响(p发芽率=0.002<0.01,p平均发芽时间≈0.000<0.01),温度为19.6 ℃和23.0 ℃的发芽率极显著地高于28.0 ℃(85.6%和83.8% vs.72.7%),平均发芽时间则是28.0 ℃的极显著地短于19.6 ℃和23.0 ℃(9.2 d vs.10.8 d);不同浓度的GA3也极显著地影响平均发芽时间(p平均发芽时间=0.009<0.01),GA3浓度为0.05 g/L和0.10 g/L的平均发芽时间(9.0,10.0 d)极显著地短于0.15 g/L(10.9 d);不同温度和GA3的水平显著地影响种子的发芽势和发芽指数(p发芽势=0.014<0.05,p发芽指数=0.025<0.05),即19.6 ℃的发芽势显著地高于28.0 ℃的(发芽势:25.8% vs.17.6%),GA30.10 g/L的发芽指数显著高于0.05 g/L的(发芽指数:4.5粒/d vs.3.7粒/d;图1和图2)。说明云南松种子的发芽对温度较为敏感,随着温度的升高种子的发芽率、发芽势降低,因此,温度为19.6 ℃有利于云南松种子发芽;高温可缩短种子的发芽时间。种子的发芽指数在不同浓度的GA3中呈现先上升再下降的趋势,说明0.10 g/L的GA3有效地促进云南松种子发芽,进而提高种子的发芽率,保证种子发芽的整齐性;平均发芽时间随着GA3浓度的升高呈下降的现象,即高浓度的GA3溶液浸种延迟种子发芽。不同浓度的IBA对此4项指标均未呈现显著的差异影响,发芽指数随IBA浓度的增加而下降,平均发芽时间随其浓度的增加呈现先缩短后延长的趋势,表明相对高浓度的IBA溶液浸种与GA3相同,延迟种子发芽。

图1 发芽率和发芽势随因素水平的变化
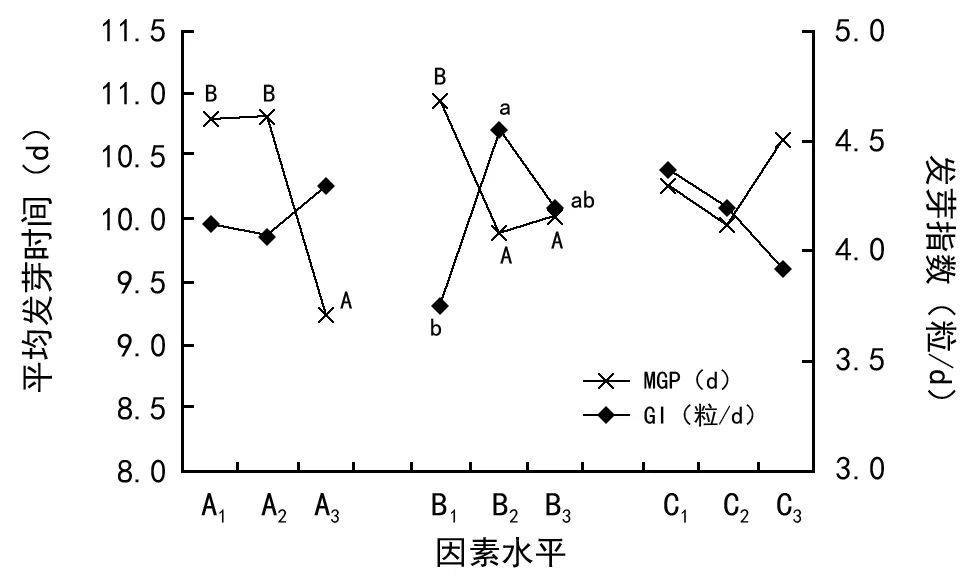
图2 平均发芽时间和发芽指数随因素水平的变化

图3 因素水平的交互对GR的影响
3.4 因素交互作用对发芽指标的影响分析
因素A、B和因素C两两间交互作用均对发芽的4个指标具有极显著的差异影响,因此,对其进行交互作用分析。
3.4.1 因素水平交互作用对发芽率的影响
固定B因素的3个水平,当B因素的水平由1增加至2时,A因素3个水平的折线均上升,即因素A的3个水平与B2相遇时,对发芽率为正的交互作用;但当因素B的水平由2增加至3时,A因素的3个水平折线则均下降,表明A因素的3个水平与B3相遇时对发芽率为负的交互作用,即因素A和因素B不同水平间的交互作用相一致;同样,固定因素C的3个水平,当因素C的水平1增加至水平2时,除因素A的1水平外,2水平和3水平折线均下降,对发芽率为负的交互作用;当因素C的水平2增加至水平3时,因素A的1水平和3水平折线下降,2水平的上升,即因素A的1水平和3水平在B2~B3区间对发芽率为负的交互作用,与1~2水平区间为正的交互作用(图3),表明A和C二者不同水平间,其交互作用对发芽率的影响不一致,A1和C2、A2和C3相交时,提高种子发芽的发芽率。与A和B的相同方法,固定因素B的3个水平,因素C的2水平和3水平与因素B的1~2水平区间为正的交互作用,与B因素的水平2~3区间为负的交互作用;A1与B的1~2水平和2~3水平交互作用先下降后上升(图3),也许是受其他因素的影响,有待进一步研究因素A、B和因素C不同水平间的交互作用对发芽率影响的大小不一致,结合前述温度(A)是影响发芽率的主导因子,GA3(B)则是次要因子,且因素B和因素C的负交互作用导致发芽率最高的组合分别是A1B2C2和A2B2C3。从图3还可以看出,清水浸种(ck1,85.3%)的发芽率略高于不浸种的(ck2,84.7%),与对照相比较,A因素中,仅A1、A2与B2及其与C2和C3的交互作用的发芽率高于ck1的;同样,仅B2与C2和C3交互作用的发芽率高于ck1的。交互作用及其与对照分析表明,19.6 ℃和23.0 ℃下,0.10 g/L的GA3及0.10 g/L和0.15 g/L的IBA单独或混合浸种可相对于清水浸种提高种子发芽率。因此,提高云南松种子发芽率的外源激素浸种具有严格的浓度要求。
3.4.2 因素水平交互作用对发芽势的影响
与发芽率相同进行因素水平交互作用对发芽势影响的分析(图4),因素A的3个水平与B2相遇时,对发芽势为正的交互作用,因素B由水平2增加至3时,仅因素A1表现为正的交互作用,2水平为负的交互作用,表明在19.6 ℃温度下发芽,随GA3的浓度提高,发芽率尚有提高的可能。同样,A1和A2与因素C的水平1~3区间相遇时,均为正的交互作用,而A3则为负的交互作用,即28.0 ℃温度下发芽,IBA溶液浸种降低发芽势,即导致发芽不整齐。与前面的相同,C1、C2随因素B的水平1~2~3区间,先上升后降低,即因素C的此2水平与B1~B2间发芽势表现为正的交互作用,与B2~B3间为负的交互作用;C3的发芽势随B因素水平的增加而增大,即0.15 g/L的IBA随着GA3浓度提高,发芽势也随着提高,指出在实验的浓度范围内,发芽随2种外源浓度的相互升高而趋于整齐一致。ck1的发芽势(28.7%)明显高于ck2的(21.3%),即虽然清水浸种提高发芽率的作用有限,但可明显促进发芽的整齐一致;仅A1与B3和C3及B3与C3交互作用的发芽势高于ck1(图4),表明19.6 ℃温度下发芽时,相对高浓度(0.15 g/L)的GA3和IBA单独或混合浸种可提高云南松种子发芽的发芽势,即促进种子发芽的整齐性。
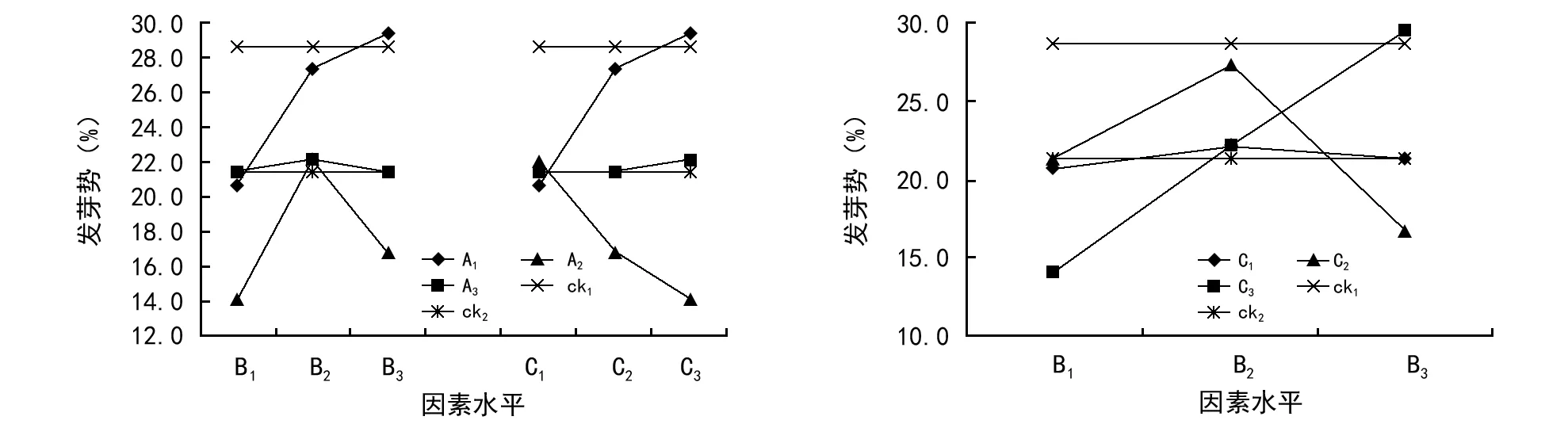
图4 因素水平的交互对发芽势的影响
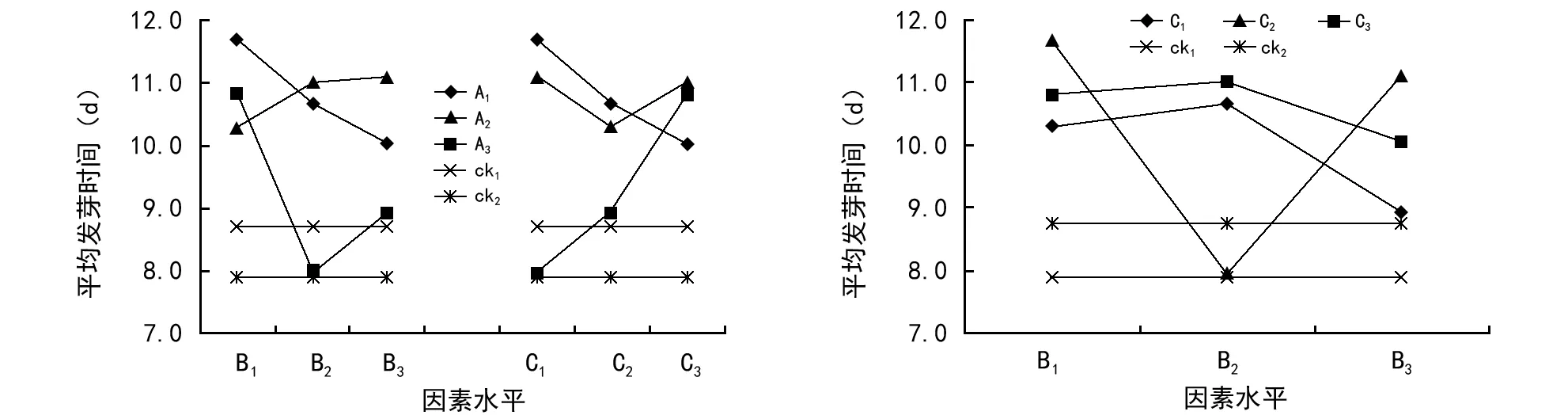
图5 因素水平交互对平均发芽时间的影响

图6 因素水平间的交互对发芽指数的影响
3.4.3 因素水平间交互作用对平均发芽时间的影响
与发芽率和发芽势相同的方法分析交互作用对平均发芽时间的影响(图5),A1的平均发芽时间与随B1~B3的增加而降低(负的交互作用),即19 ℃下发芽,随着GA3浓度的提高,加速种子发芽(时间缩短),A2则相反,随B1~B3的增加而发芽时间延长;A3与B2相遇时,发芽时间最短,与B的其余2个水平相遇时,平均发芽时间增长,表明23.0 ℃下发芽,0.10 g/L的GA3浸种,可缩短云南松种子的发芽时间。A1与C的3个水平交互作用对平均发芽时间的影响同其与B的相一致,同样A3与C的类似于A2与B的;A2的则类似于A3与B的。同样的方法分析B和C不同水平交互作用对平均发芽时间的影响(图4),C1和B2的交互作用缩短发芽时间, C1与B的其余2个水平则提高平均发芽时间;C2和C3与B2相遇时,提高平均发芽时间,与B的其余2水平相遇时降低平均发芽时间。ck1的平均发芽时间(7.9 d)短于ck2的(8.7 d),与发芽率的结果相一致,清水浸种促进云南松种子发芽的整齐一致;A1与B2和C1及B1与C2交互作用的平均发芽时间与ck1的相差不大,表明置于28.0 ℃温度下发芽,0.05 g/L的IBA和0.10 g/L的GA3混合溶液或清水浸种可缩短种子的发芽时间。
3.4.4 因素水平间交互作用对发芽指数的影响
与前述3个指标相同的方法分析因素水平交互作用对发芽指数的影响(图5),A1的发芽指数随B1~B3的变化而提高,即19.6 ℃温度下发芽,随着GA3浓度的提高,每天发芽的粒数增加,与此温度下随GA3浓度提高发芽时间缩短(图5)相一致;A2与A1的相反,A2与B2相遇时,发芽指数增加,与其余2水平相遇时则发芽指数降低。A1随C1~C3的增加而发芽指数提高,A3则与A1的相反,A2类似A3与B的3个水平,但变化幅度相对较小。C和B因素之间(图6),C1和B2相遇时,发芽指数提高,与其余2水平相遇时则发芽指数降低,C2与B的3个水平相遇时,对发芽指数无明显的影响,C3的发芽指数则随B因素水平的增加而提高。同样,ck1的发芽指数(5.6粒/d)高于ck2的(5.1粒/d),且无因素水平交互作用的发芽指数高于ck1的,表明清水浸种可提高云南松种子发芽指数。
4 结论与讨论
4.1 结 论
采用L9(34)正交设计,应用GA3和IBA溶液对云南松种子浸种后于19.6,23.0 ℃和28.0 ℃下开展发芽试验。结果表明,种子的发芽率、发芽势、平均发芽时间和发芽指数分别为66.0%~86.0%、14.0%~29.3%、7.9~11.7 d和3.3~5.6粒/d,处理组合间此4个指标具有显著或极显著的差异(p发芽率=0.011<0.05,p发芽势=0.027<0.05,p平均发芽时间≈0.000<0.01和p发芽指数≈0.000<0.01)。温度是影响种子发芽率、发芽势、平均发芽时间的主导因子,发芽指数主要受GA3和IBA的交互作用影响。温度、GA3和IBA的不同水平对4个发芽指标的影响不一致。GA3、IBA和温度的两两交互作用对发芽4个指标的影响较为复杂,特定温度条件下,GA3和IBA适宜浓度单独或混合处理种子,可促进其发芽的整齐一致。19.6 ℃下发芽能提高云南松种子发芽率,高温虽然缩短种子的发芽时间,但降低发芽率。清水或0.10 g/L的GA3浸种提高种子发芽率和促进发芽的整齐性。
4.2 讨 论
温度是植物种子发芽和出苗的基本条件,温度过高或过低均影响种子的萌发[18]。本实验中,温度是影响云南松种子发芽的主导因子,19.6 ℃条件下提高发芽率,且19.6~23.0 ℃发芽环境是云南松种子发芽的较佳温度,符合温度对种子发芽的普遍规律,并与张跃敏等[6]、周安佩等[19]的试验结果基本一致。丰富了温度对种子发芽的资料;然而,此结论与倪广艳等[20]对25~28 ℃提高金钟腾(Merremiaboisiana)发芽指标的研究结果不一致。叶景学等[21]在不同温度下采用GA3处理醉蝶花(CleomeSpinosa)种子的结果与倪广艳等相一致,也许与种类和研究因素的组合不同有关。
植物生长调节剂的种类繁多且作用对不同物种效果也不尽相同,种子发芽中运用植物生长调节剂的研究也有较多[10-11,14-16,19-24]。结果表明,适宜浓度的GA3或清水浸种促进云南松种子发芽和缩短发芽时间,IBA对云南松种子发芽影响较小或负效应,与张薇等[16]采用L9(34)正交设计进行IAA、GA3和IBA混合溶液浸种发芽的结果类似,但与于国栋等[22]的研究结果不一致,其原因是否与因素的组合及其交互作用有关,有待进一步的试验研究。本实验结果表明,0.10 g/L的GA3有效地促进云南松种子发芽,但高浓度的GA3溶液浸种延迟种子发芽,此结论与杨阳等[23]和王胜等[24]研究GA3对沙冬青(Ammopiptanthusmongolicus)种子萌发影响的结果相似,即低浓度的GA3浸种对种子发芽具有促进作用,但高浓度则具有轻微抑制效应;杨阳等[23]和王胜等[24]研究表明,GA3处理沙冬青种子的最佳浓度为0.20 g/L,与本研究的不一致,可能与物种和因素及其水平组合的不同有关。
种子的发芽率和发芽指数的优水平组合在实验中均未出现,发芽势和平均发芽时间的优水平组合虽然在实验中出现,但与实际值最高的有不完全一致,这与实验中的交互效应和正交设计为部分实验有关,因此需要进一步开展优水平组合的试验实施,以证明本研究理论优水平组合的可靠性。
[1]中国森林编写委员会.中国森林(第2卷:针叶林)[M].北京:中国林业出版社,1999:971-985.
[2]云南森林编写委员会.云南森林[M].北京:中国林业出版社,1985:125-127.
[3]杨永祥,战铁铮,白沙林.云南松林分系统的形成与演变[J].林业科学,1991,27(3):199-209.
[4]段旭,李根前,李莲芳.不同水分控制对云南松幼苗生长及生理特性的影响[J].种子,2013,32(3):75-78.
[5]孙时轩.造林学[M].北京:中国林业出版社,1990.
[6]张跃敏,李根前,李莲芳,等.温度和湿度对云南松种子发芽的影响[J].陕西林业科技,2010(4):1-4.
[7]黄帅.嘌呤型化合物的合成及植物生长调节活性测试[D].太原理工大学,2007.
[8]汪进,薛玉,王化南,等.吲哚丁酸酯类的合成及其生物活性研究[J].黑龙江大学自然科学学报,1998(1):113-116.
[9]孙昂,李莲芳,段安安,等.云南松苗木生长对水肥和IBA的响应试验[J].西部林业科学,2013(5):87-92.
[10]郭樑,李莲芳,孙昂,等.遮荫、微波辐射和IBA浸种对云南松苗木生长的影响[J].福建林业科技,2014(3):100-105.
[11]苏柠,张薇,王慷林,等.微波辐射和IBA浸种对云南松幼苗生长的影响[J].种子,2015,34(6):69-72.
[12]郑书绿,鲍雪纤,李莲芳,等.云南松苗木生长对施肥和水分等多因素的响应[J].河南农业科学,2015(8):114-118.
[13]张薇,王文俊,李莲芳,等.施肥及喷施B-Y 2和IBA对云南松苗木芽萌发和穗条产量的影响[J].西南林业大学学报,2015(6):66-71.
[14]高春智,何炎红,田有亮,等.不同浓度赤霉索浸种对樟子松种子萌发的影响[J].内蒙古农业大学学报,2012,33(3):67-71.
[15]龚永尉,王远丽,宋勃鹏,等.赤霉素浸种对鹤望兰种子发芽率的影响[J].黑龙江农业科学,2016(3):84-85.
[16]张薇,王文俊,李莲芳,等.外源激素浸种对云南松种子发芽的影响[J].种子,2015,34(4):1-4.
[17]郝黎仁,樊元,郝哲欧,等.SPSS实用统计分析[M].北京:中国水利水电出版社,2002:280-288.
[18]韩丽娟,马爽,王光野.不同温度对木兰种子萌发的影响[J].长春师范学院学报(自然科学版),2010(8):79-82.
[19]周安佩,李莲芳,刘东玉,等.发芽环境、微波辐射和激素浸泡对云南松种子发芽的影响[J].种子,2012,31(9):89-92.
[20]倪广艳,王昌伟,彭少麟.不同温度处理对金钟藤种子萌发的影响[J].生态环境,2005(6):898-900.
[21]叶景学,张广臣,杨朔,等.GA3和温度对醉蝶花种子发芽的影响[J].种子,2012,31(8):84-85.
[22]于国栋,李莲芳,孙昂,等.微波辐射和IBA浸种对云南松种子发芽的影响[J].种子,2014,33(5):8-12.
[23]杨阳,刘秉儒,贾倩民,等.赤霉素对干旱胁迫下沙冬青种子萌发的影响[J].江苏农业科学,2014(5):271-275.
[24]王胜,丁雪梅,尹金珠,等.赤霉素浸泡和盐碱地播种对沙冬青、金叶莸和化香树种子萌发的影响[J].山东林业科技,2016(2):6-11.
Effects of Temperature and Exogenous Hormone Presoaking Seeds on Seed Germination ofPinusyunnanensis
YANGWenjun,LILianfang,WANGYayu,OUYa,LINGLifang,XUTingting,WUSiming
(Forestry College of Southwest Forestry University,Kunming Yunnan 650224,China)
In order to understand effects of different temperature and GA3,IBA levels and their treatment combinations (TC) on seed germination traits ofPinusyunnanensis,the L9(34) orthogonal design was applied to implement germination experiment under different temperature conditions after exogenous hormones soaking seeds.The results showed that mean germination rates,germination energies,mean germination periods,and germination index were 66.0%-86.0%,14.0%-29.3%,9-11.7 d and 3.3-5.6 seed/d of different TC,respectively,with significant differences of the 4 parameters (p<0.05 orp<0.01) between the TC.Temperature was the pivotal factor effecting the seed germination,with 19.6 ℃ improve the GR.Different levels of the temperature and the GA3were significantly influenced.Germination parameters of the seeds (p<0.05 orp<0.01),the 0.10 g/L of GA3the solution soaking seeds was promoted seed germination.The interactions between the GA3,IBA and temperature on the germination parameters were more complex,and the interaction effect on germination parameters were different under different conditions.
Pinusyunnanensis; seed; germination; temperature; exogenous hormone
2017-03-10
国家级林业科学技术推广项目(项目批准号[2015]26号)和国家自然科学基金项目(项目批准号:31170585)共同资助。
杨文君(1993—),女,云南昭通人;在读硕士研究生,本科,研究方向:森林培育;E-mail:Maria325820@163.com。
李莲芳(1964—),女,云南墨江人;博士,教授,博士生导师;主要从事森林培育、林木遗传育种及林学相关的教学和科研研究等工作;E-mail:llianf@126.com。
10.16590/j.cnki.1001-4705.2017.08.010
S 791.257
A
1001-4705(2017)08-0010-07
