芦苇种子萌发对不同环境因子的响应
2017-12-01,,,
, , ,
(齐齐哈尔大学生命科学与农林学院, 黑龙江 齐齐哈尔 161006)
芦苇种子萌发对不同环境因子的响应
焦德志,黄曌月,王乐园,荣子
(齐齐哈尔大学生命科学与农林学院, 黑龙江 齐齐哈尔 161006)
以扎龙湿地芦苇种子为试验材料,采用培养皿室内培养的方法,研究不同培养基质、不同萌发温度、不同基质埋藏深度和不同基质水分饱和度条件下芦苇种子的萌发过程,比较不同处理条件对芦苇种子萌发的影响。结果表明,不同培养基质条件下芦苇种子萌发过程呈现“S”型曲线,种子发芽率均较高,土壤培最高(达94%),滤纸最低(为82.6%),发芽势土壤最高(为93.34%),滤纸最低(为71.34%);芦苇种子低于20 ℃恒温培养很难发芽,20~30 ℃随温度的增高芦苇发芽率和发芽势均呈增加趋势;蛭石培1~6 mm埋深芦苇种子均能出苗,发芽率2 mm埋深最高(为96%),土壤培仅在1~2 mm埋深时出苗,发芽率和发芽势1 mm埋深最高;蛭石培、土壤培在80%水分饱和度发芽率最高(分别为93.34%、90%)。不同培养条件对芦苇种子萌发影响较大,蛭石在30 ℃、80%水分饱和度、2 mm埋深为芦苇种子萌发的最适条件。
芦苇; 基质; 温度; 发芽率; 水分饱和度
繁殖是生物繁衍后代延续种族最基本的行为过程[1],它不仅是种群形成、发展和进化的核心问题,也是生物群落和生态系统演替的基础。植物在不同生境中的繁殖过程可以反映植物对环境的适应能力和生殖潜能[2]。
陆生植物种子萌发过程、生理方面的研究有很多,例如萌发过程中水分吸胀作用[3-7]、营养物质的水解和利用[8-12]、呼吸速率的变化[13-14]等。此外,也有报道了酸雨、重金属、盐碱胁迫以及大分子物质等对萌发的生理生化影响[5, 15-17]。芦苇是典型的长根茎克隆植物,是世界广布种,天然种群主要依靠营养繁殖补充更新,因此,人们对芦苇营养繁殖的关注更多[1],尤其外界环境条件对芦苇种子萌发、成苗的研究报道较少。
试验以芦苇种子为材料,采用培养皿室内培养方法,分别设置不同的培养基质、不同的萌发温度、不同的基质埋深、不同的基质水分饱和度,比较分析外界环境条件对芦苇种子萌发的影响,不仅揭示芦苇种子萌发的最适条件,为进一步研究克隆植物的无性繁殖和有性繁殖的权衡关系提供依据,为湿地退化生态系统组织机理恢复过程的研究提供参考。
1 材料与方法
1.1 材 料
2014年10月在扎龙国家级自然保护区保护采集芦苇种子,剪取芦絮带回实验室,晾干后,手工搓取种子,4 ℃下储藏备用。
1.2 方 法
实验前用0.1%的KNO3溶液浸泡种子10 min[18],蒸馏水冲洗5次后用蒸馏水浸泡10 h,使种子吸收充足的水分。
选取滤纸、沙子、土壤、蛭石、蛭石与沙子混合(1∶1)、蛭石与土壤混合(1∶1)为培养基质,基质过筛高温消毒后备用。8 cm培养皿均匀植入50粒种子,基质埋深2 mm,基质水分饱和度80%,室温(25~10 ℃)条件下自然培养。3次重复,每隔24 h观察1次,以胚芽长出1 mm为标准统计发芽的种子数,直至连续3 d没有种子发芽为止。
选取土壤、蛭石2种基质,分别在不同温度、埋深、水分饱和度培养芦苇种子。温度设置10,15,20,25,30 ℃,埋深设置1,2,3,4,5,6 mm,水分饱和度设置100%,80%,60%,40%,20%,按上述方法进行试验。
1.3 数据处理
分别计算芦苇种子不同处理条件的发芽率、发芽势。
发芽率(%)=发芽种子粒数/50粒种子×100%;
发芽势(%)=规定时间内发芽种子粒数/50粒种子×100%。
用SPSS 17.0完成数据均值分析比较,显著度水平为0.05,用Excel 2007作图。
2 结果分析
2.1 不同基质对芦苇种子萌发的影响
如图1所示,芦苇种子在不同基质中萌发过程均呈现近“S”形曲线,1~2 d为迟缓期,3~4 d为指数期,5 d后逐渐减缓,8 d后基本稳定。土壤发芽率最高(为94%),蛭石次之(为90.6%),沙子、蛭石与沙子混合、蛭石与土壤混合均(为88%),滤纸最低(为82.6%)。

图1 不同基质芦苇种子发芽率
如图2所示,芦苇种子在土壤基质中的发芽势最高(为93.34%),蛭石次之(为90.66%),沙子、蛭石与土壤混合基质的种子发芽势为85.34%,86.66%,再次为蛭石与沙子混合种子的发芽势(为75.34%),最低的为滤纸(仅为71.34%)。
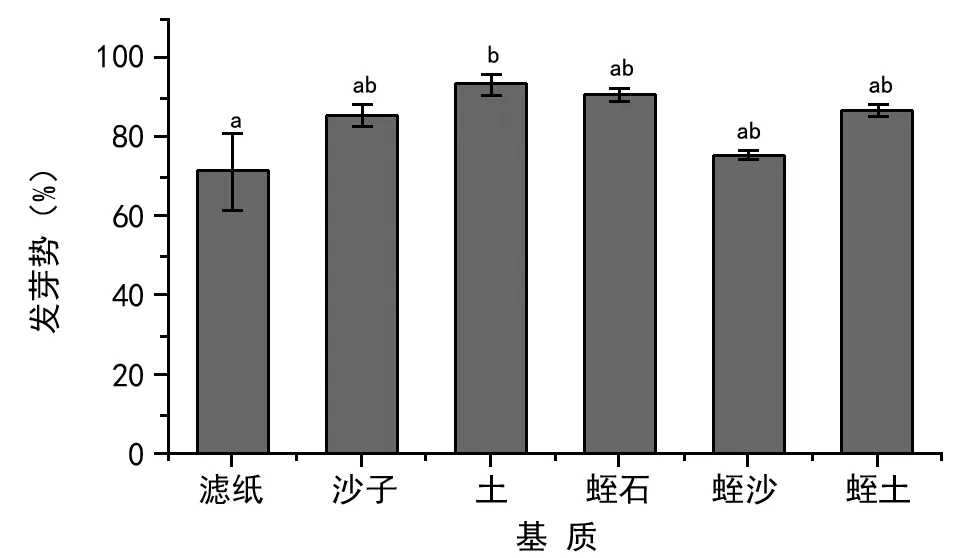
注:不同小写字母表示各处理间的差异显著(plt;0.05)。下同。图2 不同基质芦苇种子发芽势
2.2 不同温度对芦苇种子萌发的影响
如图3所示,芦苇种子在土壤和蛭石中的萌发率都随着温度的升高先增加后减小。30 ℃下土壤的发芽率最高(为44.66%),蛭石次之(为32%)。35 ℃下发芽率最低,蛭石中为10.1%,土壤中为8.6%。芦苇种子在15 ℃下的蛭石、土壤2种基质中均不发芽。
如图4所示,2种基质中芦苇种子发芽势都随着温度先升高后降低,其中土壤中种子在30 ℃的发芽势最高(为44.66%),次之为25 ℃下蛭石、土壤2种基质中发芽势(为17.5%、18.3%)。35 ℃下蛭石、土壤2种基质中发芽势都最低,分别为6.1%、6.3%。

图3 不同温度芦苇种子发芽率

图4 不同温度芦苇种子发芽势
2.3 不同埋藏深度对芦苇种子出苗率的影响
如图5所示,芦苇种子在蛭石、土壤基质中随着埋藏深度的增加发芽率逐渐降低。在蛭石中埋藏深度在2 mm时出苗率最高,达到96%。在土壤基质中仅在1~2 mm的埋藏深度下出苗,其他深度下不出苗。

图5 不同埋藏深度芦苇种子发芽率
如图6所示,芦苇种子在蛭石、土壤基质中发芽势都呈下降趋势。芦苇种子在土壤中1 mm处发芽势最大(为78%),次之为蛭石在1 mm处的发芽势(为76%)。土壤基质在2 mm的埋深下发芽势仅为12%。3 mm之下土壤基质中发芽势为0。

图6 不同埋藏深度芦苇种子发芽势
2.4 不同水分饱和度对芦苇种子萌发的影响
如图7所示,芦苇种子的发芽率在2种基质中随水分饱和度降低呈两头低中间高的趋势。蛭石基质在水分饱和度为80%时,发芽率最高(为93.34%),而土壤基质在水分饱和度为80%时,发芽率最高(为90%)。蛭石、土壤2种基质均在水分饱和度为100%时,发芽率最低,分别为41%、37.2%。
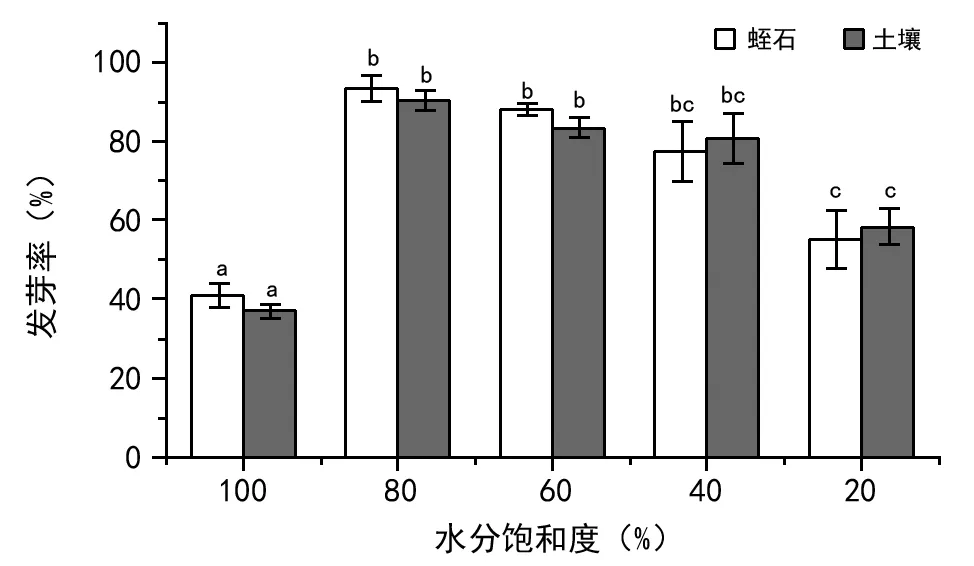
图7 不同水分饱和度芦苇种子发芽率

图8 不同水分饱和度芦苇种子发芽势
如图8所示,芦苇种子的发芽势在2种基质中随水分饱和度降低呈两头低中间高的趋势。在水分饱和度为100%时,发芽势最低,蛭石和土壤的发芽势分别为37%、34%。蛭石、土壤基质在水分饱和度为80%时,发芽势最高,分别为85.34%、81%。
3 讨 论
3.1 基质的物理性状对芦苇种子萌发的影响
发芽率能近似地反映出苗率,发芽势可以表明种子活力的高低,两者均可表示出苗的好坏[19]。试验所用基质的物理性状如表1所示,其中容重反映基质的疏松、紧实程度,总孔隙度反映基质通气孔隙和持水孔隙的大小,大孔隙度反映基质空气所能占据的空间,小孔隙度反映基质水分所能占据的空间,大小孔隙度比反映基质水、气的状况。本试验结果表明,土壤和蛭石的容重、总孔隙度、大孔隙度、小孔隙度存在较大差异,但大小孔隙度比比较接近0.5,沙子特别大,其他3种基质又相对较小,因此,芦苇种子的发芽率和基质的大小孔隙度比关系密切,最理想基质的大小孔隙度比以0.5为宜。
表1 几种基质的物理性状

基质容重(g/m3)总孔隙度(%)大孔隙度(%)小孔隙度(%)大小孔隙度比土壤1.0266.020.445.60.45蛭石0.1595.030.065.00.46沙子1.3730.529.51.029.50蛭沙混合0.8163.111.751.40.23蛭土混合0.8836.46.628.80.22滤纸1.1890.39.980.40.12
3.2 温度及其变化对芦苇种子萌发的影响
任何植物种子的萌发都需要适宜的温度来保证。试验结果表明,20 ℃以下的恒温培养条件下,芦苇种子很难发芽,试验设置的30 ℃条件下,芦苇的发芽率和发芽势均较高,无论在土壤和蛭石基质中,芦苇种子的发芽率和发芽势均随温度的增加而呈现增高的趋势,因此,芦苇种子发芽的适宜温度范围较窄再一次得到证实[20]。另外,随着温度升高,种子的初始发芽时间有所提前,20 ℃下蛭石基质第3天开始发芽,30 ℃第1天就开始发芽。30 ℃恒温条件下芦苇种子在土壤基质中发芽率和发芽势最高(为45%和32%),这个值也远远小于在实验室室温(25~10 ℃)条件下的93.4%和84.6%,由此可见,温度的周期性变化对芦苇种子萌发的促进作用远大于温度增高的影响,说明芦苇种子的萌发需要2种或者2种以上温度的周期性交替作用或种子萌发率在变温的作用下会有所提高,这一点在其他许多植物中也得到了证实[21]。温度的周期性变化对芦苇种子萌发的影响可能和激素合成和作用有关,较高的恒温条件可以促进植物激素的合成,但过高的激素浓度也同时会抑制种子的萌发,而周期性的温度变化培养,白天较高温度合成的植物激素会在夜间较低温度下被消耗,种子萌发过程中始终保持适宜的激素浓度,其真正原因正在设计试验进一步研究中。
3.3 氧气供给对芦苇种子萌发的影响
植物种子萌发过程中需要一定量的氧气供给,较厚的基质埋深抑制种子萌发和幼苗的出土[22],蛭石总孔隙度较大(达到95%),其中大孔隙度也达到30%,蛭石培养基中所有设置埋藏深度芦苇种子均可发芽,最终长出幼苗,蛭石较大通气孔隙为种子萌发提供了必需的氧气。不同埋深发芽势呈波动性变化,并且初始出苗时间相差较大,发芽势是以种子出苗后观测记录的,埋深的增加会延迟幼苗出土的时间。因此,蛭石埋深的增加也会导致幼苗出土后的死亡率有所增加。土壤培养基中芦苇种子只在1 mm和2 mm埋藏深度出苗,其余深度都不出苗,土壤的大孔隙度比蛭石小得多,埋深会导致基质中氧气匮乏,芦苇种子难以萌发,再次证明湿地植物种子对埋藏深度的敏感性是由于土壤环境缺氧所引起的[23]。
3.4 基质水分饱和度对芦苇种子萌发的影响
充足的水分是种子萌发的必要保证[24],在基质培养中水气矛盾也是制约种子萌发的主要因素。正常而言,固体基质中持水性和透气性之间存在着对立统一的关系,即基质中水分含量高时,空气含量就低,反之,空气含量高时,水分含量就低。蛭石的总孔隙度较大,具有较高的储水和储氧能力,而土壤的总孔隙度相对较小,储水和储氧能力都较弱,但两者的大小孔隙度比几乎相等,也就是说在解决水气矛盾上具有相近的潜力和能力。因此,基质水分饱和度高于60%,土壤和蛭石培养发芽率和发芽势间无显著差异,基质水分饱和度低于40%,土壤培养的发芽率和发芽势略高于蛭石培养。发芽率和发芽势在2种基质中随水分饱和度降低呈两头低中间高的趋势,即在60%和80%水分饱和度时最高,100%水分饱和度时最低。
4 结 论
4.1土壤基质中芦苇种子发芽率和发芽势最高,不同基质配比有提高芦苇种子萌发的可能性,但比例有待进一步研究。
4.2温度的增高可以提高芦苇种子的初始萌发时间,缩短种子萌发进程,提高种子的发芽率和发芽势,较低温度时纸培最高,较高温度时土培最高,在变温条件下芦苇种子能得到更高的发芽率,但具体变温条件还有待研究。
4.3埋藏深度的增加可以推迟芦苇种子的出苗时间,发芽势呈先降低后升高的趋势,蛭石培3 mm埋深发芽势最低,4,6,8 mm埋深间无差异显著,土培1 mm埋深显著高于2 mm,芦苇种子在土壤3 mm埋深以上不再出苗是由芦苇种子个体小,能量少造成的。
4.4基质水分饱和度的增加可以促进芦苇种子萌发,土培种子初始萌发时间早于蛭石培,相同水分饱和度下2种基质发芽率无显著差异;蛭石培在高水分饱和度下种子发芽势无显著差异,均高于20%水分饱和度,土培80%水分饱和度种子发芽势最高,显著高于其它。
4.5综合来看,蛭石基质在温度30 ℃、水分饱和度80%、埋藏深度2 mm条件下最适合芦苇种子萌发。试验虽然对萌发温度、湿度和埋深进行了优选,但却不是最优培养基质,在变温条件下蛭石与土壤合理配比能达到理想中的最好效果,此条件还需要进一步研究。
[1]张友民,卢曦,杨允菲.芦苇种群的繁殖方式对湿地生态环境的适应机制[J].吉林农业大学学报,2008(3):279-283.
[2]周纪伦.植物种群生态学[M].北京:高等教育出版社,1992.
[3]Orth RJ,Luckenbach ML,Marion SR,et al.Seagrassrecovery of in the Delmarva Coastal Bays,USA.Aquatic Botany,2006,84:26-36.
[4]TrAber MS,Granger S,Nixon SW.Mechanical seeder provides alternative method for restoring eelgrass habitat (Rhode Island).Ecology Restoration,2003,21:213-214.
[5]Orth RJ,Fishman JR,Harwell MC,et al.Seed-density effects on germination and initial seedling establishment in eelgrass Zostera marina in the Chesapeake Bay region.Marine Ecology Progress Series,2003,50:71-79.
[6]Pickerell CH,Schott S,Wyllie-Echeverria S.Buoy-deployed seeding:Demonstration of a new eelgrass (ZosteramarinaL.) planting method.Ecological Engineering,2005,25:127-136.
[7]Harwell MC,Orth RJ.Eelgrass (ZosteramarinaL.) seed protection for field experiments andimplications for large-scale restoration.Aquatic Botany,1999,64:51-61.
[8]Brenchley JL,Probert RJ.Seed germination response to some environmental factors in the seagrass Zostera capricorni from eastern Australia.Aquatic Botany,1998,62:177-188.
[9]Abe M,Kurashima A,Maegawa M.Temperature requirements for seed germination and seedling growth of Zostera marina from central Japan.Fisheries Science,2008,74(3):589-593.
[10]Loques F,Caye G,Meinesz A.Germination in the marine phanerogam Zostera noltii Hornemann at Golfe Juan,French Mediterranean.Aquatic Botany,1990,38:249-260.
[11]Hootsmans MJM,Vermaat JE,Van Vierseen W.Seed-bank development,germination and early seedling survival of two seagrass species from The Netherlands:Zostera marina L.andZostera noltii hornem.Aquatic Botany,1987,28(3-4):275-285.
[12]Moore KA,Orth RJ,Nowak JF.Environmental regulation of seed germination inZosteramarinaL.(eelgrass) in Chesapeake Bay:effects of light,oxygen and sediment burial.AquaticBotany,1993,45:79-91.
[13]Caye G,Bulard C,Meinesz A,et al.Dominant role of seawater osmotic pressure on germination in Cymodocea nodosa.Aquatic Botany,1992,42:187-193.
[14]Liu J,Zhang PD,Guo D,et al.Annual chang in photosynthesis pigment contents ofZosteramarinaL.in Swan Lake.African Journal of Biotechnology,2011,10(79):18 194-18 199.
[15]Baskin CC,Baskin JM.Seeds:ecology, biogeography,and evolution of dormancy and germination.New York:Academic Press,1998.
[16]Tanner CE,Parham T.Growing Zostera marina (eelgrass) from seeds in land-based culture systems for use in restoration projects.Restoration Ecology,2010,18(4):527-537.
[17]Conacher CA,Poiner IR,Butler J,et al.Germination, storage and viability testingof seeds of Zostera capricorni Aschers.from a tropical bay in Australia. Aquatic Botany, 1994,49:47-58.
[18]孟焕,王雪宏,佟守正,等.预处理方式对香蒲和芦苇种子萌发的影响[J].生态学报,2013(19):6 142-6 146.
[19]苏智先,张素兰,钟章成.植物生殖生态学研究进展[M].北京:科学出版社,2000:2 202-2 081.
[20]李有志.小叶章和芦苇种子萌发以及幼苗生长对环境因子的响应研究[D].湖南农业大学,2007.
[21]Rajput A,Tiwari KP.Effect of alternate chilling/heating on germination of fresh teak (TectonagrandisL.f.) drupes,without scarification of felty mesocarp.Seed Sciamp;Technol,2001,29:57-64.
[22]Maun M A.Adaptations enhancing survival and establishment of seedlings on coastal dunesystems[J].Vegetation,1994,111:59-70.
[23]Chauhan BS.Weedy rice (Oryzasativa).Ⅱ.Response of weedy rice to weed burial and flooding depth.Weed Science,2012,60:385-388.
[24]薛建国.水分、盐分和温度对几种荒漠植物种子萌发的影响[D].甘肃农业大学,2008.
升高,引起细胞膜结构损伤,使细胞膜透性增大,从而抑制幼苗的生长[15],本试验主要体现在幼苗的株高、分支数、叶片总数、幼苗干重均受到了显著的抑制作用。汞胁迫同时导致了紫云英幼苗根系的抗氧化酶SOD、POD活性以及根系活力的下降,这一研究结果与高大翔等[7]的研究结果不一致,这主要也归因于Hg2+的起始处理浓度(12.5 mg/L)过高的缘故。
参考文献:
[1]曹毅,陆宁,孟建玉,等.汞胁迫对烤烟生理特性的影响[J].西南农业学报,2011,24(6):2 152-2 155.
[2]过昱辰,刘莹莹,王赛,等.汞胁迫对两种暖季型草坪草生理生化特征的影响[J].天津农业科学,2016,22(2):22-26.
[3]尚爱安,刘玉荣,梁重山,等.土壤重金属的生物有效性的研究进展[J].土壤,2000(6):294-300.
[4]杨肖娥,龙新宪,倪吾钟.超积累植物吸收重金属的生理及分子机制[J].植物营养与肥料学报,2002,8(1):8-15.
[5]母波,韩善华,张英慧,等.汞胁迫对植物细胞结构与功能的影响[J].中国微生态学杂志,2007,19(1):112-113.
[6]曾斌,赵鹂,朱诚,等.水稻突变体对土壤汞胁迫耐性机理的初步研究[J].浙江大学学报(农业与生命科学版),2008,34(1):57-64.
[7]高大翔,郝建朝,李子芳,等.汞胁迫对水稻生长及幼苗生理生化的影响[J].农业环境科学学报,2008,27(1): 58-61.
[8]庞欣,王东红,彭安.汞胁迫对小麦幼苗抗氧化酶活性的影响[J].环境化学,2001,20(4):351-355.
[9]钟士传.汞胁迫对花生种子发芽及生理生化特性的影响.种子,2009,28(12):89-90,101.
[10]韩春梅.菊叶鱼眼草水浸液对白菜种子萌发和生长的影响[J].蔬菜,2014(1):13-14.
[11]李春龙.水花生不同部位水浸液对豇豆种子萌发的影响.种子,2013,32(7):72-73.
[12]韩春梅,贺阳冬,刘德万.铝胁迫对大白菜种子萌发及幼苗根系生理生化指标的影响[J].长江蔬菜,2009(22):43-44.
[13]陈建勋,王晓峰主编.植物生理学实验指导[M].广州:华南理工大学出版社,2002.
[14]韩春梅,李春龙,贺阳冬,等.NaCl胁迫对莴笋种子萌发及幼苗根系生理生化指标的影响[J].长江蔬菜,2009(10):21-23.
[15]阎雨平,蔡士悦,史艇.广东赤红壤、红壤含汞的农作物污染效应及其临界含量研究[J].环境科学研究,1992,5(2):49-53.
Study on the Responses of Seed Germination ofPhragmitescommunisto Environmental Factors
JIAODezhi,HUANGZhaoyue,WANGLeyuan,RONGZi
2016-09-30
黑龙江省教育厅科学技术研究项目(12541887)和齐齐哈尔大学研究生创新科研项目(YJSCX 2014-019 X)资助。
焦德志(1970—),男,黑龙江省克山县人;在读博士研究生,副教授,主要从事植物生态学研究。
10.16590/j.cnki.1001-4705.2017.01.094
Q 948
A
1001-4705(2017)01-0094-05
