植物生长素响应因子ARF研究进展
2017-12-01,,,,
, , , ,
(沈阳农业大学 a.园艺学院; b.林学院, 辽宁 沈阳 110866)
·综述·
植物生长素响应因子ARF研究进展
梅梅a,王晓禹a,张晓林b,陆秀君a,b
(沈阳农业大学 a.园艺学院; b.林学院, 辽宁 沈阳 110866)
生长素响应因子(Auxin response factor, ARF)属于一类转录因子,一般包含3个结构域,能够与生长素响应元件结合,促进或抑制基因的表达。笔者详细阐述了包括木本植物在内的ARF基因分子结构、时空表达、分子功能及调控机理,发现ARF5-8 、ARF19等转录激活子在胚模式建成、维管组织形成、花发育、向光性等过程中起重要作用,而其余转录抑制子主要在衰老、种子大小、侧生器官背腹性以及根的向重力性等过程中起重要作用。ARF基因受光照、激素与环境条件变化调控其转录水平表达后,通过内源小分子RNA等实现转录后水平的调节,最终达到调控植物生长发育的目的。
生长素响应因子; 基因功能; 调控机制
在植物生长发育的各个阶段,生长素都作为非常重要的植物激素,参与调控植物生长发育的许多方面。如种子的发育与萌发[1],植株的向性运动、顶端优势,细胞伸长、分裂及分化,对生长素快速响应的基因表达等作用。这些作用过程由生长素调控的基因表达来起始或介导。生长素响应因子(Auxin response factor,ARF)和 Aux/IAA转录因子是2个调控生长素信号转导的关键转录因子[2-3],2类转录因子均以家族形式对生长素信号转导进行调控。ARF 基因家族在草本及木本植物中的功能略有不同,主要体现在各家族成员在不同组织器官中的表达,相关功能作用也有所不同。近年来,人们对ARF 基因的分子结构、表达调控研究逐渐增多,对不同植物中ARF基因功能作用及其靶基因的调控机制等研究方面逐渐深入。ARF基因在花芽分化[4]、维管组织形成[5]、胚的发育[6]以及侧根发生[7]等研究领域均有密切关系,对ARF基因的深入研究越来越受研究者重视。
1 植物中的ARF基因
生长素响应因子是由 Ulmasov等[8]在拟南芥中鉴定,后鉴定拟南芥中该家族基因共23个[7]。这23个基因在其5条染色体上均有分布(图1 A)。ARF23只编码部分序列,目前研究并不能确认其功能,只暂时推断其为一个假基因,也位于第1条染色体上。进化分析显示,ARF家族某些成员同源关系很近,如ARF1和ARF2等可形成sister pairs(图1 B),暗示这些ARF之间可能具有冗余的功能。ARF基因家族在不同植物中所包含的成员数目略有不同。如水稻(Oryzasativa)、玉米(Zeamays)、番茄(Solanumlycopersicum)分别有基因组编码25个、31个和17个ARF基因[9-11];杨树(Populoustrichocarpa)则有多达39个ARF基因[4],苹果(Malusdomestica)有29个ARF 基因[12],巨桉(Eucalyptusgrandis)只有17个ARF 基因,与其他被子植物中ARF基因家族所含的成员数目相比较少[13]。由于其他物种中还未发现ARFs家族的存在,因此认为ARFs是植物特异性的蛋白[14]。
2 ARF蛋白的分子结构
ARF蛋白包含3个结构域,分别为氨基末端的DNA结合区(DNA-binding domain,DBD),具有激活或抑制作用的中间区(middle region,MR),和羧基末端的二聚作用结构域(carboxy-terminal dimerization domain CTD)[15]。ARF 蛋白的 DBD 区能够与AuxRE元件的TGTCTC序列结合[16]。拟南芥全部ARF 成员、玉米全部ARF 成员和水稻大多数ARF成员均含有一个DBD结构域,水稻中的OsARF20含有2个DBD 结构域,拟南芥ARF23为只编码部分B 3型DBD的短基因,不含其它结构域[7,10]。ARF 蛋白的中间区如富含谷氨酸、丝氨酸和亮氨酸残基,则该ARF蛋白具有激活作用;如中间区富含色氨酸、脯氨酸、亮氨酸和甘氨酸等残基,则该ARF蛋白具有抑制作用[15](图2)。通过CTD功能域,ARF蛋白可以形成同源二聚体,或者与Aux/IAA 蛋白形成异源二聚体,从而起到调控作用。并非所有的ARF蛋白都包含1个保守的CTD 结构域(图2),其功能还有待研究[17]。
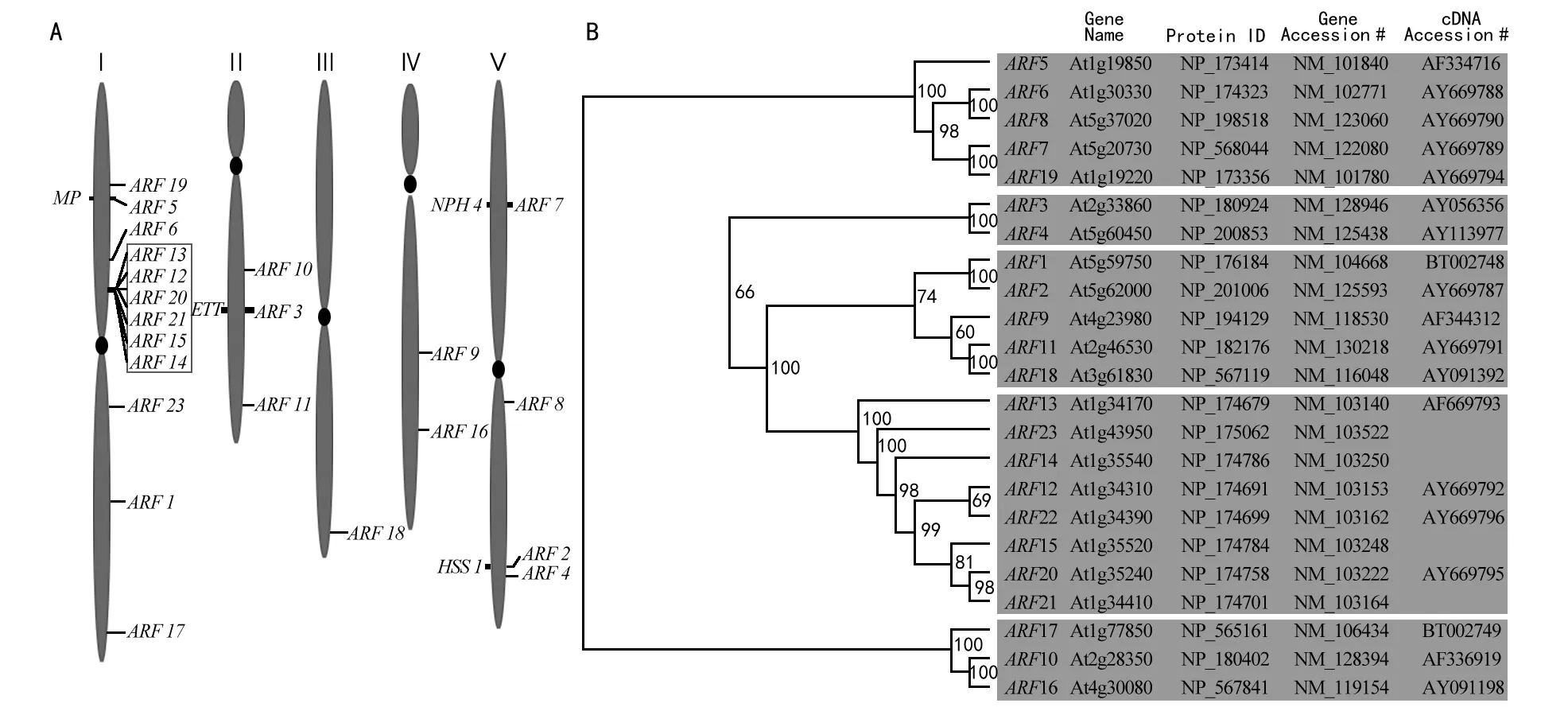
注:A为ARF 基因家族染色体定位;B为系统发育进化图。图1 拟南芥ARF基因家族[7]
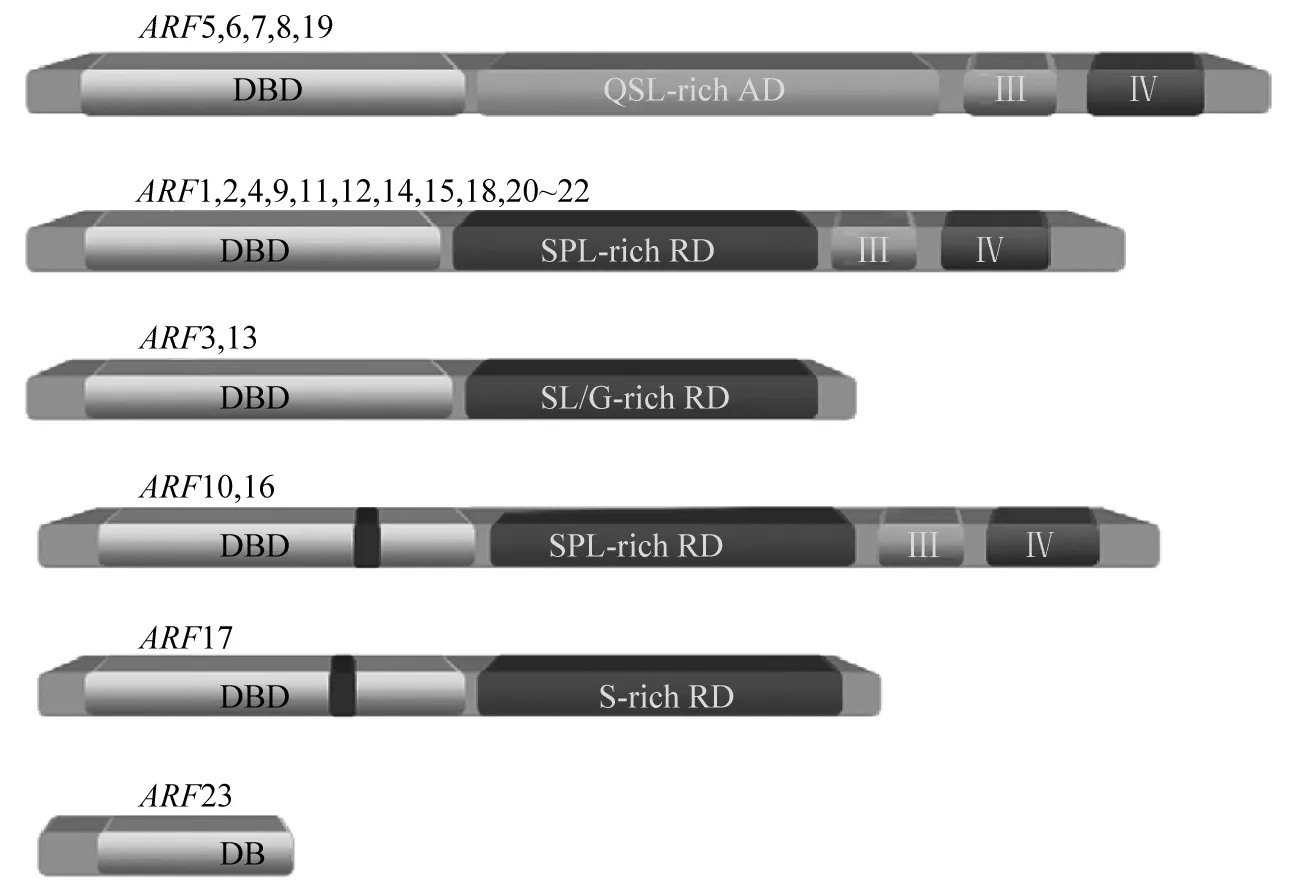
注:Q为谷氨酸;S为丝氨酸;L为亮氨酸;P为脯氨酸;G为甘氨酸。图2 拟南芥转录因子ARF家族[7]
3 ARF的时空表达模式
植物中ARF家族成员数量不一,其时空表达模式在物种间存在不同程度的差异[30]。表1中整理了包括拟南芥、番茄、玉米、水稻等及草本植物ARF基因的表达情况,表2也补充了近年来对杨树、巨桉、茶等木本植物的研究结果。ARF基因家族在植株各部位及时间的表达特异且多样。在拟南芥中,AtARF1主要在花中表达,AtARF2在各组织中普遍表达[18-20]。草本植物与木本植物中ARF基因家族的时空表达也存在较大差异。木本植物研究中出现2个基因与拟南芥基因比对具有相同基因的同源性,这种现象在草本植物中较为少见。如在巨桉ARF家族的研究中,发现2个基因均与拟南芥AtARF6同源,其中与AtARF6同源性更高的命名为EgrARF6A,另一基因命名为EgrARF6B[13]。这一现象在杨树等木本植物中均有体现。此外,木本植物中ARF家族还与木质部形成有关,这是木本植物所特有的。光照、黑暗等环境条件及一些外源激素处理等也会影响ARF基因的表达。拟南芥在黑暗条件下,可引起ARF家族基因转录水平变化,其中ARF2、ARF7和ARF19表达上调,而ARF1的表达下调[18],光照条件下仅ARF8 基因上调表达[31]。但水稻中OsARF8的表达会在光照条件下略有降低[9]。外援生长素或乙烯也会影响ARF基因表达水平,但表达量影响较小[7,23-24]。
4 ARF在植物生长发育过程中的作用
ARF在植物各器官不同时期的表达调控,使其在生长发育过程中起重要作用。拟南芥作为模式植物,ARF家族在其生长过程中的功能研究较为细致。其中拟南芥ARF家族的基因研究比较深入,主要通过研究各个突变体与野生型的表型性状差异来研究各基因的功能。
表1 ARF基因的时空表达情况(草本植物)
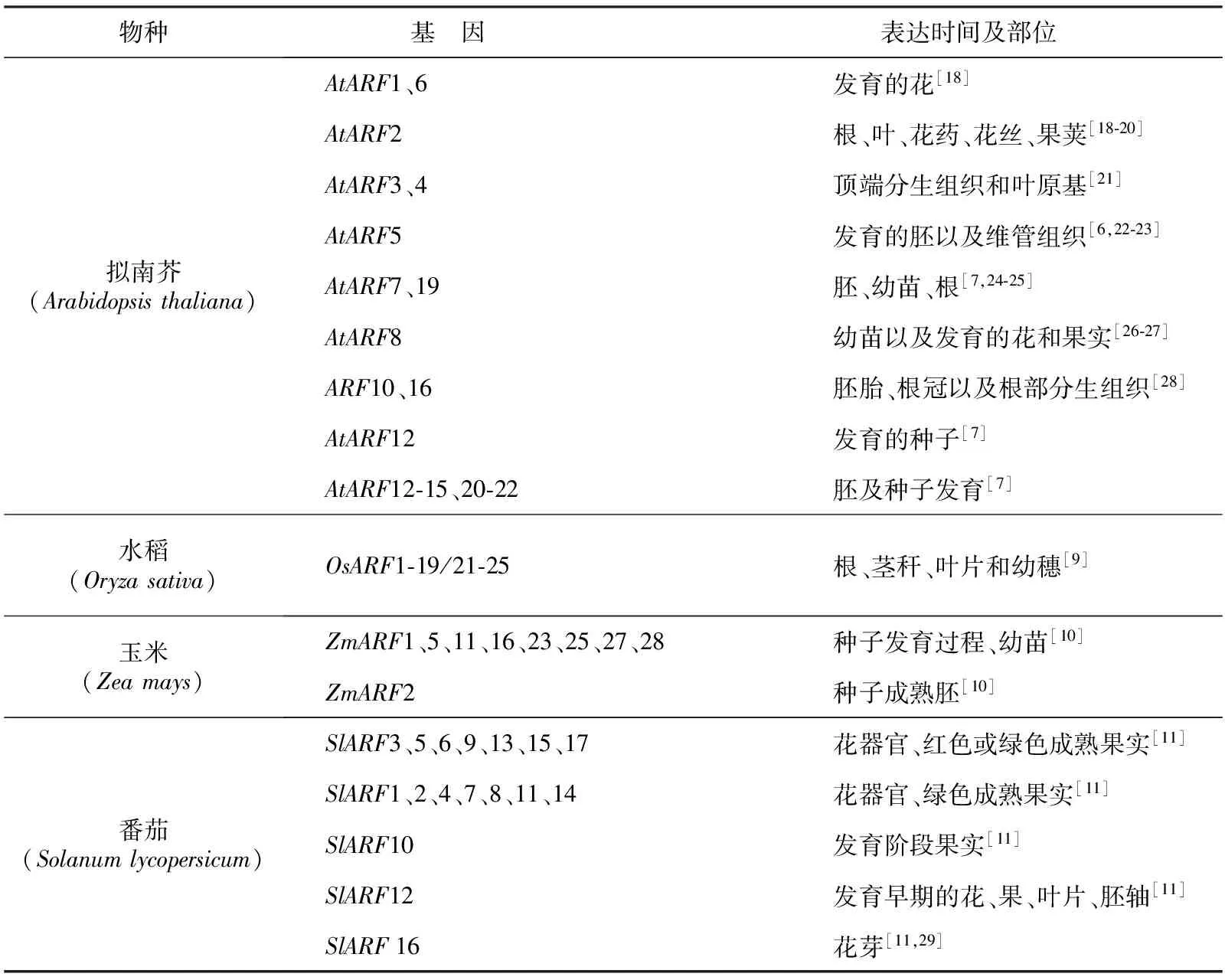
物种基 因 表达时间及部位 拟南芥(Arabidopsisthaliana) AtARF1、6 发育的花[18] AtARF2 根、叶、花药、花丝、果荚[18⁃20] AtARF3、4 顶端分生组织和叶原基[21] AtARF5 发育的胚以及维管组织[6,22⁃23] AtARF7、19 胚、幼苗、根[7,24⁃25] AtARF8 幼苗以及发育的花和果实[26⁃27] ARF10、16 胚胎、根冠以及根部分生组织[28] AtARF12 发育的种子[7] AtARF12⁃15、20⁃22 胚及种子发育[7]水稻(Oryzasativa) OsARF1⁃19/21⁃25 根、茎秆、叶片和幼穗[9]玉米(Zeamays) ZmARF1、5、11、16、23、25、27、28 种子发育过程、幼苗[10] ZmARF2 种子成熟胚[10]番茄(Solanumlycopersicum) SlARF3、5、6、9、13、15、17 花器官、红色或绿色成熟果实[11] SlARF1、2、4、7、8、11、14 花器官、绿色成熟果实[11] SlARF10 发育阶段果实[11] SlARF12 发育早期的花、果、叶片、胚轴[11] SlARF16 花芽[11,29]
表2ARF基因的时空表达情况(木本植物)
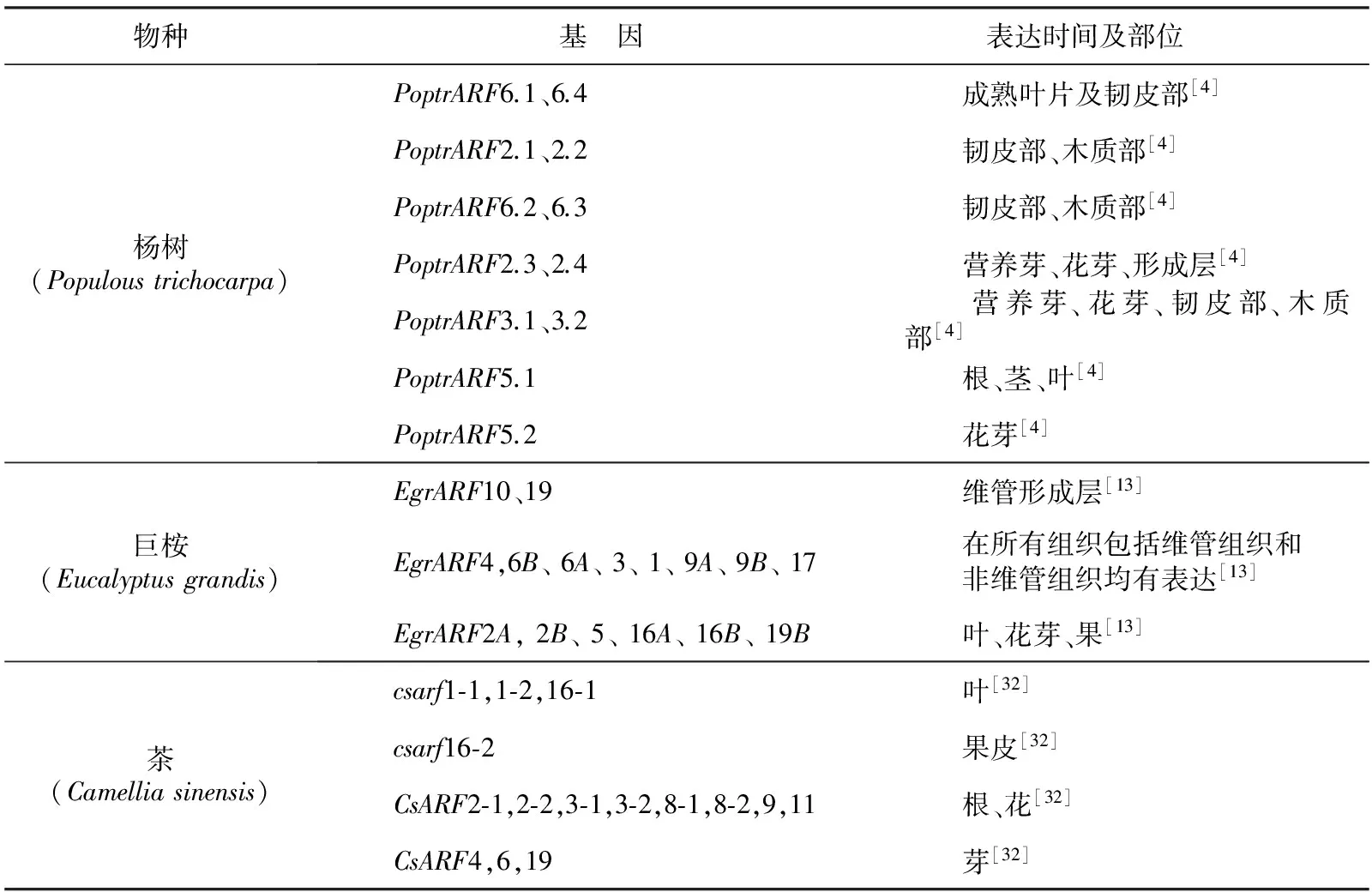
物种基 因表达时间及部位 杨树(Populoustrichocarpa) PoptrARF6.1、6.4 成熟叶片及韧皮部[4] PoptrARF2.1、2.2 韧皮部、木质部[4] PoptrARF6.2、6.3 韧皮部、木质部[4] PoptrARF2.3、2.4 营养芽、花芽、形成层[4] PoptrARF3.1、3.2 营养芽、花芽、韧皮部、木质部[4] PoptrARF5.1 根、茎、叶[4] PoptrARF5.2 花芽[4]巨桉(Eucalyptusgrandis) EgrARF10、19 维管形成层[13] EgrARF4,6B、6A、3、1、9A、9B、17 在所有组织包括维管组织和 非维管组织均有表达[13] EgrARF2A,2B、5、16A、16B、19B 叶、花芽、果[13]茶(Camelliasinensis) csarf1⁃1,1⁃2,16⁃1 叶[32] csarf16⁃2 果皮[32] CsARF2⁃1,2⁃2,3⁃1,3⁃2,8⁃1,8⁃2,9,11 根、花[32] CsARF4,6,19 芽[32]
4.1 拟南芥转录激活子功能
拟南芥转录激活子AtARF5-8、AtARF19富含谷氨酰胺、丝氨酸和亮氨酸,同源关系较近,相关突变体的研究表明它们在胚的发育、下胚轴伸长、维管组织形成、侧根形成、花发育、向光性等过程中起重要作用(表3)。
以AtARF5的研究为例,拟南芥的monopteros(mp)突变体能够干扰维管组织形成的各个阶段,也参与早期胚胎形成过程,利用图位克隆技术分离该基因,证明其为AtARF5的等位基因[6],参与生长素信号转导[33]。胚胎形成早期,AtARF5/MP不但能够促进生长素运输到相邻胚柄细胞,还包括根尖分生组织的静止中心前体[34]。等位基因表型的强弱与ARF 蛋白的突变位置有关[35]。通过分析植株形态及解刨学观察,突变体植株拥有大致正常的花和根系统,但花序甚少或不能形成侧花,花序的生长素运输能力也受到阻碍[5]。试验推测ARF5/MP发生突变后,可以改变AMP1(altered meristem program1)基因功能不正常,表明MP基因可以阻碍AMP1的正常表达,从而调控胚的正常分化[37]。对拟南芥愈伤组织的研究也表明ARF5/MP是拟南芥愈伤组织形成的必要因素,可以调控芽的形成[38]。因此,AtARF5 直接参与植物胚模式建成,维管组织形成等过程。此外,AtARF5间接参与植物生长发育调控,如通过直接调节DRN基因来间接调控子叶的发育[39],通过直接调节AtARR7、15间接调控植物顶端分生组织[40],通过直接调控AtATHB8间接参与叶片维管组织的形成[41]。
表3 拟南芥ARF基因功能
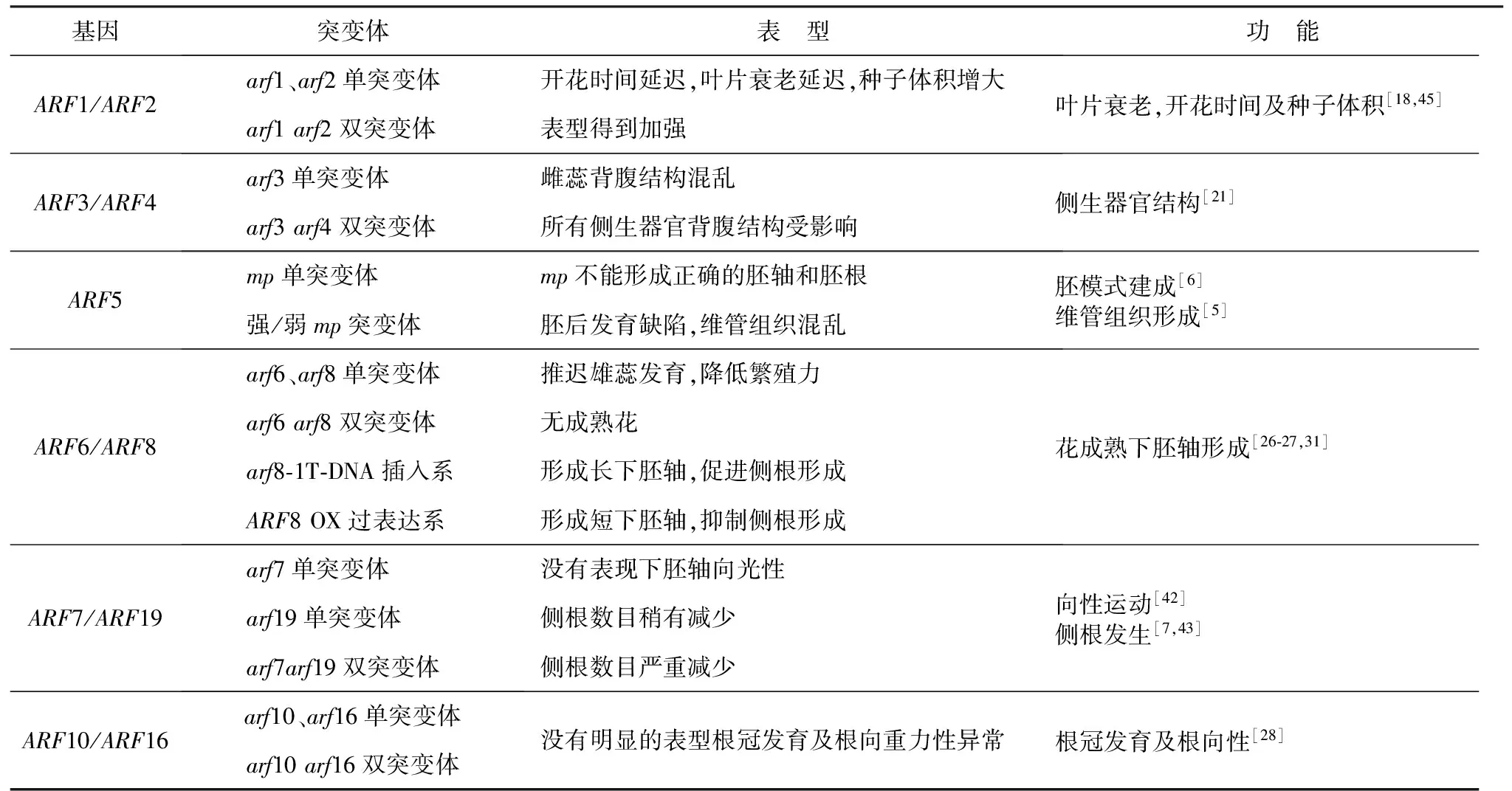
基因突变体表 型功 能ARF1/ARF2 arf1、arf2单突变体开花时间延迟,叶片衰老延迟,种子体积增大 arf1arf2双突变体表型得到加强叶片衰老,开花时间及种子体积[18,45]ARF3/ARF4 arf3单突变体雌蕊背腹结构混乱 arf3arf4双突变体所有侧生器官背腹结构受影响侧生器官结构[21]ARF5 mp单突变体mp不能形成正确的胚轴和胚根 强/弱mp突变体胚后发育缺陷,维管组织混乱胚模式建成[6]维管组织形成[5]ARF6/ARF8 arf6、arf8单突变体推迟雄蕊发育,降低繁殖力 arf6arf8双突变体无成熟花 arf8⁃1T⁃DNA插入系形成长下胚轴,促进侧根形成 ARF8OX过表达系形成短下胚轴,抑制侧根形成花成熟下胚轴形成[26⁃27,31]ARF7/ARF19 arf7单突变体没有表现下胚轴向光性 arf19单突变体侧根数目稍有减少 arf7arf19双突变体侧根数目严重减少向性运动[42]侧根发生[7,43]ARF10/ARF16arf10、arf16单突变体arf10arf16双突变体 没有明显的表型根冠发育及根向重力性异常根冠发育及根向性[28]
AtARF6 和AtARF8参与调控花成熟[27],AtARF8还调控下胚轴的形成与伸长[31],并且是果实起始发育的负调控子[26]。在拟南芥野生植株下胚轴单侧施加适量浓度生长素时,下胚轴表现弯曲,而在拟南芥arf7突变体下胚轴单侧施加生长素时,下胚轴并未相应弯曲,说明AtARF7在向性运动中起重要作用[42]。arf7和arf19单突变体存在侧根数目减少的现象不明显,但arf7arf19双突变体侧根数目严重减少,这是单突变体中未观察到的表型[43]。这种功能并非两基因对植株侧根的直接调控,研究证明,AtARF7和AtARF19可通过直接调节一些LBD/ASL基因来影响侧根的发生[44]。
4.2 拟南芥转录抑制子功能
拟南芥中其他ARF家族成员主要起转录抑制作用。其作用包括种子大小、侧生器官背腹性以及根向性等(表3)。在拟南芥衰老叶片中ARF2基因被诱导表达,调控叶片衰老和开花及脱落的时间[18,45]。arf2突变体除花期延后外,种子体积急剧增加,说明该基因也调控种子大小,arf1arf2双突变体各项相关表型均有所加强[46]。AtARF3在花形成阶段表达,突变体主要为ettin(ett)突变体,表现为雌蕊的背腹结构混乱,对其他花器官的发育产生影响[47]。Arf3、4 和arf10、16相类似,其单突变体表现不显著甚至没有明显表型,而双突变体表现显著异常[28]。
由此可见,拟南芥ARF家族无论是转录激活子还是转录抑制子,在不同器官不同时间有着多样且重要的作用。生长素控制细胞的生长与分化,细胞所处器官与生长素作用有密切关系, ARF作为生长素响应因子,受生长素的调控,对植物的花、叶、根、种子的形成与衰败均有重要的调控作用。并且在ARF家族中的 sister pair 基因的双突变的表型往往比单突变要强,且可能出现单突变没有出现的表型,这表明ARF sister pair在功能上是冗余之外,对1对基因功能同时进行研究显得更加重要。
4.3 其他植物中ARF转录因子功能
对其他植物中的ARF功能进行研究,各家族成员的基本功能与拟南芥中的功能基本相似,但也因不同植物自身特点而略有不同。构建pGmARF 17∷mGmARF 17 (mGmARF 17) 抗降解表达载体并转化大豆,使其下胚轴生长受到明显的抑制,说明ARF17对大豆下胚轴生长具有调控作用[48]。马铃薯茎顶端芽存在休眠,在休眠芽中检测不到ARF6的表达,但在切除顶芽后ARF6的表达量迅速增加[49]。龙眼中ARF5参与鱼雷形胚时期的形态建成[50]。杨树中有2个基因与拟南芥AtARF5同源,这2个基因均与维管组织发育有关,并可能在杨树次生木质部的发育起到类似的作用[51]。将芒果MiARF2基因转至拟南芥中构建拟南芥过表达植株,验证该基因抑制拟南芥下胚轴的伸长[52]。茶树中通过研究CsARF1基因在各组织中表达量,证实该基因与茶树越冬芽的休眠与解除相关[53]。由此可见,木本植物维管组织发达,因此与维管组织形成有关的ARF5等基因表达更为重要。而存在休眠的马铃薯、茶树等植物中,ARF家族也有部分转录激活子或转录抑制子起重要作用。
5 ARF基因的转录后调控
ARF基因受光照、激素与环境条件变化调控其转录水平表达,后通过内源小分子RNA等实现转录后水平的调节,包括microRNA (简称 miRNA)和反式作用小干扰RNAs(简称 ta-siRNA)。在受外界信号刺激时,miRNA和ta-siRNA可以对ARF的mRNA进行切割,从而使细胞中的ARF迅速发生变化[54]。这种调控方式可以快速调控ARF基因的表达水平,随着miRNA的研究热度逐渐增加,从这一角度切入研究ARF基因的转录后调控逐渐受到重视。
由于ARF家族存在同源关系较近的sister pairs,因此同一miRNA或ta-siRNA可能调控1组sister pairs,他们之间可能会形成1个调控网络,实现对植物生长发育的调控。已有研究报道,在拟南芥中,miR167以ARF6/ARF8为靶基因,MIR167前体基因的过量表达能够引起植株花药开裂、花粉萌发和花丝伸长等异常现象,定量检测转录水平ARF6/ARF8表达量下调[55-56]。MIR160可以调控ARF10、16 、17三个基因,从而调控植物种子萌发[57]。将MIR160的结合位点进行突变,使之不能与ARF17 的mRNA结合,检测转基因植株中ARF17 mRNA,发现其成熟mRNA增加,相应出现植株根部弯曲的表型性状,说明ARF17虽不直接参与根冠发育,但可通过影响ARF10、16的功能进而影响植物根部形态[28]。TAS 3 ta-siRNAs可与ARF结合并抑制其表达[58]。miRNA也可能通过调节ta-siRNA间接调控ARF基因的表达。当ta-siRNA与ARF2、3、4等基因结合时,会抑制其表达活性,而miR390可切割 ta-siRNA,从而解除ta-siRNA对ARF基因的抑制作用,从而使侧根得到生长。ARF2、3、4等基因的积累反作用于miR390,减少miR390的表达,形成反馈效应。miR390对ARF2/ARF3/ARF4的这种正向及负向调控,使得ARFs蛋白在侧根形成和生长过程中维持最适表达水平[59]。一些ARF基因受其他途径的转录后水平的调控。如ARF5/MP和ARF3的 mRNA上游都存在一个开放阅读框,能够对下游基因在转染原生质体和体外翻译体系中的翻译呈负调控[60]。
6 ARF 的靶基因及其对靶基因的调控机制
ARF转录因子通过激活或抑制其靶基因,实现相应生长素或其他环境条件对植物生长发育的调控。ARF的靶基因主要为受生长素快速诱导的基因,被称为初级生长素响应基因,包括Aux/IAA基因、SAUR基因及GH 3基因。ARF的DBD可以结合同样的AuxRE元件的TGTCTC/GAGACA序列,激活或抑制靶基因的表达[8]。目前研究主要通过原生质体转染实验、染色质免疫共沉淀(chromatin immunoprecipitation assay, CHIP)、arf及aux/iaa突变体相关芯片等技术研究ARF靶基因[15]。
ARF靶基因研究是研究其基因功能的重要部分。随着CHIP、突变体芯片等技术的发展,寻找特定靶基因的准确性与得到显著提高。利用CHIP等技术,检测到拟南芥胚中AtARF5/MP的直接靶基因为DORNRÖSCHEN(DRN),从而调控子叶的发育[39]。AtARF5/MP可直接调控TMO5 (TARGETOFMP5) 和TMO7的表达,而这2个基因为bHLH 家族的转录因子,因此AtARF5/MP可间接调控控制胚根的形成[61]。AtARF5可与AtARR7和AtARR15的启动子区域结合,从而激活或抑制该基因的表达[40]。AtARF5和AtARR7可调控AP2/EREBP转录因子家族中的PLETHORA(PLT)基因,从而调控胚发育进程[62-63]。AtATHB8为AtARF5/MP的另一靶基因,受到AtARF5/MP的正调控,进而参与叶片维管束的形成[41]。已有研究证明,AtARF5/MP广泛控制Aux/IAA近一半的表达[64]。可见,在不同条件下,ARF家族蛋白根据不同时期、不同组织,会选择不同的靶基因实现其不同功能。从拟南芥的AtARF5可以看出,其靶基因以转录因子为主,因此可以推测,ARF可能在多级转录调控过程中实现对植株生长发育的调控。此外,AtARF7、19可直接激活某些LBD/ASL基因以调控拟南芥侧根的发育[44]。GH3.5与GH3.6受ARF8正调控,并受ARF17负调控[65]。ARF家族多个成员与靶基因存在调控关系,在ARF行使不同功能时,会存在一个最优调控组合,调节植物生长发育进程。
7 展 望
ARF作为与生长素响应相关的转录因子,其功能涉及植物生长发育的各个方面。在草本植物中,ARF主要与花、叶、根、胚等组织器官的生长发育相关,除此之外,ARF与木本植物的韧皮部、木质部的形成也有着密切关系。目前对不同植物中ARF的表达及参与相关植物生长发育过程已经有了很多研究,由于ARF基因之间存在功能冗余,为其功能研究带来困难。虽然ARF 对下游靶基因调控机制的研究已取得了一定的进展,但由于多家族多基因的参与,也使得该调控网络趋于复杂,使得对 ARF 基因表达调控的机制认识还不够深入。随着高通量测序、CHIP、DNA芯片以及新技术的发展,人们对ARF家族在不同植物、不同组织、不同时期的表达特点、新功能挖掘、调控机理及与其他基因或蛋白之间的相互作用会有更深入的研究。对完善生长素信号途径,揭示植物胚胎发生等提供理论基础。植物对生长素响应非常复杂,ARF的研究可作为一条重要线索,来探究植物生长发育调控机制。
[1]周建荣.不同激素处理对油松种子萌发特性的影响[J].种子,2016,35(1):85-87.
[2]Woodward A W,Bartel B.A receptor for auxin[J].The Plant Cell,2005,17(9):2 425-2 429.
[3]Quint M,Gray W M.Auxin signaling[J].Current Opinion in Plant Biology,2006,9(5):448-453.DOI:10.1016/j.pbi.2006.07.006.
[4]Kalluri U C,DiFazio S P,Brunner A M,et al.Genome-wide analysis of Aux/IAA and ARF gene families in Populus trichocarpa[J].BMC Plant Biology,2007,7(1):59.DOI:10.1186/1471-2229-7-59.
[5]Przemeck G K,Mattsson J,Hardtke C S,et al.Studies on the role of the Arabidopsis gene MONOPTEROS in vascular development and plant cell axialization[J].Planta,1996,200(2):229-237.
[6]Hardtke C S,Berleth T.The Arabidopsis gene MONOPTEROS encodes a transcription factor mediating embryo axis formation and vascular development[J].EMBO J,1998,17(5):1 405-1 411.DOI:10.1093/emboj/17.5.1405.
[7]Okushima Y,Overvoorde P J,Arima K,et al.Functional Genomic Analysis of the AUXIN RESPONSE FACTOR Gene Family Members in Arabidopsis thaliana:Unique and Overlapping Functions of ARF 7 and ARF 19[J].THE PLANT CELL ONLINE,2005,17(2):444-463.DOI:10.1105/tpc.104.028316.
[8]Ulmasov T,Hagen G,Guilfoyle T J.ARF 1,a transcription factor that binds to auxin response elements[J].Science,1997,276(5 320):1 865-1 868.
[9]Wang D,Pei K,Fu Y,et al.Genome-wide analysis of the auxin response factors (ARF) gene family in rice (Oryzasativa)[J].Gene,2007,394(1-2):13-24.DOI:10.1016/j.gene.2007.01.006.
[10]Xing H,Pudake R N,Guo G,et al.Genome-wide identification and expression profiling of auxin response factor (ARF) gene family in maize[J].BMC Genomics,2011,12:178.DOI:10.1186/1471-2164-12-178.
[11]Kumar R,Tyagi A K,Sharma A K.Genome-wide analysis of auxin response factor (ARF) gene family from tomato and analysis of their role in flower and fruit development[J].Molecular Genetics and Genomics,2011,285(3):245-260.DOI:10.1007/s00438-011-0602-7.
[12]李慧峰,冉昆,何平,等.苹果生长素响应因子(ARF)基因家族全基因组鉴定及表达分析[J].植物生理学报,2015,51(7):1 045-1 054.
[13]Yu H,Soler M,Mila I,et al.Genome-Wide Characterization and Expression Profiling of the AUXIN RESPONSE FACTOR (ARF) Gene Family in Eucalyptus grandis[J].PLoS ONE,2014,9(9):108 906.DOI:10.1371/journal.pone.0108906.
[14]吴蓓,吴建勇,蔡刘体,等.生长素反应因子[J].植物生理学通讯,2005,41(3):273-278.
[15]Guilfoyle T J,Hagen G.Auxin response factors[J].Current Opinion in Plant Biology,2007,10(5):453-460.DOI:10.1016/j.pbi.2007.08.014.
[16]Ulmasov T,Hagen G,Guilfoyle T J.Activation and repression of transcription by auxin-response factors[J].Proc Natl Acad Sci U S A,1999,96(10):5 844-5 849.
[17]Tiwari S B,Hagen G,Guilfoyle T.The Roles of Auxin Response Factor Domains in Auxin-Responsive Transcription[J].THE PLANT CELL ONLINE,2003,15(2):533-543.DOI:10.1105/tpc.008417.
[18]Ellis C M,Nagpal P,Young J C,et al.AUXIN RESPONSE FACTOR 1 and AUXIN RESPONSE FACTOR 2 regulate senescence and floral organ abscission in Arabidopsisthaliana[J].Development,2005,132(20):4 563-4 574.DOI:10.1242/dev.02012.
[19]Okushima Y,Mitina I,Quach H L,et al.AUXIN RESPONSE FACTOR 2 (ARF 2):a pleiotropic developmental regulator[J].The Plant Journal,2005,43(1):29-46.DOI:10.1111/j.1365-313X.2005.02426.x.
[20]Finet C,Fourquin C,Vinauger M,et al.Parallel structural evolution of auxin response factors in the angiosperms[J].The Plant Journal,2010,63(6):952-959.DOI:10.1111/j.1365-313X.2010.04292.x.
[21]Pekker I,Alvarez J P,Esheda Y.Auxin Response Factors Mediate Arabidopsis Organ Asymmetry via Modulation of KANADI Activity[J].THE PLANT CELL ONLINE,2005,17(11):2 899-2 910.DOI:10.1105/tpc.105.034876.
[22]Hardtke C S,Ckurshumova W,Vidaurre D P,et al.Overlapping and non-redundant functions of the Arabidopsis auxin response factors MONOPTEROS and NONPHOTOTROPIC HYPOCOTYL 4[J].Development,2004,131(5):1 089-1 100.DOI:10.1242/dev.00925.
[23]Wenzel C L,Schuetz M,Yu Q,et al.Dynamics of MONOPTEROS and PIN-FORMED 1 expression during leaf vein pattern formation in Arabidopsis thaliana[J].The Plant Journal,2007,49(3):387-398.DOI:10.1111/j.1365-313X.2006.02977.x.
[24]Li J,Dai X,Zhao Y.A Role for Auxin Response Factor 19 in Auxin and Ethylene Signaling in Arabidopsis[J].PLANT PHYSIOLOGY,2006,140(3):899-908.DOI:10.1104/pp.105.070987.
[25]Wang S.AUXIN RESPONSE FACTOR 7 Restores the Expression of Auxin-Responsive Genes in Mutant Arabidopsis Leaf Mesophyll Protoplasts[J].THE PLANT CELL ONLINE,2005,17(7):1 979-1 993.DOI:10.1105/tpc.105.031096.
[26]Goetz M,Vivian-Smith A,Johnson S D,et al.AUXIN RESPONSE FACTOR8 Is a Negative Regulator of Fruit Initiation in Arabidopsis[J].THE PLANT CELL ONLINE,2006,18(8):1 873-1 886.DOI:10.1105/tpc.105.037192.
[27]Nagpal P,Ellis C M,Weber H,et al.Auxin response factors ARF 6 and ARF 8 promote jasmonic acid production and flower maturation[J].Development, 2005,132(18):4 107-4 118.DOI:10.1242/dev.01955.
[28]Wang J W,Wang L J,Mao Y B,et al.Control of root cap formation by MicroRNA-targeted auxin response factors in Arabidopsis[J].Plant Cell,2005,17(8):2 204-2 216.DOI:10.1105/tpc.105.033076.
[29]Jones B,Frasse P,Olmos E,et al.Down-regulation of DR 12,an auxin-response-factor homolog,in the tomato results in a pleiotropic phenotype including dark green and blotchy ripening fruit[J].Plant J,2002,32(4):603-613.
[30]Yang J.Arabidopsis Auxin Response Factor ARF 17 Regulates Pollen Wall Pattern Formation[D].Shanghai Normal University,2013.
[31]Tian C,Muto H,Higuchi K,et al.Disruption and overexpression of auxin response factor 8 gene of Arabidopsis affect hypocotyl elongation and root growth habit,indicating its possible involvement in auxin homeostasis in light condition[J].The Plant Journal,2004,40(3):333-343.DOI:10.1111/j.1365-313X.2004.02220.x.
[32]Xu Y,Mao J,Chen W,et al.Identification and expression profiling of the auxin response factors (ARFs) in the tea plant (Camelliasinensis(L.)O.Kuntze) under various abiotic stresses[J].Plant Physiology and Biochemistry,2016,98:46-56.DOI:10.1016/j.plaphy.2015.11.014.
[33]Odat O,Gardiner J,Sawchuk M G,et al.Characterization of an Allelic Series in the MONOPTEROS Gene of Arabidopsis[J].genesis,2014,52(2):127-133.DOI:10.1002/dvg.22729.
[34]Rademacher E H,Lokerse A S,Schlereth A,et al.Different Auxin Response Machineries Control Distinct Cell Fates in the Early Plant Embryo[J].Developmental Cell,2012,22(1):211-222.DOI:10.1016/j.devcel.2011.10.026.
[35]刘振华,于延冲,向凤宁.生长素响应因子与植物的生长发育[J].遗传,2011,33(12):1 335-1 346.
[36]Vidaurre D P,Ploense S,Krogan N T,et al.AMP1 and MP antagonistically regulate embryo and meristem development in Arabidopsis[J].Development,2007,134(14):2 561-2 567.DOI:10.1242/dev.006759.
[37]Ckurshumova W,Smirnova T,Marcos D,et al.Irrepressible MONOPTEROS/ARF 5 promotes de novo shoot formation[J].New Phytologist,2014,204(3):556-566.DOI:10.1111/nph.13014.
[38]Cole M,Chandler J,Weijers D,et al.DORNROSCHEN is a direct target of the auxin response factor MONOPTEROS in the Arabidopsis embryo[J].Development,2009,136(10):1 643-1 651.DOI:10.1242/dev.032177.
[39]Zhao Z,Andersen S U,Ljung K,et al.Hormonal control of the shoot stem-cell niche[J].Nature,2010,465(7301):1 089-1 092.DOI:10.1038/nature09126.
[40]Donner T J,Sherr I,Scarpella E.Regulation of preprocambial cell state acquisition by auxin signaling in Arabidopsis leaves[J].Development,2009,136(19):3 235-3 246.DOI:10.1242/dev.037028.
[41]Harper R M,Stowe-Evans E L,Luesse D R,et al.The NPH4 locus encodes the auxin response factor ARF 7,a conditional regulator of differential growth in aerial Arabidopsis tissue[J].Plant Cell,2000,12(5):757-770.
[42]Wilmoth J C,Wang S,Tiwari S B,et al.NPH 4/ARF 7 and ARF 19 promote leaf expansion and auxin-induced lateral root formation[J].The Plant Journal,2005,43(1):118-130.
[43]Okushima Y,Fukaki H,Onoda M,et al.ARF 7 and ARF 19 regulate lateral root formation via direct activation of LBD/ASL genes in Arabidopsis[J].Plant Cell,2007,19(1):118-130.DOI:10.1105/tpc.106.047761.
[44]Lim P O,Lee I C,Kim J,et al.Auxin response factor 2 (ARF 2) plays a major role in regulating auxin-mediated leaf longevity[J].Journal of Experimental Botany,2010,61(5):1 419-1 430.DOI:10.1093/jxb/erq010.
[45]Schruff M C,Spielman M,Tiwari S,et al.The AUXIN RESPONSE FACTOR 2 gene of Arabidopsis links auxin signalling,cell division,and the size of seeds and other organs[J].Development, 2005,133(2):251-261.DOI:10.1242/dev.02194.
[46]Sessions R A,Zambryski P C.Arabidopsisgynoecium structure in the wild type and in ettinmutants[J].Development,1995,121(5):1 519-1 532.
[47]李小平,曾庆发,张根生,等.大豆生长素响应因子基因GmARF17对胚轴生长发育的调控作用[J].核农学报,2015,29(9):1 668-1 676.
[48]Faivre Rampant O,Cardle L,Marshall D,et al.Changes in gene expression during meristem activation processes in Solanum tuberosum with a focus on the regulation of an auxin response factor gene[J].Journal of Experimental Botany,2004,55(397):613-622.DOI:10.1093/jxb/erh075.
[49]林丽霞,屈莹,徐洋,等.龙眼体胚发生过程生长素响应因子DlARF 5 a的克隆及表达分析[J].西北植物学报,2014,34(06):1 075-1 082.
[50]Johnson L A,Douglas C J.Populus trichocarpa MONOPTEROS/AUXIN RESPONSE FACTOR 5(ARF 5)genes:comparative structure,sub-functionalization,and Populus-Arabidopsis microsynteny1[J].Canadian Journal of Botany,2007,85(11):1 058-1 070.DOI:10.1139/B07-065.
[51]Wu B,Li Y,Wu J,et al.Over-expression of mango (MangiferaindicaL.) MiARF 2 inhibits root and hypocotyl growth of Arabidopsis[J]. Molecular Biology Reports,2011,38(5):3 189-3 194.DOI:10.1007/s11033-010-9990-8.
[52]郝心愿,曹红利,杨亚军,等.茶树生长素响应因子基因CsARF1的克隆与表达分析[J].作物学报,2013,39(3):389-397.
[53]Bartel B,Bartel D P.MicroRNAs:At the Root of Plant Development?[J].PLANT PHYSIOLOGY,2003,132(2):709-717.DOI:10.1104/pp.103.023630.
[54]Wu M F,Tian Q,Reed J W.Arabidopsis microRNA 167 controls patterns of ARF 6 and ARF 8 expression,and regulates both female and male reproduction[J].Development,2006,133(21):4 211-4 218.DOI:10.1242/dev.02602.
[55]Jay F,Wang Y,Yu A,et al.Misregulation of AUXIN RESPONSE FACTOR 8 Underlies the Developmental Abnormalities Caused by Three Distinct Viral Silencing Suppressors in Arabidopsis[J].PLoS Pathogens,2011,7(5):e1002035.DOI:10.1371/journal.ppat.1002035.
[56]Liu P,Montgomery T A,Fahlgren N,et al.Repression of AUXIN RESPONSE FACTOR 10 by microRNA 160 is critical for seed germination and post-germination stages[J].The Plant Journal,2007,52(1):133-146.DOI:10.1111/j.1365-313X.2007.03218.x.
[57]Fahlgren N,Montgomery T A,Howell M D,et al.Regulation of AUXIN RESPONSE FACTOR 3 by TAS 3 ta-siRNA Affects Developmental Timing and Patterning in Arabidopsis[J].Current Biology,2006,16(9):939-944.DOI:10.1016/j.cub.2006.03.065.
[58]Marin E,Jouannet V,Herz A,et al.miR 390,Arabidopsis TAS 3 tasiRNAs,and Their AUXIN RESPONSE FACTOR Targets Define an Autoregulatory Network Quantitatively Regulating Lateral Root Growth[J].The Plant Cell,2010,22(4):1 104-1 117.DOI:10.1105/tpc.109.072553.
[59]Nishimura T,Wada T,Yamamoto K T,et al.The Arabidopsis STV 1 Protein,Responsible for Translation Reinitiation,Is Required for Auxin-Mediated Gynoecium Patterning[J].THE PLANT CELL,2005,17(11):2 940-2 953.DOI:10.1105/tpc.105.036533.
[60]Schlereth A,Möller B,Liu W,et al.MONOPTEROS controls embryonic root initiation by regulating a mobile transcription factor[J].Nature,2010,464(7 290):913-916.DOI:10.1038/nature08836.
[61]Sato A,Yamamoto K T.What's the physiological role of domain II-less Aux/IAA proteins?[J].Plant signaling amp; behavior,2008,3(7):496-497.
[62]Wang P,Shi J,Zhang Y,et al.The research progress of the pattern formation and gene regulation mechanism in plant embryogenesis[J].Journal of Nanjing Forestry University,2013,37(5):134-138.
[63]Krogan N T,Yin X,Ckurshumova W,et al.Distinct subclades of Aux/IAA genes are direct targets of ARF 5/MP transcriptional regulation[J].New Phytologist,2014,204(3):474-483.DOI:10.1111/nph.12994.
[64]Sorin C,Bussell J D,Camus I,et al.Auxin and Light Control of Adventitious Rooting in Arabidopsis Require ARGONAUTE 1[J].The Plant Cell,2005,17(5):1 343-1 359.DOI:10.1105/tpc.105.031625.
(本栏目责任编辑:周介雄)
Advances in Plant Auxin Response Factors
MEIMeia,WANGXiaoyua,ZHANGXiaolinb,LUXiujuna,b
2016-09-26
国家自然科学基金面上项目(31570621)。
梅 梅(1989—),博士生,主要从事种子萌发研究工作;E-mail:meim302@sina.com。
陆秀君(1966—),博士,教授,主要从事林木种苗研究工作;E-mail:lxjsyau@126.com。
10.16590/j.cnki.1001-4705.2017.01.047
S 722
A
1001-4705(2017)01-0047-08
