重组产气荚膜梭菌plc毒素基因植物乳酸杆菌的构建
2017-12-01周庆民冯万宇李兰兰郑晓星宁秀云李广兴
张 艳 , 周庆民 , 冯万宇 , 徐 馨 , 黄 健 , 王 新 , 李兰兰 ,郑晓星 , 宁秀云 , 李广兴
(1.黑龙江省兽医科学研究所 , 黑龙江 齐齐哈尔 161006 ;2.东北农业大学动物医学学院 ,黑龙江 哈尔滨 150030 ;3.黑龙江省讷河市动物防疫站 , 黑龙江 齐齐哈尔 161300)
重组产气荚膜梭菌plc毒素基因植物乳酸杆菌的构建
张 艳1,2, 周庆民1, 冯万宇1, 徐 馨1, 黄 健1, 王 新1,2, 李兰兰2,郑晓星2, 宁秀云3, 李广兴2
(1.黑龙江省兽医科学研究所 , 黑龙江 齐齐哈尔 161006 ;2.东北农业大学动物医学学院 ,黑龙江 哈尔滨 150030 ;3.黑龙江省讷河市动物防疫站 , 黑龙江 齐齐哈尔 161300)
依据乳酸菌的肠道益生作用,选择产气荚膜梭菌关键致病因子α毒素/磷脂酶C为抗原,构建产气荚膜梭菌α毒素去除信号肽的plc基因片段重组植物乳杆菌,利用植物乳酸菌穿梭载体pSIP409构建重组质粒pSIP409-plc,经双酶切鉴定和序列测定正确后转化大肠杆菌BL21(DE3)感受态细胞并进行SppIP诱导表达。Western Blot证明重组蛋白表达成功,并且主要以包涵体形式存在,plc重组蛋白相对分子质量分别为40 kDa。重组质粒pSIP409-plc分别电转化植物乳杆菌NC8细胞,PCR和双酶切鉴定正确后进行SppIP诱导表达。Western Blot和间接免疫荧光鉴定表明,构建的重组植物乳酸杆菌具有诱导分泌plc蛋白的能力,可作为黏膜免疫的候选抗原。
产气荚膜梭菌 ; plc基因 ; 植物乳酸杆菌 ; 表达
随着养禽业中抗生素禁用,坏死性肠炎的发病率明显上升,给养禽业带来严重的经济损失,所以本病预防变得尤为重要[1-2]。能导致家禽坏死性肠炎的产气荚膜梭菌主要是A型和C型[3],α毒素为所有类型产气荚膜梭菌都分泌的外毒素,plc基因为α毒素去除信号肽的片段。α毒素可破坏细胞膜的完整性,主要是通过第二信使途径最终使受感染的机体组织缺氧,营造适合菌体的生长的条件,导致肠道菌群失衡[4]。
同时,由于乳酸杆菌作为保护性抗原呈递有效活载体不仅能够诱发机体全身性免疫应答,更为明显的是能诱导机体的局部黏膜免疫[5],所以本试验依据植物乳杆菌的肠道益生作用,利用其作为呈递产气荚膜梭菌关键毒素抗原α毒素(plc)的载体,研制出口服重组活菌疫苗为NE疫苗早日应用于实践提供理论基础。
1 材料与方法
1.1 菌株与载体LactobacillusplantarumNC8和穿梭表达载体pSIP409由吉林农业大学动物科学技术学院王春风教授馈赠;克隆宿主菌E.coliJM109、表达宿主菌E.coliBL21(DE3)、plc阳性质粒pGEX-plc由本实验室保存;鼠抗产气荚膜梭菌plc基因单抗由本实验室制备。
1.2 培养基和主要试剂ExTaqDNA聚合酶、限制性内切酶、T4 DNA连接酶、蛋白质及核酸分子质量标准,均购自宝生物工程(大连)有限公司;IPTG,购自Amresco公司;溴化乙锭、4-氯-1-萘酚、红霉素,购自Sigma公司;HRP标记山羊抗兔IgG、FITC标记山羊抗兔IgG,购自北京中杉金桥生物技术有限公司;MRS培养基,购自北京索莱宝科技有限公司;SppIP由上海强耀公司合成;其他常规试剂为分析纯。
1.3 重组体pSIP409-plc的构建 采用HindIII和EcoRI分别双酶切阳性克隆质粒pGEX-plc和乳酸杆菌pSIP409载体质粒,利用凝胶回收纯化试剂盒对目的基因plc和载pSIP409片段分别回收纯化后,以T4 DNA连接酶进行连接,并转化至大肠杆菌感受态细胞JM109中,提取质粒进行PCR和酶切鉴定,取适量经PCR鉴定和双酶切鉴定初步判定为阳性的重组菌液,送至哈尔滨博仕生物科技有限公司进行序列测定。
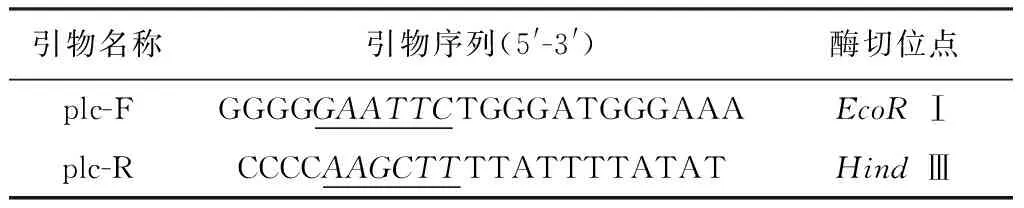
表1 扩增plc基因的引物序列
1.4 重组质粒pSIP409-plc的转化 取测序结果正确的重组质粒pSIP409-plc和载体质粒pSIP409各1 μL转化至大肠杆菌表达感受态细胞BL21中。挑取单个菌落接种至3 mL Em+抗性LB液体培养基中,37 ℃振荡培养过夜。以菌液为模板进行PCR鉴定。将阳性质粒pSIP409-plc采用电穿孔法转入新制备的植物乳酸杆菌感受态中,调节电穿孔仪的电压和时间分别为1 890 V和1.1 ms。电转化结束后,将转化产物置于10 μg/mL Em+抗性的MRS液体培养基中,30 ℃厌氧培养3 h,涂布于MRS固体培养基(Em+10 μg/mL),30 ℃厌氧培养24~72 h至形成单菌落。挑取单菌落克隆,利用质粒小量提取试剂盒提取转化后重组乳酸杆菌的质粒,采用PstⅠ和XhoⅠ进行双酶切鉴定。
1.5 plc蛋白的表达
1.5.1 在大肠杆菌系统的表达 将PCR鉴定阳性的重组表达菌按1∶100(v/v)接种于50 mL Em+抗性LB液体培养基中,于37 ℃振荡培养6 h~8 h。当培养物的OD600 nm值达0.4~0.6时,取出1 mL菌液作为诱导前(0 h)对照,置于4 ℃暂时保存。向剩余菌液中加入诱导剂SppIP,使其终浓度达2 mg/L,继续培养。每隔6 h(即诱导后第6、12、18、24、30 h和36 h)取出1 mL菌液,置于4 ℃暂时保存。将各小时菌液进行10 000 r/min离心5 min收集细菌沉淀,加入20 μL PBS悬起沉淀后加入等量2×SDS上样缓冲液(含200 mmo1/L DTT)混匀,煮沸10 min,用于10 %凝胶SDS-PAGE分析。
SDS-PAGE分析后将凝胶电转移至硝酸纤维素膜(NC膜)进行Western Blot鉴定,NC膜经3%脱脂乳(TTBS)封闭1 h,TTBS洗涤3次,加入适当稀释的鼠抗产气荚膜梭菌plc基因单克隆抗体中进行孵育,室温振荡40 min,TTBS洗涤3次,将NC膜放入经TTBS适当稀释的HRP标记山羊抗鼠IgG中孵育,室温振荡40 min,TTBS洗涤3次,四氯萘酚显色。
1.5.2 在植物乳酸杆菌系统的表达 将重组乳酸菌pSIP409-plc接种于5 mL含10 μg/mL Em+抗性的MRS液体培养基中,30 ℃厌氧静置培养过夜。取1 mL接种于20 mL MRS液体培养基中,30 ℃厌氧静止培养至OD600 nm为0.3,在培养基中添加SppIP诱导肽,每隔6 h取一次菌液,取5次。以同样的方法诱导含空质粒pSIP409的乳酸菌培养30 h后作对照。将各个时间诱导收获的菌液均调至OD600 nm为0.6~0.8,取菌液2 mL,12 000 r/min离心10 min,收集菌体。适量PBS悬起菌体后超声裂解,按1.5.1方法进行SDS-PAGE和Western Blot鉴定。
1.6 间接免疫荧光对plc蛋白的表达进行定位 采用IFA法对重组菌pSIP409-plc诱导后目的蛋白的表达进行分析。分别取500 μL经诱导的重组植物乳杆菌和经诱导的含空质粒的pSIP409植物乳杆菌,5 000 r/min离心5 min,菌体沉淀用无菌PBS充分洗涤3次,5 000 r/min离心5 min,弃上清;加入PBS稀释的产气荚膜梭菌plc基因单克隆抗体作为第一抗体,混和均匀,37 ℃水浴作用60 min,5 000 r/min 离心5 min,菌体沉淀用无菌PBS充分洗涤3次,5 000 r/min离心5 min,弃上清;加入PBS稀释的FITC标记羊抗鼠IgG荧光二抗,悬浮混合后37 ℃作用60 min 5 000 r/min 离心5 min,菌体沉淀用无菌PBS洗涤3次,5 000 r/min 离心 5 min,弃上清;菌体沉淀悬浮于400 μL的PBS中,用接种环取适量涂片,自然干燥后,荧光显微镜观察菌体表面荧光反应。
2 结果
2.1 plc基因与pSIP409的重组 将回收纯化的plc基因片段与乳酸杆菌载体片段连接转化至大肠杆菌感受态细胞JM109中,构建重组质粒pSIP409-plc,如图1。采用PstⅠ和XhoⅠ对构建的重组质粒进行酶切,得到约为6 262k bp和2 261 bp的2个片段,如图2,与预计大小相符,表明阳性重组质粒pSIP409-plc构建成功。

图1 pSIP409-plc重组菌的菌液PCR鉴定

图2 重组质粒pSIP409-plc的双酶切鉴定
2.2 重组质粒pSIP409-plc序列测定 测序结果进行BLAST和MegAlign分析,重组质粒pSIP409-plc的核苷酸序列与登录号为HQ585981.1的产气荚膜梭菌plc基因片段的同源性达到99%,与参考序列EU143239.1的核苷酸序列和氨基酸序列同源性均达到99%,共有2处碱基、1处氨基酸发生突变,均为无疑义突变,表明重组质粒pSIP409-plc构建成功。
2.3 重组plc蛋白在大肠杆菌中的诱导表达 重组菌pSIP409-plc诱导后,菌体裂解经SDS-PAGE电泳和NC膜转印后,分别与鼠抗产气荚膜梭菌plc基因单克隆抗体和HRP标记山羊抗小鼠IgG作用,结果表明,重组菌经诱导后,在40 kDa位置出现一条清晰且单一的目的条带,说明蛋白表达正确,如图3。

图3 重组质粒pSIP409-plc在大肠杆菌中的表达
2.4 重组plc蛋白在植物乳杆菌中的诱导表达
2.4.1 pSIP409-plc的电转化 以重组质粒为模板,进行PCR扩增,产物经10 μg/mL琼脂糖凝胶电泳检测,结果见图4,在目的位置1 134 bp处出现明显条带,与预期结果相符。

图4 重组质粒pSIP409-plc PCR鉴定
2.4.2 重组plc蛋白在植物乳酸菌中的表达 菌体沉淀经超声裂解后,裂解上清进行SDS-PAGE后,电转移至NC转移膜上,进行蛋白印迹分析,如图5中可见在目的位置有1条明显的蛋白印迹带,大小为40 kDa,而以含有载体pSIP409的裂解上清作为阴性对照的乳酸菌经蛋白印迹分析后无印迹带,表明所构建的重组质粒pSIP409-plc成功转入植物乳酸菌内表达了plc蛋白,且具有反应原性。

图5 重组质粒pSIP409-plc在乳酸菌中的表达
2.5 表达plc蛋白的重组植物乳酸菌的间接免疫荧光鉴定 重组植物乳酸菌pSIP409-plc/L.plantarum进行IFA试验结果表明,经荧光显微镜检查可见经SppIP诱导后的重组菌分别可以与plc单克隆抗体结合,菌体表面出现明显的黄绿色荧光(图6A),未诱导的重组菌pSIP409-plc/L.plantarum不与plc单克隆抗体结合,菌体表面未发现绿色荧光(图6B)。由此表明,重组植物乳酸菌表达的外源蛋白位于菌体的表面。

图6 免疫荧光鉴定目的蛋白的表达 (40×)
3 讨论
α毒素是几乎所有产气荚膜梭菌都能产生的一种多功能性金属酶,是典型的致死性毒素,近20年来,α毒素被认定是养禽业坏死性肠炎的主要致病因素。α毒素具有磷脂酶C(Phospholipase C,PLC)和鞘磷脂酶(Sphingomyelinase)活性,不仅能水解红细胞、血小板、白细胞、内皮细胞和肌细胞的膜磷脂,导致细胞膜裂解,而且具有其他细胞毒性[6-8],包括出血、坏死[9]和显著的致死性。本试验选择α毒素(plc)基因作为主要免疫抗原基因。参考产气荚膜梭菌plc(序列号为HQ585981.1)基因的核苷酸序列,设计两对引物。同时参考植物乳酸菌载体pSIP409的限制性内切酶位点序列,在上游和下游引物的的5′端插入一个限制性酶切位点和保护性碱基序列,将目的基因与载体pSIP409连接后进行菌液PCR和双酶切鉴定,测序比对结果显示,重组质粒pSIP409-plc的核苷酸序列与登录号为HQ585981.1的产气荚膜梭菌plc基因片段的同源性达到99%,与参考序列产气荚膜梭菌ATCC13124(CP000246.1)的核苷酸序列和氨基酸序列同源性均达到99%,共有2处碱基发生突变,1处氨基酸发生突变,表明重组质粒pSIP409-plc构建成功。
重组蛋白的表达,首先将已构建的重组质粒在大肠杆菌系统进行表达。先将重组质粒转化入E.coilBL21表达菌,鉴定后用SppIP进行诱导表达,Western Blot结果显示,诱导表达的蛋白与产气荚膜梭菌plc单克隆抗体反应分别在40 kDa处出现单一且清晰的条带,证明重组蛋白在大肠杆菌系统中成功表达,氨基酸突变并没有影响所表达蛋白的免疫原性。然后,将重组质粒转化入植物乳酸菌表达系统,虽然将质粒导入乳酸菌表达系统的方法很多,但是普遍存在时间长、效率低、不稳定等特点,所以一般采用操作简单且效率高的电转化法。但是,能影响电转化的因素有很多。首先,要有适当的质粒DNA浓度,浓度过低时DNA分子过少不能产生高转化率,而浓度过高时DNA分子过饱和又不利于转化[10];其次,合理的电场强度,电压过低细胞难以极化使DNA不能进入,而电压过高时细胞会过度损伤导致死亡[11];最后,恰当的脉冲时间,本实验选择Eppendorf细菌酵母电转仪,可以根据所选电压自动调整合适的脉冲时间。经鉴定电转化成功后,使用SppIP进行植物乳酸菌表达系统的诱导,使用Western Blot鉴定后证明重组蛋白在植物乳酸菌中表达成功,间接免疫荧光实验同样证明了蛋白的表达。为重组乳酸菌进行免疫和诱导有效的免疫应答提供了重要的物质基础。试验选取的表达载体pSIP409属pSIPP表达系统,它表达的基因具有可控性,可以避免机体发生免疫耐受[10],但是同时乳酸菌表达系统一直以来存在一个缺点,即表达量低,以后的疫苗研究中可以着重于乳酸菌载体的改造来提高抗原表达量,使乳酸菌的免疫产生更好的免疫效果。
[1] Dibner J J, Richards J D. Antibiotic growth promoters in agriculture: history and mode of action[J]. Poultry Science, 2005, 84(4): 634-643.
[2] Castanon J I. History of the use of antibiotic growth promoters in European poultry feeds[J]. Poultry Science, 2007, 86(11): 2 466- 2 471.
[3] Songer J G, Meer R R. Genotyping of Clostridium perfringens by polymerase chain reaction is a usefui adjunct to diagnosis of clostridial enteric disease in animals[J]. Anaerobe,1996, 2(4): 197-203.
[4] Samuelsson B. Leukotrienes:mediators of immediate hypersensitivity reactions and inflammation[J]. Science,1983,220:568-575.
[5] 郭兴华.益生菌基础与应用[M].北京:北京科学技术出版社,2002.
[6] Elder J M, Miles A A. The action of the lethal toxins of gas gangrene clostridia on capillary permeability[J]. Pathology Bacteriol, 1957, 74: 133-145.
[7] Mollby R. Bacterial toxins and cell membranes[J]. Academic Press, 1978, 367-424.
[8] Smith L. Virulence factors of Clostridium perfringens[J]. Reviews Infectious, 1979, 1: 254-260.
[9] Timoney J F, Gillespie J H, Scott F W. Hagan and Bruner’s microbiology and infectious diseases of domestic animals[M]. Comstock Publishing Associates, 1988.
[10] 秦玉静,金建玲,鲍晓明.影响酿酒酵母电击转化率的条件[J].山东大学学报(理学版),1999,34(2):236-240.
[11] 贾士芳,王荫榆,郭兴华.乳杆菌电转化条件的研究[J].生物工程学报,1998,14(4):429-433.
ConstructionofrecombinantLactobacillusplantarumcontainingplcgeneofClostridiumperfringens
ZHANG Yan1,2, ZHOU Qing-min1, FENG Wan-yu1, XU Xin1, HUANG Jian1, WANG Xin1,2, LI Lan-lan2, ZHENG Xiao-xing2, NING Xiu-yun3, LI Guang-xing2
(1. Heilongjiang Veterinary Science Research Institute, Qiqihar 161006, China;2.College of Veterinary Medicine, Northeast Agricultural University, Harbin 150030, China;3.Animal epidemic prevention station of Nehe, Qiqihar 161300, China)
In this study, according to the intestinal effervescent effect of lactic acid bacteria, the key pathogenic factor α-toxin / phospholipase C was selected as the antigen to construct the plc gene fragment of Clostridium perfringens alpha toxin by removing the signal peptide. The recombinant plasmid pSIP409-plc was constructed by using pSIP409, which was transformed into Escherichia coli BL21 (DE3) competent cells and identified by SppIP induction. Western Blot demonstrated that the recombinant protein was successfully expressed and contained mainly in inclusion bodies. The relative molecular mass of plc recombinant protein was 40 kDa. The recombinant plasmid pSIP409-plc was transformed into Lactobacillus plantarum NC8 cells by PCR and digested with double digestion. Western Blot and indirect immunofluorescence showed that the constructed recombinant Lactobacillus plantar had the ability to induce plc protein secretion and could be used as candidate antigen for mucosal immunization.
Clostridiumperfringens; plc gene ;Lactobacillusplantarum; express
LI Guang-xing
S858.31
A
0529-6005(2017)10-0031-04
2016-07-27
张艳(1987-),研究实习员,硕士,研究方向为基础兽医学,E-mail: zhangyanyan008@163.com
李广兴, E-mail:liguangxing1968@hotmail.com
