低氧调控EIMD后肌细胞膜损伤MAPK机制的探索与验证
2017-12-01黄巧婷曹建民徐玉明
徐 飞,黄巧婷,曹建民,王 平,徐玉明
低氧调控EIMD后肌细胞膜损伤MAPK机制的探索与验证
徐 飞1,黄巧婷2,曹建民2,王 平1,徐玉明1
目的:探索运动性肌损伤(EIMD)后低氧调控肌细胞膜损伤的MAPK机制,并进行验证。方法:健康雄性SD大鼠随机分为对照组、常氧24 h、48 h、72 h组和低氧24 h、48 h、72 h组。大鼠以EIMD运动模型进行间歇性下坡跑离心运动,腹腔注射伊文氏蓝荧光染色剂(EBD),取腓肠肌样本,用激光共聚焦显微镜观察EBD切片和阳性细胞率(PRC)评价膜损伤。用RT-qPCR和Western blot测定MAPK的ERK1/2、JUN、p38和BMK1的mRNA表达、蛋白含量和磷酸化水平。再开展抑制剂实验以确认低氧调控膜损伤MAPK机制中的关键信号通路。结果: EIMD后,低氧与常氧各组均出现明显膜损伤,低氧各组阳性细胞率显著高于常氧各组和对照组(P<0.01)。低氧组ERK1、p38和BMK1通路的mRNA表达、蛋白含量和磷酸化水平显著高于常氧对应组(P<0.05),JNK信号通路蛋白含量和磷酸化水平无显著变化(P>0.05)。抑制剂实验结果表明,ERK1/2和p38抑制剂组的蛋白含量和磷酸化水平无显著变化(P>0.05)。BMK1抑制剂组24 h、48 h的磷酸化水平、阳性细胞率显著低于安慰剂对应组(P<0.001),且与对照组无显著差异(P>0.05)。结论:1)EIMD后低氧明显加剧膜损伤并造成损伤峰值前移。2)低氧调控膜损伤主要通过BMK1通路实现,抑制BMK1磷酸化能阻止低氧对膜损伤的加剧作用。BMK1/ERK5通路是低氧调控EIMD后膜损伤MAPK机制的关键途径。
低氧;运动性肌损伤;肌细胞膜;细胞信号通路;丝裂原活化蛋白激酶
前言
运 动 性 肌 损 伤(exercise-induced muscle damage,EIMD)会导致肌纤维微损伤并伴随延迟性肌肉酸痛(DOMS)症状[40]。高原/低氧引起骨骼肌适应性萎缩和低氧(缺氧)对肌肉代谢[25,32]及细胞生物学功能的影响[25,32]一直是医学和训练学的研究热点,但因机制不明,高原/低氧训练后EIMD的有效恢复手段一直颇有争议。有探索性研究发现,低氧应激会影响骨骼肌细胞肌节外骨架蛋白的完整性[30,39],提示,低氧会影响肌细胞和细胞膜损伤后修复过程。Chen等[14](2016)发现,骨骼肌特异性LKB1基因敲除鼠在跑台运动后肌肉微损伤炎症反应降低,同期伴随丝裂原活化蛋白激酶(Mitogen-activated Protein Kinases,MAPK)活性显著增加,提示MAPK可能参与肌纤维损伤后的修复。Kim等[21](2016)通过培养C2C12骨骼肌细胞证实MAPK参与了肌细胞的修复过程。Gonzalez等[16](2016)和Nicoll等[27](2016)通过人体实验(肌肉活检)证实了Kim等的结论。所以,低氧可能通过MAPK信号通路调控EIMD后肌细胞的修复过程。
细胞外刺激通过MAPK途径将信号转导至胞内及核内而影响细胞增殖、发育、老化及凋亡等生物学反应[20,31]。MAPK通过整合不同受体系统有关的信号和(或)通过核转位激活下游底物而起枢纽作用[20],其主要涉及细胞外信号调节激酶1/2(ERK1/2)、c-Jun氨基末端激酶(JNK)、p38以及大丝裂原活化蛋白激酶1/细胞外信号调节激酶5(BMK1/ERK5)①此通路在文献中有BMK1/ERK5、BMK1和ERK5 3种表述方式,为简练表达并与ERK1/2通路区别,本文采用BMK1表述。但在引用文献内容时,尊重并保留原文献中BMK1/ERK5或ERK5的表述。4条信号通路[20,31]。有研究已发现,大运动量和(或)大强度间歇训练[4,7,16,17]、抗阻运动[13]、耐力训练[6,8,9]均可激活MAPK通路,离体(in vitro)实验也发现,MAPK激活与肌细胞免疫炎症反应有关[14,21,29,32]。但EIMD后是否激活MAPK通路,以及低氧是否通过MAPK通路调节EIMD后肌细胞和膜损伤的修复情况,目前未见报道。一项有价值的研究发现,选择性抑制MAPK家族的MEK1/2信号通路,能通过影响低氧诱导因子-1(HIF-1)而调控IGF-1的浓度和活性[34]。这搭建了研究低氧通过MAPK调控肌细胞生物学功能的桥梁。但MAPK涉及的4条信号通路包含复杂的信号级联反应,若能够明确低氧通过MAPK调控EIMD后肌细胞和细胞膜损伤的具体途径,对于理解低氧调控EIMD的机制、改进高原/低氧训练方法、探索有效恢复手段和提高训练效果均有参考价值。所以,本研究通过大鼠EIMD模型,研究EIMD后低氧对细胞膜通透性的影响,探索低氧调控EIMD膜损伤效果及与MAPK各信号通路的关系。再通过测定抑制MAPK各信号通路对膜损伤的影响,明确MAPK信号通路中有关低氧调控EIMD后膜损伤的机制。
1 材料与方法
1.1 动物饲养与分组
1.1.1 低氧观察实验
56只8周龄雄性SD大鼠,标准啮齿类动物饲料分笼饲养,室温22±2℃,相对湿度30%~60%。自由饮食进水,12/12 h光照/熄灯模拟昼夜交替。大鼠随机分为7组:安静对照组(C),运动后常压常氧(Normoxia)休息24 h组(N24)、48 h组(N48)、72 h组(N72)以及运动后常压低氧(Hypoxia)24 h组(H24)、48 h(H48)、72 h组(H72)。
1.1.2 抑制剂实验
72只8周龄雄性SD大鼠随机分为9组,除空白对照组(B组)外,其余各组注射MAPK各信号通路的抑制剂(Inhibitor,I-)或安慰剂(Placebo,Pl-),每一抑制剂或安慰剂组分为运动后低氧24 h、48 h组(分别为I-ERK 24 h和48 h组、I-BMK1 24 h和48 h组、I-p38 24 h和48 h、Pl-24 h和48 h组)。
1.2 实验标本制备
1.2.1 低氧EIMD动物模型制备
除C组外的各组大鼠在常氧下进行为期4天的适应性跑台训练,待恢复后依据经典的大鼠骨骼肌损伤模型[10],在常压低氧环境(氧浓度为12.7%)进行间歇性下坡跑运动(离心运动)。运动参数:在-16°坡度以26.8 m/min速度运动5 min×10组,组间间歇1 min。
1.2.2 伊文氏蓝(Evans blue dye,EBD)鉴定膜损伤
各组大鼠处死前24 h腹腔注射EBD(Sigma,USA)荧光染色剂,观察膜通透性变化以鉴别损伤模型。EBD注射前经Millex-GP 0.22 µm过滤器(Millipore,Bedford,MA,USA)灭菌,剂量为1 mg EBD/0.1 mL PBS(pH7.4)/10 g体重。预实验结果显示,大鼠运动后细胞膜通透性改变,24 h、48 h尤为明显,成功模拟离心运动导致的骨骼肌损伤。
1.2.3 抑制剂注射
先将抑制剂(Selleck,USA)溶解于配好的10% DMSO中,现配现用。抑制剂各组大鼠运动后即刻进行腹腔注射(安慰剂组注射载体DMSO)。然后置于低氧环境恢复,48 h组在低氧24 h后再注射一次,抑制剂抑制的信号通路和剂量见表1。

表1 本研究MAPK信号通路抑制剂使用情况Table 1 The Usage Discritption of Inhibitors of the MAPK Related Signaling Pathway
1.2.4 取材与处理
用2%的戊巴比妥钠(2.3 mL/kg)腹注麻醉,迅速分离左侧腓肠肌内侧头,留取表层中段肌纤维,切块冻存。再分离右侧腓肠肌,于冰上切取3×3×5 mm3,OCT包埋后用液氮预冷的正己烷(-70℃)速冻,锡纸包裹好后放入液氮,以备制作冷冻切片。
1.3 测试指标与方法
1.3.1 细胞膜完整性
Leica冰冻切片机(CM 1850,Germany)将EBD染色组织块切出6 μm厚度样本,荧光显微镜568 nm检测。激光共聚焦显微镜(Leica sp8,Germany)观察EBD切片,测量左、右、上、下、中部5个视野,用IPP 6.0光密度分析软件(USA)统计EBD阳性率细胞(Positive Ratio of Cells,PRC),鉴别肌纤维细胞膜完整性改变的范围及程度。1.3.2 Western blot(WB)
预冷RIPA蛋白抽提试剂,加入蛋白酶抑制剂(磷酸化蛋白需同时加入磷酸酶抑制剂)。蛋白抽提前加入0.1 mol/L PMSF母液,称取组织重量后加入裂解液,电动匀浆完成后在冰上孵育20 min以13 000 r/min 4℃离心20 min,取上清分装保存待测。用BCA法测定匀浆液蛋白浓度。据目标蛋白的分子量,配制对应浓度分离胶和浓缩胶,样品上样量20 μg/孔进行电泳。湿转法转膜,完成后用丽春红染色剂对膜染色。随后将膜完全浸没于3% BSA-TBST中,室温轻摇30 min,加稀释后的一抗(兔多抗)室温孵育。第2天室温孵育后洗膜,稀释二抗加膜反应后晾干拍照,处理条带并计算IOD值,β-tubulin(鼠单抗)为内参。
1.3.3 实时荧光定量RT-qPCR
RT-qPCR法检测MAPK相关通路核心分子mRNA表达,PCR扩增引物(Invitrogen公司)序列(5’ to 3’):p38上下游引物(115 bp)分别为AGTCCTATCCACGCACCTCA、GTCCCGTTTCCTGCACCAC;BMK1上 下 游 引 物(108 bp)分 别 为TCTCCAGACTGCCCCTTCCACTA、CCAGATGGGAAGTAAGGCAGAAC;JNK上 下 游 引物(114 bp)分 别 为TATGATTTCTAGCCTCTCACCT、TCTATAACCCAAGAGGCACGAC;ERK1上 下 游 引 物(177 bp)分别为CATTGTTCAGGACCTCATGGAGACG、CAGGTGGTGTTGATAAGCAGATTGG;ERK2上 下游 引 物(137 bp)分 别 为TGGAGCTGGACGACTTAC、GACACCGACATCTGAACG;内 参GAPDH上 下 游引 物(138 bp)分 别 为TGGAGTCTACTGGCGTCTT、TGTCATATTTCTCGTGGTTCA。用超纯RNA试剂盒(CWbio,Cat#CW0581)提取组织样本总RNA,取5μL RNA进行1%琼脂糖凝胶电泳检测RNA完整性,DNaseⅠ试剂盒(CWbio,Cat#CW2090)对RNA残留基因组DNA进行消化处理,HiFi-MMLVcDNA第一链合成试剂盒(CWbio,Cat#CW0744)进行反转录,ABI7500型荧光定量PCR仪,2﹣△△CT法进行相对定量分析。
1.4 数据处理
2 结果与分析
2.1 EIMD动物模型鉴定
除C组肌纤维无明显EBD染料侵入外,低氧和常氧组急性离心运动后出现明显EBD阳性纤维(图1A)。低氧各组与常氧对应组之间PRC有显著差异(P<0.01),N48组骨骼肌阳性细胞率(PRC)达峰值(20.50±7.20);而低氧组峰值(21.00±7.69)高于常氧组(P>0.05),峰值出现时间(24 h)①EBD注射时间点为运动后即刻。早于常氧组(48 h)。说明,低氧造成膜损伤时间提前。H72组的PRC停留在H48组水平,显著高于N72组和C组水平,N72组(3.17±1.72)接近C组水平(P>0.01)。

图1 EIMD后低氧暴露对膜损伤的影响Figure 1. Effect of Hypoxia on Sarcolemma Injury after EIMD
2.2 EIMD后低氧加剧膜损伤时MAPK各信号通路基因表达、蛋白含量和磷酸化水平的变化
双因素方差分析结果如表2所示,MAPK各信号通路蛋白含量和磷酸化的Western blot测试结果如图2所示。当交互作用显著时,考察低氧或暴露时间的单一因素对MAPK通路的作用没有意义,故须区分低氧在时间因素的不同水平(24 h、48 h和72 h)作用的大小。结果显示,除p-BMK1外,MAPK各通路相关指标低氧×暴露时间的交互作用不显著,与本实验考察低氧作为主要因素(主效应)影响MAPK各信号通路的研究假设相符。所以,除分析低氧对BMK1磷酸化的影响采用简单效应分析外,其他指标只考察低氧的主效应。

表2 低氧与暴露时间对MAPK信号通路的交互效应Table 2 Interaction of Hypoxia and Exposure Time on MAPK Signaling Pathways

图2 低氧对EIMD后MAPK信号通路核心分子蛋白含量和磷酸化变化 (Western blot结果)Figure 2. Changes of Protein Content and Phosphoylation of MAPK Signal Pathway after EIMD by Western Blot
2.2.1 ERK1/2通路的变化
低氧各组与常氧各组ERK1/2 mRNA表达无显著差异(P>0.05),H24组ERK1蛋白含量显著低于N24组(分别为0.93±0.13和1.26±0.28,P=0.041,图3C),H24组磷酸化水平低于N24组(分别为0.64±0.48和1.53±1.17,P=0.067,图3B),接近统计显著性差异的临界值。ERK2的蛋白含量和磷酸化水平无显著差异(P>0.05,图3D、F)。
2.2.2 JNK通路的变化
H24组JNK的mRNA表达显著低于N24组(分别为0.19±0.19和0.60±0.45,P=0.032),随后低氧和常氧趋于一致。但各组JNK蛋白含量、磷酸化水平均无显著性差异(图4)。
2.2.3 p38通路的变化
H48组p38的mRNA表达显著低于N48组(分别为0.91±0.19和1.15±0.19,P=0.024)。低氧与常氧各组p38蛋白量并无显著差异(P>0.05,图5B),但H24组、H48组p38磷酸化水平低于常氧对应组,接近统计显著性差异临界值(分别为P=0.068,P=0.065,图5C)。

图3 低氧对EIMD后ERK1/2的mRNA、蛋白表达和磷酸化水平的影响Figure 3. The Changes of Gene Expression of MAPK in Four Major Signaling Pathways
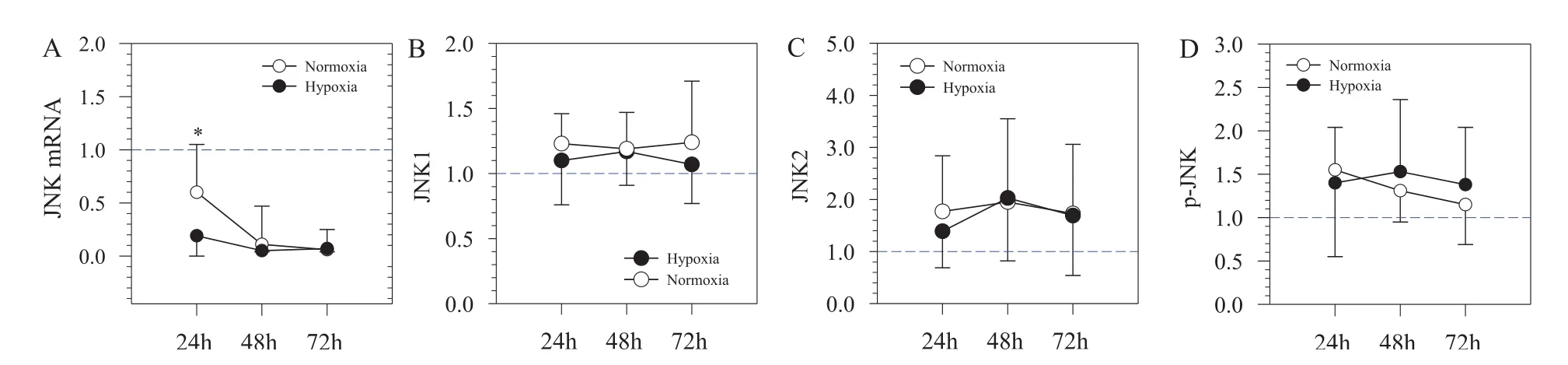
图4 低氧对EIMD后JNK的mRNA、蛋白表达和磷酸化水平的影响Figure 4. Effects of Hypoxia on the Protein Content of MAPK Signal Pathway

图5 低氧对EIMD后p38的mRNA、蛋白表达和磷酸化水平的影响Figure 5. Changes of Phosphorylation of Key Molecules of MAPK Signal Pathway
2.2.4 BMK1/ERK5通路的变化
双因素方差分析发现低氧与暴露时间交互效应显著(P=0.040,表2),所以固定暴露时间的3个水平(24 h、48 h和72 h),分别检验低氧对BMK1的简单效应。结果发现:BMK1的mRNA表达与常氧组无显著差异(P>0.05)。低氧各组p-BMK1低于常氧各组,无统计学意义(P>0.05)。H48组p-BMK1显著 低 于N48组(分别为0.82±0.17和1.43±0.68,P=0.009,图6C)。
2.3 抑制剂对低氧暴露后MAPK各信号通路蛋白含量和磷酸化水平的影响
2.3.1 蛋白含量
抑 制 剂 对ERK1/2、p38和BMK1通 路 的 蛋 白含量均无显著影响(图7A),对BMK1蛋白(分别为1.325±1.764和0.834±0.293,P=0.345)和p38蛋白(分别为0.677±0.430和0.981±0.182,P=0.086)有所抑制,但无统计学意义。

图6 低氧对EIMD后BMK1的mRNA、蛋白表达和磷酸化水平的影响Figure 6. Changes of Phosphorylation of Key Molecules of MAPK Signal Pathway
2.3.2 磷酸化水平
BMK1抑制效果显著,抑制剂组24 h、48 h磷酸化均显著低于安慰剂组(分别为P=0.035,P=0.043,图7A),ERK1/2、p38的磷酸化无显著变化。
2.4 抑制BMK1/ERK5通路对膜损伤的影响
激光共聚焦镜观察到,抑制剂组(I-)和空白对照组(B)肌纤维排列整齐、纹路清晰,无明显EBD染料侵入。安慰剂(Pl-)24 h、48 h组EBD染料侵入明显(图7B)。BMK1通路抑制后膜损伤减轻,说明细胞膜通透性和完整性改变,出现明显膜损伤。阳性细胞率(图7C):Pl-24 h(0.019±0.025)与Pl-48 h组(0.114±0.037)PRC有显著差异(P<0.001);I-24 h(0.016±0.018)和I-48 h(0.009±0.013)组显著低于Pl-24 h(0.194±0.025,P<0.001)和Pl-48 h组(0.194±0.025,P<0.001),I-24 h组和I-48 h组PRC与B组无显著差异。

图7 抑制MAPK各信号通路的效果及其对膜损伤的影响Figure 7. The Effects of Inhibitor on MAPK Signaling Pathways and Its In fl uence on Sarcolemma Injury
3 讨论
3.1 EIMD后低氧加剧膜损伤
已证实离心运动会导致骨骼肌出现微损伤[24,28,33],细胞膜损伤是骨骼肌微损伤的重要标志之一[26]。激光共聚焦显微镜观测到低氧、常氧各组出现明显的EBD阳性纤维(图1A),证实肌细胞膜完整性受到破坏,说明本研究采用的EIMD运动模型造成大鼠肌纤维损伤,与经典研究模型[10]的效果一致。因为,EBD与血清蛋白结合形成的伊文氏蓝-白蛋白复合物是经典示踪剂,在胞内大量出现则表明肌膜完整性受损、肌纤维损伤[18]。PRC结果也证实,EIMD模型造成明显的膜损伤,常氧组膜损伤恢复时程与经典研究证实的离心运动所致肌肉微损伤(EIMD或DOMS)的时程特征一致。但本研究发现,低氧48 h和72 h组仍显著低于常氧组和对照组(图1B),说明低氧显著影响EIMD后膜损伤的恢复、加剧了膜损伤。
3.2 EIMD后低氧加剧膜损伤时MAPK各信号通路变化
3.2.1 ERK1/2通路与膜损伤的关系
ERK1/2对细胞增殖有重要意义[20]。ERK1/2通路中,Raf与Ras等上游分子结合,选择性激活MEK1/2,活化的MEK识别“Thr-X-Thr”模序激活ERK入核后再激活NF-κB和Stat等转录因子,抑制PPAR和EGFR等的磷酸化,使细胞从G0进入G1期[20]。目前,运动激活ERK1/2通路并无争议,但ERK1/2 mRNA表达结果不同,张雪等[9](2010)证实,急性运动和耐力运动都可激活ERK1/2信号通路,但ERK1/2mRNA表达无显著改变。另有研究发现,7周耐力训练使24 h和48 h ERK1/2蛋白量显著增高,ERK2 mRNA表达增加[2]。而低氧对ERK1/2通路的影响尚不明确。本研究发现,低氧组ERK1/2 mRNA无显著变化,但蛋白含量和磷酸化降低,说明EIMD后低氧抑制ERK1/2通路的激活,结合图1低氧加剧膜损伤的证据,认为低氧抑制ERK1/2通路活性与加剧膜损伤之间存在关联(相关而非因果)。Sutton等[34]发现,低氧激活低氧诱导因子-1(HIF-1),通过抑制ERK1/2及其上游激酶MEK1/2活性而下调IGF-1的表达和活性,提示,该信号通路参与肌细胞的增殖。分析认为,本研究和Sutton等的研究中,低氧激活HIF-1并无争议,都发现低氧抑制ERK1/2通路的活性,不同的是,本研究发现ERK1/2抑制与膜损伤有关,而Sutton等证实ERK1/2活性降低影响了IGF-1,所以,两项研究关于低氧抑制ERK1/2通路活性的结果是一致的,但去向不同。所以需要更有力的证据来确认ERK1/2活性降低与膜损伤的关系。
3.2.2 JNK通路与膜损伤的关系
JNK信号通路是细胞正常与疾病状态的重要调节靶点[20],MAPKJNK的磷酸化水平是关注的焦点。有研究发现,耐力训练诱导小鼠心脏重塑过程中JNK mRNA在0~7天内无显著变化,JNK蛋白含量在72 h后显著降低[8]。其实Boppart等[11]早期就已发现一次性离心运动后即刻JNK蛋白活性改变,运动后6 h恢复至安静水平,但他们也明确指出,其研究只能证实JNK蛋白活性改变与离心运动有关。虽然上述研究的运动刺激和肌肉类型(心肌[8]和骨骼肌[11])不同,但JNK信号通路作用的机制相同。Boppart等指出,JNK的磷酸化水平是更有说服力的指标[11]。在此基础上,曹师承等[1](2009)研究不同时长运动影响胰岛素受体信号改变的MAPK机制,发现运动后24 h JNK mRNA表达显著增加,但24 h和48 h JNK的蛋白总量和磷酸化无显著差异。本研究中,常氧组JNK的结果证实了Boppart等[11]和曹师承等[1]的研究发现(常氧和低氧各组JNK mRNA、蛋白含量和磷酸化与对照组相比,图4),但低氧组JNK mRNA表达显著增加、蛋白含量和磷酸化水平并无显著差异,说明JNK通路并非低氧调控EIMD膜损伤的主要通路。因为JNK磷酸化是激活其直接上游激酶MKK4/7的关键[20],但本研究未发现低氧对JNK磷酸化有显著抑制或激活效应,而JNK mRNA表达显著增加有可能与其他因素(如miRNA-350表达增加[8])以不完全互补形式结合从而抑制JNK蛋白表达有关[15]。
3.2.3 p38通路与膜损伤的关系
已证实骨骼肌的适应性与p38/NF-κB信号通路有关[4,20]。本研究发现,低氧对p38 mRNA的影响与膜损伤后PRC的变化趋势一致(图5A、图1B)。因为p38是肌细胞分化过程的重要调节剂,阻断p38α/β后,肌肉特异性基因表达和肌细胞融入肌管过程均受阻[4]。急性运动后p38短期内被激活、24 h即恢复正常[35],本研究中,常氧运动p38mRNA与磷酸化变化与前人的结果[4,35]较为一致,而低氧显著抑制p38 mRNA表达和磷酸化激活,抑制谷值出现在EIMD后48 h(图5C),提示,p38通路与膜损伤关系密切。王今越等[4]发现,大强度运动后腓肠肌质量丢失,p38蛋白含量无显著变化,但p38磷酸化显著增加,这从另一角度支持了本研究结果。王今越等采用的大强度运动与本研究采用的离心运动模型均能导致膜损伤,因为运动强度是膜损伤的重要诱因(大强度离心运动更甚)[10,11,22],且其研究与本研究所取样的肌肉(腓肠肌)、测试方法(WB、RT-qPCR)相同,故笔者认为两项研究有关p38的结果可以相互印证。综上,本研究观察到低氧加剧膜损伤(图1)的同时p38磷酸化受到显著抑制,提示,p38 MAPK通路可能是低氧调控EIMD后膜损伤的重要途径。
但需注意的是:1)双因素方差分析结果显示p38通路活性改变并无显著的低氧×时间的交互效应(表2),说明p38蛋白含量显著降低(图5B)、p38磷酸化下降接近显著性差异临界值(图5C)是低氧主效应所致。综合考虑样本量(n=8)和随机误差等可能的影响,并参考前人研究[20](p38有4类亚型,无法确认测得p38蛋白含量和磷酸化的变化能涵盖其4类亚型),笔者认为尚不能完全确认EIMD后低氧加剧膜损伤与p38信号通路无关。2)MAPK通路级联信号中,虽然JNK和p38通路的激活因素和生物学作用近似,但二者的上游激酶[20]和调节机制[41]均有不同,多项动物[12,22]和人体[35,38]研究以及综述结论[36]表明,运动后p-JNK和p-p38变化趋势并不相同。本研究中,除低氧组JNK mRNA表达高于常氧组外(图4A),p38、p-p38和双因素方差分析结果均显示JNK与低氧调控EIMD膜损伤无直接相关,所以,后续抑制剂实验纳入p38而不纳入JNK通路进行验证。
3.2.4 BMK1/ERK5通路与膜损伤的关系
BMK1/ERK5是MAPK家族最晚发现的一条非典型信号通路,相关研究较少。但此通路的酶作用底物是转录因子肌细胞增强因子(MEF2C),MEF2C蛋白与BMK1碳端结合,其转录活性在被磷酸化后显著增强[29]。Li等[23](2016)研究发现,胰岛素样生长因子(IGF)和机械生长因子(MGF)显著增加的平滑肌肥大者的BMK1 mRNA呈高表达,证实早期综述中指出的ERK5是MAPK途径中运动诱导骨骼肌基因表达调节机制重要组成部分的观点[37]。本研究发现,EIMD后大鼠BMK1 mRNA显著下调(低氧和常氧组运动后48 h、72 h均显著低于对照组基线值),低氧组BMK1蛋白量下降、磷酸化水平显著低于常氧组(图6),说明低氧抑制BMK1通路的活性,但仍需要进一步确认。比较好的方案是通过抑制或激活BMK1的活性,再观察其信号通路级联反应变化。因为蛋白磷酸化(包括脱磷酸化)在细胞信号转导过程中对细胞能感受、放大和整合外界信号、识别并结合受体等方面起更关键的作用[6,20]。Luo等[25](2016)指出,MAPK的4条信号通路对低氧/缺血性肾病(Hypoxic/Ischemic Nephropathy)病理反应有所不同,新近研究证实,ERK5信号通路在肿瘤侵袭和转移过程中起传递和放大信号的作用[25,32]。结合低氧加剧膜损伤时BMK1活性受抑制的初步证据,提示,BMK1通路可能是低氧调节EIMD后膜损伤的重要途径。
综上,本实验结果初步证实:低氧使大鼠EIMD后阳性细胞率显著升高,加剧细胞膜损伤并使峰值前移。MAPK主要信号通路中,JNK通路与膜损伤无直接相关,低氧可能通过ERK1/2、p38和BMK1/ERK5通路调控EIMD后的膜损伤。所以,本研究在此基础上开展抑制剂实验以验证低氧调控膜损伤的确切机制。
3.3 抑制剂对低氧暴露后MAPK各信号通路蛋白含量和磷酸化水平的影响
已证实低氧及多种生长因子可激活BMK1/ERK5通路[19,31],但通过抑制剂验证此通路对肌纤维和细胞膜损伤机制的研究尚未见报道。He等[19](2016)发现,低氧诱导p38、ERK1/2磷酸化显著增强、刺激干细胞增值,而抑制剂能显著降低磷酸化水平和干细胞增值,说明低氧通过MAPK信号通路调控干细胞增殖。本研究亦用同样的理路:发现EIMD后低氧加剧细胞膜损伤,同时观察到低氧显著抑制ERK1/2、p38和BMK1通路活性。抑制剂实验结果表明,MAPK下3条通路中只有BMK1通路呈现出显著的抑制效果(BMK1磷酸化水平显著降低,图6C)。新近研究证实,运动刺激雄激素分泌和骨骼肌蛋白合成伴随MAPK通路蛋白表达和磷酸化水平均增加,其中磷酸化水平是关键[6]。本研究也发现BMK1磷酸化是抑制剂起作用的关键,提示,BMK1磷酸化是低氧加剧膜损伤的关键。因为磷酸化的主要作用是变构蛋白以激活蛋白的活力(酶活力),而磷酸化除了变构及激活作用外,还能够与其他蛋白形成蛋白复合体结构基因。蛋白复合体形成后会进一步促进蛋白磷酸化,循环并扩增刺激细胞的信号,最终入核发挥生物学功能[3,5]。所以,BMK1可能是低氧调控EIMD后MAPK膜损伤机制的关键信号通路,但仍需验证抑制BMK1通路对膜损伤的影响,才能确认BMK1的作用。
需注意的是,BMK1和p38蛋白含量降低虽无统计学意义,但统计结果接近统计显著性临界值(P=0.086,图7A)。虽然本研究排除p38通路是低氧调控EIMD后MAPK膜损伤机制的关键信号通路,但笔者认为需谨慎看待此结果。因p38有α、β1/2、γ、δ 4类亚型,本研究选用了针对p38最广谱的抑制剂Losmapimod,该抑制剂能有效抑制分布最广的p38 α和β两种亚型(目前还没有能涵盖p38所有亚型的抑制剂)。所以,虽然可能性较小,但本实验p38的结果理论上仍存在假阳性错误的可能。此外,实验中大鼠需注射抑制剂和EBD(48 h组注射2次,表1),致抑制剂用量和抑制效应受限。笔者预实验曾尝试梯度增加剂量,但大鼠死亡率过高,无法完成实验。理论上而言,这也可能对抑制剂效应有影响。所以,将来的研究需进一步验证并确认p38 MAPK调控膜损伤的效果。
3.4 抑制BMK1/ERK5通路对膜损伤的影响
抑制BMK1后,EBD切片结果显示,抑制剂组(I-)和空白对照组(B)肌纤维排列整齐、肌细胞无明显EBD染料侵入,而安慰剂组EBD侵入明显(图7B),说明抑制BMK1减轻了膜损伤。安慰剂组PRC显著高于抑制剂组和对照组(抑制剂组PRC与B组相当,P<0.05,图7C),说明未抑制BMK1的安慰剂组膜的通透性和完整性改变,膜损伤程度显著高于BMK1抑制剂组。这不仅印证了图1的研究结果,还证实BMK1通路活性改变与低氧加剧膜损伤直接相关。分析认为,BMK1/ERK5通路对应MAPK家族有3个对应顺序激活成分,其中,MEKK2/3被G蛋白偶联受体激活后再激活MEK5,MEK5是BMK1/ERK5唯一的特异性上游激酶[20]。本实验所用抑制剂BIX02188是MEK5的选择性抑制剂、还同时抑制ERK5催化活性,对MEK1/2,ERK2和JNK2均无抑制性,能针对性地抑制BMK1通路活性。PRC结果证实,抑制剂主要通过抑制BMK1磷酸化(图7A)而显著降低阳性细胞率。目前尚未见低氧调控ERK5与肌细胞膜损伤的研究,仅Rovida等[32]发现,沉默RNA技术(siRNA)敲减ERK5后,抑制ERK5活性能限制肝癌细胞增值并增加细胞在G0/G1期比例,且沉默ERK5能阻止低氧诱导的细胞迁移和细胞骨架重塑。虽然此研究与本研究不直接相关,但低氧抑制ERK5对细胞的调节功能与本研究发现的低氧抑制ERK5活性的效应类似(图6)。本研究证实,抑制BMK1/ERK5通路活性可阻止EIMD后低氧对膜损伤的加剧作用,也提示,此通路是EIMD后低氧调控膜损伤的关键机制。另外,目前关于抑制ERK5活性的研究多是癌细胞有关的离体实验,用以确认ERK5的生物学功能并作为新的治疗和药物靶标[14,21,29,32],结论已比较明确。本研究开展的在体抑制剂研究,保留了体内神经、内分泌和免疫系统的综合调控作用,更适于考察运动、低氧条件下BMK1/ERK5通路的作用机制。
4 结论
低氧导致大鼠EIMD后阳性细胞率显著升高,造成细胞膜损伤加剧和峰值前移。抑制BMK1/ERK5通路可阻止低氧对膜损伤的加剧作用,说明此通路是低氧调控EIMD后膜损伤的关键机制。
[1] 曹师承,孙黎光,赵刚,等. 运动干预对大鼠骨骼肌JNK磷酸化与表达的影响[J]. 中国应用生理学杂志,2009,25(1):103-106.
[2] 曹师承,孙黎光,赵刚,等. 耐力运动对大鼠骨骼肌ERK1/2活性的影响[J]. 中国应用生理学杂志,2007,23(3):351-354.
[3] 孙超,刘景生,彭雪贤. 信号转导与人类疾病[M]. 北京:化学工业出版社,2006:84-87.
[4] 王今越,丁树哲,王小虹,等. p38、NF-κB、IL-6在长期大强度运动诱导大鼠骨骼肌发生中的作用[J]. 体育科学,2010,30(2):75-82.
[5] 王金发. 细胞生物学[M]. 北京:科学出版社,2003:213-218.
[6] 王洋,佟钧,张忍发,等. MAPK信号通路在雄激素和运动对大鼠骨骼肌蛋白合成中的作用[J]. 昆明医科大学学报,2016,37(1):60-64.
[7] 吴迎,曾凡星,李奕,等. 长期不同负荷运动对心肌MAPK信号通路的影响[J]. 中国体育科技,2013,49(6):94-99.
[8] 翟帅,陈佩林. 运动心脏重塑过程中miRNA-350/JNK信号通路的动态变化[J]. 体育科学,2014,34(5):9-14.
[9] 张雪,丁树哲. 耐力训练对SD大鼠氧化应激及MAPKERK1/2的影响[J]. 体育科学,2010,30(5):49-55.
[10] ARMSTRONG R B,OGILVIE R W,SCHWANE J A. Eccentric exercise-induced injury to rat skeletal muscle[J]. J Appl Physiol Respir Environ Exerc Physiol,1983,54(1):80-93.
[11] BOPPART M D,ARONSON D,GIBSON L,et al. Eccentric exercise markedly increases c-Jun NH(2)-terminal kinase activity in human skeletal muscle[J]. J Appl Physiol (1985),1999,87(5):1668-1673.
[12] BOPPART M D,ASP S,WOJTASZEWSKI J F,et al. Marathon running transiently increases c-Jun NH2-terminal kinase and p38 activities in human skeletal muscle[J]. J Physiol,2000,526(Pt 3):663-669.
[13] BROWN J L,ROSA-CALDWELL M E,LEE D E,et al.PGC-1alpha4 gene expression is suppressed by the IL-6-MEKERK 1/2 MAPK signalling axis and altered by resistance exercise,obesity and muscle injury[J]. Acta Physiol (Oxf),2017,220(2):275-288.
[14] CHEN T,MOORE T M,EBBERT M T,et al. Liver kinase B1 inhibits the expression of inflammation-related genes postcontraction in skeletal muscle[J]. J Appl Physiol (1985),2016,120(8):876-888.
[15] GE Y,PAN S,GUAN D,et al. MicroRNA-350 induces pathological heart hypertrophy by repressing both p38 and JNK pathways[J].Biochim Biophys Acta,2013,1832(1):1-10.
[16] GONZALEZ A,HOFFMAN J R,TOWNSEND J R,et al.MAPK signaling following high volume and high intensity resistance exercise protocols in trained men[J]. Med Sci Sports Exerc,2016,48(5 Suppl 1):17.
[17] GONZALEZ A M,HOFFMAN J R,TOWNSEND J R,et al.Intramuscular MAPK signaling following high volume and high intensity resistance exercise protocols in trained men[J]. Eur J Appl Physiol,2016,116(9):1663-1670.
[18] HAMER P W,MCGEACHIE J M,DAVIES M J,et al. Evans Blue Dye as an in vivo marker of myo fi bre damage:Optimising parameters for detecting initial myofibre membrane permeability[J].J Anat,2002,200(Pt 1):69-79.
[19] HE Y,JIAN C X,ZHANG H Y,et al. Hypoxia enhances periodontal ligament stem cell proliferation via the MAPK signaling pathway[J]. Genet Mol Res,2016,15(4):1-10.
[20] KATO Y,TAPPING R I,HUANG S,et al. Bmk1/Erk5 is required for cell proliferation induced by epidermal growth factor[J].Nat,1998,395(6703):713-716.
[21] KIM J S,LEE Y H,CHANG Y U,et al. PPARgamma regulates inflammatory reaction by inhibiting the MAPK/NF-kappaB pathway in C2C12 skeletal muscle cells[J]. J Physiol Biochem,2017,73(1):49-57.
[22] LEE J S,BRUCE C R,SPURRELL B E,et al. Effect of training on activation of extracellular signal-regulated kinase 1/2 and p38 mitogen-activated protein kinase pathways in rat soleus muscle[J].Clin Exp Pharmacol Physiol,2002,29(8):655-660.
[23] LI C,VU K,HAZELGROVE K,et al. Increased IGF-IEc expression and mechano-growth factor production in intestinal muscle of fibrostenotic Crohn’s disease and smooth muscle hypertrophy[J].Am J Physiol Gastr L,2015,309(11):G888-899.
[24] LIEBER R L,THORNELL L E,FRIDEN J. Muscle cytoskeletal disruption occurs within the fi rst 15 min of cyclic eccentric contraction[J]. J Appl Physiol,(1985). 1996,80(1):278-284.
[25] LUO F,SHI J,SHI Q,et al. Mitogen-activated protein kinases and hypoxic/Ischemic nephropathy[J]. Cell Physiol Biochem,2016,39(3):1051-1067.
[26] MCNEIL P L,KHAKEE R. Disruptions of muscle fi ber plasma membranes. Role in exercise-induced damage[J]. Am J Pathol,1992,140(5):1097-1109.
[27] NICOLL J X,FRY A C,GALPIN A J,et al. Changes in resting mitogen-activated protein kinases following resistance exercise overreaching and overtraining[J]. Eur J Appl Physiol,2016,116(11-12):2401-2413.
[28] NOSAKA K,CLARKSON P M. Muscle damage following repeated bouts of high force eccentric exercise[J]. Med Sci Sports Exerc,1995,27(9):1263-1269.
[29] QIU J,ZHENG Y,HU J,et al. Biomechanical regulation of vascular smooth muscle cell functions:From in vitro to in vivo understanding[J]. J R Soc Interface,2014,11(90):2013-2052.
[30] RIZO-ROCA D,SANTOS-ALVES E,RIOS-KRISTJANSSON JG,et al. Intermittent hypoxia increases mitochondrial dynamics and biogenesis after eccentric exercise-induced muscle damage in trained rats[J]. Med Sci Sports Exerc,2016,48(5 Suppl 1):899-900.
[31] ROBERTS O L,HOLMES K,MULLER J,et al. ERK5 and the regulation of endothelial cell function[J]. Biochem Soc Trans,2009,37(Pt 6):1254-1259.
[32] ROVIDA E,DI MAIRA G,TUSA I,et al. The mitogen-activated protein kinase ERK5 regulates the development and growth of hepatocellular carcinoma[J]. Gut,2015,64(9):1454-1465.
[33] STAUBER W T,KNACK K K,MILLER G R,et al. Fibrosis and intercellular collagen connections from four weeks of muscle strains[J]. Muscle Nerve,1996,19(4):423-430.
[34] SUTTON K M,HAYAT S,CHAU N M,et al. Selective inhibition of MEK1/2 reveals a differential requirement for ERK1/2 signalling in the regulation of HIF-1 in response to hypoxia and IGF-1[J]. Oncogene,2007,26(27):3920-3929.
[35] VAN GINNEKEN M M,DE GRAAF-ROELFSEMA E,KEIZER H A,et al. Effect of exercise on activation of the p38 mitogen-activated protein kinase pathway,c-Jun NH2 terminal kinase,and heat shock protein 27 in equine skeletal muscle[J]. Am J Vet Res,2006,67(5):837-844.
[36] WAGNER E F,NEBREDA A R. Signal integration by JNK and p38 MAPK pathways in cancer development[J]. Nat Rev Cancer,2009,9(8):537-549.
[37] WIDEGREN U,RYDER J W,ZIERATH J R. Mitogen-activated protein kinase signal transduction in skeletal muscle:Effects of exercise and muscle contraction[J]. Acta Physiol Scand,2001,172(3):227-238.
[38] WILLIAMSON D,GALLAGHER P,HARBER M,et al. Mitogen-activated protein kinase (MAPK) pathway activation:Effects of age and acute exercise on human skeletal muscle[J]. J Physiol,2003,547(Pt 3):977-987.
[39] XU Y M,LI J P,WANG R Y. Changes of dystrophin and desmin in rat gastrocnemius under micro-damage induced by hypoxia[J].Acta Physiol Sin,2010,62(4):339-348.
[40] YANAGISAWA O,SAKUMA J,KAWAKAMI Y,et al. Effect of exercise-induced muscle damage on muscle hardness evaluated by ultrasound real-time tissue elastography[J]. Springerplus,2015,4:308.
[41] ZBINDEN-FONCEA H,RAYMACKERS J M,DELDICQUE L,et al. TLR2 and TLR4 activate p38 MAPK and JNK during endurance exercise in skeletal muscle[J]. Med Sci Sports Exerc,2012,44(8):1463-1472.
Exploration and Veri fi cation of MAPK Mechanism of Hypoxia Regulates Sarcolemma Injury after EIMD
XU Fei1,HUANG Qiao-ting2,CAO Jian-min2,WANG Ping1,XU Yu-ming1
Objective:To investigate and verify the effects of hypoxia on sarcolemma injury,and regulated mechanism by mitogen-activated protein kinases (MAPK) after exercise-induced muscle Damage (EIMD). Methods:The male SD rats were randomly divided into control group,normoxia (24,48 and 72h group) and hypoxia group (24,48 and 72h group). Rats were experienced intermittent downhill running according to EIMD model. And Rats were treated with intraperitoneal injection of Evans blue dye (EBD) after downhill running. Gastrocnemius muscle sample was isolated quickly and prepared to analyze. The positive ratio of cells (PRC) was observed by fl uorescence microscope.To explore the hypoxia regulating mechanism of MAPK signal pathways in sarcolemma injury after EIMD,the mRNA,protein content and phosphylation of ERK1/2,JUN,p38 and BMK1 were tested by RT-qPCR and Western blot. Subsequently,inhibitor experiment was carried out so as to con fi rm the sarcolemma injury regulation mechanism of MAPK signal pathways in hypoxia.. Results:After EIMD,hypoxia and normoxia groups suffered a signi fi cant sarcolemma injury. The PRC showed a signi fi cant difference between hypoxia groups and normoxia groups (P<0.01). The mRNA,protein expression and phosphorylation of ERK1,p38 and BMK1 in hypoxia groups were signi fi cantly higher than those in normoxia groups (P<0.05). In addition,protein expression and phosphorylation of JNK had no signi fi cant change (P>0.05). The results of inhibitor experiment showed no signi fi cant changes of phosphorylation and PRC in inhibitor group (P>0.05). However,phosphorylation and PRC in inhibitor 24 h and 48 h BMK1 groups were signi fi cantly lower than placebo group (P<0.001).And there were no signi fi cant difference between BMK1 inhibitor groups and placebo group (P>0.05).Conclusions:1) The hypoxia exacerbates sarcolemma injury and causes the peak value shift forward after EIMD. 2) Inhibition of BMK1 phosphorylation can prevent sarcolemma injury. BMK1/ERK5 is the key signal pathway of MAPK mechanism in hypoxia regulates sarcolemma injury after EIMD.
hypoxia;exercise-induced muscle damage (EIMD);sarcolemma injury;cell signal pathway;mitogen-activated protein kinase (MAPK)
1000-677X(2017)11-0063-09
10. 16469/j. css. 201711008
G804.7
A
2016-12-15;
2017-11-07
浙江省自然科学基金面上项目(LY18C110002);国家自然科学基金资助项目(31271276);杭州市社科优秀青年人才培育计划资助项目(2017RCZX40)。
徐飞,男,副教授,博士,主要研究方向为低氧生理学,运动技能学习的神经生理机制,E-mail:feixueka@qq.com;曹建民,男,教授,博士,主要研究方向为运动生物化学、运动营养学;徐玉明,男,教授,博士,主要研究方向为低氧生理学,E-mail:xuyuming110@126.com。
1.杭州师范大学 体育与健康学院,浙江 杭州 310036;2.北京体育大学,北京 100084
1.Hangzhou Normal University,Hangzhou 311136,China;2.Beijing Sport University,Beijing 100084,China.
