运动性心脏重塑:microRNA的调节
2017-12-01王世强饶志坚黄晓丽王国军
王世强,常 芸,饶志坚,黄晓丽,王国军
运动性心脏重塑:microRNA的调节
王世强1,常 芸2,饶志坚2,黄晓丽1,王国军1
长期适宜强度的运动训练可诱导心脏重塑,主要表现为促进心肌细胞肥大和增殖、细胞存活、心肌血管再生、抑制心肌间质纤维化等一系列结构重塑,心脏产生适应性增大。虽已有较多研究探讨运动性心脏重塑的发生机制,但其至今尚不十分清楚。近年,研究人员通过基因芯片技术获得了运动性心脏重塑发生过程miRNA的表达图谱,部分研究通过功能获得和缺失方法进一步确认了关键miRNA,为研究运动性心脏重塑的调控机制提供了新的视角。另外,miRNA在运动性心脏重塑和病理性心脏重塑发生过程中表现出明显不同的变化特点,为运动性心脏重塑属生理性而非病理性重塑的阐释提供了新的证据。深入分析miRNA在运动性心脏重塑过程中的变化规律和作用机制,可为应用miRNA预防和治疗心脏疾病提供新的方法和策略。
运动;心脏重塑;细胞肥大;微小RNA
前言
心脏重塑是心脏受到生理或病理刺激而引起细胞和分子层面发生一系列变化的结果,表现为心脏体积、形状和功能的改变,有生理性心脏重塑和病理性心脏重塑两种类型。生理性心脏重塑主要由运动或妊娠诱导的心脏适度肥大,是心脏产生的适应性变化[66]。运动性心脏重塑是心脏对长期运动产生的适应性变化,适宜强度的有氧运动诱导的心脏重塑主要表现为生理性心肌肥大,同时伴随细胞凋亡降低、细胞间质重塑和心脏血管再生等,是一种生理性结构重塑,促进了心脏功能的提高,有利于心脏健康。与运动性心脏重塑明显不同,由疾病导致的病理性心肌重塑结构改变虽有心脏体积的增加,但具有明显的细胞死亡和间质纤维化,功能改变则表现为心肌舒缩功能降低,心肌顺应性下降[30]。尽管长期超负荷运动可增加心血管疾病的风险,使心脏具有部分病理性心脏肥大的特征。但长期规律适宜强度的运动诱导的心脏重塑不仅能促进正常人群的心脏健康,降低心脏疾病的发生风险,还能有效抑制衰老、心肌梗死和糖尿病导致的心脏病理性变化,改善心脏病患者的心肌功能[6,34,38]。既往研究认为,心钠素、胰岛素样生长因子(IGF-1)、血管紧张素和儿茶酚胺等神经-内分泌激素在运动性心脏肥大过程中扮演重要角色[1]。但是,运动性心脏重塑的发生机制尚未被完全阐明,关于运动性心脏重塑发生机制的研究是当今运动科学领域的前沿课题之一。
MicroRNA(miRNA,微小RNA)的发现为研究运动性心脏重塑的发生机制提供了新的视角。近年研究发现,运动通过上调或下调心肌某些miRNA参与调节心肌细胞肥大和增殖、心血管再生、心肌间质重塑等过程,诱导心脏肥大的发生。在运动性心脏重塑动物模型中发现, miRNA-29、miRNA-30、miRNA-222、miRNA-17、miRNA-126、miRNA-208、miRNA-499等多个miRNA表现出明显的变化,一些研究通过功能获得和缺失方法进一步确认了miRNA的调节途径。对比分析发现,在运动性和病理性心肌重塑心脏模型中,某些miRNA表现出不同的变化趋势,这也为阐释两种不同的心脏重塑调节机制提供了新的证据。在心脏疾病模型中研究发现,运动能通过调控相关miRNA的表达,促进心肌细胞增殖、抑制心肌纤维化,减缓病理性心脏重塑导致的心脏功能降低。miRNA已成为治疗心血管疾病潜在靶点,具有广泛的应用前景。本文就miRNA在运动性心脏重塑调控中的作用及其在运动诱导的心肌保护效应进行综述。
1 miRNA概述
1.1 miRNA的发现和生物学特征
miRNA是指长度大约为22个核苷酸的内源性非编码单链RNA。1993年,Lee等[43]在研究秀丽隐杆线虫时发现一个可以时序性调控其生长发育的小分子非编码RNA,被命名为Lin-4,这是第1个被发现的miRNA。当时研究人员并没有意识到miRNA的重要性,认为其可能是秀丽隐杆线虫所特有的。直到7年以后人们发现了另外一个和Lin-4具有类似结构的小分子Let-7,由于其广泛存在于多个物种体内,人们才逐渐认识到miRNA的重要性。2001年,不同国家的研究人员在线虫、果蝇和人体中均发现了近百个类似的小分子RNA,国际统一将其命名为miRNA[62]。此后的十几年中,研究人员在不同的物种中发现了数以万计的miRNA。由于miRNA在多种生理和病理的发生过程中具有重要调节作用,miRNA受到了广泛的关注。最新的miRBase 21.0数据库共收录了223物种28 645条发夹前体序列,35 828条成熟的miRNA。其中,人成熟的miRNA新增至2 581条,大鼠成熟的miRNA增至766条,小鼠成熟的miRNA增至1 917条(数据来源于miRBase Release 21.0:2014.06. http://www.mirbase.org/)。
研究显示,miRNA虽然只占人体基因数量的1%~3%,但据推测其可调控30%~50%的人类蛋白质编码基因,在细胞增殖、分化和凋亡等过程中具有调节作用[33]。miRNA的生物学特征主要表现为:高度保守性、时序特异性和组织特异性。1)高度保守性。miRNA序列结构在各个物种间具有高度的进化保守性,这也提示,在不同的物种之间,具有相同的miRNA调控机制;2)时序特异性。研究表明,多数miRNA具有时序表达特异性。在机体发育的不同阶段,miRNA呈现出不同水平的表达;3)组织特异性。研究显示,部分miRNA在一些组织中表达,而在其他的组织中不表达。也有一些miRNA广泛的存在于不同的组织中[14]。
1.2 miRNA的生物合成和作用机制
大多数编码miRNA的基因以单拷贝、多拷贝或基因簇等形式存在于基因组中。与其他形式的RNA转录一样,编码miRNA的基因在核糖核酸聚合酶Ⅱ(RNA polymerase,RNA Pol Ⅱ)的作用下,转录生成长度约为300~1 000碱基的具有发夹结构的初始miRNA,即Pri-miRNA。在Drosha酶和DGCR8微处理复合物的作用下,Pri-miRNA进一步生成含有50~80个碱基的Pre-miRNA。Pre-miRNA通过输出蛋白5(exportin-5)被运输到胞浆中,在Dicer核酸酶的作用下,被剪切成约22个核苷酸长度的成熟双链miRNA。随后,双链miRNA在Dicer和TRBP的作用下,解螺旋为两条成熟的单链miRNA。其中一条链被降解,另一条链则和RNA诱导的沉默复合物(RNA-induced silencing complex,RISC)结合组成miRNA效应器复合物,即miRISC复合物,即成熟的miRNA[57](图1)。miRISC复合物通过碱基配对结合目的mRNA的3’非翻译区(3’-UTR),当其完全配对时,起到降解mRNA的作用,而当其和mRNA未完成配对时,则抑制目的mRNA的翻译,抑制的程度和碱基互补的程度相关。也正因为miRNA这种不严格的配对,才造成同1个miRNA可以调节若干个基因的表达、同一个靶基因可能受到不同的miRNA的调节的现象[12]。
2 miRNA在心脏中的特异性表达
miRNA在心血管发育和疾病发生过程中具有重要调节作用。研究证实,特异性剔除心肌miRNA合成关键酶Dicer后,发现心肌收缩蛋白异常表达,肌小节紊乱排列,出现扩张型心肌病、自发性心肌重塑和进行性心脏衰竭,表明miRNA对维持心血管的稳态具有关键作用[18,23]。研究证实,miRNA具有组织表达特异性,在心肌组织中表达峰度较高的miRNA主要有:1)促进心肌肥大的miRNA,主 要 包 括miRNA-21、miRNA-130a、miRNA-146a、miRNA-208、miRNA-222、miRNA-499等;2)抑制心肌肥大的miRNA,主要包括miRNA-1和miRNA-133a等。其中,在心肌和骨骼肌中呈特异性表达的有miRNA-1、miRNA-133a、miRNA-208和miRNA-499,被称为 “myomiRs”[41]。最新研究通过观察正常生理状态下的人心肌miRNA的表达谱,发现438种心肌miRNA中,左心室miRNA-1的表达峰度最高,占比为26%。而miRNA-208的含量占比虽然较小,但是其具有明显的心房和心室表达差异,miRNA-208a主要表达在心房而miRNA-208b则主要在心室中表达[40]。目前,关于这些miRNA,特别是心肌特异性的miRNA的研究较多,在各种疾病导致的病理性心肌重塑过程中的作用较为明确。
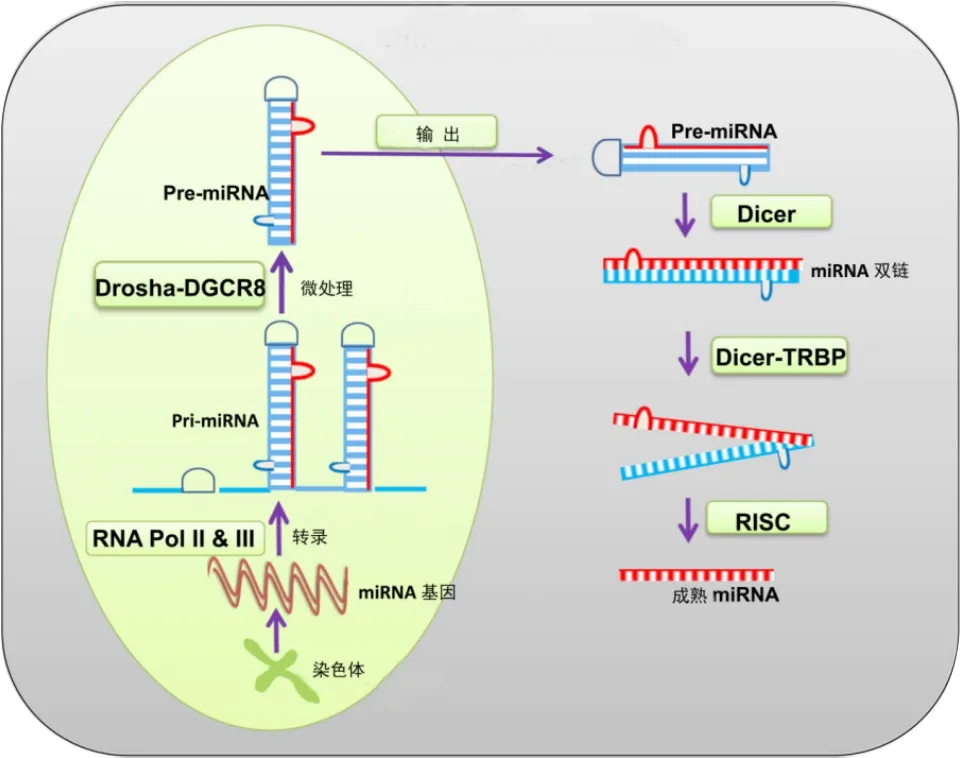
图1 miRNA的生物合成过程示意图Figure 1. Schematic Diagram of miRNA Biosynthesis
3 循环miRNA与运动性心脏重塑
除了在组织中表达,miRNA还能游离于细胞之外,组织中的miRNA可被释放进入血液循环中。循环中的miRNA在血液中稳定存在,同时其浓度受到生理或病理应激影响而发生变化[7,20]。循环miRNA具备生物分子标志物特点,在疾病诊断和预后评价等方面被认为具有潜在的应用价值。近年在运动科学领域,研究发现,循环miRNA与运动存在较强的关联度。作为方便易行的检查指标,循环miRNA有望为运动能力的预测[26]、训练效果评定[35]、运动性损伤和疲劳判断[7,20]提供参考。
研究表明,循环miRNA与运动心脏重塑密切相关。人体研究发现,长期有氧运动可显著增加血液循环中miRNA-21的表达[8,25,54],且耐力型运动员miRNA的表达要显著高于力量型运动员[68]。进一步研究显示,运动增加了循环中miRNA-21的表达,与运动促进心脏健康和运动的心肌保护效应密切相关[25]。Mooren等[53]发现,马拉松运动后即刻,运动员血液中miRNA-1、miRNA-133、miRNA-206、miRNA-499和miRNA-208b均出现显著的增加。miRNA-1、miRNA-133a与miRNA-206和最大摄氧量以及个体乳酸阈下的跑速有关,而miRNA-1与左心室射血分数呈负相关,miRNA-133a与室间隔的厚度呈正相关。Clauss等[19]发现,马拉松运动后即刻,专业运动员血浆中miRNA-1和miRNA-133a出现显著性增加,而业余选手略有增加,但未发现显著性的变化。相关性分析证实,miRNA-1和miRNA-133a与专业运动员左心房的直径呈正相关,而与业余选手左心房直径无相关性。结果提示,miRNA-1和miRNA-133a可能是运动员心房重塑的潜在生物学标记物。Baggish等[9]研究发现,马拉松运动后即刻血液中miRNA-208a上升9.4倍,24 h后恢复到运动前水平的1.4倍,其变化趋势与心肌损伤标志物cTcI和NT-proBNP(brain natriuretic peptide)较为一致,提示,循环miRNA-208a可作为运动性心肌损伤及其恢复程度判定的敏感指标。miRNA-126对维持血管完整性、增加血管再生、促进心脏健康等方面具有重要作用。最近,Schmitz等[59]发现,4周低强度运动和高强度间歇运动促进了循环miRNA-126的表达,而高强度持续运动对循环miRNA-126没有明显影响。结果提示,miRNA-126 对运动强度较为敏感,低强度运动和高强度间歇运动对心血管健康有益,而持续高强度运动对心血管健康益处则被抑制。
以上研究提示,循环miRNA在运动心脏结构和功能重塑、运动性心肌损伤的诊断和运动方式的选择等方面具有潜在的应用价值,可作为运动心脏健康促进效果评价的特异性标记物。
4 miRNA在运动性心脏重塑中的调节作用
心脏主要由心肌细胞、心肌间质及血管构成。因此,运动性心脏重塑的过程主要包括运动对心肌细胞肥大、心肌细胞增殖和凋亡、心肌间质(主要是胶原蛋白)代谢以及心肌血管的再生的影响。近年的研究表明,miRNA通过调节上述生理过程从而参与了运动性心脏重塑的发生发展[9,65](表1、图2)。
4.1 运动性心肌细胞肥大与miRNA的调节作用
运动性心肌细胞肥大主要指心肌细胞体积增加,表现为心脏重量和体积增加,心脏重量/体重的比值升高。耐力运动主要使心脏腔室体积增加并伴随室壁增厚,抗阻运动则主要造成心室壁增厚并具有轻度的心室扩张。这两种类型的运动心脏均发生了心肌细胞肥大。力量型运动主要使心肌细胞横向生长,细胞宽度的增加幅度大于长度的增加幅度,而耐力型运动主要使心肌细胞纵向生长,细胞长度的增加幅度大于宽度的增加幅度。混合运动使心肌细胞横向和纵向均有不同程度的生长[1]。研究表明,心肌细胞体积增加的程度与运动强度和运动时间有关,在一定的范围内,运动强度越大,运动的时间越长,心肌细胞体积增加的程度就越大[65]。虽然,由疾病导致的病理性心肌肥大也有心肌细胞体积的增加,但是,病理性心肌肥大状态下,心肌细胞收缩蛋白α-MHC向β-MHC转化,提示心肌发生损伤。而运动性心肌肥大细胞内的β-MHC向α-MHC转化,表明心肌未发生心肌损伤。运动通过刺激细胞核内基因的表达,增加心肌细胞内蛋白质的合成,降低蛋白的降解,使心肌细胞的体积增大,心肌的舒缩性能增强,提高了心肌的射血功能[65]。
研 究 表 明,miRNA-208、miRNA-222、miRNA-17和miRNA-499等miRNA介导了运动性心肌细胞肥大的调节。Soci等[63]发现,游泳抑制了心肌miRNA-208的表达,其靶蛋白Sox6、Med13、PurB的表达显著升高。同时观察到心肌细胞体积增加,心肌的收缩性能增强。研究证实,miRNA-208能调节(MHC)-α/β比例的转化,在病理性心肌重塑过程中,miRNA-208的表达增高,(MHC)-α/β的比值降低。而运动诱导的生理性重塑发生过程中,miRNA-208的表达降低,(MHC)-α/β的比值升高[55]。miRNA-222参与了运动性心肌肥大的发生过程,受到广泛的关注。Liu等[47]研究显示,miRNA-222增加了心肌细胞肌球蛋白重链 (MHC)-α/β的比例,降低了ANP、BNP和α-肌动蛋白的表达,提示,运动通过促进miRNA-222的表达而导致生理性的而非病理性的心肌肥大。该研究显示,跑台和游泳均促进了小鼠心肌miRNA-222的表达。p27、HIPK1和Hmbox-1是miRNA-222下游的3个作用靶点,p27和HIPK1与细胞的增殖有关,而Hmbox-1则与细胞体积的增大关系密切。进一步研究发现,3周的游泳运动后,Hmbox-1的表达显著降低,小鼠心肌细胞体积增加20%。通过反义寡核苷酸体内抑制miRNA-222后,Hmbox-1的表达显著增加,小鼠心肌细胞体积减小,部分抑制了运动诱导的心脏体积增加幅度。此研究提示,miRNA-222/Hmbox-1信号通路参与了运动性心肌细胞肥大的调节。
研究表明,某些miRNA可通过调节PI3K/Akt信号通路介导运动引起的心肌细胞体积的增加。运动激活PI3K/Akt信号通路,然后通过mTOR(Mammalian Target of Rapa-Mycin,哺乳动物雷帕霉素靶蛋白)磷酸化,使p70S6K的活性增强和真核起始因子4E绑定蛋白1(Eukaryotic Initiation Factor 4E-Binding Protein 1,4EBP-1)发生磷酸化,调控细胞内蛋白质的翻译过程,促进蛋白的合成,心肌细胞体积增加,心脏发生肥大[46,48]。而PTEN是PI3K/Akt信号通路的天然性抑制剂。Akt基因敲除的小鼠,PI3K/Akt信号通路被阻断,运动促进心肌细胞体积增加效应则会受到明显抑制[73]。PI3K转基因小鼠和运动性心肌肥大的小鼠具有相同心肌保护作用,均能抑制由压力负荷过载而造成的病理性心肌重塑[70]。
Martinelli等研究发现,7天的自主运动后,小鼠左心室miRNA-26b的表达显著性降低。采用TargetScan预测分析发现,miRNA-26b和PI3K信号通路调节因子有关。该研究提示,miRNA-26b可能通过PI3K信号通路参与运动性心肌细胞肥大的调节[49]。Ma等[48]证实,8周的游泳运动后,miRNA-21、miRNA-144和miRNA-145分别上调152%、128%和101%,PI3K/Akt/mTOR信号途径中相关分子被激活,参与了运动性心肌细胞的肥大的发生。有研究报道,Akt转基因小鼠心肌中, miRNA-133显著下调,这和运动后小鼠心脏发生的变化一致,提示,运动可能通过Akt降低了miRNA-133的表达[15]。但以上研究没有通过体内或体外抑制和过表达的方法确认miRNA与PI3K/Akt信号通路的相互关系。最近,Shi等[61]研究发现,运动诱导小鼠运动性心肌肥大过程中伴随miRNA-17的显著上调。体内抑制miRNA-17的表达后发现,PTEN的表达显著升高,Akt的磷酸化增加,WGA染色显示小鼠心肌细胞体积显著增加。然而结果显示,PTEN并不是miRNA-17直接调控的靶基因,表明miRNA-17间接通过促进PTEN的表达,激活Akt信号通路,促进运动性心肌肥大。
Johnson等[39]研究发现,自主运动2周和4周后,小鼠心肌miRNA-499的表达均显著降低,VW/BW比值升高,表现出心脏肥大。miRNA-499转基因小鼠经过2周运动后心肌细胞的体积显著小于正常运动小鼠,而和安静非转基因小鼠相比,未发现显著性变化。miRNA-499基因敲除的小鼠经过2周运动后,心肌细胞体积显著高于安静对照组,也显著高于正常运动小鼠。采用尾静脉注射antimiR-499,急性抑制miRNA-499的表达后,和miRNA-499基因敲除小鼠表现出相似的变化趋势。进一步研究显示,miRNA-499通过抑制靶基因p85α和Rictor信使RNA的表达,激活PI3K/Akt信号通路,参与了运动性心肌细胞肥大的调节。

表1 运动性心脏重塑过程中miRNA的变化Table1 Change of miRNA in the process of exercise-induced cardiac remodeling

图2 miRNA对运动性心脏重塑的调节Figure 2. Regulation of miRNA on exercise-induced cardiac remodeling
4.2 运动对心肌细胞增殖的影响及miRNA的调节
运动对心肌细胞数量的影响主要通过对细胞凋亡和增殖的调节来实现。传统观点认为,成年以后,心肌细胞退出细胞周期,不再具备增殖的能力。但从维持细胞数量稳定的角度分析,成体心肌细胞应具有一定的增殖能力,否则,由大强度负荷运动导致的心肌细胞凋亡而发生的运动风险就难以估计[4]。最新研究显示,3周游泳训练后,Ki67阳性细胞数量增多,p27表达降低,使细胞周期G1向S期的转变,促进了心肌细胞的增殖[47]。与此一致,田振军等研究也发现,8周的有氧运动后,CyclinD2和CKD4蛋白表达具有增加趋势,细胞增殖的标记蛋白PCNA表达显著增加。有研究进一步指出,运动促进心脏新生细胞的数量与运动强度和运动时间紧密相关,大强度和长时间组新生细胞数量要显著高于低强度短时间的运动组。研究证实,运动促进心肌细胞的生成与心脏干细胞的动员、增殖和分化有关[69]。心脏中存在固有的干细胞或祖细胞,可表达干细胞标志蛋白C-kit和Sca-1等,具备分化为心肌细胞、内皮细胞和平滑肌细胞的能力。成年心脏中具有静息的内源性心肌干细胞和祖细胞(Endogenous Cardiac Stem and Progenitor Cells,eCSC),eCSC具有增殖和分化的潜能。在心肌负荷增加时,eCSC被激活、动员并向心肌细胞分化。近年发现,有氧运动不仅抑制了心肌细胞的凋亡,而且还可以促进心肌细胞的增殖相关因子的表达,诱导心肌细胞的增殖。当心肌受损时,心肌干细胞或祖细胞能重新进入细胞周期并进行分化,修复损伤的心肌组织[4]。Sca-1基因敲除使心肌丧失增殖能力后,心脏的收缩功能发生障碍,对病理性损伤的抵抗能力降低[10]。研究表明,有氧运动可促进C-kit和Sca-1阳性细胞数量增多,提示,运动促进了干细胞数量增加,心脏重量/体重的比值增加[69,71]。
研究表明,运动促进心脏健康、产生心肌保护效应与运动促进细胞增殖和抑制心肌细胞凋亡有关,其调节机制与microRNA参与有关。microRNA可通过影响细胞周期相关蛋白的表达调节心肌的增殖和凋亡过程,进而影响心肌细胞的数量。Liu等[47]研究显示,3周游泳训练后,miR-222的表达增加,Ki67阳性细胞数量增多,心肌细胞增殖能力增强。体内抑制miR-222的表达后,Ki67阳性细胞数量减少,运动诱导的心肌细胞增殖效应被抑制。进一步研究显示,miRNA-222抑制了靶基因p27的表达,从而使p27与cyclin结合减少,CDK的活性增强,使细胞周期G1向S期的转变,促进了心肌细胞的增殖。
Jing等研究发现,miRNA -17通过靶向调节TIMP-3介导了运动性心肌肥大过程。miRNA-17在运动21天的小鼠心脏中显著增加,而在骨骼肌等其他组织中没有明显改变。采用antagomiR体内抑制miRNA-17的表达后,EdU检测显示,小鼠运动诱导的心肌细胞增殖受到抑制。RNAhybrid软件预测并经荧光素酶检测证实,TIMP-3是miRNA-17的直接靶基因。进一步通过体外实验发现,miRNA-17的模拟物通过促进EGFR和JNK的磷酸化、增加p-SP-1的表达,进而促进心肌细胞的增殖。以上研究提示,运动上调miRNA-17抑制TIMP-3的表达,促进心肌细胞的增殖,诱导心肌肥大,可能是通过EGFR/JNK/p-SP-1信号通路实现的[61]。
4.3 运动对细胞凋亡的影响及miRNA调节
细胞凋亡是细胞程序性死亡的过程,机体能够通过细胞凋亡的方式去除损伤细胞、维持代谢稳定和保持机体内环境的稳态。细胞凋亡对人类的生长、发育和疾病的调节具有重要影响。研究显示,虽然过度超负荷运动或力竭运动均可造成大鼠心肌细胞凋亡增加,但中小强度的有氧运动能有效抑制心肌细胞凋亡,对心肌产生保护效应,降低心肌梗死[34]、高血压和衰老[42]导致的心肌细胞凋亡。目前,运动对心肌细胞凋亡调节的研究主要集中在促凋亡关键基因Bax、caspase-3和p53,抑制凋亡的基因Bcl-2。早年研究证实,长期中等强度的运动可造成大鼠心肌细胞中凋亡调控基因Bcl-2表达明显增加,抑制心肌细胞凋亡[2]。田振军等[4]研究发现,有氧运动促进了大鼠心肌细胞Bcl-2蛋白的表达,而降低了p53和Bax蛋白的表达。近年,研究证实运动抑制了Bax的表达,上调Bcl-2,Bax/Bcl-2的比率下降,减弱caspase酶的活性,部分抑制了慢性心脏疾病导致的心肌细胞凋亡[36,44]。然而,这些均是对细胞凋亡直接相关的凋亡分子研究,运动调节心肌细胞凋亡的调节机制还未完全阐明,仍需进一步研究。
miRNA的发现为解释运动调节细胞凋亡这一老命题提供了新视角。近年的研究显示,miRNA介导了运动促进或抑制心肌细胞凋亡的发生。Zhao等[74]发现,8周游泳训练抑制了小鼠心肌细胞凋亡,miRNA-30b的表达增加32%。进一步研究发现,miRNA-30b可能通过调节P53抑制心肌细胞的凋亡。miRNA-21是调节细胞凋亡的关键microRNA之一,程序性细胞死亡因子(Programmed Cell Death 4,PDCD4)是其靶蛋白之一,PDCD4是促进细胞凋亡的因子。研究发现,运动促进小鼠心肌miRNA-21的上调,PDCD4的表达降低,Bcl-2/Bax比值降低,抑制了心肌细胞凋亡进程。
4.4 运动促进心脏血管新生与miRNA的调节
研究表明,运动主要通过促进血管内皮生长因子(Vascular Endothelial Growth Factor ,VEGF)的表达、增加一氧化氮的释放、提高血管内皮祖细胞的释放和分化等途径来促进血管的生长。近年的研究证实,miRNA可通过作用以上3个途径调节血管的生成。miRNA-126、miRNA-27和miRNA-210是促进血管生成的miRNA,而miRNA-34则是抑制血管生成的miRNA。
miRNA-126是血管内皮细胞特异性表达的miRNA,是促进血管再生的关键miRNA。DA等[22]研究表明,中等强度和大强度游泳训练促进了大鼠miRNA-126的表达,升高幅度分别为26%和42%,调节血管生长的关键蛋白VEGF显著增加(升高42%和108%)。统计表明,miRNA-126与心肌中毛细血管/肌纤维的升高比例(58%和101%)具有明显的相关性。研究还发现,两种不同强度运动引起miRNA-126的靶蛋白Spred-1和PI3KR2不同比例的下降,激活MAPK和PI3K/Akt/eNOS信号通路,进而上调VEGF的表达,促进心脏血管的再生。最近,Ghorbanzadeh 等[32]也证实,8周自主转轮运动促进了大鼠miRAN-126的表达,心肌组织新生血管密度增加。同时发现,Akt和ERK1/2的磷酸化增多,VEGF的表达增加,提示,运动可能通过诱导miRNA-126的表达,激活Akt和ERK信号通路,进一步促进VEGF的表达,增强心肌组织的血管再生。该研究同时发现,运动促进心脏血管新生还可能与miRNA-210的表达增加有关。可能的机制是,miRNA-210对低氧较为敏感,受到HIF-α的调控。运动时心肌局部组织处于缺氧状态,激活了HIF-α途径诱导miRNA-210的增加,而miRNA-210会间接促进VEGF的表达,从而促进血管再生[31]。Fernandes等[29]研究证实,有氧运动后miRNA-27的表达上调,而miRNA -27可通过抑制Sprouty-2基因促进血管的生成。研究报道,有氧运动下调了miRNA-34,而作为miRNA-34的靶基因,VEGF的表达增加,进而促进了心肌血管的生成[11,56]。
4.5 运动对心肌间质的重塑与miRNA的调节
心肌间质是心肌组织细胞间的结缔组织,具有连接、支持、营养和保护心肌组织细胞的作用,主要成分为胶原蛋白。早年,研究报道,适宜强度的有氧运动能降低胶原蛋白的含量,增加心肌的顺应性,增强心脏的功能。近年,研究发现,microRNA对心肌间质具有调节作用。miRNA-29是调节细胞间质最重要的miRNA之一。它可直接作用于靶基因Ⅰ型和Ⅲ型胶原蛋白,调控胶原的合成过程。研究发现,进行10周、每周5天、60 min/天的有氧运动使心肌miRNA-29的表达增加了52%,Ⅰ型胶原蛋白和Ⅲ型胶原蛋白分别减少27%和33%,左心室的顺应性增强。研究提示,有氧运动可上调miRNA-29,减少心肌间质胶原蛋白的含量,增加心肌的顺应性[64]。另外,贾明学等[3]发现,有氧运动上调小鼠心室肌组织中miRNA-30c的表达,抑制靶蛋白CTGF的表达,降低了心肌中细胞间质的水平,抑制心肌纤维化的发生,提高了运动性心肌重塑过程中的心室顺应性。
然而,长期的超负荷运动则会造成胶原蛋白的过度增生,导致心肌纤维化,诱发心律失常。课题组前期研究发现,16周的大强度运动促进大鼠心房转化生长因子(Transforming Growth Factor-β1,TGF-β)和miRNA-21的表达,TGF-β1是损伤修复的重要调节因子,长期过度TGF-β1的表达可通过上调miRNA-21诱导心房纤维化的发生,而中等强度运动对miRNA-21没有明显影响。结果提示,不同运动强度可能对miRNA的表达产生明显的差异[5]。
4.6 运动性心脏电重塑与miRNA的调节
长期运动造成心率减慢,引起心动徐缓。近年,研究证实,运动性心动徐缓是主要由于运动导致窦房结发生重塑引起心肌电生理发生重塑的结果。研究表明,运动导致窦房结HCN4 mRNA和蛋白的表达显著下调,降低了自动除极If电流密度。进一步研究指出,HCN4的高低与miRNA-1的表达有关。运动促进miRNA-1的表达,进一步引起HCN4表达下调可能是运动性心动徐缓的重要调节机制[21]。
5 miRNA在病理性心脏重塑和运动性心脏重塑的差异表达
从以上研究可以看出,在运动性心脏重塑过程中,miRNA-1、miRNA-17、miRNA-21、miRNA-29、miRNA-30、miRNA-126、miRNA-208、miRNA-222等表达显著增加,而miRNA-34和miRNA-499等明显下调。而在病理性心脏重塑中,则存在明显不同的变化趋势。Diniz等[27]发现,在甲状腺素诱导的肥大中,miRNA-1表达显著降低,miRNA-1的过表达则会降低HDAC mRAN的表达,进而抑制心肌细胞肥大。在心肌梗死和心肌缺血再灌注模型中,心肌miRNA-17[17]、miRNA-21[24]、miRNA-30[60]、miRNA-29[28]和miRNA-222[47]表达下调,阻碍了细胞增殖,促进细胞凋亡,加速了心肌纤维化的发生。与在运动性心脏重塑动物模型调控的靶基因不同,miRNA-208的靶基因还包括Myh6、GATA4和CX-40。Callis等[13]发现,心肌miRNA-208转基因小鼠表现有心脏病理性肥大,同时具有心电传导异常。在主动脉狭窄和心肌梗死导致心脏病理性重塑过程中,miRNA-34的表达显著上调,通过对POFUT1、Notch1和SEMA4B靶基因的调控导致心肌细胞肥大。在另一项研究中发现,心肌梗死后,表达增多的miRNA-34通过直接抑制smad-4的表达,促进心肌纤维化的发生[11,37]。Matkovich等[50]研究显示,在具有心肌症的人和小鼠心组织中,miRNA-499的表达显著增加,是诱导心肌细胞肥大发生的重要调控因子。进一步研究显示,MEKK2可能是miRNA-499调控的靶基因(表2)。

表2 miRNA病理性心脏重塑中的表达变化Tabel 2 The Change of miRNA in Pathological Heart Remodeling
综上所述,在运动性和病理性心脏重塑过程中,一些心肌组织miRNA的表达呈现截然不同的变化,这为阐释这两种不同的心脏重塑的调节机制提供了新的依据,同时,这也为心脏疾病的治疗提供了潜在的靶点。
6 运动调节microRNA对心脏的保护作用
运动可通过调节microRNA的表达,抑制心脏疾病导致的病理性心脏重塑,改善心脏功能,产生良好的心脏保护效应。研究发现,运动可通过调节microRNA减轻糖尿病、心肌梗死等疾病诱导的心肌细胞凋亡、心肌纤维化等过程,抑制病理性心脏重塑,改善心肌功能障碍(表3)。

表3 运动通过miRNA抑制病理性心脏重塑Tabel 3 Exercise Inhibits Pathological Heart Remodeling through miRNA
6.1 糖尿病性心脏病
研究显示,糖尿病性心脏病是糖尿病患者的重要并发症之一,可引起糖尿病患者致死率增加2倍以上。人体和动物实验均表明,细胞凋亡增加和心肌纤维化加剧可能是糖尿病性心肌病的重要病理机制之一。有氧运动可部分抑制糖尿病导致的病理性心脏重塑,改善糖尿病患者心脏功能障碍。其中,miRNA-29、miRNA-133、miRNA-126等多个microRNA参与了该过程的调节。Chaturvedi等[16]研究发现,运动降低了糖尿病小鼠心肌MMP-9的表达,抑制了心肌纤维化的程度,这可能与运动促进小鼠心肌miRNA -29的表达增多有关,而miR-29是由外泌体分泌而来的。研究发现,miRNA-133的调节靶基因之一是CTGF,CTGF是促进成纤维细胞增殖和分化、促进心肌纤维化的重要因子。通过抑制糖尿病大鼠心肌miRNA -133的表达后发现,心肌氧化应激反应和心脏功能障碍加重。10周的游泳运动增加了2型糖尿病小鼠心肌miRNA-133的表达,同时降低了CTGF的表达,抑制心肌纤维化,改善了小鼠心肌舒缩功能。而miRNA-133在骨骼肌和心肌中均呈现高表达,运动导致的心肌组织miRNA-133的增多是心源性的还是由骨骼肌分泌通过血液循环转移到心肌中的,该研究没有给出结论[45]。另外,Rawal等[58]发现,在糖尿病小鼠血液和心肌中miRNA-126的表达均显著降低,同时伴随心脏血管密度的降低。体外研究进一步证实,miRNA-126的过表达恢复了血管再生的潜能,该研究提示,运动通过促进心肌表达miRNA-126,增进心肌血管新生,缓解糖尿病导致的血供异常。
6.2 心肌梗死
心肌梗死是冠状动脉持续缺血缺氧导致的心肌坏死,是心脏衰竭最主要的原因之一。运动训练作为一种有效的疗法,可有效减少细胞凋亡,抑制心肌纤维化,促进血管新生,改善心脏功能,已经成为心肌梗死后康复训练的重要手段之一。近年研究发现,miRNA-1、miRNA -29和miRNA-222等microRNA介导了运动对心肌梗死的保护效应。Liu等[47]发现,心衰患者miRNA-222的表达显著降低,而运动后即刻,患者血液中miRNA-222的含量增加了1.8倍。动物实验表明,miRNA-222可以减轻由心肌缺血导致的心肌细胞凋亡、心肌间质纤维化,同时促进心肌细胞再生,改善心肌功能障碍。Melo等[52]发现,10周的游泳训练促进了大鼠心肌梗死区和边缘区miRNA-29的表达,I型和III型胶原蛋白的表达均显著增加,抑制了心肌纤维化。Xiao等[72]人的研究也发现,间歇有氧运动通过上调miRNA-29的表达抑制TGF-β1/Smad信号通路,降低心肌间胶原蛋白沉积,减轻了心肌纤维化的程度。在另外一项研究中,Melo等[51]发现,心肌梗死大鼠miRNA -1的表达降低,miRNA-214的表达升高。而运动促进了心梗大鼠miRNA-1的表达,抑制miRNA-214的表达,使其靶基因NCX和Serca-2a的表达恢复到正常水平,改善心肌收缩能力和顺应性。
7 总结和展望
miRNA在运动诱导的心肌细胞肥大、细胞增殖和凋亡、心肌血管再生、心肌间质和电重塑等多个过程均具有一定的调节作用。其中,miRNA-222、miRNA-17-3p和miRNA-499对运动性心肌细胞肥大和细胞增殖调节的研究较为充分,受到广泛关注。miRNA-1、miRNA-29、miRNA-133、miRNA-126、miRNA-214、miRNA-222等在运动性心脏重塑和病理性心脏重塑中具有明显不同的变化趋势,这也为揭示运动性心脏重塑是适应性而非病理性重塑提供了新的证据。运动可通过调节microRNA减轻糖尿病、心肌梗死等疾病诱导的心肌细胞凋亡、心肌纤维化等过程,产生心肌保护效应,抑制病理性心脏重塑,改善心肌功能障碍。深入研究miRNA在运动性心脏重塑中的调节作用,有助于阐释运动心脏健康促进的发生机制,为治疗心脏疾病提供潜在的miRNA靶点。
运动性心脏重塑过程中的心肌肥大受运动方式(耐力或抗阻)的影响,目前的研究多是关于耐力运动对心肌miRNA的调节,少有研究抗阻运动诱导的向心性心肌肥大过程中miRNA的调节作用。不同运动强度对血液循环和心肌组织中miRNA的表达影响存在差异,哪些miRNA可以作为心血管运动效果评价和损伤预防潜在的生物学标志,也值得开展研究。另外,目前的研究,大部分还停留在运动性心脏重塑过程中miRNA及其靶基因的变化趋势层面,少有研究采用功能获得和缺失的方法深入研究,以进一步明确miRNA的调节作用。因此,将来的研究应采用体内过表达或抑制、基因敲除等方法,明确相关miRNA在运动性心脏重塑过程中的作用机制。
[1] 常芸. 运动心脏重塑的调节[J]. 体育科学,2004,24(02):12-16.
[2] 张钧,陈晓莺,许豪文. 运动对心肌细胞中凋亡调控基因表达的影响[J]. 体育科学,2005,25(08):79-82.
[3] 贾明学,张国海,李艳,等. 微小RNA 30c增加有氧运动训练小鼠心室顺应性的研究[J]. 体育科学,2013,33(09):70-76.
[4] 田振军,蔡梦昕,邢维新. 有氧运动对心肌细胞增殖/凋亡的影响及其机制探讨[J]. 体育科学,2012,32(03):60-66.
[5] 王世强,常芸,马晓雯,等. 不同强度耐力运动对大鼠心房TGF-β1/miR-21信号途径的影响[J]. 体育科学,2015,35(11):30-37,44.
[6] ACANFORA D,SCICCHITANO P,CASUCCI G,et al. Exercise training effects on elderly and middle-age patients with chronic heart failure after acute decompensation:A randomized,controlled trial[J]. Int J Cardiol,2016,225:313-323.
[7] AOI W,SAKUMA K. Does regulation of skeletal muscle function involve circulating microRNAs?[J]. Front Physiol,2014,5:39.
[8] BAGGISH A L,HALE A,WEINER R B,et al. Dynamic regulation of circulating microRNA during acute exhaustive exercise and sustained aerobic exercise training[J]. J Physiol,2011,589(Pt 16):3983-3994.
[9] BAGGISH A L,PARK J,MIN P K,et al. Rapid upregulation and clearance of distinct circulating microRNAs after prolonged aerobic exercise[J]. J Appl Physiol (1985),2014,116(5):522-531.
[10] BAILEY B,FRANSIOLI J,GUDE N A,et al. Sca-1 knockout impairs myocardial and cardiac progenitor cell function[J]. Circ Res,2012,111(6):750-760.
[11] BERNARDO B C,GAO X M,WINBANKS C E,et al. Therapeutic inhibition of the miR-34 family attenuates pathological cardiac remodeling and improves heart function[J]. Proc Natl Acad Sci U S A,2012,109(43):17615-17620.
[12] BHARTIYA D,SCARIA V. Genomic variations in non-coding RNAs:Structure,function and regulation[J]. Genomics,2016,107(2-3):59-68.
[13] CALLIS TE,PANDYA K,SEOK HY,et al. MicroRNA-208a is a regulator of cardiac hypertrophy and conduction in mice[J]. J Clin Invest,2009,119(9):2772-2786.
[14] CARDINAL-FERNANDEZ P,FERRUELO A,ESTEBAN A,et al. Characteristics of microRNAs and their potential relevance for the diagnosis and therapy of the acute respiratory distress syndrome:from bench to bedside[J]. Transl Res,2016,169:102-111.
[15] CARE A,CATALUCCI D,FELICETTI F,et al. MicroRNA-133 controls cardiac hypertrophy[J]. Nat Med,2007,13(5):613-618.
[16] CHATURVEDI P,KALANI A,MEDINA I,et al. Cardiosome mediated regulation of MMP9 in diabetic heart:role of mir29b and mir455 in exercise[J]. J Cell Mol Med,2015,19(9):2153-2161.
[17] CHEN J,HUANG Z P,SEOK H Y,et al. mir-17-92 cluster is required for and sufficient to induce cardiomyocyte proliferation in postnatal and adult hearts[J]. Circ Res,2013,112(12):1557-1566.
[18] CHEN J F,MURCHISON E P,TANG R,et al. Targeted deletion of Dicer in the heart leads to dilated cardiomyopathy and heart failure[J]. Proc Natl Acad Sci U S A,2008,105(6):2111-2116.
[19] CLAUSS S,WAKILI R,HILDEBRAND B,et al. MicroRNAs as biomarkers for acute atrial remodeling in marathon runners (The miRathon Study——A Sub-Study of the Munich Marathon Study)[J].PLoS One,2016,11(2):e0148599.
[20] CUI S,SUN B,YIN X,et al. Time-course responses of circulating microRNAs to three resistance training protocols in healthy young men[J]. Sci Rep,2017,7(1):2203.
[21] D’SOUZA A,BUCCHI A,JOHNSEN A B,et al. Exercise training reduces resting heart rate via downregulation of the funny channel HCN4[J]. Nat Commun,2014,5:3775.
[22] DA SILVA N D JR,FERNANDES T,SOCI UP,et al. Swimming training in rats increases cardiac MicroRNA-126 expression and angiogenesis[J]. Med Sci Sports Exerc,2012,44(8):1453-1462.
[23] DA COSTA MARTINS P A,BOURAJJAJ M,GLADKA M,et al. Conditional dicer gene deletion in the postnatal myocardium provokes spontaneous cardiac remodeling[J]. Circulation,2008,118(15):1567-1576.
[24] DENG W,WANG Y,LONG X,et al. miR-21 reduces hydrogen peroxide-induced apoptosis in c-kit+ cardiac stem cells in vitro through PTEN/PI3K/Akt signaling[J]. Oxid Med Cell Longev,2016,2016:5389181.
[25] DENHAM J,O’BRIEN B J,MARQUES F Z,et al. Changes in the leukocyte methylome and its effect on cardiovascular-related genes after exercise[J]. J Appl Physiol (1985),2015,118(4):475-488.
[26] DENHAM J,PRESTES P R. Muscle-enriched micrornas isolated from whole blood are regulated by exercise and are potential biomarkers of cardiorespiratory fi tness[J]. Front Genet,2016,7:196.
[27] DINIZ G P,LINO C A,MORENO C R,et al. MicroRNA-1 overexpression blunts cardiomyocyte hypertrophy elicited by thyroid hormone[J]. J Cell Physiol,2017,232(12):3360-3368.
[28] DRUMMOND C A,HILL M C,SHI H,et al. Na/K-ATPase signaling regulates collagen synthesis through microRNA-29b-3p in cardiac fi broblasts[J]. Physiol Genomics,2016,48(3):220-229.
[29] FERNANDES T,HASHIMOTO N Y,MAGALHAES F C,et al.Aerobic exercise training-induced left ventricular hypertrophy involves regulatory MicroRNAs,decreased angiotensin-converting enzyme-angiotensin ii,and synergistic regulation of angiotensin-converting enzyme 2-angiotensin (1-7)[J]. Hypertension,2011,58(2):182-189.
[30] FIGUEIREDO P A,APPELL CORIOLANO H J,DUARTE J A. Cardiac regeneration and cellular therapy:is there a bene fi t of exercise?[J]. Int J Sports Med,2014,35(3):181-190.
[31] GAO Y,LI P,LIU Z,et al. Expression levels of vascular endothelial cell growth factor and microRNA-210 are increased in medulloblastoma and metastatic medulloblastoma[J]. Exp Ther Med,2015,10(6):2138-2144.
[32] GHORBANZADEH V,MOHAMMADI M,DARIUSHNEJAD H,et al. Cardioprotective effect of crocin combined with voluntary exercise in rat:Role of mir-126 and mir-210 in heart angiogenesis[J].Arq Bras Cardiol,2017,109(1):54-62.
[33] GRECO S,GOROSPE M,MARTELLI F. Noncoding RNA in age-related cardiovascular diseases[J]. J Mol Cell Cardiol,2015,83:142-155.
[34] GUIZONI D M,OLIVEIRA-JUNIOR S A,NOOR S L,et al.Effects of late exercise on cardiac remodeling and myocardial calcium handling proteins in rats with moderate and large size myocardial infarction[J]. Int J Cardiol,2016,221:406-412.
[35] HOPPE M W,BAUMGART C,HILBERG T,et al. Changes of standard physiological-perceptual markers and circulating MicroRNAs in response to tennis match-play:A case report of two elite players[J]. J Hum Kinet,2016,51:71-81.
[36] HUANG C Y,YANG A L,LIN Y M,et al. Anti-apoptotic and pro-survival effects of exercise training on hypertensive hearts[J].J Appl Physiol (1985),2012,112(5):883-891.
[37] HUANG Y,QI Y,DU J Q,et al. MicroRNA-34a regulates cardiac fi brosis after myocardial infarction by targeting Smad4[J].Expert Opin Ther Targets,2014,18(12):1355-1365.
[38] HUSSAIN S R,MACALUSO A,PEARSON S J. High-intensity interval training versus moderate-intensity continuous training in the prevention/management of cardiovascular disease[J]. Cardiol Rev,2016,24(6):273-281.
[39] JOHNSON B A. Regulation of exercise-dependent cardiac growth by microRNAs[D]. Dallas:University of Texas,2013.
[40] KAKIMOTO Y,TANAKA M,KAMIGUCHI H,et al. MicroRNA deep sequencing reveals chamber-specific miR-208 family expression patterns in the human heart[J]. Int J Cardiol,2016,211:43-48.
[41] KATZ M G,FARGNOLI A S,KENDLE A P,et al. The role of microRNAs in cardiac development and regenerative capacity[J].Am J Physiol Heart Circ Physiol,2016,310(5):H528-541.
[42] KWAK H B. Effects of aging and exercise training on apoptosis in the heart[J]. J Exerc Rehabil,2013,9(2):212-219.
[43] LEE R C,FEINBAUM R L,AMBROS V. The C. elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14[J]. Cell,1993,75(5):843-854.
[44] LEE SD,SHYU WC,CHENG IS,et al. Effects of exercise training on cardiac apoptosis in obese rats[J]. Nutr Metab Cardiovasc Dis,2013,23(6):566-573.
[45] LEW J K,PEARSON J T,SCHWENKE D O,et al. Exercise mediated protection of diabetic heart through modulation of microRNA mediated molecular pathways[J]. Cardiovasc Diabetol,2017,16(1):10.
[46] LIAO J,LI Y,ZENG F,et al. Regulation of mTOR pathway in exercise-induced cardiac hypertrophy[J]. Int J Sports Med,2015,36(5):343-350.
[47] LIU X,XIAO J,ZHU H,et al. miR-222 is necessary for exercise-induced cardiac growth and protects against pathological cardiac remodeling[J]. Cell Metab,2015,21(4):584-595.
[48] MA Z,QI J,MENG S,et al. Swimming exercise training-induced left ventricular hypertrophy involves microRNAs and synergistic regulation of the PI3K/AKT/mTOR signaling pathway[J]. Eur J Appl Physiol,2013,113(10):2473-2486.
[49] MARTINELLI N C,COHEN C R,SANTOS K G,et al. An analysis of the global expression of microRNAs in an experimental model of physiological left ventricular hypertrophy[J]. PLoS One,2014,9(4):e93271.
[50] MATKOVICH S J,HU Y,ESCHENBACHER W H,et al. Direct and indirect involvement of microRNA-499 in clinical and experimental cardiomyopathy[J]. Circ Res,2012,111(5):521-531.
[51] MELO S F,BARAUNA V G,NEVES V J,et al. Exercise training restores the cardiac microRNA-1 and -214 levels regulating Ca2+handling after myocardial infarction[J]. BMC Cardiovasc Disord,2015,15:166.
[52] MELO S F,FERNANDES T,BARAUNA V G,et al. Expression of microRNA-29 and collagen in cardiac muscle after swimming training in myocardial-infarcted rats[J]. Cell Physiol Biochem,2014,33(3):657-669.
[53] MOOREN F C,VIERECK J,KRUGER K,et al. Circulating microRNAs as potential biomarkers of aerobic exercise capacity[J].Am J Physiol Heart Circ Physiol,2014,306(4):H557-563.
[54] NIELSEN S,AKERSTROM T,RINNOV A,et al. The miRNA plasma signature in response to acute aerobic exercise and endurance training[J]. PLoS One,2014,9(2):e87308.
[55] OLIVEIRA-CARVALHO V,CARVALHO V O,BOCCHI E A.The emerging role of miR-208a in the heart[J]. DNA Cell Biol,2013,32(1):8-12.
[56] OOI J Y,BERNARDO B C,MCMULLEN J R. The therapeutic potential of miRNAs regulated in settings of physiological cardiac hypertrophy[J]. Future Med Chem,2014,6(2):205-222.
[57] PASQUINELLI A E,HUNTER S,BRACHT J. MicroRNAs:a developing story[J]. Curr Opin Genet Dev,2005,15(2):200-205.
[58] RAWAL S,MUNASINGHE P E,SHINDIKAR A,et al.Down-regulation of proangiogenic microRNA-126 and microRNA-132 are early modulators of diabetic cardiac microangiopathy[J].Cardiovasc Res,2017,113(1):90-101.
[59] SCHMITZ B,SCHELLECKES K,NEDELE J,et al. Dose-response of high-intensity training (HIT) on atheroprotective miRNA-126 levels[J]. Front Physiol,2017,8:349.
[60] SHEN Y,SHEN Z,MIAO L,et al. miRNA-30 family inhibition protects against cardiac ischemic injury by regulating cystathionine-gamma-lyase expression[J]. Antioxid Redox Signal,2015,22(3):224-240.
[61] SHI J,BEI Y,KONG X,et al. miR-17-3p contributes to exercise-induced cardiac growth and protects against myocardial ischemia-reperfusion injury[J]. Theranostics,2017,7(3):664-676.
[62] SINGH N K. microRNAs databases:Developmental methodologies,structural and functional annotations[J]. Interdiscip Sci,2017,9(3):357-377.
[63] SOCI U P,FERNANDES T,BARAUNA V G,et al. Epigenetic control of exercise training-induced cardiac hypertrophy by miR-208[J]. Clin Sci (Lond),2016.DOI:10.1042/CS20160480.
[64] SOCI U P,FERNANDES T,HASHIMOTO N Y,et al. MicroRNAs 29 are involved in the improvement of ventricular compliance promoted by aerobic exercise training in rats[J]. Physiol Genomics,2011,43(11):665-673.
[65] TAO L,BEI Y,ZHANG H,et al. Exercise for the heart:signaling pathways[J]. Oncotarget,2015,6(25):20773-20784.
[66] VEGA R B,KONHILAS J P,KELLY D P,et al. Molecular mechanisms underlying cardiac adaptation to exercise[J]. Cell Metab,2017,25(5):1012-1026.
[67] WANG H,LU J,WU S,et al. Effects of electroacupuncture at different acupoints on apoptosis and the expression of miRNAs in myocardial cells in rats model of myocardial ischemia[J].Chin Acup Moxib,2016,36(3):281-286.
[68] WARDLE S L,BAILEY M E,KILIKEVICIUS A,et al. Plasma microRNA levels differ between endurance and strength athletes[J].PLoS One,2015,10(4):e0122107.
[69] WARING C D,VICINANZA C,PAPALAMPROU A,et al. The adult heart responds to increased workload with physiologic hypertrophy,cardiac stem cell activation,and new myocyte formation[J]. Eur Heart J,2014,35(39):2722-2731.
[70] WEEKS K L,GAO X,DU X J,et al. Phosphoinositide 3-kinase p110alpha is a master regulator of exercise-induced cardioprotection and PI3K gene therapy rescues cardiac dysfunction[J]. Circ Heart Fail,2012,5(4):523-534.
[71] XIAO J,XU T,LI J,et al. Exercise-induced physiological hypertrophy initiates activation of cardiac progenitor cells[J]. Int J Clin Exp Pathol,2014,7(2):663-669.
[72] XIAO L,HE H,MA L,et al. Effects of miR-29a and miR-101a expression on myocardial interstitial collagen generation after aerobic exercise in myocardial-infarcted rats[J]. Arch Med Res,2017,48(1):27-34.
[73] YANG K C,TSENG Y T,NERBONNE J M. Exercise training and PI3Kalpha-induced electrical remodeling is independent of cellular hypertrophy and Akt signaling[J]. J Mol Cell Cardiol,2012,53(4):532-541.
[74] ZHAO Y,MA Z. Swimming training affects apoptosis-related microRNAs and reduces cardiac apoptosis in mice[J]. Gen Physiol Biophys,2016,35(4):443-450.
Exercise-induced Cardiac Remodeling:Regulation of MiRNA
WANG Shi-qiang1,CHANG Yun2,RAO Zhi-jian2,HUANG Xiao-li1,WANG Guo-jun1
Long-term moderate intensive training can induce cardiac remodeling,displaying cardiomyocyte hypertrophy and proliferation,cell survival,myocardial angiogenesis,inhibiting myocardial fi brosis and a series of structural remodeling with the adaptive cardiac enlargement. Although a lot of research has been carried out to explore the mechanism of exercise-induced cardiac remodeling,so far,it is not clear. In recent years,the researchers has obtained the expression pro fi les of micrornas in the process of exercise-induced cardiac remodeling with the help of gene chiptechnology. Some researchers con fi rmed the key microRNAs using the “gain and loss ” method. miRNA provides a new perspective for the study of the regulation mechanism of exercise-induced cardiac remodeling. In addition,the miRNA showed varying characteristics between exercise-induced cardiac remodeling and pathological cardiac remodeling,thus providing a new evidence for physiologic remodeling interpretation of exercise-induced cardiac remodeling rather than pathological remodeling. The analysis of the changes and mechanism of miRNA in the process of exercise-induced cardiac remodeling can provide new methods and strategies for the prevention and treatment of cardiac diseases by miRNA.
exercise;cardiac remodeling;cell hypertrophy;microRNA
G804.7
A
1000-677X(2017)11-0081-10
10. 16469/j. css. 201711010
2017-08-11;
2017-11-10
国家体育总局体育科学研究所基本科研业务经费(15-37)。
王世强,男,讲师,博士,主要研究方向为运动心脏生理和病理,E-mail:suswsq@163.com;常芸,女,研究员,博士,博士研究生导师,主要研究方向为运动员心脏病生理与医务监督,Tel:(010)87182526,E-mai:changyun@ciss.cn;饶志坚,男,在读博士研究生,主要研究方向为运动心脏生理和病理。
1. 湖南工业大学 体育学院,湖南 株洲,412000;2.国家体育总局体育科学研究所,北京 100061
1.Hunan University of Technology,Zhuzhou 412000,China;2.China Institute of Sports Science,Beijing 100061,China.
