毒性中药治疗恶性肿瘤的研究概况
2017-11-30
嘉兴学院医学院,浙江 嘉兴 314001
毒性中药治疗恶性肿瘤的研究概况
徐佳颖黄越燕*
嘉兴学院医学院,浙江 嘉兴 314001
以毒攻毒是中医药治疗恶性肿瘤的重要手段之一。对近年来毒性中药在抗肿瘤的实验研究方面进行综述,归纳毒性中药用于治疗恶性肿瘤的作用机制包括:抑制肿瘤细胞增殖和血管新生、诱导肿瘤细胞凋亡和分化、逆转肿瘤细胞多药耐药、抑制肿瘤细胞侵袭和转移及增加机体免疫功能等,探讨毒性中药作为抗肿瘤新药研究与开发的前景。
毒性中药; 恶性肿瘤; 机制
恶性肿瘤是严重威胁人类健康和生命的重大疾病,其防治策略一直是医药工作者研究的重点。历代医家常采用药性剧烈的毒性中药,达到攻坚蚀疮、破瘀散结、以毒攻毒的目的[1]。现代医学研究证实,毒性中药在恶性肿瘤的治疗中作用显著,但其较大的毒性也带来临床应用上的限制。众多毒性中药的抗肿瘤效应与其毒性作用是否直接相关,尚存在较大争议[2]。笔者就近年来毒性中药相关抗肿瘤作用的研究概况进行综述,为该类中药作为抗肿瘤药物的研发提供依据与参考。
1 毒性中药的毒性成分
毒性中药是指含有剧毒成分,药性峻烈,治疗窗窄,使用不当会致人中毒或死亡的中药,其成分不同,对人体产生毒性的作用也不同[3]。毒性中药的主要毒性成分有金属元素、生物碱、毒蛋白类、生物碱类、苷类、萜类及内酯类等[4]。
1.1 金属元素 含砷、铅、汞等金属元素的矿物类中药,如砒霜、雄黄、水银、朱砂、铅粉等,对人体毒性较大。汞具有强烈刺激和腐蚀作用,抑制多种酶的活性,引起中枢神经和植物神经紊乱;砷具有原浆毒作用,能抑制含巯基的酶蛋白活性,扩张毛细血管,使血压降低,并可以损害神经细胞;铅为多亲和性毒性物质,损害神经、造血、消化和心血管系统[5]。
1.2 生物碱类 主要毒害中枢神经系统。川乌、草乌、附子等植物,含有二萜类生物碱,作用于中枢神经和周围神经,使之先兴奋后抑制甚至麻痹,还作用于心脏,导致心律失常;马钱子含有番木鳖碱,选择性兴奋脊髓,引起特殊的强直性痉挛,因呼吸肌强直性收缩而引起窒息死亡[5-6];雷公藤含有雷公藤定碱,引起视丘、延脑、中脑、脊髓的病理改变,使心脏、肝肾等脏器出血坏死。
1.3 毒蛋白类 主要对消化系统有毒性,可强烈刺激和腐蚀胃肠道,引起内脏的出血。苍耳子、巴豆、蓖麻子等均含有毒蛋白,可导致剧烈吐泻、尿血,甚至惊厥及死亡[5-6]。
1.4 苷类 小剂量强心苷有强心作用,较大剂量或较长时间的应用则可导致心脏中毒甚至停博。夹竹桃、八角枫、万年青等中药含有毒性强心苷;苦杏仁、白果等中药含有氰苷,在体内被酶水解后产生的氰氢酸为强细胞毒性物质;木通、商陆、黄药子等中药含有皂苷类,对循环系统有毒性作用,能抑制呼吸、损害心脏,可引起溶血;芫花、广豆根等中药含有黄酮苷,刺激胃肠道,造成肝脏损害,并可引起恶性呕吐、黄疸[6-7]。
1.5 萜类及内酯类 对局部有强烈刺激性,并可抑制中枢神经系统。艾叶含挥发油,能刺激胃肠道,引起肝损害;马桑含有马桑内酯,可兴奋大脑及延脑,降低体温,引起惊厥或窒息[8]。
2 毒性中药的抗癌机制
现代药理研究证实,多种毒性中药具有明显的抗肿瘤作用,但机制复杂。目前研究较为深入的毒性中药抗肿瘤的相关机制包括以下几方面。见表1。
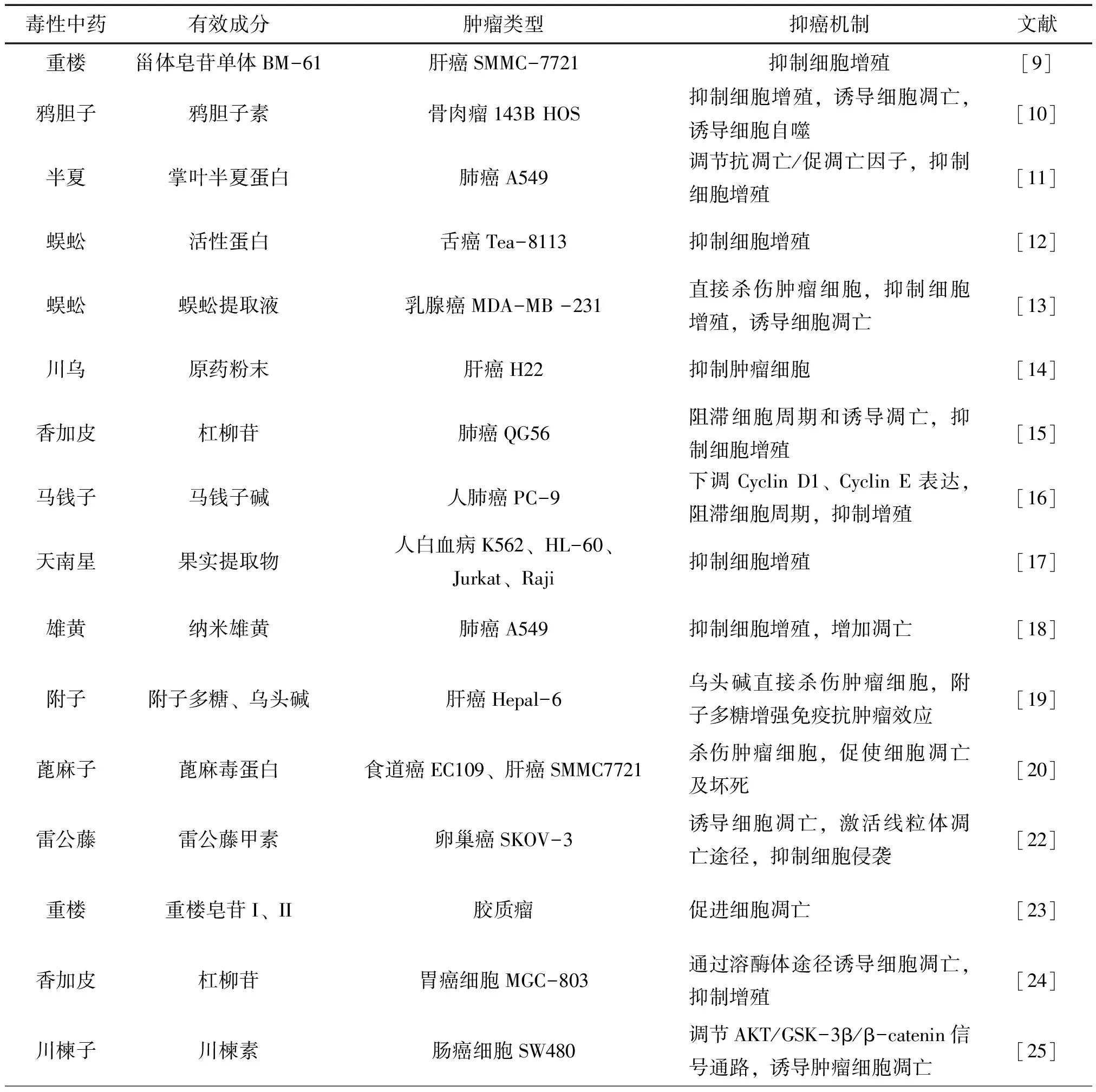
表1 常见毒性中药抗肿瘤机制研究

续表 表1 常见毒性中药抗肿瘤机制研究
2.1 抑制肿瘤细胞增殖 肿瘤发生的主要原因是细胞周期失调后导致的细胞无限增殖,较多毒性中药对不同肿瘤细胞具有不同程度的直接杀伤作用,或可通过阻滞细胞周期,来抑制肿瘤细胞增殖,发挥抗肿瘤作用。例如重楼[9]、鸦胆子[10]、半夏[11]、蜈蚣[12-13]、川乌[14]、香加皮[15]、马钱子[16]、天南星[17]、雄黄[18]、附子[19]、蓖麻子[20]等。郑颖等[10]研究报道经鸦胆子素D作用后骨肉瘤143B HOS细胞的存活率下降,细胞克隆数下降,G0/G1期细胞比例增高,细胞凋亡比例增加。张明川等[11]研究发现掌叶半夏蛋白对人肺癌细胞A549具有明显细胞增殖抑制作用,且呈剂量依赖性,掌叶半夏蛋白组在 G0~G1期肺癌细胞明显增多,而S期肺癌细胞明显减少,差异均有统计学意义,推测其可能是通过调节抗凋亡/促进凋亡因子(Bcl-2/Bax)平衡,从而抑制细胞增殖。刘兵等[12]研究发现在一定范围内,少棘蜈蚣活性蛋白对舌癌Tea-8113细胞具有一定体外抗肿瘤活性,并呈现量效依赖关系和时间依赖关系,推测其抑瘤活性与丝蛋白酶溶解破坏肿瘤细胞的完整结构相关。
2.2 诱导肿瘤细胞凋亡 细胞凋亡是由多基因调控的一种生理性或病理性的自杀性细胞死亡方式,它与肿瘤的发生、发展有密切关系。雷公藤[21-22]、重楼[23]、香加皮[24]、川楝子[25]、吴茱萸[26]、马钱子[27]、斑蝥[28]、蜈蚣[13]、杏仁等[29]均可通过调控肿瘤细胞凋亡相关基因的表达和激活相关信号转导通路,诱导细胞凋亡,抑制肿瘤生长增殖,这是毒性中药抗癌的重要机制之一。Tozawa等[21]发现雷公藤红素能够使多发性骨髓瘤细胞株停滞在G期,并诱导细胞凋亡,其机制可能与激活核转录因子-Κb和Caspase-3途径有关。郑彬等[23]研究发现重楼皂苷I和重楼皂苷II对胶质瘤细胞U251具有明显抗肿瘤作用,其作用机制与上调Fas、Caspase-8和Caspase-3表达,促进细胞凋亡相关。冯程程[25]研究发现川楝素作用于人肠癌SW480细胞后能明显引起早期凋亡,可见凋亡小体等凋亡形态学改变,并呈现浓度依赖性,G0/G1期前出现明显亚二倍体,细胞被阻滞于S期,其可能通过AKT/GSK-3β/β-catenin信号通路诱导肿瘤细胞凋亡。
2.3 抑制肿瘤血管新生 肿瘤的生长和转移很大程度上依赖于新生血管的生成,因此,抑制血管生成已成为抗肿瘤治疗的有效途径。肿瘤新生血管形成过程中,血管内皮细胞的增殖和迁移是血管新生的最重要的环节。水蛭[30]、全蝎[31]、斑蝥等[32-33]均可通过抑制肿瘤血管新生,发挥其抗肿瘤作用。李小菊等[30]研究报道表明水蛭可通过改善肿瘤缺氧微环境、抑制血管生成来发挥抗肿瘤作用,其机制可能是通过降低HIF-1a蛋白水平和mRNA的表达,及降低由HIF-1a所介导的靶基因VEGFmRNA的表达来实现的。隋文文[31]研究发现蝎毒多肽提取物可抑制小鼠H22肝癌移植瘤的生长,通过影响肿瘤微环境中PTEN、PI3K、P-Akt、COX-2、HIF-1a和VEGF-A的表达,而达到抗肿瘤血管生成的作用。Zhang等[32]研究去甲斑蝥素对血管内皮生长因子(VEGF)、血管内皮生长因子受体(VEGFR2)及其下游信号分子MEK、ERK的影响,结果发现去甲斑蝥素通过抑制VEGFR2/MEK/ERK信号通路活化,削弱VEGF的作用,减少了肿瘤血管生成。
2.4 诱导肿瘤细胞分化及老化 细胞分化异常是肿瘤细胞最本质的特征,诱导分化是指在体内外分化诱导剂的作用下,恶性肿瘤细胞向正常细胞方向逆转的现象。肿瘤细胞老化缺陷,不能进入完全老化程序,或发生不成熟老化,被致癌基因激活,可导致肿瘤复发。因此,诱导肿瘤细胞分化,促进细胞完全老化,也是治疗肿瘤的重要方法和研究热点,如水蛭[34]、蛇床子[34]、雷公藤[36]等毒性中药。肖移生等[34]研究发现经水蛭提取物处理的人白血病HL-60细胞,其CD11b表达升高,说明水蛭提取物可诱导HL-60向成熟粒系方向分化,从而抑制肿瘤细胞增殖。苏立平[35]研究发现蛇床子素对2种肝癌大鼠模型的抗肿瘤作用,体现在给药组肿瘤分化程度有一定程度升高,从而降低其侵袭能力,同时血管内皮细胞VEGF表达明显降低。潘燕燕[36]研究发现雷公藤内酯酮显著抑制白血病细胞HL60和U937细胞的生长,诱导出现体积增大,细胞核难以分裂等细胞老化的形态学改变,激活白血病细胞中老化关键基因TERT的表达,上调p16和p21的表达,同时激活MKK3-p38-DDIT3信号通路,导致老化细胞凋亡,发挥抗癌效应。
2.5 逆转肿瘤细胞多药耐药 对单一或多种药物治疗出现的耐药现象是恶性肿瘤的特点,极可能导致化疗失败和复发。逆转耐药是抗肿瘤治疗的重要手段,作用机制包括抑制mdr1的功能与表达,抑制P-糖蛋白的表达,提高DNA拓扑异构酶II的活性,抑制谷胱甘肽-S-腺苷转移酶-π的表达等。雷公藤[37-38]、马钱子[39]、蛇床子等[40]通过此类机制发挥抗肿瘤作用。郭琼等[37]研究发现经雷公藤内酯醇预处理的DU145/ADM细胞,其mdr1表达明显下降,肿瘤细胞对阿霉素敏感性增加,提示雷公藤内酯醇可能成为一种耐药逆转剂。梁虹等[39]研究表明,马钱子碱通过下调K562/A02细胞多药耐药基因mRNA的表达,导致细胞膜上药物外排泵P-糖蛋白(P-gp)的表达量减少,化疗药物从细胞内溢出减少,从而部分逆转人慢性白血病细胞系K652/A02细胞的耐药性。
2.6 抑制肿瘤细胞侵袭和转移 侵袭和转移是恶性肿瘤的生物学特性,也是造成肿瘤治疗失败和患者死亡的重要原因。基质金属蛋白酶、肝素酶、血管扩张刺激磷蛋白、血管生成因子等,对于肿瘤细胞的转移和侵袭发挥着主要作用。全蝎[31]、雷公藤[42-45]、青风藤等[46]均可发挥此类作用机制。郝征等[41]研究报道蝎毒多肽具有抑制uPA及uPAR、MMP2、MMP9基因与蛋白的作用,干预细胞外基质降解机制,阻抑急性白血病髓外浸润传变的进展。Yadav等[42]研究发现雷公藤红素通过下调CXCR4 趋化因子受体的表达而抑制结肠癌和胰腺癌细胞的侵袭和转移。Kim等[43]研究报道雷公藤红素是通过抑制NF-κB介导的MMP-9表达,而抑制PMA 诱导的乳腺癌细胞侵袭和迁移。Zhu等[44]研究发现雷公藤红素抑制人肺癌95-D和小鼠黑色素瘤B16F10 细胞的细胞外基质(ECM)的黏附,并在体内抑制注入B16F10绿色荧光蛋白基因的C57BL/6小鼠模型的肺转移,表明雷公藤红素在体内外均有较好抗转移活性。
2.7 增加机体免疫功能 肿瘤的发病机制与免疫反应和免疫调节功能减低密切相关。免疫治疗在提高患者生存质量,对抗恶性肿瘤中起到举足轻重的作用。川楝子[47]、白附子[48-49]、蟾蜍等[50]毒性中药可通过增加免疫功能发挥抗肿瘤作用。候西栋[47]研究发现川楝子水煎液呈剂量依赖性抑制Lewis和A549肺癌细胞增殖,明显下调自噬相关蛋白LC3及Beclinl的表达,并可减少肺癌小鼠血清中hs-CRP、IL-6的表达,增加 IgG的表达,说明川楝子的抗肿瘤和抗转移作用机制可能与增强机体免疫功能,阻止肿瘤细胞自噬,改善机体内环境相关。于晓红等[48-49]研究发现白附子能明显抑制H22细胞的生长,促进荷瘤小鼠的胸腺发育,通过改善荷瘤机体CD4/CD8的失衡状态,促进IL-2等TH1型细胞因子的表达,而提高荷瘤机体免疫功能。
3 结语与展望
肿瘤是指机体在各种致瘤因子作用下,局部组织细胞增生所形成的新生物。历代医家运用药性剧烈的毒性中药治疗恶性肿瘤的历史悠久,取药毒,攻邪毒,是中医药辨证治疗的精髓。用以毒攻毒的治疗方法,使得一批有毒性的中药有潜力成为抗肿瘤新药的筛选对象,具有良好的研发前景。通过对毒性中药抗肿瘤作用机制的研究整理,可以使毒性中药在抗肿瘤作用方面发挥更大的作用。
随着科学发展,应用现代提取分离纯化手段,UV、HPLC、GC-MS等现代化分析技术、现代分子生物学技术和方法及建立多层次新药筛选平台等,可以更深入地研究毒性中药的毒性-药效物质基础,体内过程,作用机制,及其炮制加工、制剂、配伍、应用规律等,揭示毒性中药的科学内涵, 为抗肿瘤新药的研究开发以及中药产业可持续发展提供科学支撑和理论依据。
[1]常中飞,李菁,胡秀敏.浅论抗恶性肿瘤中药及有效成分研究思路与方法[J].时珍国医国药,2011,22(4):1027-1029.
[2]亿亚丽,朱秉宜,谷云飞.试述“有毒”中药在恶性肿瘤防治中的应用[J].辽宁中医药大学学报,2013,15(8):160-162.
[3]彭成,王昌恩,林娜. 有毒中药毒效相关性基础研究的意义与实践[J]. 中药药理与临床, 2008, 24(1): 71-73.
[4]白晓菊, 赵燕. 试论有毒中药的合理应用[J]. 中国药物警戒, 2009, 6(9): 526-529.
[5]张须学, 程晓卫. 有毒中药的抗癌作用及合理应用[J]. 中草药, 2005, 36(5): 795-796.
[6]裴为国, 黄治东. 探讨有毒中药的合理应用分析[J]. 内蒙古中医药, 2013, 32(13): 92.
[7]何昕. 探讨有毒中药的合理应用[J]. 中国民族民间医药, 2012(4): 49-50
[8]陈成. 中药毒副作用机理探析[J]. 中国民族民间医药,2010(21):14-20.
[9]仲光勇, 王昌利, 宋延平, 等. 陕重楼甾体皂苷类单体B(BM-61)对SMMC-7721细胞增殖的影响[J]. 河南中医,2016,36(4):135-138.
[10]郑颖, 王刚阳, 陈瑞玲, 等. 探讨鸦胆子素D对骨肉瘤细胞增殖、凋亡与自噬的作用[J]. 中国骨与关节杂志, 2017, 6(6): 433-438.
[11]张明川, 赵刚, 舒畅, 等. 掌叶半夏蛋白对肺癌细胞增殖的影响研究[J]. 现代医药卫生, 2016, 32(24): 3760-3762.
[12]刘兵, 谭竹钧, 孔祥平, 等. 少棘蜈蚣活性蛋白对舌癌细胞Tea-8113的抑制作用研究[J]. 时珍国医国药, 2013, 24(6):3-4.
[13]周恩相. 蜈蚣提取液治疗乳腺癌的实验研究[D]. 长沙: 中南大学, 2011.
[14]黄秀曼, 刘迎辉, 杜钢军. 川乌抗肿瘤初步研究[J]. 河南大学学报(医学版), 2014, 33(2): 82-84.
[15]张静, 杨光, 赵学涛, 等. 香加皮杠柳苷对人肺癌QG56细胞抑制作用的研究[J]. 天津医药, 2014, 42(3): 197-199.
[16]李苗, 李平, 张梅, 等. 马钱子碱通过阻滞细胞周期抑制人肺癌细胞株PC-9增殖[J]. 中国肺癌杂志, 2014, 17(6): 444-450.
[17]杨国平, 曹怀泽, 李杨, 等. 天南星果实对4株人白血病细胞株的体外抑瘤作用研究[J]. 西北药学杂志, 2012, 27(2): 133-135.
[18]王巍炜, 王德光, 巫正伟, 等. 纳米雄黄对肺癌A549细胞增殖、凋亡及迁徙的影响[J].中国组织工程研究, 2016, 20(34);5098-5103.
[19]钱珍. 附子多糖联用乌头碱对肝细胞肝癌的作用及机理初步研究[D]. 南京: 南京中医药大学, 2015.
[20]陈元. 蓖麻种子毒蛋白的纯化及相关性质的研究[D]. 开封: 河南大学, 2014.
[21]Tozawa K, Sagawa M, Kizaki M. Quinone methide tripterine, celastrol, induces apoptosis in human myeloma cells via NF-κB pathway[J]. Inter J Oncology, 2011, 39(5): 1117-1122.
[22]刁幼林, 于建华. 雷公藤甲素诱导卵巢癌SKOV-3细胞株凋亡的实验研究[J]. 中国医师杂志, 2017, 19(6): 889-892.
[23]郑彬, 王穗暖, 屈洪涛, 等. 重楼皂苷I与重楼皂苷II对胶质瘤细胞U251的抑制作用及其机制研究[J]. 中华神经医学杂志,2013, 12(12): 1220-1223.
[24]李磊, 赵连梅, 崔雯萱, 等. 香加皮杠柳苷通过溶酶体途径诱导胃癌MGC-803细胞凋亡[J]. 肿瘤防治研究, 2016, 43(5):335-340.
[25]冯程程. 川楝素对人肠癌SW480细胞的抑制作用及其作用机制的探讨[D]. 南京: 南京中医药大学, 2014.
[26]袁源, 李松霖, 王忠华, 等. 吴茱萸碱抑制Wnt/β-catenin信号通路诱导骨肉瘤MG-63细胞凋亡[J]. 国际肿瘤学杂志, 2017, 44(2): 86-90.
[27]李逦, 王纯, 卢宏达. 马钱子碱通过抑制IL-6/STAT3信号通路诱导结肠癌SW480细胞凋亡[J]. 中国病理生理杂志, 2016, 32(6): 998-1003.
[28]颜道宇, 郑典鹏, 高维鸿, 等. 去甲斑蝥素诱导肿瘤干细胞凋亡作用研究[J]. 中草药, 2017, 48(11): 2237-2241.
[29]ZHOU C, QIAN L, MA H, et al. Enhancement of amygdalin activated with β-D-glucosidase on HepG2 cells proliferation and apoptosis[J]. Carbohydrate Polymers, 2012, 90(1): 516-523.
[30]李小菊, 卢宏达, 陈卫群, 等. 水蛭抑制肿瘤血管生成的作用及其机制[J]. 肿瘤防治研究, 2013, 40(1): 46-50.
[31] 隋文文. 蝎毒多肽提取物抑制H22肝癌血管生成的作用机制研究[D]. 济南: 济南大学,2014.
[32]Zhang L, Ji Q, Liu X, et al. Norcantharidin inhibits tumor angiogenesis via blocking VEGFR2/MEK/ERK signaling pathways[J]. Cancer Science, 2013, 104(5): 604-610.
[33]杜向青. 去甲斑蝥素抑制乳腺癌MCF-7细胞血管生成研究[J]. 中医学报, 2015, 30(1): 23-24.
[34]肖移生, 侯吉华, 廖夫生, 等. 水蛭提取物对HL-60细胞增殖和分化的影响[J]. 江西中医药, 2014, 45(9): 32-34.
[35]苏立平, 薛明明, 陈立, 等.蛇床子素对大鼠肝癌动物模型肝细胞生物行为学特性及血管特征的影响[J]. 中国生化药物杂志, 2014, 34(6): 35-37.
[36]潘燕燕. 中草药单体雷公藤内酯酮诱导细胞完全老化的抗急性髓细胞白血病新策略及机制研究[D]. 苏州: 苏州大学, 2016.
[37]郭琼, 南小新, 张欢, 等. 雷公藤内酯醇对DU145/ADM细胞阿霉素化疗敏感性及逆转耐药的影响[D]. 长沙: 中南药学, 2013, 11(2): 81-84.
[38] 衣君玫. 抗肿瘤耐药化合物雷公藤内酯醇与YCH337的作用及机制研究[D]. 北京: 中国科学院大学, 2016.
[39]梁虹, 茆俊卿, 张育, 等. 马钱子碱对白血病K562/A02细胞多药耐药性的逆转作用[J].肿瘤防治研究, 2010, 37(7): 739-743.
[40]王晓华. 蛇床子素逆转人膀胱肿瘤T24/ADM细胞耐药作用及其机制[D]. 太原: 山西医科大学,2012.
[41]郝征, 杨文华. 蝎毒多肽干预急性白血病髓外浸润传变的机制[J]. 中华中医药杂志, 2012, 27(4): 1106-1110.
[42]Yadav VR, Sung B, Prasad S, et al. Celastrol suppresses invasion of colon and pancreatic cancer cells through the downregulation of expression of CXCR4 chemokine receptor[J]. J Mol Med(Berl), 2010, 88(12): 1243-1253.
[43]Kim Y, Kang H, Jang SW, et al. Celastrol inhibits breast cancer cell invasion via suppression of NF-kB-mediated matrix metalloproteinase-9 expression[J]. Cell Physiol Biochem, 2011, 28(2): 175-184.
[44]Zhu H, Liu XW, Cai TY, et al. Celastrol acts as a potent antimetastatic agent targeting beta1 integrin and inhibiting cell-extracellular matrix adhesion, in part via the p38 mitogen- activated protein kinase pathway[J]. J Pharmacol Exp Ther, 2010, 334(2): 489-499.
[45]梅彧. MiR-27a对前列腺癌细胞迁移和侵袭的影响[D]. 哈尔滨: 哈尔滨工业大学, 2015.
[46]谢涛. 青藤碱通过ROS诱发内质网应激导致骨肉瘤凋亡并抑制骨肉瘤增殖、侵袭、转移[D]. 杭州: 浙江大学, 2016.
[47]候西栋. 川楝子对肺癌的治疗作用及其机制初步研究[D]. 开封: 河南大学, 2015.
[48]于晓红, 阚红敏, 胡艳文. 白附子混悬液对H22荷瘤小鼠肿瘤生长抑制作用及其免疫器官功能的影响[J]. 浙江中医药大学学报, 2011, 35(5): 735-740.
[49]于晓红, 宋娜, 胡艳文. 白附子混悬液对H22荷瘤小鼠抗肿瘤作用的免疫调节机制研究[J]. 天津中医药, 2011, 28(4): 326-328.
[50]邹振玉. 蟾皮抗肿瘤活性组分筛选及荷人结肠癌裸鼠淋巴道化疗的实验研究[D]. 北京:中国人民解放军医学院, 2013.
ResearchProgressofToxicTraditionalChineseMedicineinTreatingMalignantTumor
XU Jiaying HUAGN Yueyan*
Jiaxing University College of Medicine, Jiaxing 314001, China
Fight poison with posion is one of the important means of traditional Chinese medicine in the treatment of malignant tumors. The author reviewed the recent experimental studies on antitumor effect of the toxic traditional Chinese medicine. The mechanism of the toxic traditional Chinese medicine in the treatment of malignant tumors include: inhibition of tumor cell proliferation and angiogenesis, inducing apoptosis and differentiation of tumor cells, reversal of multidrug resistance in tumor cells, inhibition of tumor cell invasion and metastasis, and increase immune function. This paper discusses the prospect of the research and development of toxic traditional Chinese Medicine as a new anticancer drug.
Toxic Traditional Chinese Medicine; Malignant Tumors; Action Mechanism
浙江省科技厅实验动物计划项目(2018C37091);浙江省教育厅科研项目(Y201431468);嘉兴市科技局科技计划项目(2016AY23096);浙江省大学生科技创新活动项目(2016R417009);嘉兴学院2016年SRT计划项目(SRT2016C093)。
徐佳颖(1997-),女,药学专业本科在读。E-mail: 1353871067@qq.com
黄越燕(1976-),女,汉族,硕士研究生,副教授,研究方向为中药抗肿瘤药理学。E-mail:hyylinda@163.com
R73
A
1007-8517(2017)21-0053-06
2017-09-14 编辑:陶希睿)
