SACC-83来源的外泌体调节唾液腺间质成纤维细胞表达FAP的实验研究
2017-11-29宋梦阳王方圆侯晋殷学民
宋梦阳 王方圆 侯晋 殷学民
SACC-83来源的外泌体调节唾液腺间质成纤维细胞表达FAP的实验研究
宋梦阳 王方圆 侯晋 殷学民
目的研究腺样囊性癌(adenoid cystic carcinoma,ACC)细胞SACC-83来源的外泌体(exosome,EXO)对人正常唾液腺间质成纤维细胞(human normal salivary gland stromal fibroblasts,hSGSFs)表达成纤维细胞活化蛋白(fibroblast activation protein,FAP)的影响。方法采用超滤管浓缩与EXO提取试剂盒相结合的方法从SACC-83的培养上清中提取EXO,通过透射电镜及Western Blot对所提取的EXO进行鉴定;将SACC-83来源的EXO用荧光染料PKH67标记后与hSGSFs共培养48 h,采用激光扫描共聚焦显微镜(LSCM)观察hSGSFs对于SACC-83来源的EXO的摄取情况;利用qRT-PCR和Western Blot法检测在SACC-83来源的EXO作用下,hSGSFs中FAP的表达变化。结果SACC-83培养上清中所提取到的微囊泡直径为30~100 nm,EXO的膜蛋白标记物CD63和TSG101的表达为阳性;携带PKH67荧光标记的EXO可被hSGSFs摄取,并可在mRNA和蛋白水平上调hSGSFs中FAP的表达。结论SACC-83来源的EXO可被hSGSFs摄取,并可显著上调hSGSFs中FAP的表达。提示ACC可能通过EXO途径促进正常唾液腺间质成纤维细胞向癌相关成纤维细胞(cancer-associated fibroblasts, CAF)的转化。
腺样囊性癌; 外泌体; 成纤维细胞活化蛋白; 癌症相关成纤维细胞
外泌体(exosome,EXO)是指由细胞内多泡小体(MVBs)与细胞质膜融合并把其内含小泡分泌至细胞外的一类膜性生物小囊泡[1]。研究证实,EXO广泛存在于血液、唾液、尿液、乳汁以及羊水等多种体液中,而且所有体外培养细胞的培养上清中都含有EXO[2]。肿瘤细胞来源的外泌体(tumor exosomes, TEX)是指来源于肿瘤细胞并向外分泌至肿瘤微环境中的外泌体,由于其包裹着肿瘤细胞所产生的特异性肿瘤调控相关的蛋白质、mRNA 和ncRNA,并可将这些活性物质靶向性传递给间质细胞、内皮细胞、炎症细胞以及免疫细胞,通过影响受体细胞基因表型改变蛋白功能,达到促进肿瘤增殖、侵袭、转移以及免疫抑制的目的;或在局部及远处形成一个“肿瘤转移前微环境”(pre-metastatic niche),以利于肿瘤细胞转移。TEX与正常细胞来源的EXO相比具有其特殊性,即它可以“驯化”肿瘤微环境细胞,使其获得恶性肿瘤的间质细胞特征,甚至可以将正常细胞转变为肿瘤细胞[3]。
肿瘤微环境中包含间质成纤维细胞、细胞外基质以及血管等成分,其中癌症相关成纤维细胞(cancer-associated fibroblast, CAF)已被证实在肿瘤发展的各阶段具有显著的作用[4]。细胞表面抗原成纤维细胞激活蛋白(fibroblast activation protein,FAP)作为CAF的重要标记物,研究证实FAP在肿瘤的发生发展过程中具有促进肿瘤血管生成及促进细胞外基质降解等作用,从而促进肿瘤的侵袭转移[5]。本文探讨腺样囊性癌细胞株SACC-83来源的TEX对正常人唾液腺间质成纤维细胞(human salivary gland stromal fibroblasts, hSGSFs)中FAP表达的影响,为进一步研究ACC来源的TEX在ACC侵袭和转移中的调节作用奠定基础。
1 材料与方法
1.1 主要仪器与试剂
DMEM 培养基、RPMI 1640 培养基、胎牛血清(fetal bovine serum,FBS)(Corning,美国);角质细胞培养基(KGM-Gold Keratinocyte Growth Medium) (Lonza, 美国);青霉素100 U/ml、链霉素100 μg /ml、胰蛋白酶(Gibco,美国);RNAiso Plus、逆转录试剂盒(TaKaRa,日本);荧光定量PCR试剂盒(Roche,瑞士);兔抗人CD63单克隆抗体、兔抗人TSG101单克隆抗体、兔抗人FAP多克隆抗体(Abcam,英国);100 kDa 超滤管(Millipore,美国);Total Exosome Isolation Reagent(Invitrogen,美国);Micro BCA Protein Assay Kit(Thermo Fisher,美国);PKH67 Green Fluorescent Cell Linker Mini Kit(Sigma,美国);Alexa Fluor®594 Phalloidin(molecular probe,美国);共聚焦培养皿(NEST);FV10i 激光扫描共聚焦显微镜(Olympus,日本);65670 贝克曼高速离心机(Beckman,美国);罗氏L480实时荧光定量PCR仪(Roche,瑞士);Odyssey近红外成像系统(Licor,德国)。
1.2 人唾液腺间质成纤维细胞的原代培养及鉴定、SACC-83的传代培养
用于hSGSFs的原代培养的样本取自南方医科大学南方医院口腔颌面外科住院患者因舌下腺囊肿需要摘除的舌下腺间质组织。术前患者未接受过任何治疗,采用组织块法培养hSGSFs,待细胞生长汇合达70%~80%时,进行传代、鉴定,取生长良好的第4代hSGSFs,使用免疫细胞化学染色方法对其进行鉴定。
复苏后的SACC-83细胞(中山大学孙逸仙纪念医院李劲松教授馈赠)用含10%FBS的RPIM 1640培养基进行常规培养,待细胞生长稳定后,用无菌PBS洗涤细胞3 遍,更换为无血清的KGM培养基常规培养,每72 h换液,收集培养上清用于TEX的提取。
1.3 腺样囊性癌细胞SACC-83来源的EXO的提取及透射电镜观察
将收集的SACC-83细胞培养上清液在4 ℃下以300 g力离心5 min,去除死亡细胞,再行2 000 g力离心20 min,10 000 g力离心30 min,以去除其他MVBs;将离心后的上清液用100 kDa的超滤管浓缩,在得到的上清浓缩液中,以2∶1比例加入Total Exosome Isolation Reagent(Invitrogen,美国),4 ℃过夜,10 000 g力离心60 min,将所得沉淀用PBS重悬,使用Micro BCA Protein Assay Kit进行定量。所得到的外泌体用2%磷钨酸负染后,滴于铜网上,透射电镜下观察(120 kV)。
1.4 hSGSFs 对SACC-83来源的EXO的摄取实验
使用PKH67 Green Fluorescent Cell Linker Mini Kit,按说明书对SACC-83来源的TEX进行标记。将hSGSFs以104/ml密度接种于共聚焦培养皿中,待细胞贴壁后,加入2 μg PKH67标记的TEX。常规培养48 h后,吸弃培养液,细胞用PBS清洗2 次;4%多聚甲醛固定10 min,PBS洗涤2~3 次,每次10 min,1%Triton 透化处理10 min;然后PBS洗涤2~3 次,每次10 min;加入1 ml 1%BSA,孵育20~30 min;滴加适宜浓度的Alexa Fluor®594 Phalloidin和DAPI对细胞骨架中的F-actin和细胞核进行染色;共聚焦显微镜下观察hSGSFs对SACC-83来源的TEX的摄取情况。
1.5 qRT-PCR
将2 μg SACC-83来源的TEX与hSGSFs共培养72 h后收集细胞,将收集的细胞用RNAiso Plus裂解,按照产品说明提取总RNA。以总RNA为模板,使用PrimerScript RT Reagent Kit试剂盒进行逆转录。qRT-PCR检测FAP基因在对照组与TEX处理组的hSGSFs中的表达。所用引物序列见表 1。反应条件为:95 ℃ 5 min(预变性);95 ℃ 10 s(变性);60 ℃ 20 s(退火);72 ℃ 20 s(延伸);变性、退火、延伸共45 个循环。

表 1 FAP及GAPDH引物序列及大小
1.6 Western Blot
将提取的SACC-83来源的EXO或收集的细胞用含有蛋白酶抑制剂的RIPA裂解液裂解,提取总蛋白,用BCA法定量,每个样本以40 μg的总蛋白量进行SDS-PAGE电泳,Odyssey近红外成像系统扫描成像。
1.7 统计学分析
qRT-pCR实验数据采用2-ΔΔCT法进行处理。用SPSS 19.0统计软件进行相关数据分析,两组间数据比较采用独立样本t检验,检验水准α=0.05,采用双侧性检验。
2 结 果
2.1 TEX的鉴定
透射电镜下,可以观察到从SACC-83培养上清中提取的微囊泡直径在30~100 nm之间(图 1),符合文献报道的外泌体的直径范围。Western Blot结果显示,该微囊泡表达外泌体特异性蛋白CD63和TSG101(图 2),证实所提取的微囊泡为外泌体。

图 1 透射电镜下观察来源于腺样囊性癌细胞SACC-83的外泌体
Fig 1 Exosomes derived from SACC-83 cells oberved under TEM
2.2 免疫细胞化学染色鉴定hSGSFs
对细胞进行免疫组化染色观察,显示细胞角蛋白CK19染色阴性, 而波形丝蛋白染色强阳性,胞质内阳性颗粒均匀分布,胞核清晰、无染色;证明培养的细胞为中胚层来源,且无上皮源性细胞混杂(图 3)。结合取材部位可证明所培养的细胞为hSGSGs。
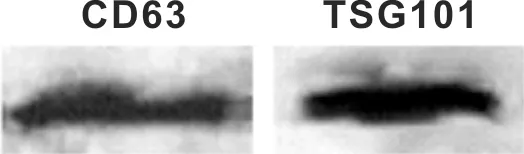
图 2 Western blot鉴定外泌体特异性蛋白CD63、TSG101
Fig 2 Western blot analysis of exosomal markers CD63 and TSG101

图 3 免疫细胞化学染色结果显示原代培养的hSGSFs
(A: CK19表达, B: Vimentin表达; ×200)
Fig 3 Primarily cultured normal human SGSFs examined by IHC
(A: CK19 expression, B: Vimentin expression; ×200)
2.3 hSGFSs对于SACC-83来源的TEX的摄取
SACC-83来源的TEX作用hSGSFs 72 h后,激光扫描共聚焦显微镜下可观察到:被PKH67标记的、呈现绿色荧光的TEX主要位于hSGFs的胞质内,且主要分布在核周;而且几乎所有的细胞内都可观察到绿色荧光。此实验结果说明,正常唾液腺间质成纤维细胞可摄取SACC-83来源的TEX(图 4),也就是说,hSGSFs 是SACC-83来源的TEX的靶细胞。腺样囊性癌细胞可能通过外泌体途径改变正常唾液腺间质成纤维细胞基因和蛋白的表达。

图 4 共聚焦显微镜下观察共培养48 h后hSGSFs对SACC-83来源的TEX的摄取 (×60)
Fig 4 Confocal microscopy observation of PKH67-labeled (green) SACC-83 TEX uptake by hSGSFs after co-culture for 48 h (×60)
2.4 腺样囊性癌来源TEX对于hSGSFs中FAP表达的影响
SACC-83来源的TEX作用hSGSFs 72 h后,qRT-PCR的结果显示:TEX处理组hSGSFs中FAP的表达水平明显高于对照组(P=0.006 7)(图 5)。我们应用Western Blot对该结果进行了蛋白水平的验证。Western Blot的结果显示,对照组的hSGSFs中FAP的表达为阴性,而在SACC-83来源的TEX作用后,hSGSFs中FAP的表达则呈阳性(图 5)。该实验结果提示,在SACC-83来源的TEX作用下,hSGSFs可能具备了向肿瘤相关性成纤维细胞转化的趋势;同样表明了ACC可以通过EXO途径改变间质细胞的生物学功能。
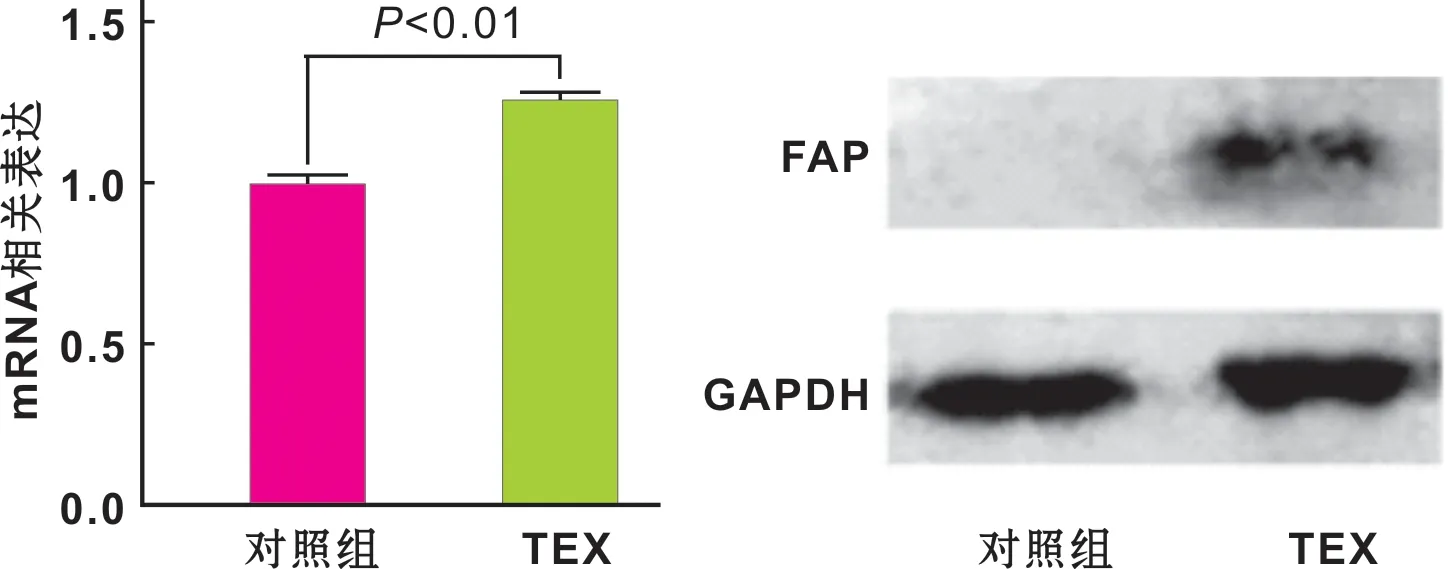
图 5 SACC-83细胞来源的TEX诱导hSGSFs中FAP的表达
Fig 5 Quantitative real time PCR and Western blot analysis of FAP mRNA and protein expression in hSGSFs after co-culture with TEX derived from SACC-83 cells
3 讨 论
肿瘤细胞来源的EXO作为肿瘤“信息”的携带者,通过供受体之间的交换作用将其内含的mRNA、miRNA、DNA等遗传物质靶向输送至肿瘤局部或远处的微环境受体细胞中,从而调节部分肿瘤相关因子的表达或促进上皮-间充质转化(epithelial-mesenchymal transition,EMT)等促瘤机制的激活,以达到促进肿瘤的生长、侵袭转移作用[6]。Clayton[7]研究组发现,来源于间皮癌、胰腺癌、结肠癌以及乳腺癌细胞的TEX皆能诱导成纤维细胞转化为具有CAF特性的成肌纤维细胞。Paggetti等[8]发现慢性淋巴细胞白血病细胞来源的EXO可以促进间质细胞的增殖、迁移以及炎性细胞因子的分泌,促进其转化成肿瘤相关成纤维细胞。这些研究都表明,TEX可以作用于正常细胞,促进肿瘤微环境的形成。
经研究证实,FAP作为肿瘤相关性成纤维细胞(cance-associated fibroblast,CAF) 的表面特异性抗原,在一系列的促瘤过程中具有重要作用[9]。Goodman等[10]发现在人乳腺癌细胞株MDA-MB-435/436中有高水平的FAP表达,提示FAP具有促进肿瘤生长的能力。Lai等[11]研究发现使用siRNA沉默FAP基因可以抑制肿瘤的生长,并导致体外CAF细胞周期的停止,达到抑瘤的效果。以上结果均证实了FAP作为肿瘤相关成纤维细胞CAF的特异性抗原,可使其母细胞获得恶性肿瘤的生物学特征,促进肿瘤的发生发展。
为了明确SACC-83来源的TEX是否能够靶向hSGSFs并促进其向CAF转化,本实验首先将PKH67绿色荧光标记的TEX与hSGSFs共培养,通过荧光共聚焦显微镜观察发现hSGSFs可以摄取SACC-83来源的TEX,表明了hSGSFs为SACC-83来源的TEX的靶细胞,这也意味着腺样囊性癌细胞可通过EXO途径将促瘤因子靶向传递给hSGSFs,以改变其基因表型,影响其生物学功能。随后本研究通过qRT-PCR和Western Blot实验证实了,经SACC-83来源的TEX作用后,hSGSFs内FAP的表达量显著增高,提示SACC-83来源的TEX具有诱导hSGSFs向CAF转化的能力,通过增加促瘤基因FAP的表达来调控肿瘤微环境中hSGSFs恶性化、致瘤化从而大大提高肿瘤的侵袭转移能力。但是TEX使hSGSFs内FAP含量增加的具体机制尚不明了,是通过miRNA基因调控亦或是其他转录因子的调控尚未可知,有待于进一步的深入研究。
本研究的结果显示,SACC-83来源的TEX可以被正常人唾液腺间质成纤维细胞所摄取,并可显著上调hSGSFs细胞内FAP的表达。该结果说明,SACC-83来源的TEX可以靶向hSGSFs,并改变其表型,促进其向癌症相关成纤维细胞的转化。
[1] Johnstone RM, Adam M, Hammond JR, et al. Vesicle formation during reticulocyte maturation.Association of plasma membrane activities with released vesicles (exosomes)[J]. J Biol Chem, 1987, 262(19):9412-9420.
[2] Salido-Guadarrama I, Romero-Cordoba S, Peralta-Zaragoza O, et al. MicroRNAs transported by exosomes in body fluids as mediators of intercellular communication in cancer[J]. Onco Targets Ther, 2014, 7:1327-1338.
[3] Milane L, Singh A, Mattheolabakis G, et al. Exosome mediated communication within the tumor microenvironment[J]. J Control Relaease, 2015, 219:278-294.
[4] Li M, Li M, Yi T,et al.Targeting of cancer-associated fibroblasts enhances the efficacy of cancer chemotherapy by regulating the tumor microenvironment[J].Mol Med Rep, 2016, 16 (3):2476-2484.
[5] Colombo M, Raposo G, Théry C, et al. Biogenesis,secretion, and intercellular interactions of exosomes and other extracellular vesicles[J]. Annu Rev Cell Dev Biol, 2014, 30:255-289.
[6] Kourembanas S. Exosomes: Vehicles of intercellular signaling, biomarkers, and vectors of cell therapy[J]. Annu Rev Physiol, 2014, 77:13-27.
[7] Webber J, Steadman R, Mason MD, et al. Cancer exosomes trigger fibroblast to myofibroblast differentiation[J]. Cancer Res, 2010, 70 (23):9621-9630.
[8] Paggetti J, Haderk F, Seiffert M, et al. Exosomes released by chronic lymphocytic leukemia cells induce the transition of stromal cells into cancer-associated fibroblasts[J]. Blood, 2015, 126(9):1106-1117.
[9] Lee HO, Mullins SR, Franco-Barraza J, et al. FAP-overexpressing fibroblasts produce an extracellular matrix that enhances invasive velocity and directionality of pancreatic cancer cells[J]. BMC Cancer, 2011, 11:245.
[10]Goodman JD, Rozypal TL, Kelly T. Seprase,a membrane-bound protease,alleviates the serum growth requirement of human breast cancer cells[J]. Clin Exp Metastasis, 2003, 20(5):459-470.
[11]Lai D, Ma L, Wang F. Fibroblast activation protein regulates tumor-associated fibroblasts and epithelial ovarian cancer cells[J]. Int J Oncol, 2012, 41(2):541-550.
(收稿: 2016-06-02 修回: 2016-09-07)
SACC-83-derivedexosomesinducefibroblastactivationproteinexpressioninnormalsalivaryglandstromalfibroblasts
SONGMengyang,WANGFangyuan,HOUJin,YINXuemin.
510515Guangzhou,DepartmentofOralandMaxillofacialSurgery,NanfangHospital,SouthernMedicalUniversity,China
Objective: To study the effects of exosomes(EXO) released by adenoid cystic carcinoma SACC-83 cells on the expression of fibroblast activation protein (FAP) in normal human salivary gland stromal fibroblasts (hSGSFs).MethodsACC exosomes were isolated from SACC-83 cell culture supernatant by using Total Exosome Isolation Reagent. The whole-mount EXO were characterized and assessed by transmission electron microscope and Western Blot. The exosomes were labeled with green fluorescent dye PKH67 and co-cultured with hSGSFs for 48h, followed by staining with Alexa Fluor 594 Phalloidin and DAPI. Afterwards, exsosomes uptake was observed under a laser scanning confocal microscope. After a 48-hour co-culture of SACC-83 exosomes with hSGSFs, the expression of FAP in SACC-83-EXO-treated hSGSFs was investigated by qRT-PCR and Western Blot.ResultsThe vesicles isolated from SACC-83 cell culture supernatant had the reported size range of 30-100 nm, expressed the exosomal marker CD63 and TSG101. After co-culture of hSGSFs with PKH67 labeled SACC-83 exosomes, exosomes were taken up by hSGSFs and FAP expression was elevated in hSGSFs.ConclusionExosomes derived from SACC-83 cells can be taken up by hSGSFs and can induce the expression of FAP in hSGSFs. These results suggest that exosomes derived from SACC-83 cells might induce the transformation of normal salivary gland stromal fibroblasts to cancer associated fibroblasts.
Adenoidcysticcarcinoma;Exosomes;Fibroblastactivationprotein;Cancer-associatedfibroblasts
广东省科技计划项目(编号: 2014A020212397)
510515 广州, 南方医科大学南方医院口腔颌面外科,南方医科大学口腔医学院
殷学民 E-mail: yinxm@fimmu.com
R739.8
A
10.3969/j.issn.1001-3733.2017.01.015
