脓毒症患儿免疫抑制与多器官功能障碍相关性研究
2017-11-29张宪伟
孙 杭 张宪伟
南京医科大学附属儿童医院检验科(江苏南京 210008)
脓毒症患儿免疫抑制与多器官功能障碍相关性研究
孙 杭 张宪伟
南京医科大学附属儿童医院检验科(江苏南京 210008)
目的研究脓毒症患儿免疫水平与病情严重程度的相关性,探讨免疫抑制对器官功能损害的影响。方法回顾分析375例脓毒症患儿的临床资料,分析患儿转入重症监护室24小时内免疫功能指标与器官损害数之间的关系;Logistic逐步回归分析发生多器官功能障碍综合征(MODS)及院内死亡的风险因素。结果375例脓毒症患儿中位年龄8.7个月(1个月~13岁),男228例、女147例,男女比例约1.55 :1。依据治疗期间发生功能障碍的器官数目,将脓毒症患儿分为无器官功能障碍组、单器官功能障碍组及多器官功能障碍组。三组间NK细胞百分比,CD4/CD8比值,补体C3、C4水平的差异均有统计学意义(P<0.05),以多器官功能障碍组最低。Logistic多因素回归分析显示,CD4/CD8比值(OR=0.66,95%CI:0.51~0.85)、补体C3(OR=0.20,95%CI:0.10~0.42)、中枢神经系统感染(OR=2.54,95%CI:1.35~4.77)和肺部感染(OR=2.29,95%CI:1.36~3.83)是MODS发生的影响因素;补体C3(OR=0.26,95%CI:0.09~0.76)及肺部感染(OR=2.61,95%CI:1.12~6.09)为脓毒症患儿院内死亡的影响因素。结论脓毒症患儿的免疫抑制与MODS发生有相关性,CD4/CD8比值降低以及补体C3消耗可作为评估脓毒症患儿MODS发生风险的免疫学指标。
脓毒症; 多器官功能障碍综合征; 免疫抑制
脓毒症患儿常伴有高热、休克及呼吸衰竭等症状,传统理论认为脓毒症是一种失控的炎症反应,因为研究发现脓毒症患者体内炎症因子如肿瘤坏死因子(TNF)、白介素1(IL-1)等升高,且将这些炎症因子注入动物体内后亦会导致一系列脓毒症相关症状[1]。但在脓毒症治疗的相关研究中,无论是TNF、IL-1拮抗剂或者以阻断Toll样受体(TLR受体)、阻断内毒素传导为目的等药物对脓毒症患者或脓毒症动物模型的治疗都未能达到预期的改善作用[2,3]。目前已有一些旨在阻断炎症反应或免疫激活的药物用于临床试验,这种治疗方法也许在脓毒症早期处于炎症反应过度活化阶段有用,但在脓毒症后期,这种治疗方法或许并无益处,可能导致机体更易遭受再次感染[4]。近年来越来越多的研究表明,脓毒症患者体内存在着免疫抑制现象,表现为免疫细胞数目的减少以及细胞功能的丧失[5]。本研究回顾性分析脓毒症患儿细胞免疫、体液免疫指标与多器官功能障碍以及预后的关系,为了解脓毒症病情进展的机制及研究新的治疗方法提供参考。
1 对象与方法
1.1 研究对象
收集2013年1月至2016年1月间,南京医科大学附属儿童医院内、外科重症监护室收治的脓毒症患儿375例,主要为脓毒症伴肺部感染、胃肠道感染、皮肤软组织感染、中枢神经系统感染、腹腔感染或腹部术后等。研究对象入选标准:①年龄1个月至14岁;②符合中华医学会儿科学分会急救组、中华医学会急诊学分会儿科组等制定的脓毒症及多器官功能障碍相关诊疗方案[6,7];③转入重症监护室后24小时内采集过血液进行免疫学相关检测;④排除因白血病、淋巴瘤或其他实体肿瘤而接受化疗、放疗,长期或大量应用糖皮质激素治疗,先天性免疫缺陷或自身免疫性疾病等患儿。
依据患儿在ICU治疗过程中发生功能障碍的器官数目,将患儿分为无器官功能障碍、单器官功能障碍及多器官功能障碍3组。
1.2 方法
1.2.1 临床资料收集 收集患儿性别、年龄、免疫学检测指标、临床诊断及结局等信息。免疫学指标在患儿转入重症监护室的24小时内采集血液标本检测。
1.2.2 淋巴细胞免疫分型 使用美国BD公司BD FACS Calibur流式细胞仪,检测指标有T细胞百分比(CD3+)、CD4+T细胞百分比(CD3+、CD4+)、CD8+T细胞百分比(CD3+、CD8+)、NK细胞百分比(CD3-、CD16+、CD56+)、B细胞百分比(CD3-、CD19+)。
1.2.3 体液免疫分析 使用德国西门子公司的德灵BN2全自动特定蛋白分析仪,检测血清补体C3、C4浓度。
1.2.4 血常规分析 使用日本Sysmex公司XE-2100全血细胞分析仪,检测中性粒细胞计数、淋巴细胞计数等。
1.3 统计学分析
使用Stata 12.0进行统计分析。非正态分布计量资料以中位数(四分位数间距)表示,多组间比较采用Kruskal-Wallis秩和检验。计数资料以百分比表示,组间比较采用χ2检验。使用多元logistic逐步后退法筛选出与脓毒症患儿发生多器官功能障碍综合征(MODS)、院内死亡相关的免疫学指标。纳入logistic回归方程的自变量包括性别,年龄,是否有肺部感染、胃肠道感染、中枢神经系统感染、皮肤软组织感染、腹腔感染或腹部手术后,中性粒细胞计数,淋巴细胞计数,T细胞百分比,CD4/CD8,NK细胞百分比,B细胞百分比,补体C3、C4血清浓度等。其中性别以及是否有上述原发感染病灶为二分类变量,其余为连续性变量,回归方程剔除变量的P为0.10,选入变量的P为0.05。以P<0.05为差异有统计学意义。
2 结果
2.1 研究对象一般情况
共375例脓毒症患儿纳入研究,中位年龄8.7个月(1个月~13岁),男性228例、女性147例,男女比例约1.55:1。脓毒症患儿最常见感染病灶为肺部感染,占54.7%,其次为胃肠道感染(24.3%)、颅内感染(16.5%)、腹腔感染或腹部术后(12.0%)、皮肤软组织感染(4.8%),约25.9%的患儿存在2个或以上的感染灶。脓毒症患儿器官功能受累最常见为肝脏(30.9%)、心血管(30.9%)、中枢神经系统(28.3%)以及呼吸系统(24.2%)。有96例(25.6%)患儿进展为MODS,33例(9.6%)在治疗期间死亡。
2.2 免疫学指标与器官功能障碍相关性单因素分析
375例脓毒症患儿中无器官功能障碍组183例、单器官功能障碍组96例、多器官功能障碍组96例,三组患儿年龄、性别差异无统计学意义(P均>0.05)。CD4+T细胞百分比、CD4/CD8比值、NK细胞百分比和补体C 3在三组间的差异有统计学意义(P均<0.05),上述指标在MODS组均为最低。其余免疫指标如淋巴细胞计数、T细胞百分比、B细胞百分比等组间差异均无统计学意义(P>0.05)。见表1。
2.3 Logistic回归分析与MODS相关的因素
将肺部感染、胃肠道感染等原发感染因素与性别、年龄以及NK细胞百分比、CD4/CD8比值等免疫指标纳入logistic逐步回归方程,分析结果显示,中枢神经系统感染(OR=2.54,95%CI:1.35~4.77)、肺部感染(OR=2.29,95%CI:1.36~3.83)为MODS发生的独立危险因素;而CD4/CD8比值(OR=0.66,95%CI:0.51~0.85)和补体C3浓度高(OR=0.20,95%CI:0.10~0.42),则脓毒症患儿发生MODS的风险低,为MODS发生的保护因素。见表2。
2.4 Logistic回归分析影响院内死亡的相关因素
Logistic回归分析结果表明,肺部感染为脓毒症患儿院内死亡的独立危险因素(OR=2.61,95%CI:1.12~6.09),而补体C3是院内死亡发生的保护因素(OR=0.26,95%CI: 0.09~0.76),C3浓度每升高1 g/L,患儿死亡风险降为原来0.26倍。见表3。
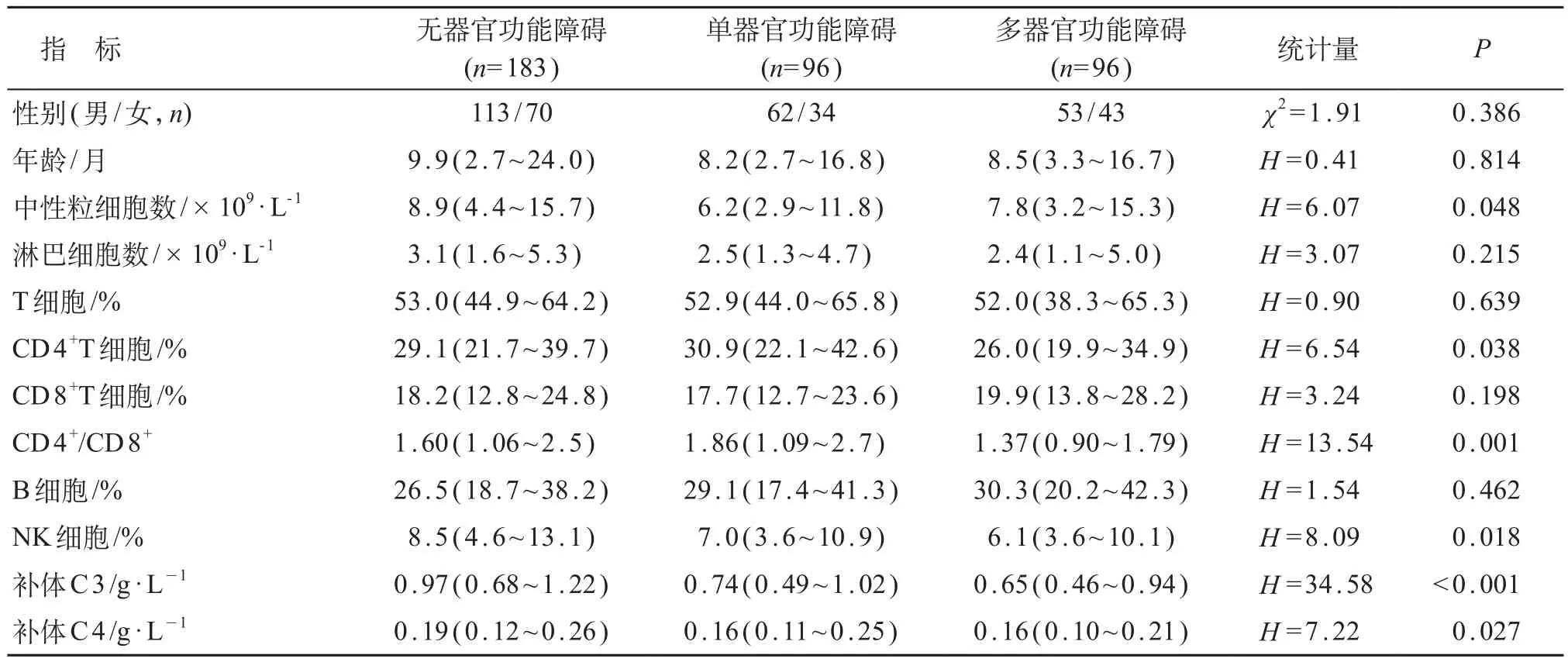
表1 不同器官功能障碍分组各指标比较[M(P25~P75)]
3 讨论
本研究表明,相对于一般脓毒症,多器官功能障碍的重症脓毒症患儿NK细胞百分比、CD4/CD8比值、补体C3等显著降低,且多元回归分析表明,CD4/CD 8比值降低与补体C 3降低是脓毒症患儿发生MODS的危险因素,此外补体C3亦可作为评估脓毒症患儿短期预后的参考指标。

表2 影响脓毒症患儿发生MODS的相关因素分析

表3 影响脓毒症患儿生存情况的因素分析
近年来越来越多的研究表明,脓毒症患者体内存在着免疫抑制的现象,主要为淋巴细胞数目减少及功能失常。淋巴细胞绝对数目的减少表现为CD4+T细胞、CD8+T细胞及B细胞等的凋亡[8,9]。研究人员对死于脓毒症患者的脾脏及动脉周围淋巴鞘组织进行切片免疫组化检查的结果表明,脓毒症患者外周免疫器官内的CD4+T细胞、CD8+T细胞、B细胞及树突状细胞减少[10,11]。另外,对淋巴细胞功能的相关研究发现,与健康对照组相比,脓毒症患者组织细胞表面的T细胞抑制性配体表达上调,表明T细胞的免疫功能受到抑制,如脓毒症患者脾脏血管内皮细胞的T细胞抑制性配体PD-L1表达上调,CD86与人类白细胞抗原DR位点(HLA-DR)在脾脏与肺组织中表达下调,脾脏中调节性T细胞数目增多,表明脓毒症患者脾脏与肺的淋巴细胞处于免疫抑制状态[12]。此外,在念珠菌血行感染所致的脓毒症患者中,可以观察到CD4+T细胞表面协同共刺激分子CD28的表达下调,T细胞表面程序性死亡分子1及其配体(PD-1/PD-L1)表达上调,表明真菌性脓毒症患者体内T细胞亦处于免疫抑制状态[13]。CD4+T细胞可分为Th1、Th2和Th17等类型。转录因子T-bet、GATA3是调节Th1、Th2细胞分化的关键因素,研究发现在创伤以及脓毒症患者中,T-bet与GATA3表达显著降低,表明Th1、Th2细胞都处于免疫抑制状态[14]。还有研究表明,调节Treg细胞的转录因子FOXP3的表达在脓毒症患者中并无变化,表明脓毒症患者体内效应T细胞功能被抑制而调节性T细胞功能则维持或增加[15],进一步证实T细胞功能被抑制。本研究也发现,CD4+T细胞、CD4/CD8比值等在MODS重症脓毒症患儿中显著降低,而CD8+T细胞在各组间无明显差异,表明脓毒症患儿T细胞免疫功能受抑制是病情进展的重要原因。
除T、B细胞外,NK细胞也在机体对抗感染的免疫过程中起重要作用。本研究发现,NK细胞百分比在多器官损害的脓毒症患儿中显著降低,表明重症脓毒症患儿体内存在固有免疫系统功能受抑制的现象。相关研究表明,脓毒症患者NK细胞的细胞毒作用以及细胞因子分泌功能都受到影响[16],脓毒症患者外周血NK细胞绝对值减少[17],NK细胞的细胞因子分泌功能也受到抑制,如IFNγ的分泌明显降低[18]。作为机体固有免疫的重要组成部分,NK细胞免疫功能受到抑制使机体更易出现二次感染[5],导致病情恶化。本研究同时发现,相比较非MODS患儿,中性粒细胞计数在MODS组并没有降低。有研究发现脓毒症患者中性粒细胞凋亡受到抑制,可能与全身炎症反应综合征(SIRS)甚至是器官损害相关[19],中性粒细胞凋亡比例与脓毒症病情严重程度以及预后无统计学相关性[20]。
上述相关机制的研究表明,脓毒症患者淋巴细胞减少是一种与病情进展相关的重要病理现象,也是脓毒症患者免疫抑制的主要原因。而脓毒症诱导的淋巴细胞凋亡是淋巴细胞减少的主要病理生理机制[5,17]。脓毒症诱导的细胞凋亡主要通过死亡受体通路及线粒体通路[5]。有研究将脓毒症小鼠死亡受体凋亡通路以及线粒体凋亡通路的关键基因敲除,发现淋巴细胞凋亡比例减少,小鼠的预后得到改善[21];而使用caspase抑制剂以及死亡受体阻断剂等[5,22],同样可以减少淋巴细胞的凋亡从而提高脓毒症小鼠的生存率。上述研究提示,对于脓毒症患儿的治疗,可考虑从增加其免疫功能,减少免疫细胞的凋亡,提高免疫细胞的功能等方面着手。
补体C3水平在多器官损害的脓毒症患儿中显著降低,且多因素回归分析提示,补体C3降低则MODS发生可能性升高,且是脓毒症患儿院内死亡的危险因素。有研究表明,补体C3、C4、C5的裂解产物C3a、C4a、C5a在因脓毒症死亡患者中的血浆浓度更高[23,24]。表明脓毒症患者体内存在着补体系统的过度活化,提示多器官损害患儿的血浆C3水平降低可能是补体系统过度活化导致的C3过度消耗所致。补体系统与凝止血及抗纤溶系统间存在复杂的交叉激活网络,补体系统的过度活化与凝血系统激活以及纤溶系统的抑制息息相关。凝血酶、纤溶酶等能够裂解C3从而启动相应的补体活化途径。同时,补体活化过程中产生的C5a能诱导组织因子表达进而激活并放大凝血级联反应,严重时可导致弥散性血管内凝血[25]。此外,C5a可诱导肥大细胞表达纤溶酶原激活抑制物1(PAI1)从而抑制纤溶作用[26]。因此,补体系统、凝血系统以及抗纤溶系统间的交叉激活网络可导致脓毒症患者凝止血、纤溶系统功能失常,使病情恶化。
本研究表明,淋巴细胞减少所致的免疫抑制及补体系统过度活化是脓毒症患儿病情进展或恶化的重要因素。重症脓毒症的治疗不应局限于控制患儿的炎症反应,更需要恢复患儿的免疫功能。
[1]Hotchkiss RS,Karl IE.The pathophysiology and treatment of sepsis [J].N Engl J Med,2003,348(2): 138-150.
[2]Angus DC.The search for effective therapy for sepsis: back to the drawing board? [J].JAMA,2011,306(23): 2614-2615.
[3]Cohen J,Opal S,Calandra T.Sepsis studies need new direction [J].Lancet Infect Dis,2012,12(7): 503-505.
[4]Schefold JC,Hasper D,Reinke P,et al.Consider delayed immunosuppression into the concept of sepsis [J].Crit Care Med,2008,36(11): 3118.
[5]Hotchkiss RS,Monneret G,Payen D.Sepsis-induced immunosuppression: from cellular dysfunctions to immunotherapy [J].Nat Rev Immunol,2013,13(12): 862-874.
[6]樊寻梅,武志远.国际儿科脓毒症定义会议介绍 [J].中华儿科杂志,2005,43(8): 618-620.
[7]中华医学会儿科学分会急救组,中华医学会急诊学分会儿科组,中华儿科杂志编辑委员会.儿科感染性休克(脓毒性休克)诊疗推荐方案 [J].中华儿科杂志,2006,44 (8):596-598.
[8]Felmet KA,Hall MW,Clark RS,et al.Prolonged lymphopenia,lymphoid depletion,and hypoprolactinemia in children with nosocomial sepsis and multiple organ failure [J].J Immunol,2005,174(6): 3765-3772.
[9]Toti P,De Felice C,Occhini R,et al.Spleen depletion in neonatal sepsis and chorioamnionitis [J].Am J Clin Pathol,2004,122(5):765-771.
[10]Hotchkiss RS,Tinsley KW,Swanson PE,et al.Sepsisinduced apoptosis causes progressive profound depletion of B and CD4+T lymphocytes in humans [J].J Immunol,2001,166(11): 6952-6963.
[11]Hotchkiss RS,Tinsley KW,Swanson PE,et al.Depletion of dendritic cells,but not macrophages,in patients with sepsis [J].J Immunol,2002,168(5): 2493-2500.
[12]Boomer JS,To K,Chang KC,et al.Immunosuppression in patients who die of sepsis and multiple organ failure [J].JAMA,2011,306(23): 2594-2605.
[13]Spec A,Shindo Y,Burnham CA,et al.T cells from patients with Candida sepsis display a suppressive immunophenotype[J].Crit Care,2016,20: 15.
[14]Pachot A,Monneret G,Voirin N,et al.Longitudinal study of cytokine and immune transcription factor mRNA expression in septic shock [J].Clin Immunol,2005,114(1): 61-69.
[15]Venet F,Chung CS,Monneret G,et al.Regulatory T cell populations in sepsis and trauma [J].J Leukoc Biol,2008,83(3): 523-535.
[16]Forel JM,Chiche L,Thomas G,et al.Phenotype and functions of natural killer cells in critically-ill septic patients[J].PLoS One,2012,7(12): e50446.
[17]Hotchkiss RS,Monneret G,Payen D.Immunosuppression in sepsis: a novel understanding of the disorder and a new therapeutic approach [J].Lancet Infect Dis,2013,13(3): 260-268.
[18]Chiche L,Forel JM,Thomas G,et al.The role of natural killer cells in sepsis [J].J Biomed Biotechnol,2011,2011:986491.
[19]Wesche DE,Lomas-Neira JL,Perl M,et al.Leukocyte apoptosis and its significance in sepsis and shock [J].J Leukoc Biol,2005,78(2): 325-337.
[20]Tamayo E,Gómez E,Bustamante J,et al.Evolution of neutrophil apoptosis in septic shock survivors and nonsurvivors [J].J Crit Care,2012,27(4): 415.e1-11.
[21]Chang KC,Unsinger J,Davis CG,et al.Multiple triggers of cell death in sepsis: death receptor and mitochondrialmediated apoptosis [J].FASEB J,2007,21(3): 708-719.
[22]Chung CS,Song GY,Lomas J,et al.Inhibition of Fas/Fas ligand signaling improves septic survival: differential effects on macrophage apoptotic and functional capacity [J].J Leukoc Biol,2003,74(3): 344-351.
[23]Nakae H,Endo S,Inada K,et al.Serum complement levels and severity of sepsis [J].Res Commun Chem Pathol Pharmacol,1994,84(2): 189-195.
[24]Gerard C.Complement C5a in the sepsis syndrome--too much of a good thing? [J].N Engl J Med,2003,348(2): 167-169.
[25]Rittirsch D,Flierl MA,Ward PA.Harmful molecular mechanisms in sepsis [J].Nat Rev Immunol,2008,8(10):776-787.
[26]Lupu F,Keshari RS,Lambris JD,et al.Crosstalk between the coagulation and complement systems in sepsis [J].Thromb Res,2014,133(Suppl 1):S28-S31.
2017-05-31)
(本文编辑:蔡虹蔚)
Analysis of correlation between immunosuppression and organ dysfunction in children with sepsis
SUN Hang,ZHANG Xianwei (Clinical Laboratory ,Children’s Hospital of Nanjing Medical University,Nanjing 210008,Jiangsu,China)
ObjectiveTo analyse the relationship between immunosuppression and severity of sepsis in children,thus to explore the role of immunity in the progression of sepsis and provide a reference for the treatment of sepsis in children.MethodsIn this retrospective study,375 children with sepsis were included.Blood specimens were collected for the analysis of lymphocyte subsets and humoral immunity in 24 hours after admission into ICU.Univariate analysis was performed between immunity indices and organ dysfunction.Logistic stepwise regression was used to screen out the risk factors of multiple organ dysfunction (MKDS) and mortality.ResultsSepsis children were divided into three groups,no organ dysfunction,single organ dysfunction and multiple organ dysfunction.NK cell percentage,CD4/CD8 and C3 were different among three groups,and signi fi cantly lower in MODS children.Multivariate analysis showed decreased CD4/CD8 (OR=0.66,95%CI:0.51-0.85).C3 level (OR=0.20,95%CI:0.10-0.42) were associated with MODS.CNS infection (OR=2.54,95%CI:1.35-4.77) and pneumonia infection (OR=2.29,95%CI:1.36-3.83) were also risk factors of MODS.Depletion of C3 (OR=0.26,95%CI:0.09-0.76) and pneumonia infection (OR=2.61,95%CI:1.12-6.09) were risk factors of mortality.ConclusionsCD4/CD8 and complement C3 were signi fi cantly decreased in sepsis children with MODS,immunosuppression may play an important role in the development of MODS in children with sepsis.Baseline CD4/CD8 and C3 level could be potential prognostic markers of sepsis.
sepsis; multiple organ dysfunction syndrome; immunosuppression
10.3969/j.issn.1000-3606.2017.11.008
孙杭 电子信箱:sunhang85@yahoo.com
