下调α-catulin基因表达对胃癌细胞增殖、迁移和侵袭的影响*
2017-11-28赵乃阔胡庆军史朝晖
赵乃阔,胡庆军,史朝晖
(1.河南省焦作市人民医院 消化内科,河南 焦作 454000;2.河南大学淮海医院,河南 开封 475000)
下调α-catulin基因表达对胃癌细胞增殖、迁移和侵袭的影响*
赵乃阔1,胡庆军1,史朝晖2
(1.河南省焦作市人民医院 消化内科,河南 焦作 454000;2.河南大学淮海医院,河南 开封 475000)
目的探讨抑制α-catulin基因表达对胃癌细胞增殖、迁移和侵袭的影响,以及可能的机制。方法培养人胃癌细胞SGC-7901,根据转染物不同将细胞分为siRNA-α-catulin组、siRNA-对照序列组和空白对照组,MTT法检测细胞增殖能力,Transwell法检测细胞迁移和侵袭能力,Western blot检测细胞中α-catulin、N-钙粘蛋白(N-cadherin)、E-钙粘蛋白(E-cadherin)和波形蛋白(Vimentin)表达。结果siRNA-α-catulin组细胞24、48、72及96 h时吸光度A值均低于siRNA-对照序列组和空白对照组,差异有统计学意义(P<0.05);与siRNA-对照序列组和空白对照组比较,siRNA-α-catulin组迁移细胞数和侵袭细胞数均降低,差异有统计学意义(P<0.05);与siRNA-对照序列组和空白对照组比较,siRNA-α-catulin组细胞中α-catulin、N-cadherin及Vimentin蛋白相对表达量均降低,而E-cadherin蛋白相对表达量增加,差异有统计学意义(P<0.05)。结论特异性沉默人胃癌细胞SGC-7901中α-catulin基因表达可有效抑制细胞增殖、迁移和侵袭能力,其机制可能与抑制上皮-间质转化过程有关。
胃癌;α-catulin;细胞增殖;细胞侵袭;上皮-间质转化
R735.2
A
胃癌作为发病率高、致死率高的消化道恶性肿瘤,由于发病隐匿,早期症状不明显且缺乏有效的筛查方法,多数患者临床确诊时已进展至中晚期,错失最佳的治疗时机[1],即使患者接受手术切除治疗,由于肿瘤复发、转移率高,5年生存率仅20%左右[2]。目前,影响胃癌复发、转移相关机制尚未完全清楚,因此,从分子生物学方面积极探讨相关机制以指导治疗,对延长患者生命,改善预后具有重要意义。αcatulin作为一种细胞骨架连接蛋白,在Rho信号通路中发挥重要作用,与炎症反应、细胞凋亡、骨架重建、细胞迁移与侵袭以及上皮-间质转化等过程密切相关[3],有研究指出[4],上皮-间质转化在胃癌细胞转移、侵袭、抗凋亡和耐药中发挥重要作用。本研究拟利用小分子干扰RNA技术(small interference RNA,siRNA)特异性下调人胃癌细胞SGC-7901中α-catulin基因表达,探讨其对细胞增殖、迁移及侵袭能力的影响,以及可能的机制,以期为胃癌机制研究提供基础资料。
1 材料与方法
1.1 主要试剂和设备
人胃癌细胞SGC-7901(购自美国ATCC),RPMI 1640细胞培养基、优质胎牛血清及胰蛋白酶(购自美国Gibco公司),Lipofectamine 2000转染试剂盒(购自美国 Invitrogen公司),siRNA-α-catulin和siRNA-对照序列(上海吉玛制药技术有限公司设计合成),MTT细胞增殖及细胞毒性检测试剂盒、ECL显色试剂盒(购自碧云天生物技术公司),二甲基亚砜(DMSO)(购自北京索莱宝科技公司),Transwell小室(购自美国Corning公司),兔抗人α-catulin多克隆抗体(购自上海万疆生物公司),兔抗人N-钙粘蛋白(N-cadherin)多克隆抗体、鼠抗人E-钙粘蛋白(E-cadherin)多克隆抗体(购自美国Santa Cruz公司),兔抗人波形蛋白(Vimentin)单克隆抗体(购自美国Cell Signaling公司),实时荧光定量PCR仪(购自ABI公司),凝胶电泳分析系统(购自美国Biorad公司)。
1.2 方法
1.2.1 细胞培养和分组处理 将人胃癌细胞SGC-7901置于含10%胎牛血清的RPMI 1640细胞培养基中,于含5%二氧化碳CO2的37℃恒温培养箱中培养,待细胞融合度达85%时,用胰酶消化后,传代培养,取3~5代细胞进行实验。按照LipofectamineTM2000转染试剂盒说明书对细胞进行转染,根据转染物不同将细胞分为3组:①siRNA-α-catulin组。转染α-catulin干扰序列:正向5'-CCAUUAACAUCAC CAACAATT-3',反向 5'-UUGUUGGUGAUGUUAAU GGTT-3';②siRNA-对照序列组。转染阴性对照序列:正向 5'-UUCUCCGAACGUGUCACGUTT-3',反向 5'-ACGUGACACGUUCGGAGAATT-3';③空白对照组。不做任何处理。转染后于含5%CO2的37℃恒温培养箱中继续培养,完成后续实验。
1.2.2 不同转染组细胞增殖能力检测 取各转染组细胞,胰酶消化后,调整细胞密度为1.5×106个/ml,接种于96孔板,每孔100μl,于含5%CO2的37℃恒温培养箱中进行培养,分别于培养24、48、72和96 h时,向各孔加入 MTT 液(浓度 5 g/L)20 μl,37℃孵育6 h,去除上清液,再加入200 μl的DMSO,于摇床上振荡15 min,使沉淀溶解充分,利用全自动酶标仪取490 nm波长处对各孔吸光度A值进行检测。
1.2.3 Transwell法检测细胞迁移能力 取各转染组转染后培养48 h细胞,调整细胞密度为1.5×106个/ml,取细胞悬液200μl加入Transwell小室上室,将600 μl含20%胎牛血清的RPMI 1640培养液加入下室,于37℃恒温培养箱中培养24 h,取出小室,用棉签将上室中散落的细胞轻轻擦去,甲醇固定,结晶紫染色后,用倒置显微镜进行观察,随机选取5个高倍视野计数穿膜细胞数,取均值作为迁移细胞数[5]。
1.2.4 Transwell法检测细胞侵袭能力 取Matrigel胶铺于Transwell小室中,风干备用。其余步骤同1.2.3。
1.2.5 Western blot检测各转染组细胞中α-catulin、N-cadherin、E-cadherin和Vimentin蛋白表达 取各转染组转染后培养48 h细胞,加入细胞裂解液,用总蛋白提取试剂盒对细胞中总蛋白提取,利用BCA蛋白定量检测试剂盒检测蛋白纯度并定量。取50μg总蛋白,进行SDS-PAGE电泳,电转移至PVDF膜,用5%脱脂奶粉4℃封闭5 h,用TBST液漂洗3次,加入一抗兔抗人α-catulin多克隆抗体、兔抗人N-cadherin多克隆抗体、鼠抗人E-cadherin多克隆抗体、兔抗人Vimentin单克隆抗体(稀释比例分别为1∶800、1∶500、1∶1 200 及 1∶1 000),4℃过夜孵育,TBST液漂洗3次,加入二抗,室温下孵育4 h,利用ECL显色试剂盒避光反应15min,拍照,利用Image J图像分析软件分析细胞中α-catulin、N-cadherin、E-cadherin和Vimentin蛋白相对表达量。
1.3 统计学方法
数据处理采用SPSS 21.0统计软件,计量资料以均数±标准差(±s)表示,比较采用方差分析,两两比较用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 各组细胞增殖能力比较
siRNA-α-catulin组细胞 24、48、72和 96 h时吸光度A值均低于siRNA-对照序列组和空白对照组,差异有统计学意义(P<0.05),提示siRNA-αcatulin组细胞增殖能力被抑制,见图1。
2.2 各转染组细胞迁移和侵袭能力比较
3组转染组迁移细胞数和侵袭细胞数差异有统计学意义(F=72.505和 99.266,均P=0.000),其中,与siRNA-对照序列组和空白对照组比较,siRNA-α-catulin组迁移细胞数和侵袭细胞数均降低,差异有统计学意义(P<0.05),见表 1和图 2、3。
2.3 各转染组细胞中 α-catulin、N-cadherin、E-cadherin和Vimentin蛋白表达比较
3 组细胞中 α-catulin、N-cadherin、E-cadherin和Vimentin蛋白相对表达量差异有统计学意义(F=33.134、8.486、19.664 和 17.414,均P=0.000),其中,与siRNA-对照序列组和空白对照组比较,siRNA-α-catulin组细胞中 α-catulin、N-cadherin及 Vi-mentin蛋白相对表达量均降低,而E-cadherin蛋白相对表达量增加,差异有统计学意义(P<0.05),见表2和图4。
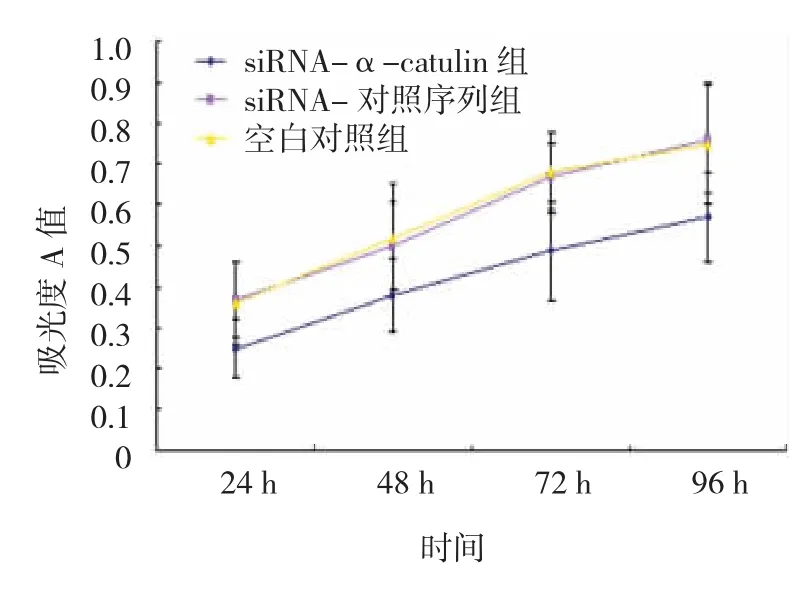
图1 各转染组细胞增殖能力比较
表1 各转染组细胞迁移和侵袭能力比较 (±s)
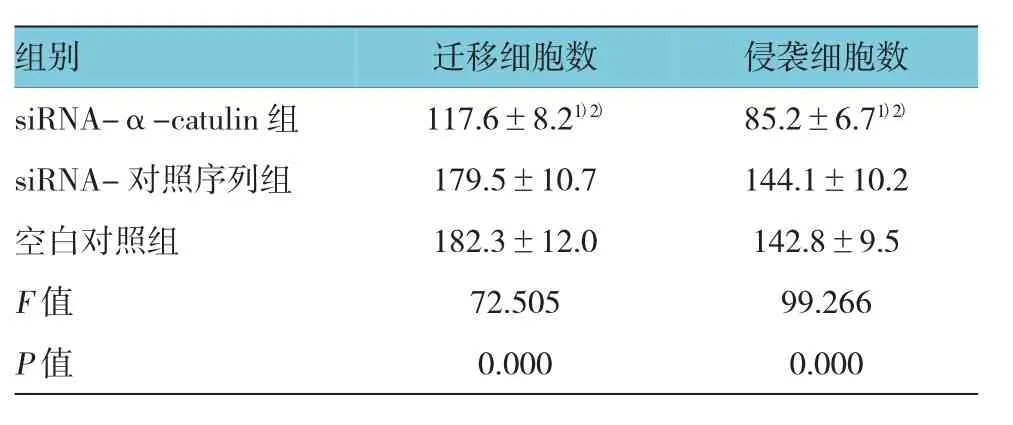
表1 各转染组细胞迁移和侵袭能力比较 (±s)
注:1)与空白对照组比较,P<0.05;2)与 siRNA-对照序列组比较,P<0.05
组别 迁移细胞数 侵袭细胞数siRNA-α-catulin 组 117.6±8.21)2) 85.2±6.71)2)siRNA-对照序列组 179.5±10.7 144.1±10.2空白对照组 182.3±12.0 142.8±9.5 F值 72.505 99.266 P值 0.000 0.000
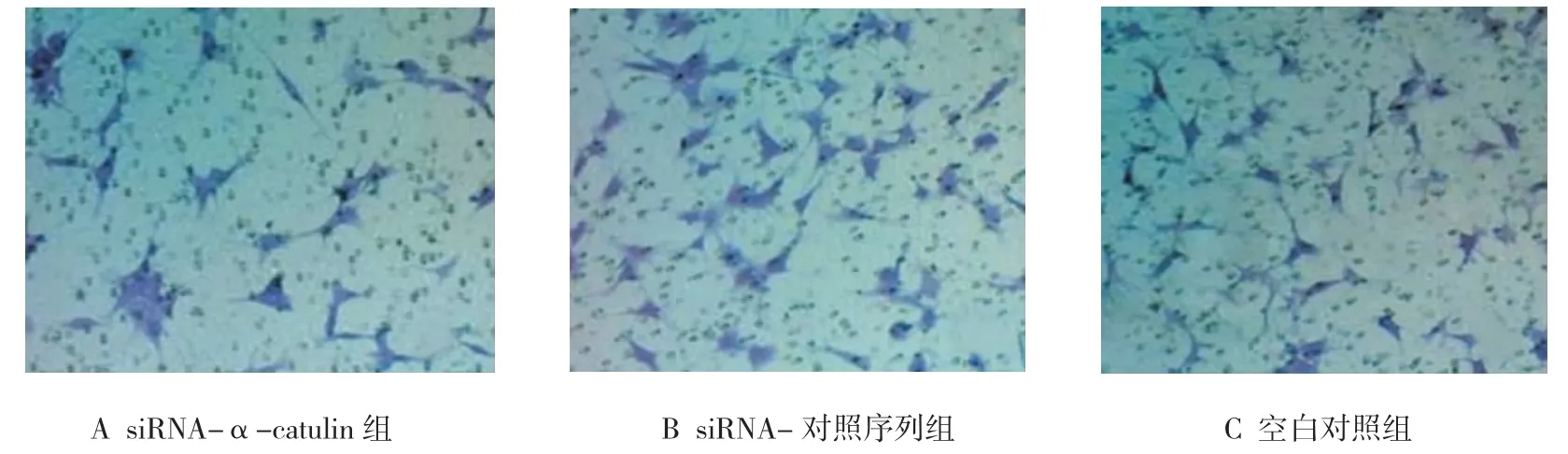
图2 各转染组细胞迁移能力比较 (结晶紫×400)
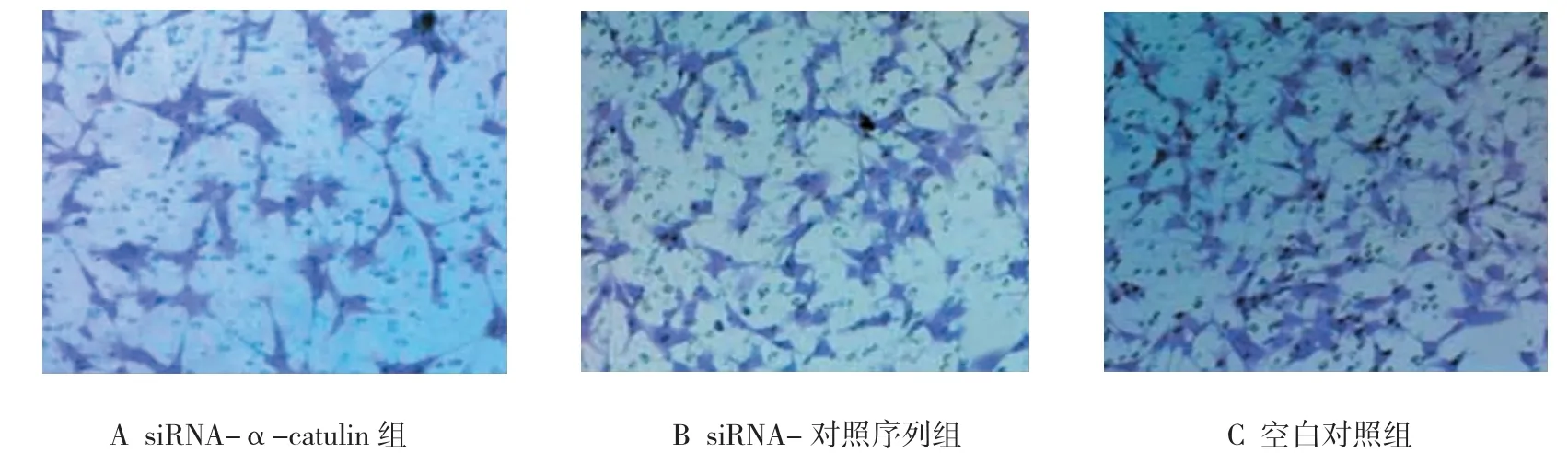
图3 各转染组细胞侵袭能力比较 (结晶紫×400)
表2 各转染组细胞中α-catulin、N-cadherin、E-cadherin和Vimentin蛋白表达比较 (±s)

表2 各转染组细胞中α-catulin、N-cadherin、E-cadherin和Vimentin蛋白表达比较 (±s)
注:1)与空白对照组比较,P <0.05;2)与 siRNA- 对照序列组比较,P <0.05
组别 α-catulin蛋白 N-cadherin蛋白 E-cadherin蛋白 Vimentin蛋白siRNA-α-catulin 组 0.26±0.071)2) 0.32±0.081)2) 0.59±0.121)2) 0.43±0.141)2)siRNA-对照序列组 0.73±0.10 0.64±0.13 0.36±0.08 0.79±0.13空白对照组 0.75±0.12 0.63±0.11 0.35±0.10 0.81±0.15 F值 33.134 8.486 19.664 17.414 P值 0.000 0.000 0.000 0.000

图4 各转染组细胞中α-catulin、N-cadherin、E-cadherin和Vimentin蛋白表达
3 讨论
胃癌发病率、致死率均位居我国消化道肿瘤首位,具有发病率高、确诊晚、转移率高及预后较差等特点[6],研究表明[7],胃癌复发、转移是导致患者死亡的主要因素。因此,积极探讨影响胃癌侵袭、转移的相关机制对治疗和预后具有重要意义。α-catulin作为Rho信号通路中重要组件,由CTNNAL1基因编码,其蛋白结构中含有与α-连环蛋白(α-actinin)和黏着斑蛋白(Vinculin)结合位点,与炎症、细胞衰老、凋亡及骨架重构等过程密切相关[8],有研究指出[9],αcatulin在头颈部鳞癌中呈高表达。CAO等[10]指出,α-actinin与鳞状细胞癌细胞迁移和侵袭密切相关,可作为癌症患者预后的标志物和未来的治疗靶标。本研究利用siRNA技术特异性沉默人胃癌SGC-7901细胞中α-catulin基因,结果显示,siRNA-α-catulin组细胞中α-catulin蛋白表达量低于siRNA-对照序列组和空白对照组,提示细胞中α-catulin基因表达被成功抑制。
有研究指出[11],α-catulin可通过改变细胞周期中的关键性基因而抑制肿瘤细胞衰老,加速细胞增殖。本研究MTT细胞增殖结果显示,siRNA-αcatulin组细胞24、48、72和96h时吸光度A值均低于siRNA-对照序列组和空白对照组,说明特异性沉默胃癌细胞中α-catulin基因后,细胞增殖能力被抑制,提示α-catulin可能参与胃癌细胞增殖过程。本研究显示,与siRNA-对照序列组和空白对照组比较,siRNA-α-catulin组迁移细胞数和侵袭细胞数均降低,说明特异性沉默胃癌细胞中α-catulin基因可有效抑制细胞迁移、侵袭能力。研究表明[12],上皮-间质转化与肿瘤细胞增殖、迁移、侵袭能力密切相关。N-cadherin、E-cadherin和Vimentin是上皮-间质转化特异性标志物,发生上皮-间质转化时,N-cadherin、Vimentin表达升高,而E-cadherin表达被抑制[13]。本研究结果显示,siRNA-α-catulin组细胞中N-cadherin、Vimentin蛋白表达被抑制,而E-cadherin蛋白表达量增加,说明特异性沉默α-catulin基因上皮-间质转化过程被抑制。
综上所述,特异性沉默人胃癌细胞SGC-7901中α-catulin基因表达可有效抑制细胞增殖、迁移和侵袭能力,其机制可能与抑制上皮-间质转化过程有关。
[1]PETRELLI F, BERENATO R, TURATI L, et al. Prognostic value of diffuse versus intestinal histotype in patients with gastric cancer:a systematic review and meta-analysis[J]. J Gastrointest Oncol,2017, 8(1): 148-163.
[2]GADDE R, TAMARIZ L, HANNA M, et al. Metastatic gastric cancer (MGC) patients: Can we improve survival by metastasecto-my? A systematic review and meta-analysis [J]. J Surg Oncol,2015, 112(1): 38-45.
[3]BEAR M D, LIU T, ABUALKHAIR S, et al. Alpha-catulin colocalizes with vimentin intermediate filaments and functions in pulmonary vascular endothelial cell migration via ROCK[J]. J Cell Physiol, 2016, 231(4): 934-943.
[4]杨柳,石燕,戴广海.上皮细胞间质化在胃癌发生发展中的作用[J].解放军医学院学报,2016,37(3):292-294.
[5]于路平,刘春雷,李清,等.性别决定区Y框蛋白18在前列腺癌中的表达及其对细胞功能的影响[J].中华泌尿外科杂志,2017,38(2):141-145.
[6]VEISANI Y, DELPISHEH A. Survival rate of gastric cancer in iran; a systematic review and meta-analysis [J]. Gastroenterol Hepatol Bed Bench, 2016, 9(2): 78-86.
[7]OKUGAWA Y, MOHRI Y, TANAKA K, et al. Metastasis-associated protein is a predictive biomarker for metastasis and recurrence in gastric cancer[J]. Oncol Rep, 2016, 36(4): 1893-1900.
[8]马雪,张斌,韩春耀,等.下调α-catulin基因的表达对舌鳞癌细胞株Tscca侵袭及迁移能力影响的体外研究[J].山东大学学报(医学版),2016,54(6):12-15.
[9]邱波,张卓,申道福,等.头颈部鳞癌中α-catulin表达的临床病理和预后意义[J].中国医科大学学报,2015,44(12):1079-1086.
[10]CAO C, CHEN Y, MASOOD R, et al. α-Catulin marks the invasion front of squamous cell carcinoma and is important for tumor cell metastasis[J]. Mol Cancer Res, 2012, 10(7): 892-903.
[11]FAN L C, CHIANG W F, LIANG C H, et al. α-Catulin knockdown induces senescence in cancer cells [J]. Oncogene,2011, 30(23): 2610-2621.
[12]白一禾,秦兆宇,贺福初,等.HMG20A对肝癌细胞体外增殖与迁移的影响及其机制[J].复旦学报(医学版),2016,43(4):385-392.
[13]JI L, ZHANG B, ZHAO G. Liver X receptor α (LXRα) promoted invasion and EMT of gastric cancer cells by regulation of NF-κB activity[J]. Hum Cell, 2017, 30(2): 124-132.
(王荣兵 编辑)
Genetic inhibition ofα-catulinon proliferation,migration and invasion of gastric cancer cells*
Nai-kuo Zhao1,Qing-jun Hu1,Chao-hui Shi2
(1.Department of Gastroenterology,People's Hospital of Jiaozuo City,Jiaozuo,Henan 454000,China;2.Huaihai Hospital Affiliated to Henan University,Kaifeng,Henan 475000,China)
ObjectiveTo investigate the effect of genetic inhibition ofα-catulinon proliferation,migration and invasion of gastric cancer cells.MethodsHuman gastric cancer cell line SGC-7901 were cultured and were divided into siRNA-α-catulin group,siRNA sequence control group and negative control group.MTT and Trans well assay were performed to measure cell proliferation and cell invasion,respectively.The levels of α-catulin,N-cad herin,E-cad herin and Vimentin were determined by Western blot.ResultsMTT results indicated that optical density value at 24 h,48 h,72 h and 96 h in the siRNA-α-catulin group were significantly lower than that of siRNA-control sequence group and negative control group (P<0.05).The amount of migrating cells and invasive cells in siRNA-α-catulin group were decreased dramatically compared with siRNA-control sequence group and blank control group (P< 0.05).Expression levels of α-catulin,N-cadherin and Vimentin in siRNA-α-catulin group decreased while E-cadherin increased significantly when compared with siRNA-control sequence group and blank control group (P<0.05).Conclusion Genetic knockdown ofα-catulingene in SGC-7901 cell line could prevent cell proliferation,migration and invasion by inhibition of transition of epithelial-mesenchymal.
gastric cancer;α-catulin;cell proliferation;cell invasion;epithelial-mesenchymal transit
10.3969/j.issn.1005-8982.2017.27.006
1005-8982(2017)27-0027-05
2017-05-16
河南省2015年科技发展计划(No:152300410164)
