右美托咪定对神经病理性痛大鼠脊髓背角COX-2和c-fos表达的影响*
2017-11-28秦梦婷邱忠鹏王业忠
秦梦婷,邱忠鹏,王业忠
(石河子大学第一附属医院 1.重症医学一科,2.骨二科,新疆 石河子 832008)
右美托咪定对神经病理性痛大鼠脊髓背角COX-2和c-fos表达的影响*
秦梦婷1,邱忠鹏2,王业忠1
(石河子大学第一附属医院 1.重症医学一科,2.骨二科,新疆 石河子 832008)
目的探讨右美托咪定对神经病理性痛大鼠脊髓背角COX-2和c-fos表达的影响。方法90只健康成年雄性Wistar大鼠随机分为假手术组(n=30)、神经病理性痛组(n=30)和右美托咪定组(n=30),利用坐骨神经结扎的方法复制神经病理性痛模型,右美托咪定组大鼠于术后即刻开始至处死前1天,每天腹腔注射50 μg/kg右美托咪定,1次/d,其他两组大鼠给予等容量生理盐水腹腔注射。分别于术前1 d(T0)、术后3 d(T1)、术后 7 d(T2)和术后 14 d(T3)对造模大鼠热痛阈(TWL)和机械痛阈(MWT)进行测定,分别于 T1、T2和 T3时测定完TWL和MWT后,处死并取脊髓组织,利用实时荧光定量PCR检测大鼠脊髓背角中COX-2 mRNA和c-fos mRNA表达。结果与假手术组比较,神经病理性痛组和右美托咪定组大鼠T1~T3时TWL均缩短,MWT均降低,差异有统计学意义(P<0.05),与神经病理性痛组比较,右美托咪定组大鼠T1~T3时TWL均延长,而MWT均升高,差异有统计学意义(P<0.05);与假手术组比较,神经病理性痛组和右美托咪定组大鼠T1~T3时COX-2 mRNA相对表达量和c-fos mRNA相对表达量均升高,差异均有统计学意义(P<0.05),与神经病理性痛组相比,右美托咪定组大鼠T1~T3时COX-2 mRNA相对表达量和c-fos mRNA相对表达量均降低,差异有统计学意义(P<0.05)。结论右美托咪定可有效抑制神经病理性痛大鼠中枢痛觉敏化,其机制可能与下调脊髓背角COX-2和c-fos表达有关。
右美托咪定;神经病理性痛;大鼠;环氧化酶-2;c-fos
右美托咪定是一种美托咪定的右旋异构体,可高选择性激动α2肾上腺素能受体,在镇痛、镇静及抗交感神经活性等方面发挥重要作用[1],有研究指出[2],右美托咪定可有效缓解神经病理性疼痛。但具体作用机制尚未完全研究清楚。有研究指出[3],外周神经发生损伤后,环氧化酶2(cyclooxygenase 2,COX-2)在脊髓背角中的表达上调,通过一系列细胞级联反应而使脊髓神经元敏化,引发并维持神经病理性疼痛。c-fos基因在细胞分化、繁殖、生长及信息传递等过程中发挥重要作用[4],其在正常生理状态下在神经元细胞中呈极低表达水平,但当外界出现机械或物理性刺激时,会导致脊髓中c-fos大量表达,从而导致脊髓神经元可塑性变化,可能是引起中枢敏化的原因之一[5]。本研究拟探讨右美托咪定对神经病理性痛大鼠脊髓背角COX-2和c-fos表达的影响,分析其镇痛的可能机制,以期为临床实践提供理论基础资料。
1 材料与方法
1.1 实验动物与分组
90只健康成年雄性Wistar大鼠,由河南省实验动物中心提供,体重185~220 g,7周龄,饲养于24℃室温条件下,相对湿度50%~60%,自由摄食和饮水。利用随机数字表随机分为假手术组(n=30)、神经病理性痛组(n=30)和右美托咪定组(n=30)。
1.2 模型复制及处理
按照文献[6]的步骤复制大鼠坐骨神经慢性压迫性损伤模型:利用40 mg/kg戊巴比妥钠腹腔注射麻醉大鼠后,将右后肢股骨中段皮肤切开,对肌肉进行分离,使坐骨神经暴露,利用4-0丝线在坐骨神经干上松扎4道,每道间隔1 mm左右,保证神经外膜稍微受压但又不让血管完全阻断,结扎过程可见大鼠肢体轻微发生抽动。操作完毕,用2 mg青霉素对切口进行外敷以防感染。假手术组大鼠仅对坐骨神经进行分离但不行结扎,右美托咪定组大鼠于术后即刻开始至处死前1天,每天腹腔注射50 μg/kg右美托咪定(批准文号:国药准字H20090248,生产单位:江苏恒瑞医药股份有限公司),1次/d,其他两组大鼠给予等容量生理盐水腹腔注射。
分别于术前 1 d(T0)、术后 3 d(T1)、术后 7 d(T2)和术后14 d(T3)对造模大鼠热痛阈(thermal pain threshold,TWL) 和 机 械 痛 阈 (mechanicalpain threshold,MWT)进行测定。利用XR1102热刺痛仪(购自上海欣软信息科技有限公司)对热痛阈进行测定,大鼠置于厚度为3 mm的玻璃板上,利用热辐光源对右后肢足底部进行照射,对从开始照射至出现缩足反应的时间进行记录,单次照射时间在20 s以内,连续进行3次,每次间隔5 min,求均值。利用von Frey纤维丝(购自美国Stoelting公司)对机械痛阈进行测定,将大鼠置于透明玻璃箱内,分别选取压力 为 (0.41、0.52、0.87、1.16、2.05、3.61、5.50、8.28、10.33和16.73 g)的von Frey纤维丝,利用初始刺激压力为2.05 g的纤维丝垂直缓慢地对大鼠右后肢足底部进行刺激,每次间隔>30 s,以大鼠出现躲避、抬足或舔足反应为阳性,以纤维丝发生90°弯曲而无反应为阴性,采取序贯法[7]对MWT进行计算,并分别在阈值上下刺激5次,求均值。
1.3 实时荧光定量PCR检测
分别于T1、T2和T3时随机从各组选取10只大鼠,测定完TWL和MWT后,腹腔注射40 mg/kg戊巴比妥钠麻醉后,断头处死。快速取出L4~L6节段脊髓组织,放入已冷冻的冻存管内,再保存于液氮中以备检。利用实时荧光定量PCR(qRT-PCR)方法对大鼠脊髓中COX-2 mRNA和c-fos mRNA表达水平进行检测,COX-2、c-fos及内参引物均由生工生物工程(上海)股份有限公司设计及合成。COX-2引物:正向 5'-CTGTATCCCGCCCTGCTGGTG-3',反向5'-ACTTGCGTTGATGGTGGCTGTCTT-3';c-fos引物:正向5'-CGGGTTTCAACGCGGACTAC-3',反向5'-G TTGGCACTAGAGACGGACAGA-3'。取脊髓背角组织放入研钵内进行迅速研磨,利用Trizol总RNA提取试剂盒(购自美国C&M biolabs公司)对组织中总RNA进行提取,并测定RNA纯度,取A260/A280在1.8~2.0的标本作为合格标本。分别取2 μl总RNA进行逆转录cDNA。利用美国ABI 7500型qRT-PCR仪(购自美国ABI公司)进行PCR扩增,扩增条件:95℃预变性 30 s,94℃ 10 s,74℃ 15 s,60℃ 15 s,连续进行35个循环。利用2-△△Ct法对COX-2 mRNA和c-fos mRNA在脊髓背角组织中的表达水平进行分析。
1.4 统计学方法
数据分析采用SPSS 21.0统计软件,计量资料以均数±标准差(±s)表示,多组间和组内比较用单因素方差分析,组间两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 3组大鼠建模后情况
3组大鼠建模后均未见切口感染。假手术组大鼠未见明显异常,神经病理性痛组和右美托咪定组大鼠右后肢足趾出现并拢,轻度外翻状,常表现悬空、抬足等异常行为。右美托咪定组大鼠在给药后有轻度嗜睡现象,但容易被唤醒,醒后仍然可站立。
2.2 3组大鼠TWL和MWT情况
T0时,3组大鼠TWL和MWT差异无统计学意义(P>0.05);与假手术组比较,神经病理性痛组和右美托咪定组大鼠T1~T3时TWL均缩短,MWT均降低,差异有统计学意义(P<0.05);与神经病理性痛组比较,右美托咪定组大鼠T1~T3时TWL均延长,而MWT均升高;与T0时比较,神经病理性痛组和右美托咪定组T1~T3时TWL均缩短,MWT均降低,与T1时比较,神经病理性痛组和右美托咪定组T2~T3时TWL均缩短,MWT均降低,与T2时比较,神经病理性痛组和右美托咪定组T3时TWL均延长,MWT则升高,差异有统计学意义(P<0.05)。见表1。
2.3 3组大鼠不同时点脊髓背角组织中COX-2 mRNA和c-fos mRNA相对表达量
与假手术组比较,神经病理性痛组和右美托咪定组大鼠T1~T3时COX-2 mRNA相对表达量和c-fos mRNA相对表达量均升高,差异有统计学意义(P<0.05);与神经病理性痛组比较,右美托咪定组大鼠T1~T3时COX-2 mRNA相对表达量和c-fos mRNA相对表达量均降低,差异有统计学意义(P<0.05);与T1时比较,神经病理性痛组和右美托咪定组大鼠T2~T3时COX-2 mRNA相对表达量和c-fos mRNA相对表达量均升高,差异有统计学意义(P<0.05);与T2时比较,神经病理性痛组和右美托咪定组大鼠T3时COX-2 mRNA相对表达和c-fos mRNA相对表达量均降低,差异有统计学意义(P<0.05)。见表2。
表1 3组大鼠不同时间TWL和MWT比较 (±s)
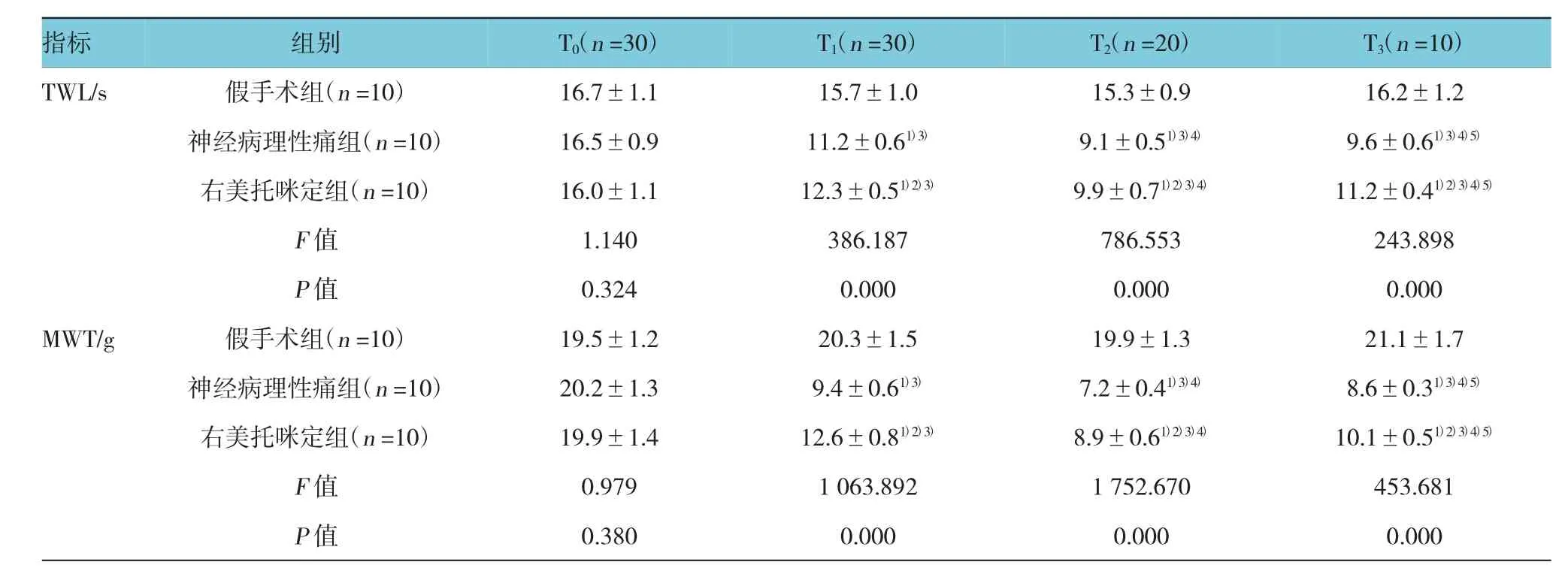
表1 3组大鼠不同时间TWL和MWT比较 (±s)
注:1)与假手术组比较,P <0.05;2)与神经病理性痛组比较,P <0.05;3)与同组内 T0时比较,P <0.05;4)与同组内 T1时比较,P <0.05;5)与同组内T2时比较,P<0.05
指标组别T0(n=30)T1(n=30)T2(n=20)T3(n=10)TWL/s 假手术组(n=10) 16.7±1.1 15.7±1.0 15.3±0.9 16.2±1.2神经病理性痛组(n=10) 16.5±0.9 11.2±0.61)3) 9.1±0.51)3)4) 9.6±0.61)3)4)5)右美托咪定组(n=10) 16.0±1.1 12.3±0.51)2)3) 9.9±0.71)2)3)4) 11.2±0.41)2)3)4)5)F值 1.140 386.187 786.553 243.898 P值 0.324 0.000 0.000 0.000 MWT/g 假手术组(n=10) 19.5±1.2 20.3±1.5 19.9±1.3 21.1±1.7神经病理性痛组(n=10) 20.2±1.3 9.4±0.61)3) 7.2±0.41)3)4) 8.6±0.31)3)4)5)右美托咪定组(n=10) 19.9±1.4 12.6±0.81)2)3) 8.9±0.61)2)3)4) 10.1±0.51)2)3)4)5)F值 0.979 1 063.892 1 752.670 453.681 P值 0.380 0.000 0.000 0.000
表2 3组大鼠不同时间脊髓背角组织中COX-2 mRNA和c-fos mRNA相对表达量 (±s)
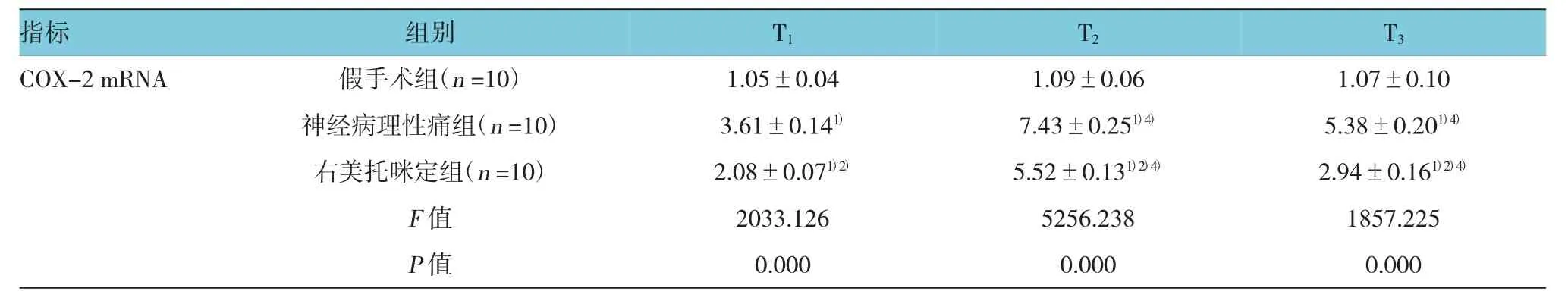
表2 3组大鼠不同时间脊髓背角组织中COX-2 mRNA和c-fos mRNA相对表达量 (±s)
指标 组别 T1 T2 T3 COX-2 mRNA 假手术组(n=10) 1.05±0.04 1.09±0.06 1.07±0.10神经病理性痛组(n=10) 3.61±0.141) 7.43±0.251)4) 5.38±0.201)4)右美托咪定组(n=10) 2.08±0.071)2) 5.52±0.131)2)4) 2.94±0.161)2)4)F值 2033.126 5256.238 1857.225 P值 0.000 0.000 0.000

续表2
3 讨论
神经病理性痛作为常见的慢性疼痛,患者常出现异常疼痛、痛觉过敏或感觉异常等症状,给患者生存质量带来严重影响[8],本研究复制神经病理性痛大鼠模型,结果显示,神经病理性痛组和右美托咪定组大鼠右后肢足趾出现并拢,轻度外翻状,常表现悬空、抬足等异常行为,且与假手术组比较,神经病理性痛组和右美托咪定组大鼠T1~T3时TWL均缩短,MWT均降低,说明制备的神经病理性痛大鼠模型复制成功。
本研究结果显示,与假手术组比较,神经病理性痛组和右美托咪定组大鼠T1~T3时COX-2 mRNA相对表达量和c-fos mRNA相对表达量均升高,说明神经病理性痛发生与脊髓背角中COX-2和c-fos表达上调有关,且随时间表达变化情况与痛阈变化相一致,提示COX-2和c-fos参与神经病理性痛的发生及进展过程,分析原因,当外周神经发生损伤时,会特异性激活胞内型磷脂酶A2活性,激发脊髓磷脂酶-环氧化酶-前列腺素级联通路级联放大反应[9],使COX-2表达升高、前列腺素物质释放增多,从而使谷氨酸等末梢神经兴奋物质释放增加[10],进而激活脊髓背角神经元NMDA受体,导致Ca2+内流增加[11],而神经元内增高的Ca2+又可促使cAMP生成,导致AMP反应元件结合蛋白磷酸化而被激活,进一步与cAMP反应元件结合而促使c-fos基因大量表达,产生的c-fos蛋白则可与c-jun蛋白结合形成复合物,通过激活目的基因而促使炎症因子合成及释放,从而引起痛觉过敏[12]。
本研究结果显示,在给予大鼠腹腔注射右美托咪定后,模型大鼠痛阈增高,神经病理性痛缓解,与神经病理性痛组比较,右美托咪定组大鼠T1~T3时COX-2 mRNA相对表达量和c-fos mRNA相对表达量均降低,提示右美托咪定可通过抑制脊髓背角组织中COX-2和c-fos的表达,而达到抑制神经病理性痛。分析原因,右美托咪定通过抑制COX-2表达及活性,减少前列腺素的产生,引起谷氨酸受体介导的兴奋性突触后电流减少,使突触前膜自发性释放谷氨酸降低[13],同时,前列腺素水平的降低亦可使突触前膜电压依赖性Ca2+内流减少,加之右美托咪定本身可通过特异性激活α2肾上腺素能受体,对脊髓背角神经元Ca2+通道进行抑制[14],从而降低胞内Ca2+水平,从而使cAMP合成减少,c-fos基因表达被抑制,炎症因子合成减少,从而抑制痛觉过敏的发生。
综上所述,右美托咪定可有效抑制神经病理性痛大鼠中枢痛觉敏化,其机制可能与下调COX-2和c-fos表达有关。
[1]YU C,LI S,DENG F,et al.Comparison of dexmedetomidine/fentanyl with midazolam/fentanyl combination for sedation and analgesia during tooth extraction[J].Int J Oral Maxillofac Surg,2014,43(9):1148-1153.
[2]LI S S,ZHANG W S,YANG J L,et al.Involvement of protein kinase B/Akt in analgesic effect of dexmedetomidine on neuropathic pain[J].CNS Neurosci Ther,2013,19(5):364-366.
[3]MOINI ZANJANI T,AMELI H,LABIBI F,et al.The Attenuation of Pain Behavior and Serum COX-2 Concentration by Curcumin in a Rat Model of Neuropathic Pain[J].Korean J Pain,2014,27(3):246-252.
[4]CAPUTTO B L,CARDOZO GIZZI A M,GIL G A.c-Fos:an AP-1 transcription factor with an additional cytoplasmic,non-genomic lipid synthesis activation capacity[J].Biochim Biophys Acta,2014,1841(9):1241-1246.
[5]ABE T,SHIMODA T,URADE M,et al.c-Fos induction in the brainstem following electrical stimulation of the trigeminal gan-glion of chronically mandibular nerve-transected rats[J].So-matosens Mot Res,2013,30(4):175-184.
[6]BENNETT G J,XIE Y K.A peripheral mononeuropathy in rat that produces disorders of pain sensation like those seen in man[J].Pain,1988,33(1):87-107.
[7]WU H E,GEMES G,ZOGA V,et al.Learned avoidance from noxious mechanical simulation but not threshold semmes weinstein filament stimulation after nerve injury in rats[J].J Pain,2010,11(3):280-286.
[8]吕客,宋一平,童迅,等.发散式冲击波在腰椎间孔镜术后神经病理性疼痛的临床观察 [J].中国疼痛医学杂志,2015,21(3):238-240.
[9]HASEGAWA S I,KOHRO Y,SHIRATORI M,et al.Role of PAF receptor in proinflammatory cytokine expression in the dorsal root ganglion and tactile allodynia in a rodent model of neuropathic pain[J].PLoS One,2010,5(5):e10467.
[10]CUNHA N V,de ABREU S B,PANIS C,et al.Cox-2 inhibition attenuates cardiovascular and inflammatory aspects in monosodium glutamate-induced obese rats[J].Life Sci,2010,87(11/12):375-381.
[11]M?LLER N.COX-2 inhibitors as antidepressants and antipsychotics:clinical evidence[J].Curr Opin Investig Drugs,2010,11(1):31-42.
[12]LEE H P,HUANG S Y,LIN Y Y,et al.Soft coral-derived lemnalol alleviates monosodium urate-induced gouty arthritis in rats by inhibiting leukocyte infiltration and iNOS,COX-2 and c-Fos protein expression[J].Mar Drugs,2013,11(1):99-113.
[13]SUKEGAWA S,HIGUCHI H,INOUE M,et al.Locally injected dexmedetomidine inhibits carrageenin-induced inflammatory responses in the injected region[J].Anesth Analg,2014,118(2):473-480.
[14]KODERA S Y,YOSHIDA M,DEZAKI K,et al.Inhibition of insulin secretion from rat pancreatic islets by dexmedetomidine and medetomidine,two sedatives frequently used in clinical settings[J].Endocr J,2013,60(3):337-346.
(王荣兵 编辑)
Effect of Dexmedetomidine on spinal expression of COX-2 and c-fos in rat models of neuropathic pain*
Meng-ting Qin1,Zhong-peng Qiu2,Ye-zhong Wang1
(1.Department of Critical Medicine,2.Department of Orthopedics,First Affiliated Hospital of Shihezi University,Shihezi,Xingjiang 832008,China)
ObjectiveTo investigate the effects of Dexmedetomidine on spinal expressions of cyclooxygenase-2 (COX-2)and c-fos in spinal dorsal horns of rat models of neuropathic pain.MethodsA total of 90 healthy adult male Wistar rats were randomly divided into sham group (n=30),neuropathic pain group(n=30)and Dexmedetomidine group(n=30).Rat models of neuropathic pain were established by sciatic nerve ligation.Sham operated rats
all procedure except for sciatic nerve ligation.Dexmedetomidine was intraperitoneally injected(50 μg/kg)daily in the Dexmedetomidine group.Vehicle saline were administered into the remaining animals.Thermal pain threshold (TWL)and mechanical pain threshold (MWT)were measured 1 day before operation(T0),and the 3th d(T1),7th d(T2)and 14th d(T3)after surgery,then spine were harvested immediately.COX-2 and c-fos in spinal cord dorsal horns were determined by real-time quantitative PCR.ResultsCompared with the sham group,TWL and MWT in the neuropathic pain group and Dexmedetomidine group decreased significantly at T1~T3(P< 0.05);TWL and MWT in the Dexmedetomidine group increased.at T1~T3(P< 0.05)compared with the neuropathic pain group.Expression levels of COX-2 mRNA and c-fos mRNA in the neuropathic pain group and the Dexmedetomidine group were increased at T1~T3dramatically (P< 0.05),but was alleviated by treatment of Dexmedetomidine compared between the neuropathic pain group and Dexmedetomidine group (P<0.05).Conclusion Dexmedetomidine inhibits central neuropathic hyperalgesia in rat models of neuropathic pain,which may be related to down-regulation of COX-2 and c-fos.
Dexmedetomidine;neuropathic pain;cyclooxygenase-2;c-fos
R791.2
A
10.3969/j.issn.1005-8982.2017.27.003
1005-8982(2017)27-0012-05
2017-05-30
国家自然科学基金(No:81360185)
