髓系抑制性细胞和调节性T细胞在小鼠实验性结肠炎中的作用*
2017-11-28吕颖卢建华吕卓段媛媛刘志权崔美兰闫会敏
吕颖 ,卢建华 ,吕卓 ,段媛媛 ,刘志权 ,崔美兰 ,闫会敏
(河北省石家庄市第五医院 1.临床医学研究中心,2.检验科,河北 石家庄 050021;3.河北医科大学 研究生学院,河北 石家庄 050017)
髓系抑制性细胞和调节性T细胞在小鼠实验性结肠炎中的作用*
吕颖1,卢建华2,吕卓3,段媛媛3,刘志权2,崔美兰1,闫会敏1
(河北省石家庄市第五医院 1.临床医学研究中心,2.检验科,河北 石家庄 050021;3.河北医科大学 研究生学院,河北 石家庄 050017)
目的探讨髓系抑制性细胞(MDSC)和调节性T细胞(Treg细胞)在小鼠溃疡性结肠炎发生、发展过程中的作用。方法使用5%右旋葡聚糖硫酸钠(DSS)溶液复制小鼠溃疡性结肠炎模型,每日观察小鼠体重和大便状况。DSS处理3和7 d后处死小鼠,苏木精-伊红染色法观察病理组织学变化,流式细胞仪检测脾脏和肠系膜淋巴结中MDSC和Treg细胞的表达。结果模型组小鼠于造模第4天体重开始下降,有腹泻和血便,HE染色结果显示小鼠结肠出现黏膜损伤及炎症表现。与对照组和造模3 d组比较,造模7 d组肠系膜淋巴结中Treg细胞比例增加,而MDSC比例降低;进一步观察MDSC亚群变化发现,粒细胞型MDSC在造模7 d组中比例下降,而单核细胞型MDSC则无改变。无论Treg细胞还是MDSC,脾脏中的水平3组比较差异无统计学意义。结论急性溃疡性结肠炎可导致MDSC降低和Treg细胞增高,可能与疾病的发生发展有关。
溃疡性结肠炎;髓系抑制性细胞;调节性T细胞;免疫调控
溃疡性结肠炎(ulcerative colitis,UC)是一种临床常见的难治性肠道疾病,因慢性迁延不愈,严重影响着人们的生活质量。虽然UC的发病机制尚未完全阐明,但普遍认为免疫紊乱,特别是效应性CD4+T细胞的过度激活是导致UC发病的重要原因之一[1]。正常状态下,机体存在着许多具有免疫调节功能的细胞,该细胞可抑制免疫应答,在维持机体免疫稳态中发挥重要作用。髓源性抑制细胞(myeloid-derived suppressor cell,MDSC)和调节性 T 细胞(regulatory T cell,Treg)是目前已知的两类重要免疫抑制细胞,MDSC由一群未成熟的高度异质性细胞组成,具有广泛且强大的抑制功能,可抑制T细胞、B细胞、NK细胞和巨噬细胞等多种免疫细胞,下调炎症因子产生[2-3];而Treg细胞是一群成熟的T细胞亚群,是机体负向调节免疫反应及维持免疫稳态的关键环节,可通过细胞间相互作用及分泌IL-10等抗炎症因子抑制多种细胞的活性[4]。
MDSC和Treg细胞作为机体免疫调控的重要细胞,能够诱导免疫抑制、参与介导免疫耐受,因此,推测UC的发生、发展可能与MDSC和Treg细胞的异常表达有关。本研究在建立小鼠急性UC模型的基础上,检测不同阶段小鼠脾脏和淋巴结中MDSC和Treg细胞的比例,以探讨MDSC和Treg细胞在UC发生发展中的可能作用。
1 材料与方法
1.1 主要试剂与仪器
清洁级BALB/c小鼠[购自河北医科大学实验动物中心,许可证号:SCXK(冀)2013-1-003],右旋葡聚糖硫酸钠(dextran sulfact sodium,DSS)(购自美国MP Biomedicals公司),小鼠 FITC-CD4、PE-CD25、PE/Cy7-CD127、FITC-CD11b、APC-Ly6G 和 PerCPCy5.5-Ly6C抗体(购自美国BD公司),红细胞裂解液(购自美国Beckman Coulter公司),FACS Canto II流式细胞仪(购自美国BD公司)。
1.2 实验方法
1.2.1 复制小鼠急性溃疡性结肠炎模型 选取健康BALB/c小鼠20只,鼠龄6~8周,体重18~22 g。将小鼠随机分为3组:①对照组(n=6);②造模3 d组(n=7);③造模7 d组(n=8)。其中,造模组小鼠分别自由饮用5%DSS溶液3和7 d,以诱导溃疡性结肠炎,对照组小鼠给予蒸馏水自由饮用。实验开始前及开始后每日称重、观察大便性状和有无便血。造模结束后处死小鼠,测量大肠长度,并取结肠进行HE染色,分离脾脏及肠系膜淋巴结制备单细胞悬液。
1.2.2 疾病活动指数 根据小鼠体重下降程度、大便性状和便血情况,计算疾病活动指数(disease activity index,DAI)评分。见表 1。

表1 小鼠结肠炎DAI评估表
1.2.3 病理组织学观察 处死小鼠后,取结肠组织固定于10%中性甲醛缓冲液,常规石蜡包埋、切片后进行常规苏木精-伊红(hematoxylin-eosin staining,HE)染色,光镜下观察病理改变。
1.2.4 脾脏和淋巴结单细胞悬液的制备 取出脾脏和肠系膜淋巴结,去除周围脂肪组织,用注射器活塞芯杆的平端在小培养皿中轻轻研磨,过200目细胞筛过滤,1 500 r/min离心后弃上清,红细胞裂解液将脾脏中红细胞破除。洗涤2次,重悬细胞后计数,并调整细胞浓度至1×107个/ml。
1.2.5 流式细胞仪检测MDSC和Treg细胞 取100 μl待测细胞,加至相应的流式管,再加入下述荧光素标记的抗体:Treg细胞:小鼠FITC-CD4,PECD25,PE/Cy7-CD127 或 MDSC:FITC-CD11b,APCLy6G,PerCP-Cy5.5-Ly6C抗体。避光孵育20~30min后,离心洗涤2次,流式细胞仪检测MDSC和Treg细胞所占比例。
1.3 统计学方法
数据分析采用SPSS 19.0统计软件,计量资料以均数±标准差(±s)表示,采用单因素方差分析,两两比较用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 体重变化和DAI评分
对照组和造模3 d组小鼠饮食量及活动状态无明显改变,未见便血,造模7 d组小鼠在造模第4天开始逐渐出现大便松软或稀糊状及不同程度的血便。体重相对变化(体重/原始体重×100%)结果显示,对照组体重逐渐增加,造模3 d组未见改变,而造模7 d组自第4天开始体重逐渐下降,实验第6天和第7天低于对照组和造模3 d组,差异有统计学意义(P<0.01)。实验第7日,造模7 d组DAI评分高于造模3 d组和对照组,差异有统计学意义(P<0.01),大肠长度短于造模3 d组和对照组,差异有统计学意义(P=0.016和0.016)。见图1和表2。
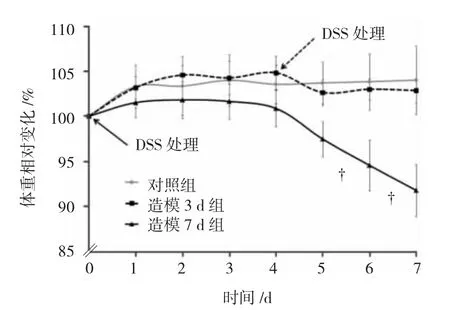
图1 各组小鼠体重变化比较
表2 各组小鼠终末结肠长度和DAI评分比较 (±s)
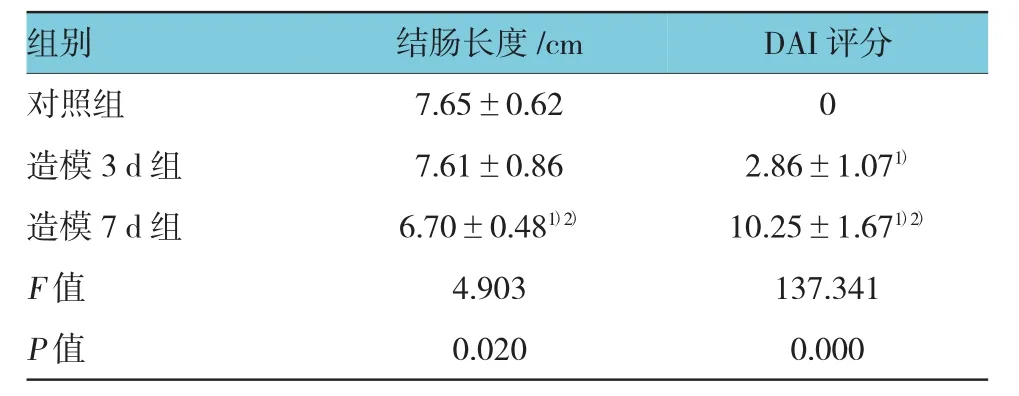
表2 各组小鼠终末结肠长度和DAI评分比较 (±s)
注:1)与对照组比较,P <0.05;2)与造模 3 d 组比较,P <0.05
组别 结肠长度/cm DAI评分对照组 7.65±0.62 0造模 3 d 组 7.61±0.86 2.86±1.071)造模 7 d 组 6.70±0.481)2) 10.25±1.671)2)F值 4.903 137.341 P值 0.020 0.000
2.2 结肠组织病理学变化
对照组小鼠结肠黏膜上皮完整,腺体排列基本整齐,固有层和黏膜层内只有少许炎症细胞浸润;经DSS诱导3 d后,结肠黏膜腺体排列稍显紊乱,炎症细胞浸润增多;至第7天,结肠固有腺体减少或缺失,可见溃疡,杯状细胞减少,黏膜组织出现弥漫性炎症细胞浸润。见图2。
2.3 各组小鼠脾脏和淋巴结中MDSC细胞的表达
与对照组比较,造模3 d组小鼠肠系膜淋巴结中MDSC百分数有下降趋势,但差异无统计学意义(P=0.075),造模7 d组肠系膜淋巴结中MDSC百分数较对照组降低,差异有统计学意义(P=0.015);进一步观察单核细胞样MDSC亚群(M-MDSC)和粒细胞样MDSC亚群(G-MDSC)的比例发现,造模7 d组G-MDSC百分数较对照组下降,差异有统计学意义(P=0.007)。脾脏MDSC及各亚群比例在3组比较差异无统计学意义(P>0.05)。见表3。
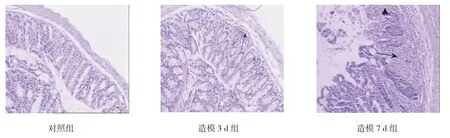
图2 各组小鼠结肠组织病理学变化 (×200)
表3 各组小鼠脾脏和淋巴结中MDSC细胞的表达 (%,±s)

表3 各组小鼠脾脏和淋巴结中MDSC细胞的表达 (%,±s)
注:†与对照组比较,P<0.05
组别 脾脏淋巴结MDSC M-MDSC MDSC M-MDSC G-MDSC对照组 1.93±0.56 1.00±0.15 0.93±0.42 0.73±0.31 0.40±0.23 0.33±0.08造模 3 d 组 1.77±0.32 0.99±0.16 0.77±0.23 0.53±0.12 0.25±0.07 0.28±0.07造模7 d组 2.23±1.30 1.19±0.67 1.04±0.64 0.45±0.06† 0.22±0.03 0.22±0.04†F值 0.586 0.530 0.654 3.875 3.094 4.768 P值 0.567 0.597 0.531 0.042 0.073 0.024 G-MDSC
2.4 各组小鼠脾脏和淋巴结中Treg细胞的表达
与对照组和造模3 d组比较,造模7 d组小鼠肠系膜淋巴结中Treg细胞百分率升高,差异有统计学意义(P=0.003和0.002)。脾脏Treg细胞百分率在3组比较差异无统计学意义(P=0.426)。见表4。
表4 各组小鼠脾脏和淋巴结中Treg细胞的表达(%,±s)
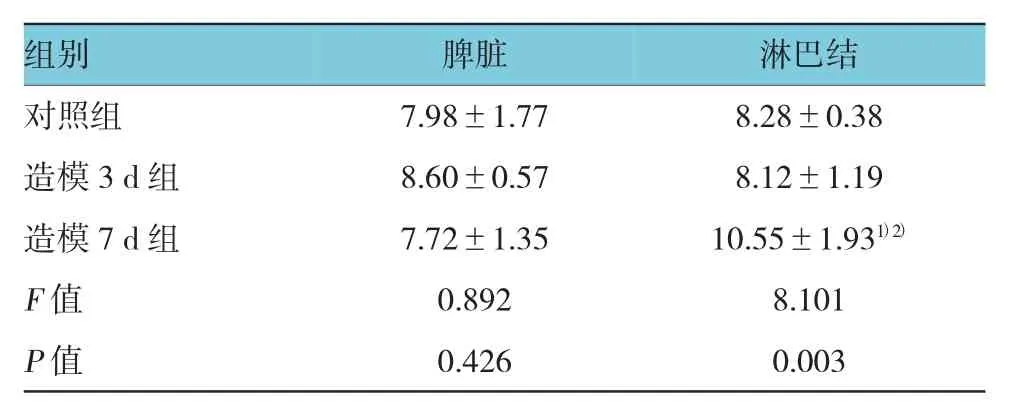
表4 各组小鼠脾脏和淋巴结中Treg细胞的表达(%,±s)
注:1)与对照组比较,P <0.05;2)与造模 3 d组比较,P <0.05
组别 脾脏 淋巴结对照组 7.98±1.77 8.28±0.38造模3 d组 8.60±0.57 8.12±1.19造模 7 d 组 7.72±1.35 10.55±1.931)2)F值 0.892 8.101 P值 0.426 0.003
3 讨论
虽然UC的发病机制仍不明确,但免疫紊乱被认为是疾病发生的重要原因之一,多种免疫学因素与UC发病密切相关,近年抑制性细胞在UC发病中的作用引起广泛关注。MDSC作为独特的抑制性细胞群体,可通过多种机制负性调控免疫应答,在肿瘤、炎症和感染等多种疾病发生中发挥重要作用。已有研究发现,肺癌、肝癌和乳腺癌等许多肿瘤组织中存在大量MDSC浸润,参与肿瘤的免疫逃逸、免疫耐受等;在肝脏疾病如急性肝损伤、病毒性肝炎和肝纤维化等发病过程中,MDSC数量增多且抑制功能增强[5-6]。本研究结果显示,随着炎症进展,小鼠淋巴结中MDSC表达逐渐减少,提示MDSC与UC发病呈负相关。MDSC具有免疫抑制功能,因此,笔者推测急性肠道炎症发生可能导致MDSC细胞数量减少及功能异常,使效应性T细胞的过度活化,黏膜炎症加重。
小鼠MDSC主要表达CD11b和Gr-1,根据Gr-1表位不同,可进一步将MDSC分为单核细胞样MDSC亚群和粒细胞样MDSC亚群,2种亚群在特征、抑制功能和机制等方面均存在很大差异,其中,M-MDSC表达CD11b+Ly6G+Ly6C+,在形态上类似于单核/巨噬细胞,主要通过上调诱导性一氧化氮合成酶、精氨酸酶以及免疫抑制因子发挥抑制作用;G-MDSC表达CD11b+Ly6G+Ly6C-,形态上类似于粒系细胞,主要通过产生活性氧化物及与T细胞直接接触发挥作用[7]。研究发现,不同疾病对MDSC亚群的影响不同,YOUN等[8]观察MDSC亚群在多种荷瘤小鼠中的变化,结果显示所有肿瘤小鼠中均存在G-MDSC高表达,而M-MDSC仅在少数模型小鼠中增高;HOCHST等[9]发现,在炎症及纤维化发生过程中,肝脏内发生大量M-MDSC聚集,而肾脏内的优势亚型则是G-MDSC。笔者观察2个亚群在UC小鼠的表达情况,结果显示随着炎症的进展,淋巴结中G-MDSC减少,而M-MDSC无变化,提示在UC发病过程中,G-MDSC可能发挥着更重要的作用。
Treg细胞是机体发挥免疫调节功能的主要效应细胞,可通过细胞间直接接触及分泌抑制性细胞因子等调控免疫反应,维持免疫耐受和免疫稳态。Treg细胞在控制肠道炎症中发挥着重要作用,动物实验和临床研究均已证实Treg细胞数量或功能异常与UC发病密切相关,外源性输注Treg细胞能通过抑制免疫应答而控制UC病情进展[10-11]。本研究发现,UC小鼠淋巴结中Treg细胞的比例增高,与以前文献报道相一致[12]。目前Treg细胞增高的原因尚不清楚,可能与机体免疫平衡调节有关,当UC发生时,活性CD4+T细胞亚群(如Th1、Th17等)细胞升高,为了维持机体免疫平衡,Treg细胞也反应性升高,但这些细胞数量的增加不足以抑制Th1、Th17等细胞引起的促炎反应;另外,增高的Treg细胞可能存在功能缺陷,因此在UC进展过程中,虽然Treg细胞数量增多,但黏膜局部仍出现炎症表现。作为机体内2种重要的抑制性细胞,MDSC与Treg细胞间存在着密切联系,MDSC可通过产生TGF-β、IL-10或精氨酸酶诱导Treg细胞,同时MDSC还具有将耐受原摄取并提呈给Treg细胞,促进Treg扩增的能力[13-14];反之,Treg细胞能够通过产生TGF-β调控MDSC的分化和功能[15],提示MDSC和Treg细胞变化可能具有相关性。然而本研究结果显示,在急性UC发生过程中MDSC比例逐渐降低,而Treg比例增高,两者变化趋势并不一致,由此可见,溃疡性结肠炎小鼠Treg细胞增加并非MDSC诱导所致,其具体机制有必要进一步研究和证实。
综上所述,在UC发病过程中,淋巴结MDSC比例下降,而Treg细胞比例升高,提示两者均与UC发生、发展密切相关,如能调控MDSC和Treg细胞的分化和功能,则可能影响UC的疾病进展。本结果为进一步揭示UC的免疫发病机制提供实验依据,为临床治疗UC提供了新的靶点。
[1]GEREMIA A, BIANCHERI P, ALLAN P, et al. Innate and adaptive immunity in inflammatory bowel disease [J]. Autoimmun Rev, 2014, 13(1): 3-10.
[2]SU Z, NI P, ZHOU C, et al. Myeloid-derived suppressor cells in cancers and inflammatory diseases: angel or demon [J]. Scand J Immunol, 2016, 84(5): 255-261.
[3]Gabrilovich D I, Nagaraj S. Myeloid-derived suppressor cells as regulators of the immune system [J]. Nat Rev Immunol, 2009, 9(3):162-174.
[4]ARCE-SILLAS A, ALVAREZ-LUQUIN D D, TAMAYA-DOMING UEZ B, et al. Regulatory T cells: molecular actions on effector cells in immune regulation [J]. J Immunol Res, 2016 (2016):1720827.
[5]ZHANG H, LIU Y, BIAN Z, et al. The critical role of myeloidderived suppressor cells and FXR activation in immune-mediated liver injury[J]. J Autoimmun, 2014(53): 55-66.
[6]PALLETT L J, GILL U S, QUAGLIA A, et al. Metabolic regulation of hepatitis B immunopathology by myeloid-derived suppressor cells[J]. Nat Med, 2015, 21(6): 591-600.
[7]MOVAHEDI K, GUILLIAMS M, van DEN BOSSCHE J, et al.Identification of discrete tumor-induced myeloid-derived suppressor cell subpopulations with distinct T cell-suppressive activity[J].Blood, 2008, 111(8): 4233-4244.
[8]YOUN J I, NAGARAJ S, COLLAZO M, et al. Subsets of myeloid-derived suppressor cells in tumor-bearing mice[J]. J Immunol,2008, 181(8): 5791-5802.
[9]HOCHST B, MIKULEC J, BACCEGA T, et al. Differential induction of Ly6G and Ly6C positive myeloid derived suppressor cells in chronic kidney and liver inflammation and fibrosis [J].PLoS One, 2015, 10(3): e0119662.
[10]吴铁龙,薛丽莉,戴圆圆,等.活动期溃疡性结肠炎患者外周血CD4+CD25+Treg细胞与肠道炎性反应的相关性研究 [J].国际消化病杂志,2015,35(4):293-294.
[11]YANG B H, HAGEMANN S, MAMARELI P, et al. Foxp3(+) T cells expressing RORγt represent a stable regulatory T-cell effector lineage with enhanced suppressive capacity during intestinal inflammation[J]. Mucosal Immunol, 2016, 9(2): 444-457.
[12]MA Y H,ZHANG J,CHEN X,et al.Increased CD4+CD45RAFoxP3 low cells alter the balance between Treg and Th17 cells in colitis mice[J].World J Gastroenterol,2016,22(42):9356-9367.
[13]ZHANG C, WANG S, YANG C, et al. The crosstalk between myeloid derived suppressor cells and immune cells: to establish immune tolerance in transplantation [J]. J Immunol Res, 2016(2016): 4986797.
[14]ZHAI N, LI H, SONG H, et al. Hepatitis C virus induces MDSCs-Like monocytes through TLR2/PI3K/AKT/STAT3 signaling[J]. PLoS One, 2017, 12(1): e0170516.
[15]LEE C R, KWAK Y, YANG T, et al. Myeloid-derived suppressor cells are controlled by regulatory T cells via TGF-β during murine colitis[J]. Cell Rep, 2016, 17(12): 3219-3232.
(王荣兵 编辑)
Role of myeloid-derived suppressor cells and regulatory T cells in mouse models of ulcerative colitis*
Ying Lv1,Jian-hua Lu2,Zhuo Lv3,Yuan-yuan Duan3,Zhi-quan Liu2,Mei-lan Cui1,Hui-min Yan1
(1.Clinical Research Center,2.Department of Laboratory Medicine,Shijiazhuang Fifth Hospital,Shijiazhuang,Hebei 050021,China;3.Hebei Medical University Graduate School,Shijiazhuang,Hebei 050017,China)
ObjectiveTo investigate the role of myeloid-derived suppressor cells(MDSC)and regulatory T(Treg)cells in development of ulcerative colitis.MethodsMouse models of ulcerative colitis were established with administration of 5%dextran sodium sulfate(DSS).Body weight and hematochezia were obtained daily.Mice were sacrificed 3 or 7 days post insult.Histological assessment of ulcerative colitis was graded with hematoxylin-eosin staining.The percentages of MDSC and Treg cells in the spleen and mesenteric lymph nodes were measured by flow cytometry.ResultsIn animals treated with DSS,body weight loss,diarrhea and hematochezia were observed on the 4th day.Histological analysis revealed colonic mucosa damage and manifestation of inflammation.The amount of Treg cells was increased,whereas the amount of MDSC was decreased significantly in mesenteric lymph nodes in 7-day model group(P<0.05).Further observation on the subsets of MDSC suggested that the percentage of granulocyte-like MDSC decreased in the 7-day model group (P<0.05)while no significant change of monocyte-like MDSC was observed among all the groups.There was no significant difference in the amount of Treg cells or MDSC in spleen among three groups.ConclusionAcute ulcerative colitis experiences decreased MDSC and increased Treg cells,which could contribute to the development of ulcerative colitis.
ulcerative colitis;myeloid-derived suppressor cell;regulatory T cell
R392.9
A
10.3969/j.issn.1005-8982.2017.27.004
1005-8982(2017)27-0017-05
2017-04-30
河北省自然科学基金(No:H2015106081);河北省医学科学研究课题计划项目(No:20150893)
闫会敏,E-mail:yanhm2538@163.com;Tel:0311-89109031
