草苁蓉环烯醚萜苷对二乙基亚硝胺诱发肝癌大鼠细胞凋亡的影响*
2017-11-28崔香丹郑峰朱洁波全吉淑尹学哲
崔香丹 ,郑峰 ,朱洁波 ,全吉淑 ,尹学哲
(1.延边大学附属医院,吉林 延吉 133000;2.延边大学基础医学院,吉林 延吉 133000)
草苁蓉环烯醚萜苷对二乙基亚硝胺诱发肝癌大鼠细胞凋亡的影响*
崔香丹1,郑峰1,朱洁波1,全吉淑2,尹学哲1
(1.延边大学附属医院,吉林 延吉 133000;2.延边大学基础医学院,吉林 延吉 133000)
目的观察二乙基亚硝胺(DEN)诱发大鼠肝癌的病理变化,探讨草苁蓉环烯醚萜苷(IGBR)对细胞凋亡的作用及对p53、Bcl-2蛋白表达的影响。方法132只Wistar雄性大鼠随机分为对照组、模型对照组、阳性对照组及IGBR组。除对照组,各组大鼠给予DEN 0.2 g/kg腹腔注射1次,而后0.05%的DEN水溶液用于自由饮水;阳性对照组腹腔注射5-氟尿嘧啶(5-FU)0.025 g/kg每周3次;IGBR组每日IGBR 0.5 g/kg灌胃1次。实验第12、20及28周末,分批处死动物,观察肝脏病理变化及细胞凋亡,免疫组织化学法和Western blot检测p53、Bcl-2的表达。结果与对照组比较,模型对照组肝细胞核大且深染,肝细胞变性、异型增生,有些增生灶可见癌变细胞。凋亡的肝细胞皱缩、核固缩及核仁消失。IGBR组与阳性对照组凋亡指数高于模型对照组,差异有统计学意义(P<0.05),但两组比较差异无统计学意义(P>0.05)。免疫组织化学结果,p53和Bcl-2阳性细胞主要分布于不典型增生灶和癌灶的胞浆中。与模型对照组比较,IGBR组和阳性对照组p53表达强度增强,而Bcl-2表达强度减弱,差异有统计学意义(P<0.05),IGBR组和阳性对照组比较,差异无统计学意义(P>0.05)。结论大鼠肝癌发生与细胞凋亡相关,IGBR通过调控p53、Bcl-2来抑制DEN诱发大鼠肝癌。
肝癌;草苁蓉环烯醚萜苷;凋亡;p53;Bcl-2
如今,原发性肝细胞癌(hepatocellular carcinoma,HCC)的发生呈迅猛的增加趋势[1],世界卫生组织揭晓的《全球癌症报告》表明,肝癌的新发和死亡人数中国居世界第一[2]。恶性肿瘤的发生与细胞凋亡和增殖紧密相关[3]。细胞凋亡是由基因调控引起的细胞环境和死亡信号变化引起的程序性细胞死亡过程。肿瘤细胞与实体肿瘤中都存在细胞凋亡,且凋亡程度的好坏直接与肿瘤的发展程度相关。
草苁蓉为中国传统的民族药,民族药名为不老草,为我国2类保护植物,是大兴安岭高山地区、长白山特有植物,可全草入药。传统医药典籍记载其有补肾壮阳、润肠通便、滋补强身、延缓衰老之功效[4]。草苁蓉环烯醚萜苷(iridoid glucosidesfrom bosch niakia rossica,IGBR)是草苁蓉提取物,具有抗癌、清除自由基及诱导凋亡等作用[5]。目前对IGBR抗癌机制方面的研究受到广泛的关注。通过观察二乙基亚硝胺(diethylnitrosamine,DEN)引发大鼠肝癌中IGBR对细胞凋亡的作用,阐明其抗癌机制。
1 材料与方法
1.1 材料与试剂
Wistar大鼠和 IGBR(延边大学提供),DEN(购自Sigma公司),p53、Bcl-2蛋白多克隆抗体、TUNEL和免疫组化试剂盒(购自北京中杉金桥),β-actin(Cell Signaling Technology公司提供),γ-谷氨酰转肽酶(γ-glutamyl-transferase,γ-GT)试剂盒(购自凯基生物科技有限公司)。
1.2 模型的复制与分组
Wistar雄性大鼠132只,分为4组,对照组大鼠给予生理盐水0.1 ml/100 g体重腹腔注射1次;模型对照组、阳性对照组、IGBR组大鼠第1天给予DEN 0.2 g/kg腹腔注射1次,然后0.05%的DEN水溶液用于自由饮水;阳性对照组大鼠腹腔注射5-氟尿嘧啶(5-FU)0.025 g/kg每周3次;IGBR组大鼠每日灌胃IGBR 0.5 g/kg。实验第12、20周末各组处死6只、28周末各组处死20只,取心脏血,肝脏甲醛固定,石蜡包埋。
1.3 检测方法
按γ-GT试剂盒的操作步骤测定血清中γ-GT,HE染色观察肝脏病理变化,TUNEL法检测肝细胞的凋亡,凋亡指数(apoptoticindex,AI)=×100%免疫组织化学法和Western blot法检测p53和Bcl-2蛋白的表达。
1.4 统计学方法
数据处理采用SPSS 19.0统计软件,计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析和χ2检验,计数资料以率(%)表示,P<0.05差异有统计学意义。
2 结果
2.1 IGBR对DEN诱发肝癌大鼠血清γ-GT含量的影响
大鼠诱癌过程中28周末,4组间γ-GT比较,差异有统计学意义(F=1111.237,P=0.000);与对照组比较,模型对照组γ-GT增高,差异有统计学意义(P<0.05);与模型对照组比较,阳性对照组与IGBR组γ-GT下降,两组差异无统计学意义(P>0.05)。见表1。
2.2 肝脏组织HE染色
肝小叶和肝索排列正常,可见中央静脉,细胞核清晰。模型对照组肝脏病理改变主要表现为肝脏炎症反应、肝硬化和肝癌。根据不同的病理变化将模型对照组病理变化分为3个阶段:①肝炎阶段(12周):可见炎症反应、坏死和淋巴细胞浸润、胶原沉积及凋亡小体;②肝硬化阶段(20周):可见结节性肝细胞再生,不同大小的肝结节,肝小叶正常结构破坏、肝索排列紊乱;③肝癌阶段(28周):可见肝细胞核深染,肝细胞变性、增生,部分可见癌细胞增生。IGBR组及阳性对照组肝小叶破坏及肝索排列紊乱程度、细胞变性及异性增生度较模型对照组各阶段均减轻,IGBR组和阳性对照组差异无统计学意义。
表1 各组大鼠γ-GT、AI值的比较 (n=6,±s)

表1 各组大鼠γ-GT、AI值的比较 (n=6,±s)
注:1)与对照组比较,P<0.05;2)与模型对照组比较,P <0.05
组别γ-GT/(U/L)AI/%对照组 38±3 1.5±0.6模型对照组 97±131) 12.3±0.41)阳性对照组 91±52) 22.3±0.22)IGBR 组 97±52) 22.2±0.12)
2.3 肝细胞凋亡染色
对照组大鼠肝细胞凋亡稀少,着色浅;模型对照组细胞凋亡率增加,胞质呈棕黄色,凋亡的肝细胞故缩、核浓缩、核仁消失。4组的AI比较,差异有统计学意义(F=42 542.984,P=0.000);IGBR 组与阳性对照组AI差异无统计学意义(P>0.05),但高于模型对照组,且差异有统计学意义(P<0.05)。见表1。
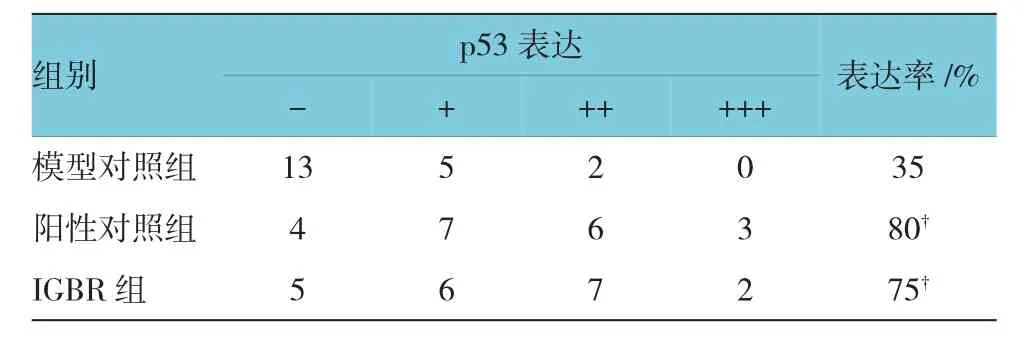
表2 各组大鼠肝癌阶段肝组织中p53表达率的比较(n=20)
2.4 p53和Bcl-2免疫组织化学染色结果
p53和Bcl-2阳性细胞主要分布于癌灶的胞浆中(见表2、3和图 1、2)。3组p53表达率的比较,差异有统计学意义(χ2=11.971,P=0.046);3组 Bcl-2表达率比较,差异有统计学意义(χ2=34.159,P=0.000)。较模型对照组比较,IGBR和阳性对照组p53表达增强,而Bcl-2表达减弱,差异有统计学意义(P<0.05)。
2.5 p53和Bcl-2表达水平比较
4组p53的比较,差异有统计学意义(F=2201.596,P=0.000),但两组间差异无统计学意义(P>0.05)。4组Bcl-2的比较,差异有统计学意义(F=2 838.713,P=0.000)。与对照组比较,模型对照组p53和Bcl-2表达水平升高(P<0.05);与模型对照组比较,IGBR组和阳性对照组p53表达水平升高,而Bcl-2表达水平降低(P<0.05),两组间比较差异无统计学意义(P>0.05),见图3。
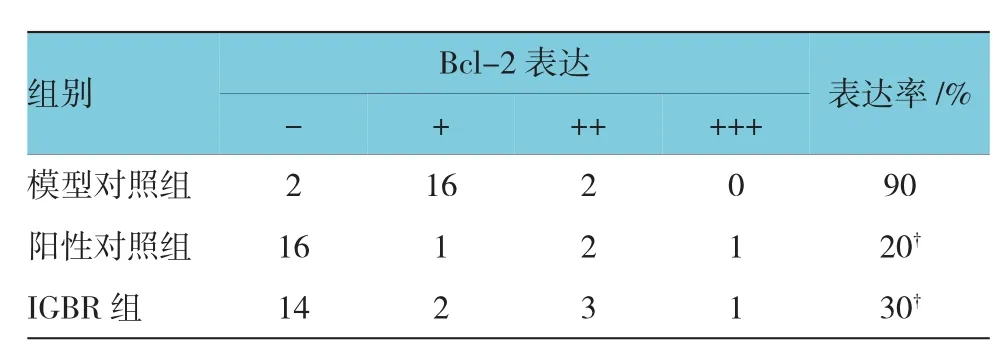
表3 各组大鼠肝癌阶段肝组织中Bcl-2表达率的比较(n=20)
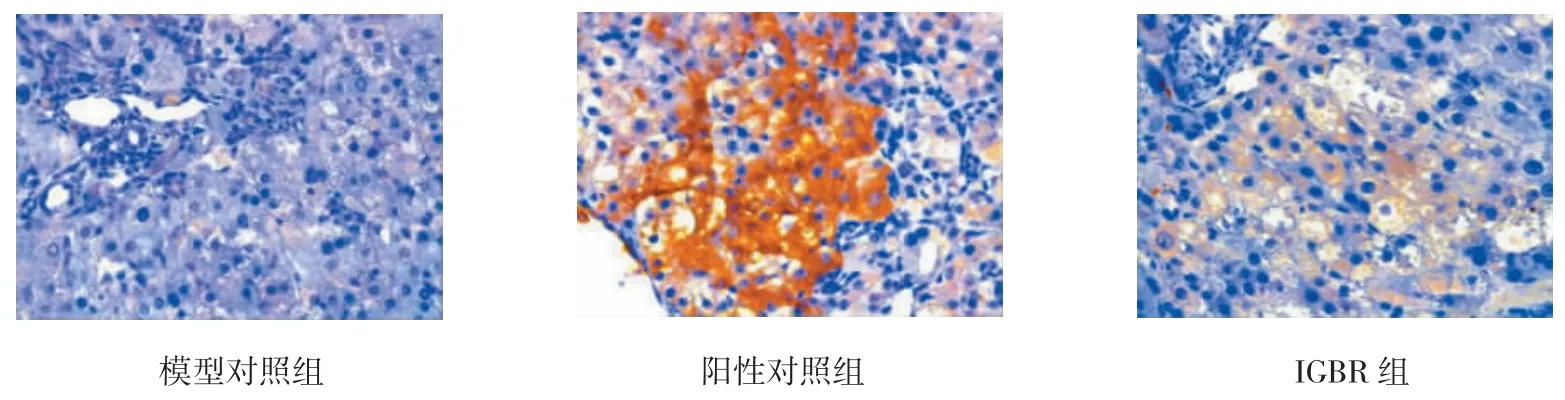
图1 肝组织p53免疫组织化学观察结果 (×100)
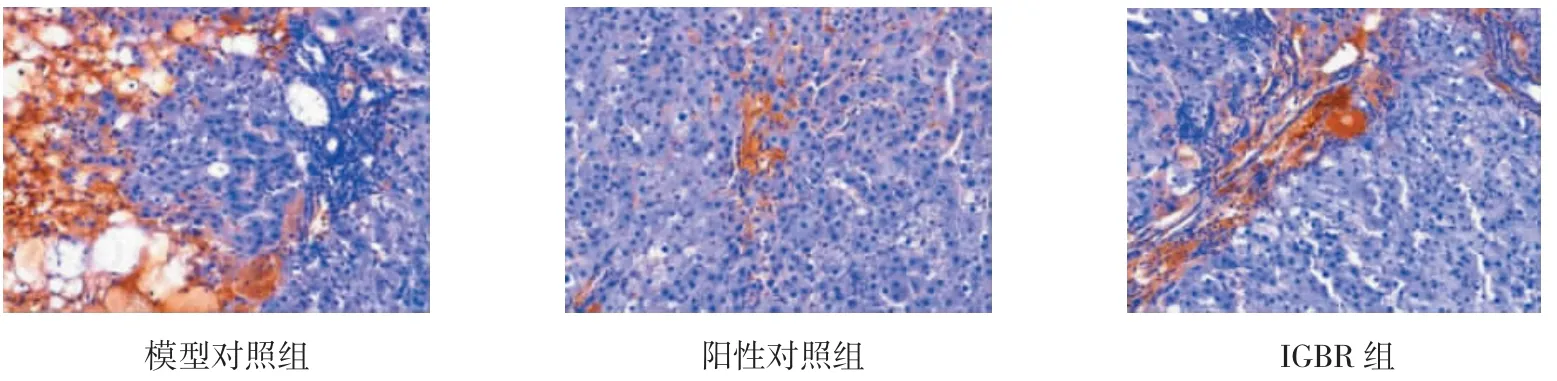
图2 肝组织Bcl-2免疫组织化学观察结果 (×100)
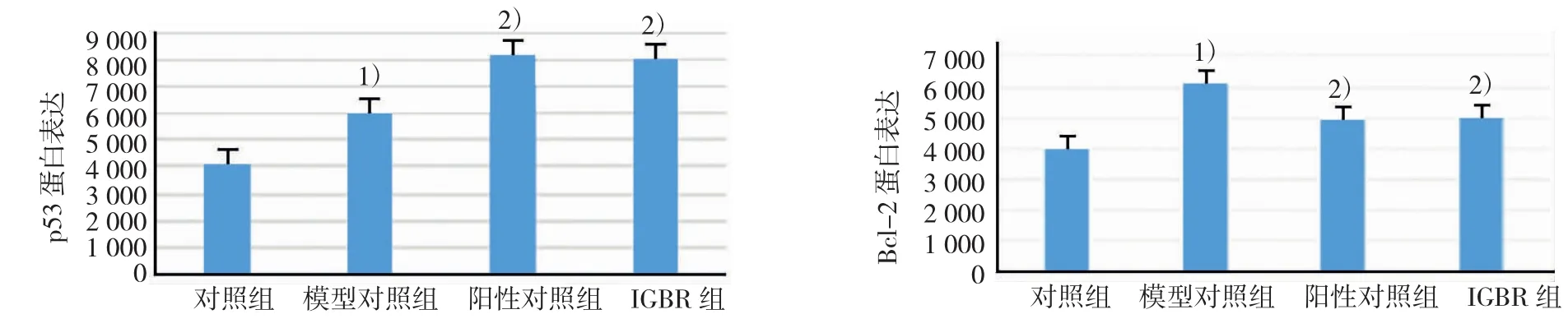
图3 肝组织p53、Bcl-2 Western blot观察结果
3 讨论
肝癌的发生机制非常复杂,有大量的研究表明,抗凋亡因子在肿瘤细胞株和实体肿瘤中表达增加。DEN诱发的大鼠肝癌多为肝细胞肝癌,造模简单易成功。张志敏等[7]观察到,DEN诱癌过程与人类肝细胞癌进程相似。本实验造模过程中28周(肝癌阶段)时血清γ-GT增高,且HE染色肝细胞核大、深染、变性、异型增生,部分可见癌变细胞,说明DEN诱发大鼠肝癌模型制作成功。
细胞凋亡是细胞程控性死亡,调控机体发育和内环境稳定[6-7]。p53与Bcl-2调节细胞凋亡与增殖,且在凋亡进程中相互影响[8]。
p53是抑癌基因,半数以上的人类癌症有p53的缺失和突变。突变型p53促进细胞生长、抑制细胞凋亡,导致基因异常表达,使细胞癌变[9-11]。各种应激使p53被不同的信号通路激活,引发下游的基因转录,导致细胞凋亡[12]。研究表明,p53基因失活与肝癌的形成与预后相关[13]。在慢性肝损伤中,肝细胞发生依赖p53的衰老程序,肝硬化的风险大大增加;另外,缺失p53表达的上皮细胞更易转化为肝癌[14]。
Bcl-2是原癌基因,通过调控凋亡信号而抑制细胞凋亡,还与细胞异常增殖有关,与肝癌的发生紧密相关[15]。Bcl-2高表达转录因子,促进其过多释放及无限制地转录,使量变诱发质变而导致肿瘤发生[16]。另外,Bcl-2与癌基因C-myc[17]和抗癌基因p53[18]互相作用,间接控制细胞程序性死亡。
本研究结果显示,DEN诱发的大鼠肝组织中p53和Bcl-2均表达增强,免疫组织化学和Western blot检测结果示IGBR与5-FU干预后,p53表达增强,而Bcl-2表达下降。IGBR和5-FU是通过介导抑癌基因和癌基因的表达而实现诱导大鼠肝癌细胞凋亡。已有研究证明5-FU为传统抗癌药,本研究结果IGBR与5-FU作用无差异,进一步证实IGBR的抗癌作用。
本研究中,通过IGBR对大鼠肝癌的影响,进一步阐明IGBR抗肝癌机制,对中医在诱导肿瘤细胞凋亡的机制进行深入研究,并为中医抗肿瘤提供科学依据。
[1]SMITH W A, LI C, NOTTAGE K A, et al. Lifestyle and metabolic syndrome in adult surviv-ors of childhood cancer: a report from the st: jude lifetime cohort study[J]. Cancer, 2014,120(17): 2742-2750.
[2]陈万青,张思维,曾红梅,等.中国2010年恶性肿瘤发病与死亡[J].中国肿瘤,2014,23(1):1.
[3]FAQABREQAT I, RONCERO C, FERNANDEZ M. Survival and apoptosis: a dysregulated balance in liver cancer [J]. Liver Int,2007, 27(2): 155-162.
[4]中华本草编委会.中华本草[M].第20版.上海:上海科学技术出版社,2002:507.
[5]尹学哲,许惠仙,金爱花,等.草苁蓉环烯醚萜苷对肺癌细胞增殖和凋亡影响[J].中国公共卫生,2010,26(7):805-806.
[6]TOMEK M, AKIYAMA T, DASS C R, et al. Role of Bcl-2 in tumour cell survival and implications for pharmacotherapy [J]. J Pharm Pharmacol, 2012, 64(12): 1695-1702.
[7]XIAO Z, SHAN J, LI C, et al. Mechanisms of cyclosporine-induced renal cell apoptosis: a systematic review[J]. Am J Nephrol,2013, 37(1): 34-40.
[8]林庆新.黄连素诱导人肝癌HepG2细胞凋亡及其机制研究[J].中药材,2015,38(7):1499-1501.
[9]张勤,刘红.P53在三阴性乳腺癌中的表达及临床意义[J].中国肿瘤临床,2011,38(4):214-217.
[10]FEMANDEZ-CUESTA L, ANAGANTI S, HAINAUT P, et al.Estrogen levels act as arheost-at on p53 levels and modulate p53-dependent responses in breast cancer cell lines [J]. Breast Cancer Res Treat, 2011, 125(1): 35-42.
[11]WALERYCH D, NAPOLI M, COLLAVIN L, et al. The rebel angel: mutant p53 as the driving oncogene in breast cancer[J].Carcinogenesis, 2012, 33(11): 2007-2017.
[12]MARCEL V, CATEZ F, DIAZ J J. p53, a translational regulator:contribution to its tumor-su ppressor activity[J]. Oncogene,2015, 34(44): 5513-5523.
[13]ZHANG Q, LIU J, LIU B, et al. Dihydromyricetin promotes hepatocellular carcinoma regre-ssionvia a p53 activation-dependent mechanism[J]. Sci Rep, 2014, 4(4): 4628.
[14]LUJAMBI O, AKKARI L, SIMON J, et al. Non-cell-autonomous tumor suppression by p53[J]. Cell, 2013, 153(2): 449-460.
[15]RODRIGUEZA WV, WOOLLISCROFT MJ, EBRAHIM AS, et al.Development and anti-tumor activity of a BCL-2 targeted singlestranded DNA oligonucleotide[J]. Cancer Chemot-her Pharmacol,2014, 74(1): 151-166.
[16]MULLER P A, VOUSDEN K H, NORMAN J C. p53 and its mutants in tumor cell migration and invasion [J]. J Cell Biol,2011, 192(2): 209-218.
[17]DEMR D, YAMAN B, ANACAK Y, et al. Prognostic signifi-cance of bcl-2, c-myc, survivin and tumor grade in synovial sarcoma[J]. Turkish Journal of Pathology, 2014, 30(1): 55-65.
[18]NAKAZAWA K, DASHZEVEG N, YOSHIDA K. Tumor suppressor p53 induces miR-1915 processing to inhibit Bcl-2 in the apoptotic response to DNA damage[J]. FEBS J, 2014, 281(13):2937-2944.
(王荣兵 编辑)
Effect of Iridoid Glucosides from Boschniakia Rossica on rat models of diethylnitrosamine-induced hepatocarcinomat*
Xiang-dan Cui1,Feng Zheng1,Jie-bo Zhu1,Ji-shu Quan2,Xue-zhe Yin1
(1.Yanbian University Hospital,Yanji,Jilin 133000,China;2.Yanbian University Medical School,Yanji,Jilin 133000,China)
ObjectiveTo investigate the effect of Iridoid Glucosides from Boschniakia Rossica (IGBR) on apoptosis and the expression of p53 and Bcl -2 proteins.MethodsA total of 132 Wistar male rats wererandomly divided into control group, model group, positive control group and IGBR group. DEN was administered once by intraperitoneal injection (0.2 g/kg), then through drinking water (0.05%) for the rest of experimental duration in each group except for the control group. Animals from the positive control group was injected with 5-FU 3 times per week (0.025 g/kg). Rats in the IGBR group were treated intragastrically with IGBR daily (0.5 g/kg). Animals were sacrificed on 12, 20 or 28 weeks post insults. Pathological alterations and apoptosis of liver cells were observed and expression of p53 as well as Bcl -2 were determined by Immunohistochemistry and Western blot.ResultsCompared with the control group, the enlarged and deeply stained nuclei, hepatocellular degeneration, dysplasia and cancer cell were observed in the liver tissue of the model group. Apoptotic hepatocyte showed cytoplasmic and nuclear shrinkage without nucleolus. Immunohistochemistry results showed that p53 and Bcl -2 positive signals were mainly distributed in the cytoplasm of atypical hyperplasia and carcinoma.Expression of p53 increased while Bcl-2 decreased in the IGBR group as well as the positive control group significantly compared with the model group(P<0.05).No obvious differences were observed between the IGBR group and the positive control group (P>0.05).ConclusionsHepatocarcinoma is closely associated with apoptosis,and IGBR inhibits DEN-induced hepatocarcinoma through mediating p53 and Bcl-2 pathway.
hepatocarcinoma; Iridoid Glucosides from Boschniakia Rossica (IGBR); apoptosis; p53; Bcl-2
R285.5
A
10.3969/j.issn.1005-8982.2017.27.002
1005-8982(2017)27-0007-05
2017-05-23
国家自然科学基金(No:81360651)
尹学哲,E-mail:yinxz@ybu.edu.cn;Tel:0433-2660004,15526770004
