过表达miR-338-3p对炎症信号通路的影响
2017-11-28隋小芳于淑倩王凤玲苏亚楠黄佳滨范巧菊陈尚君费秀斌
隋小芳,于淑倩, 王凤玲,苏亚楠,黄佳滨,范巧菊,陈尚君,费秀斌*
(1.佳木斯大学附属第一医院 老年病科,黑龙江 佳木斯154002;2.安徽省太和县人民医院 老年病科; 3.佳木斯大学附属第一医院 科研科)
过表达miR-338-3p对炎症信号通路的影响
隋小芳1,于淑倩2, 王凤玲1,苏亚楠3,黄佳滨1,范巧菊1,陈尚君1,费秀斌1*
(1.佳木斯大学附属第一医院 老年病科,黑龙江 佳木斯154002;2.安徽省太和县人民医院 老年病科; 3.佳木斯大学附属第一医院 科研科)
目的研究过表达miR-338-3p在内皮细胞系EOMA中对炎症信号通路的影响。方法将EOMA细胞分为四组即对照组、miR-338-3p过表达组、TNF-α处理组、miR-338-3p与TNF-α共处理组。用Real time PCR检测miR-338-3p及黏附分子VCAM-1和ICAM-1mRNA表达水平,Western blot分析ERK/p38 MAPK信号通路活性。结果与对照组比较,miR-338-3p过表达组的黏附分子VCAM-1及ICAM-1 mRNA表达水平和ERK/p38信号通路活性明显降低,而TNF-α处理组的黏附分子VCAM-1及ICAM-1 mRNA表达水平和ERK/p38信号通路活性明显升高;miR-338-3p与TNF-α共处理组与TNF-α处理组比较,黏附分子VCAM-1及ICAM-1 mRNA表达水平和ERK/p38信号通路活性明显降低;miR-338-3p与TNF-α共处理组与miR-338-3p过表达组比较,黏附分子表达水平及ERK/p38信号通路活性不再升高。结论过表达miR-338-3p抑制ERK/p38信号通路活性,降低黏附分子VCAM-1和ICAM-1 mRNA表达水平;过表达miR-338-3p能够逆转TNF-α对ERK/p38 通路的激活和TNF-α对黏附分子VCAM-1及ICAM-1mRNA表达的促进作用。
miR-338-3p;内皮细胞;EOMA;TNF-α;炎症
(ChinJLabDiagn,2017,21:1991)
动脉粥样硬化是心血管疾病最常见的原因。研究发现,microRNAs(miRNAs)参与调控动脉粥样硬化斑块形成、心肌缺血/再灌注及心律失常等[1]。miR-338-3p,作为miRNA的一员,已证明参与肿瘤细胞的增值、分化与迁徙[2],前期实验证实TNF-α及低表达miR-338-3p能够激活炎症信号通路活性。因此,本课题将进一步探讨过表达miR-338-3p对内皮细胞炎症信号通路的影响,为靶向治疗动脉硬化提供理论基础。
1 材料与方法
1.1材料
EOMA细胞(小鼠血管瘤内皮细胞珠,购于中国医学科学院细胞库);H-DMEM 培养基(美国Invitrogen公司);FBS胎牛血清(美国Hyclone公司);TNF-α (美国Epitomics公司);HRP标记的羊抗兔IgG相关抗原抗体(北京中杉金桥生物技术有限公司);miR-338-3p过表达腺病毒载体(AD-338-3p mimics)(购于上海吉凯科技有限公司);Rabbit GAPDH Antibody(美国CST);磷酸化丝裂原活化蛋白激酶(p-ERK)抗体、ERK抗体、磷酸化p38丝裂原活化蛋白激酶抗体及p38抗体均购于美国CST。
1.2细胞培养
EOMA细胞用含10% 胎牛血清的高糖培养基于37℃、含5% CO2的培养箱中孵育。每两天更换一次培养液,细胞达80%-90%丰度时进行传代或用于实验。
1.3构建EOMA过表达miR-338-3p模型及炎症模型
将EOMA细胞接种于六孔板中,随机分为四组:对照组(NC,阴性对照病毒感染EOMA细胞48 h);过表达组(338M,过表达miR-338-3p腺病毒感染EOMA细胞48 h);TNF-α处理组(NC+TNF-α,感染阴性对照病毒24 h后再给予TNF-α 20 ng/ml共处理24 h);miR-338-3p与TNF-α共处理组(338M+TNF-α,过表达miR-338-3p感染EOMA细胞24 h后再给予TNF-α 20 ng/ml 处理24 h)。
1.4miR-338-3p和VCAM-1及ICAM-1mRNA表达检测
收集上述细胞,用RNAVzol萃取细胞总RNA并纯化,将RNA逆转录cDNA,用SYBR Green荧光定量试剂盒和实时荧光定量PCR(Real time PCR)仪检测miR-338-3p表达和VCAM-1及ICAM-1 mRNA 表达。结果用2-ΔΔct计算相对表达量。miR-338-3p引物设计如下:

引物名称反转录引物序列5′⁃3′miR⁃338⁃3pGTCGTATCCAGTGCAGGGTCCGAGGTAT⁃TCGCACTGGATACGACCAACAAU6GTCGTATCCAGTGCAGGGTCCGAGGTAT⁃TCGCACTGGATACGACAAATATG
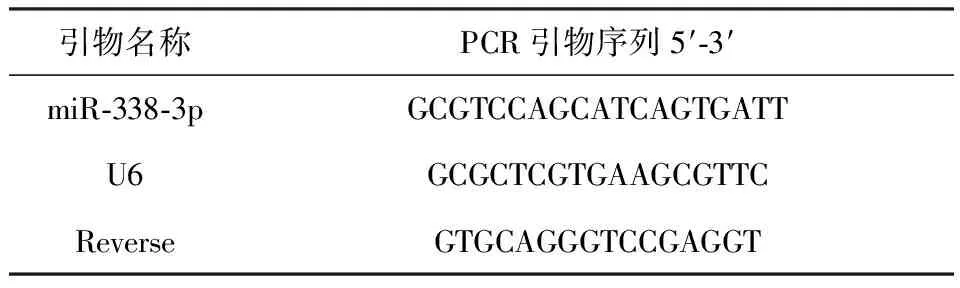
引物名称PCR引物序列5′⁃3′miR⁃338⁃3pGCGTCCAGCATCAGTGATTU6GCGCTCGTGAAGCGTTCReverseGTGCAGGGTCCGAGGT
VCAM-1和ICAM-1及内参18S的引物设计如下:
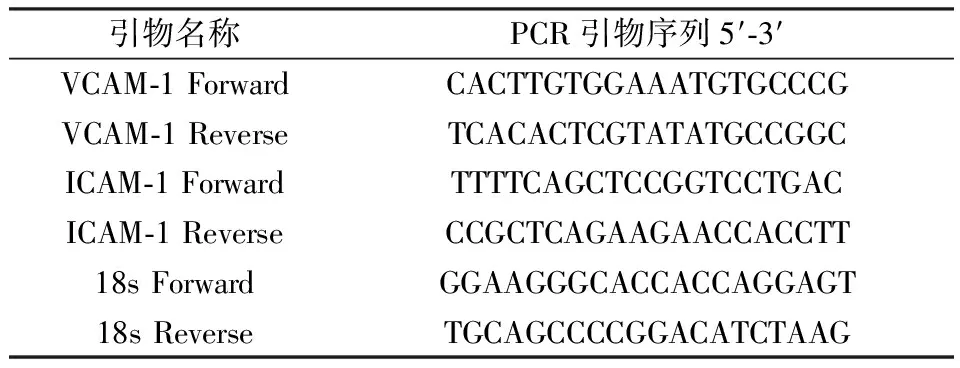
引物名称PCR引物序列5′⁃3′VCAM⁃1ForwardCACTTGTGGAAATGTGCCCGVCAM⁃1ReverseTCACACTCGTATATGCCGGCICAM⁃1ForwardTTTTCAGCTCCGGTCCTGACICAM⁃1ReverseCCGCTCAGAAGAACCACCTT18sForwardGGAAGGGCACCACCAGGAGT18sReverseTGCAGCCCCGGACATCTAAG
1.5Westernblot分析ERK/p38MAPK信号通路蛋白变化
用高效裂解液RIPA裂解1.3中4组细胞,高速离心取上清液,即获得细胞总蛋白。BCA试剂盒检测蛋白浓度,计算含15-20 μg蛋白溶液的体积即为上样量。取出上样量,加入4×SDS上样缓冲液至终浓度为1×SDS,上样前将样品于沸水浴中煮沸5-10 min。将蛋白转移到活化的PVDF膜上,5%脱脂牛奶封闭2 h,孵一抗过夜,室温下孵二抗2 h,用凝胶成像仪显影,分析蛋白条带灰度值,以GAPDH为内参,计算ERK和p38磷酸化水平即p-ERK和p-p38相对值。
1.6统计学分析
应用SPSS 17.0统计软件,采用t检验和单因素方差分析进行数据处理,以GraphPad Prism 5.0软件绘制统计图,95%可信区间,Plt;0.05为差异有统计学意义。
2 结果
2.1EOMA细胞中过表达miR-338-3p抑制ERK/p38MAPK信号通路活性,降低促炎基因VCAM-1和ICAM-1mRNA表达水平
miR-338-3p mimics感染EOMA细胞48 h,与对照组相比,Real time PCR检测miR-338-3p表达水平显著升高,黏附分子VCAM-1和ICAM-1 mRNA表达水平明显降低;Western blot分析ERK蛋白磷酸化水平(p-ERK)及p38蛋白磷酸化水平(p-p38)明显降低。结果表明:EOMA细胞中过表达miR-338-3p能够抑制ERK/p38 MAPK信号通路活性,降低黏附分子VCAM-1和ICAM-1 mRNA水平(图1)。
2.2过表达miR-338-3p能够逆转TNF-α对EOMA细胞ERK/p38MAPK信号通路活性及黏附分子VCAM-1及ICAM-1mRNA的促进作用
图2结果表明,TNF-α处理EOMA细胞升高了ERK和p38磷酸化水平及黏附因子表达水平,单独转染miR-338-3p mimics降低了ERK和p38磷酸化水平及黏附分子表达水平,当EOMA细胞高表达miR-338-3p再给予TNF-α处理,ERK和p38磷酸化水平及黏附分子表达水平不再升高。结果表明,过表达miR-338-3p能够逆转TNF-α对EOMA细胞的炎症反应。
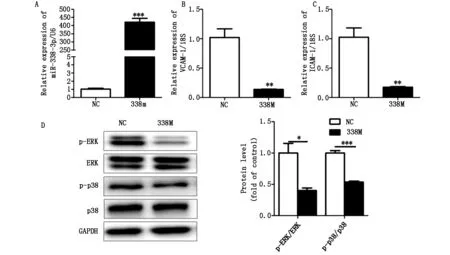
A.miR-338-3p表达水平;B.血管内皮细胞黏附分子VCAM-1表达水平;C.细胞间黏附分子ICAM-1表达水平;D.Western blot检测ERK/p38蛋白磷酸化水平(n=3,*Plt;0.05,**Plt;0.01,***Plt;0.001)
图1miR-338-3p过表达腺病毒抑制EOMA细胞炎症反应
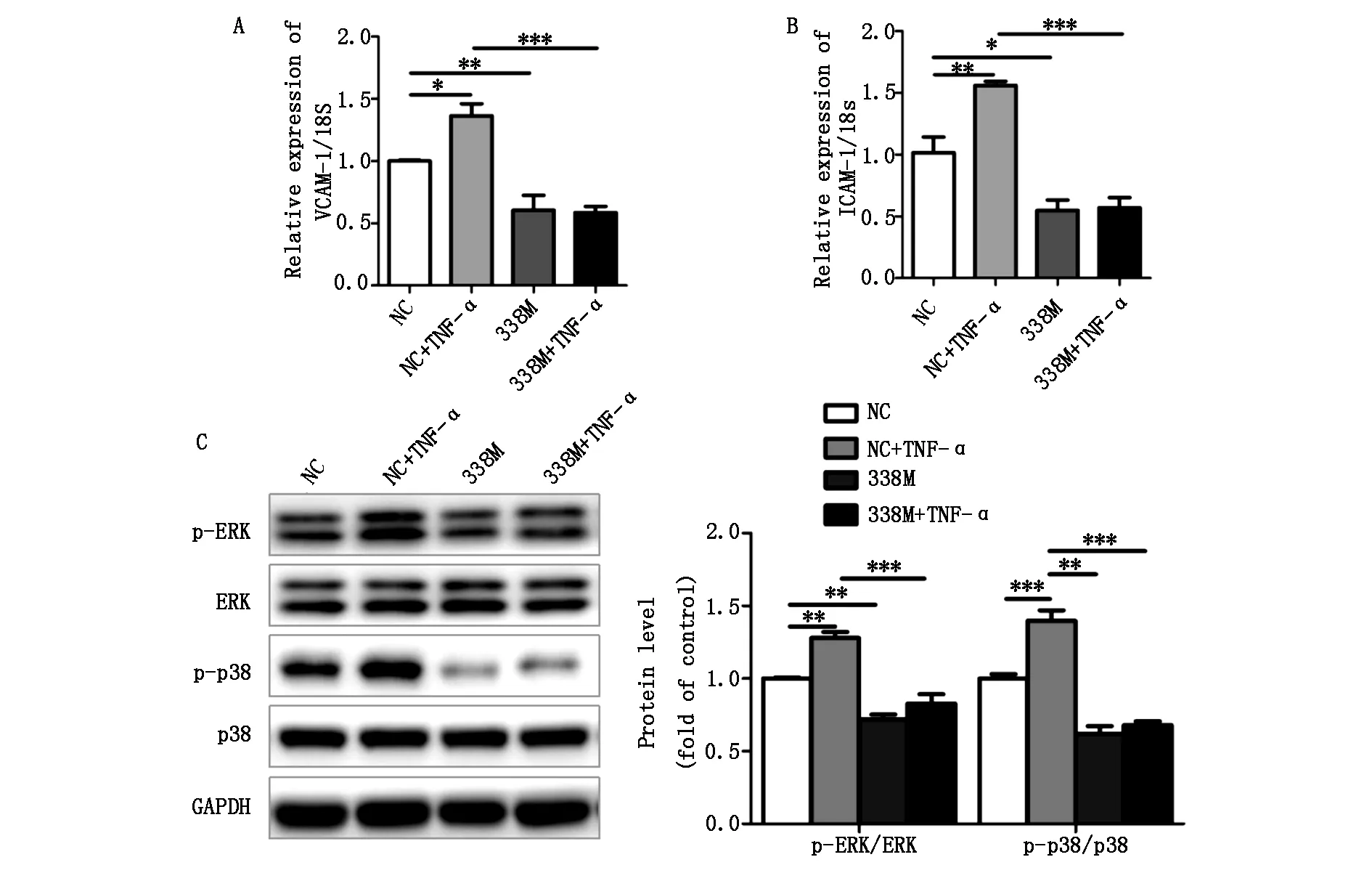
A.血管内皮细胞黏附分子VCAM-1表达水平;B.细胞间黏附分子ICAM-1表达水平;C.Western blot检测ERK/p38蛋白磷酸化水平(n=3,*Plt;0.05,**Plt;0.01,** *Plt;0.001)
图2miR-338-3p高表达腺病毒逆转TNF-α诱导的内皮细胞炎症反应
3 讨论
内皮细胞功能紊乱是动脉硬化形成和斑块破裂的开始[3],且在动脉粥样硬化慢性血管炎症发病机制中有着至关重要的作用[4,5]。内皮细胞损伤后,细胞表面黏附分子VCAM-1和ICAM-1表达增加,促进循环血液中的单核细胞聚集到血管壁内膜,这些单核细胞成熟以后变成炎症巨噬细胞,分泌促炎因子,进一步促进内皮细胞激活从而形成一种正反馈使白细胞持续聚集[6]。NF-кB和MAPK等促炎信号通路的激活,能够激活内皮细胞并产生血管炎症[6]。促动脉硬化细胞因子如TNF-α、IL-1和IL-6由巨噬细胞、自然杀伤细胞和平滑肌细胞分泌[7]。其中TNF-α和IL-1主要由p38 MAPK和NF-кB信号通路介导,通过促进细胞因子和黏附分子表达影响动脉硬化形成[8]。
miRNAs是一类重要的内源性非编码小RNA,平均约18-24 个核苷酸分子,通过绑定靶mRNA 非翻译区(3′UTR)负性调控基因表达[9]。越来越多的研究表明miRNAs参与调控不同生物学进程,如细胞分化、增生、增长和凋亡等[10]。另外,miRNAs还可通过直接结合靶基因3′UTR及调控炎性信号通路参与调控动脉硬化的形成,如miR-17-3p结合靶基因ICAM-1和miR-31结合靶基因E选择素[11],miR-181b通过调控NF-кB信号通路抑制内皮细胞炎症反应[12],miR-146通过抑制促炎通路NF-кB和MAPK 信号通路抑制内皮细胞激活[6]。miR-338位于17号染色体上,以miR-338-3p及miR-338-5p两种成熟体形式存在[13],miR-338-3p通过其宿主基因AATK,参与调控肿瘤细胞增值、分化、凋亡及迁徙等[14-17],还有研究发现miR-338-3p参与调控β细胞维持血糖稳态[18],并且与糖尿病心肌病关系密切[19]。然而miR-338-3p在内皮细胞炎症中的作用研究较少。
在之前的研究中发现TNF-α 20ng/ml能够降低miR-338-3p表达水平,说明miR-338-3p参与内皮损伤炎症反应,并且低表达miR-338-3p能够激活NF-кB/MAPK信号通路活性诱导内皮细胞炎症反应。为了进一步验证miR-338-3p对炎症信号通路的作用,我们在EOMA细胞中过表达miR-338-3p及其阴性对照,结果表明过表达miR-338-3p能够抑制ERK/p38 MAPK信号通路活性,降低促炎基因VCAM-1和ICAM-1 mRNA表达,说明过表达miR-338-3p抑制内皮细胞炎症通路活性。本实验中我们还发现,EOMA细胞增强miR-338-3p 表达后再用TNF-α处理,能够逆转TNF-α对促炎基因VCAM-1及ICAM-1的促进作用和对ERK及p38信号通路活性激活作用,进一步说明TNF-α通过调节miR-338-3p表达而影响炎症信号通路活性。
综上所述,过表达miR-338-3p不仅能够抑制内皮细胞炎症信号通路活性,并能逆转TNF-α诱导内皮损伤对促炎信号通路的促进作用。在本实验中我们首次证实了miR-338-3p在EOMA细胞中对促炎信号通路的抑制作用。因此,研究miR-338-3p在内皮细胞炎症信号通路中的调节作用对动脉硬化的风险预测及治疗有十分重要的应用前景。
[1]李雪杰,隋小芳,王凤玲,等.抑制 miRNA-291b-3p 表达对 H9C2 细胞胰岛素信号通路活性的影响[J].中国实验诊断学,2016,20(1):25.
[2]Peng Y,Liu Y M,Li L C,et al.MicroRNA-338 inhibits growth,invasion and metastasis of gastric cancer by targeting NRP1 expression[J].PloS One,2014,9(4):e94422.
[3]Tedgui A,Mallat Z.Cytokines in atherosclerosis:pathogenic and regulatory pathways[J].Physiological Reviews,2006,86(2):515.
[4]Albrecht C,Preusch M R,Hofmann G,et al.Egr-1 deficiency in bone marrow-derived cells reduces atherosclerotic lesion formation in a hyperlipidaemic mouse model[J].Cardiovascular Research,2010,86(2):321.
[5]Anderson H D I,Rahmutula D,Gardner D G.Tumor necrosis factor-α inhibits endothelial nitric-oxide synthase gene promoter activity in bovine aortic endothelial cells[J].Journal of Biological Chemistry,2004,279(2):963.
[6]Cheng H S,Sivachandran N,Lau A,et al.MicroRNA-146 represses endothelial activation by inhibiting pro-inflammatory pathways[J].EMBO Molecular Medicine,2013,5(7):1017.
[7]Tedgui A,Mallat Z.Cytokines in atherosclerosis:pathogenic and regulatory pathways[J].Physiological Reviews,2006,86(2):515.
[8]Tousoulis D,Oikonomou E,Economou E K,et al.Inflammatory cytokines in atherosclerosis:current therapeutic approaches[J].European Heart Journal,2016:ehv759.
[9]Tang Y,Zhang Y,Chen Y,et al.The role of miR-19b in the inhibition of endothelial cell apoptosis and its relationship with coronary artery disease[J].Scientific Reports,2015,5.
[10]Zheng Z,Liang J,Huang R,et al.Identification of a novel miR-146a from Pinctada martensii involved in the regulation of the inflammatory response[J].Fish amp; Shellfish Immunology,2016,54:40.
[11]Suárez Y,Wang C,Manes T D,et al.Cutting edge:TNF-induced microRNAs regulate TNF-induced expression of E-selectin and intercellular adhesion molecule-1 on human endothelial cells:feedback control of inflammation[J].The Journal of Immunology,2010,184(1):21.
[12]Sun X,He S,Wara A K M,et al.Systemic Delivery of MicroRNA-181b Inhibits Nuclear Factor-κB Activation,Vascular Inflammation,and Atherosclerosis in Apolipoprotein E-Deficient Mice[J].Circulation Research,2014,114(1):32.
[13]Xue Q,Sun K,Deng H J,et al.MicroRNA-338-3p inhibits colorectal carcinoma cell invasion and migration by targeting smoothened[J].Japanese Journal of Clinical Oncology,2014,44(1):13.
[14]Kos A,Loohuis N F M O,Wieczorek M L,et al.A potential regulatory role for intronic microRNA-338-3p for its host gene encoding apoptosis-associated tyrosine kinase[J].PLoS One,2012,7(2):e31022.
[15]Wu B,Li C,Zhang P,et al.Dissection of miRNA-miRNA interaction in esophageal squamous cell carcinoma[J].PloS One,2013,8(9):e73191.
[16]Guo B,Liu L,Yao J,et al.miR-338-3p suppresses gastric cancer progression through a PTEN-AKT axis by targeting P-REX2a[J].Molecular Cancer Research,2014,12(3):313.
[17]Xue Q,Sun K,Deng H J,et al.MicroRNA-338-3p inhibits colorectal carcinoma cell invasion and migration by targeting smoothened[J].Japanese Journal of Clinical Oncology,2014,44(1):13.
[18]Nesca V,Guay C,Jacovetti C,et al.Identification of particular groups of microRNAs that positively or negatively impact on beta cell function in obese models of type 2 diabetes[J].Diabetologia,2013,56(10):2203.
[19]Chavali V,Tyagi S C,Mishra P K.Differential expression of dicer,miRNAs,and inflammatory markers in diabetic Ins2+/- Akita hearts[J].Cell Biochemistry and Biophysics,2014,68(1):25.
TheeffectofoverexpressionofmiR-338-3pontheinflammatorysignalpathway
SUIXiao-fang1,YUShu-qian2,WANGFeng-ling1,etal.
(1.JiamusiUniversity,FirstAffiliatedHospitalofGeriatric;2.TaiheCountyinAnhuiProvince,People'sHospitalofGeriatrics;3.JiamusiUniversityFirstAffiliatedHospitalScientificResearchDivision,Jiamusi154002,China)
ObjectiveAims Our studyaims toinvestigate the effect of miR-338-3p on the inflammatory signal pathway in endothelial cell line EOMA.MethodsEOMA cells were divided into four groups:control group,miR-338-3p over expression group,TNF-α treatment group,miR-338-3p and TNF-α treatment.ResultsCompared with the control group,miR-338-3p over expression group of adhesion molecule VCAM-1 and ICAM-1 expression level of mRNA and ERK/p38 signaling pathway activity decreased significantly,and TNF-α treatment group of adhesion molecule VCAM-1 and ICAM-1 expression level of mRNA and ERK/p38 signaling pathway activity was significantly increased; miR-338-3p and TNF-α treated group compared with TNF-α treatment,adhesion molecule VCAM-1 and ICAM-1 expression of mRNA was significantly reduced,ERK/p38 pathway activity decreased significantly; miR-338-3p and TNF-α treated group and miR-338-3p overexpression group,adhesion molecule expression and ERK/p38 signaling pathway activity is no longer increasing.ConclusionOverexpression of miR-338-3p inhibited the activation of ERK and p38 signal pathways and reduced the levels of VCAM-1 and ICAM-1.Overexpression of miR-338-3p can reverse the effect of TNF-α on the activation of ERK/p38 pathway and the promotion of the expression of VCAM-1 and ICAM-1.
miR-338-3p;endothelial cell;EOMA;TNF-α;inflammatory response
黑龙江省教育厅科学技术研究项目(2016-KYYWF-0593)
*通讯作者
1007-4287(2017)11-1991-05
R392
A
隋小芳(1976-),女,主任医师,硕士研究生导师,主要从事心血管疾病的临床与基础研究。
2017-03-14)
