基于微卫星DNA标记分析福建猕猴与河南猕猴的遗传多样性
2017-11-24周建华李志雄杨燕燕谢金东俞春英刘德强王训立
周建华 ,李志雄 ,杨燕燕 ,谢金东 ,俞春英 ,林 玮 ,刘德强 ,王训立
(1.福建中医药大学实验动物中心,福建 福州 350122;2.福建省计划生育科学技术研究所,福建 福州 350011)
基于微卫星DNA标记分析福建猕猴与河南猕猴的遗传多样性
周建华1,李志雄2,杨燕燕1,谢金东1,俞春英1,林 玮1,刘德强1,王训立1
(1.福建中医药大学实验动物中心,福建 福州 350122;2.福建省计划生育科学技术研究所,福建 福州 350011)
目的 应用微卫星DNA标记分析福建猕猴与河南猕猴的遗传多样性。 方法 采用14个微卫星DNA标记技术对福建猕猴与河南猕猴遗传多样性进行分析,经基因组DNA提取、PCR扩增、非变性聚丙烯酰胺凝胶电泳等,用POPGENE 1.32等软件统计分析。 结果 14个微卫星位点均存在高度的遗传多态性,共检测到了等位基因166个,其观察等位基因数(Na)在 5~15个,平均为10.071 5个;有效等位基因数(Ne)为3.604 6~11.878 8;杂合度(H)为 0.735 7~0.932 5;香隆信息指数(I)为 1.395 7~2.557 8;多态信息含量(PIC)为 0.675 0~0.909 5。以14个微卫星标记为测度,福建猕猴的Ne、H、I和PIC的平均值均低于河南猕猴。 结论 本研究有效地分析了福建猕猴与河南猕猴两群体的遗传多态性,为今后建立两种群遗传质量监测方法提供理论依据。
微卫星标记;猕猴;遗传多样性
猕猴作为一种重要的实验动物,已广泛应用于生命科学及相关领域的科学研究,当今,利用珍贵的猕猴自然资源和人工养殖猕猴的规模正在不断扩大。我国有丰富的猕猴资源,共有6个猕猴亚种,福建猕猴是其中亚种之一[1]。为了保护猕猴遗传多样性,保护地方特有猕猴的基因资源,有必要对不同地域的猴群进行遗传背景调查,研究比较各地猕猴的遗传多样性现状。微卫星DNA(microsatellite DNA),也称为简单序列重复(simple sequence repeat,SSR),在生物基因组中一般以1~6个碱基为其核心序列、首尾相连组成串联核苷酸重复序列。由于核心序列重复数目的不同,产生了DNA多态性,是一种理想的分子标记,已广泛应用于遗传图谱的构建,亲缘关系、遗传多样性分析,品种及菌株鉴别等[2-5]。 本研究从福建猕猴(福建亚种)(Macacamulatta littoralis)的原主产地―福建武夷山区野捕来的野生猴群中和从河南新野某养殖场引进的河南猕猴中各随机抽取28只,利用14个微卫星DNA标记对该两猴群进行遗传多样性分析。
1 材料与方法
1.1 实验动物 福建猕猴(福建亚种)和河南猕猴来源于福建省计划生育科学技术研究所,各28只,普通级,雌雄各半,年龄8~14岁,体质量5~11 Kg,饲养于普通级动物实验室;特许猎捕证(闽):(猎)字 2008-1 号,准运证:(豫)动运字[2009]第 3、4、7号,实验动物生产许可证:SCXK(闽)2010-0002号,实验动物使用许可证:SPXK(闽)2010-0005号。
1.2 实验试剂和仪器 Wizard®Genomic DNA Purification Kit试剂盒(美国 Promega 公司),Gotaq®Green Master Mix试剂盒 (美国 Promega公司),pBR322 DNA/Msp I标记物(TIANGEN 公司,中国)。凝胶成像系统(美国BioRad公司),电泳仪、垂直电泳槽(北京六一仪器厂)和ABIVeriti梯度PCR仪(美国 ABI公司)。
1.3 基因组DNA提取 空腹自上肢静脉抽取全血2 mL,EDTA抗凝。采用Wizard Genomic DNA Purification Kit试剂盒提取方法提取基因组DNA,详细操作步骤见说明书。
1.4 引物设计及PCR扩增 自GenBank网站及相关文献[6-11]查取具有多态性高的50个微卫星DNA标记,由生工生物工程(上海)有限公司合成。
PCR扩增:反应体系25μL。反应程序为:95℃预变性 3 min;94℃变性 30 s,40℃~61℃复性30 s,72℃延伸 60 s,30个循环,72℃最终延伸 7min。扩增产物4℃保存。
1.5 电泳及结果记录 50个微卫星DNA位点中在两猴群中共有14个位点都呈特异性扩增,每个微卫星位点都有5个及以上等位基因,表现出不同程度的多态性。14个位点扩增产物经2%琼脂糖凝胶电泳测定是否在长度范围之内;后经8%非变性聚丙烯酰胺凝胶电泳、银染和凝胶成像系统照相保存。
1.6 统计学分析 用BioRad凝胶成像系统对8%非变性聚丙烯酰胺凝胶电泳图带进行分析,确定其核苷酸条带分子量大小,以大小不同的扩增片段为不同的等位基因按照从小到大的顺序分别依次定名为 A、B、C、D、E……。用 POPGENE 1.32 软件计算出各基因位点的等位基因频率(gene frequency)、观察等位基因数(observed number of alleles,Na)、有效等位基因数(effective number of alleles,Ne)、杂合度(heterozygosity,H)、香隆信息指数(Shannon's information index,I)等指标,并根据Botstein等的公式利用Excel计算多态信息含量(polymorphism information content,PIC)。
2 结 果
2.1 PCR扩增结果检测 对14个微卫星位点的PCR扩增产物进行8%非变性聚丙烯酰胺凝胶电泳,本文以D21S1246位点的电泳图谱为例说明,见图1。
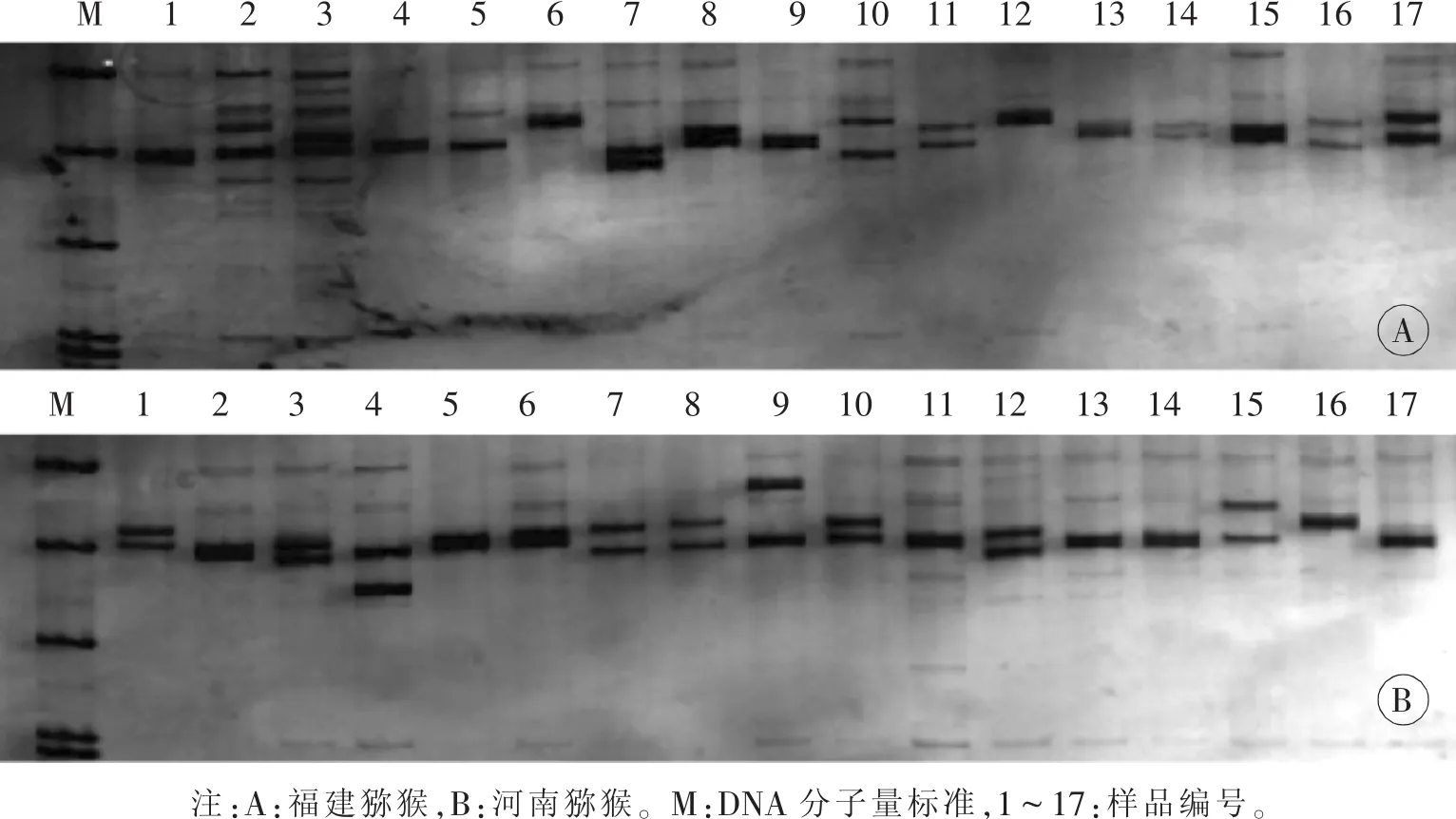
图1 D21S1246位点PCR扩增产物进行的聚丙烯酰胺凝胶电泳图
2.2 福建猕猴与河南猕猴14个微卫星位点的等位基因频率分布信息 分析14个微卫星位点在福建猕猴和河南猕猴中的观察等位基因数目及其频率的分布信息,其能反映出个体间的遗传概貌情况。14个微卫星位点在两猴群中均存在高度的遗传多态性,共检测到了等位基因166个,观察等位基因数(Na)有 5~15个,平均为10.0715个。其中,最多的位点是D1S207,福建猴和河南猴分别有15个和14个等位基因;最少的位点是D1S548,都有5个等位基因。见表1。
2.3 福建猕猴与河南猕猴14个微卫星位点的群体遗传多样性分析 有效等位基因数目(Ne)福建猴和河南猴分别为3.733 3~11.614 8和3.604 6~11.878 8,平均7.015 4和7.031 1个;杂合度(H)福建猴和河南猴分别为0.745 5~0.930 5和0.735 7~0.932 5,平均 0.855 9 和 0.857 7;香隆信息指数(I)福建猴和河南猴分别为 1.399 8~2.557 8和1.395 7~2.544 5之间,平均2.025 3和2.051 5;多态信息含量(PIC)福建猴和河南猴分别为 0.686 2~0.907 4和 0.675 0~0.909 5, 平均0.817 4和0.823 3。以上4个指标两猴群都是D1S207位点最高,D1S548位点最低,并且福建猕猴的Ne、H、I和PIC的平均值均低于河南猕猴。见表2。
3 讨 论
群体的遗传多样性通常使用多个基因位点遗传多样性参数的平均值来描述。有效等位基因(Ne),其值为纯合度的倒数。等位基因在群体中分布越均匀,有效等位基因数越接近所检测到的等位基因的绝对数,它表明等位基因之间的相互影响情况。香隆信息指数(I)表示群体内多态性位点数多少和频率分布情况,描述了群体内以标记为单位的平均离散程度,即多样性;I值越大则群体的离散性越高,多样性越丰富。杂合度(H)是群体内遗传变异的量度,其值的高低反映了群体内个体的均匀度,若数值高,表明遗传变异大,反之则群体内的遗传变异就小。多态信息含量(PIC)用以描述微卫星位点的变异程度,当PIC>0.5时,为高度多态位点。
从表1可以看出,14个微卫星位点中,除D1S548外各位点的等位基因数目和大小,群体间都有一定的差别,大都有各自的特有等位基因;所有位点的等位基因频率,两猴群也基本不同,体现出不同的遗传差异。从表2可以看出,14个微卫星位点中,两猴群的Ne数目从3.604 6~11.878 8不等,H和I都比较高,PIC值皆大于0.5,说明这14个微卫星位点具有较高的可信度,均属于高度多态性位点,能较好地反映福建猕猴与河南猕猴两猴群的遗传多样性。
从表2也可以看出,福建猕猴的Ne、H、I和PIC的平均值均低于河南猕猴,这种差别可能与地域来源及饲养管理方式有关。本实验福建猕猴来源为野生猕猴,其生活习性存在着一定程度的近交繁殖[12]。河南猕猴引进于新野一家新建的养殖场,其猕猴来源不一,群体的基因流较杂,检测到的遗传多样性相对较高。这与季芳等[13]对海南和广西猕猴的遗传多样性研究的结果相类似,岛屿型猴群(海南)的遗传变异低于大陆型猴群(广西)。福建野生猴群由于自然地域的隔离,基因交流少;而人工养殖,如有严格的饲养繁殖制度和遗传监控,适时引进种猴,随机交配,避免近交繁殖,群体的基因交流范围广,遗传多样性就较丰富。
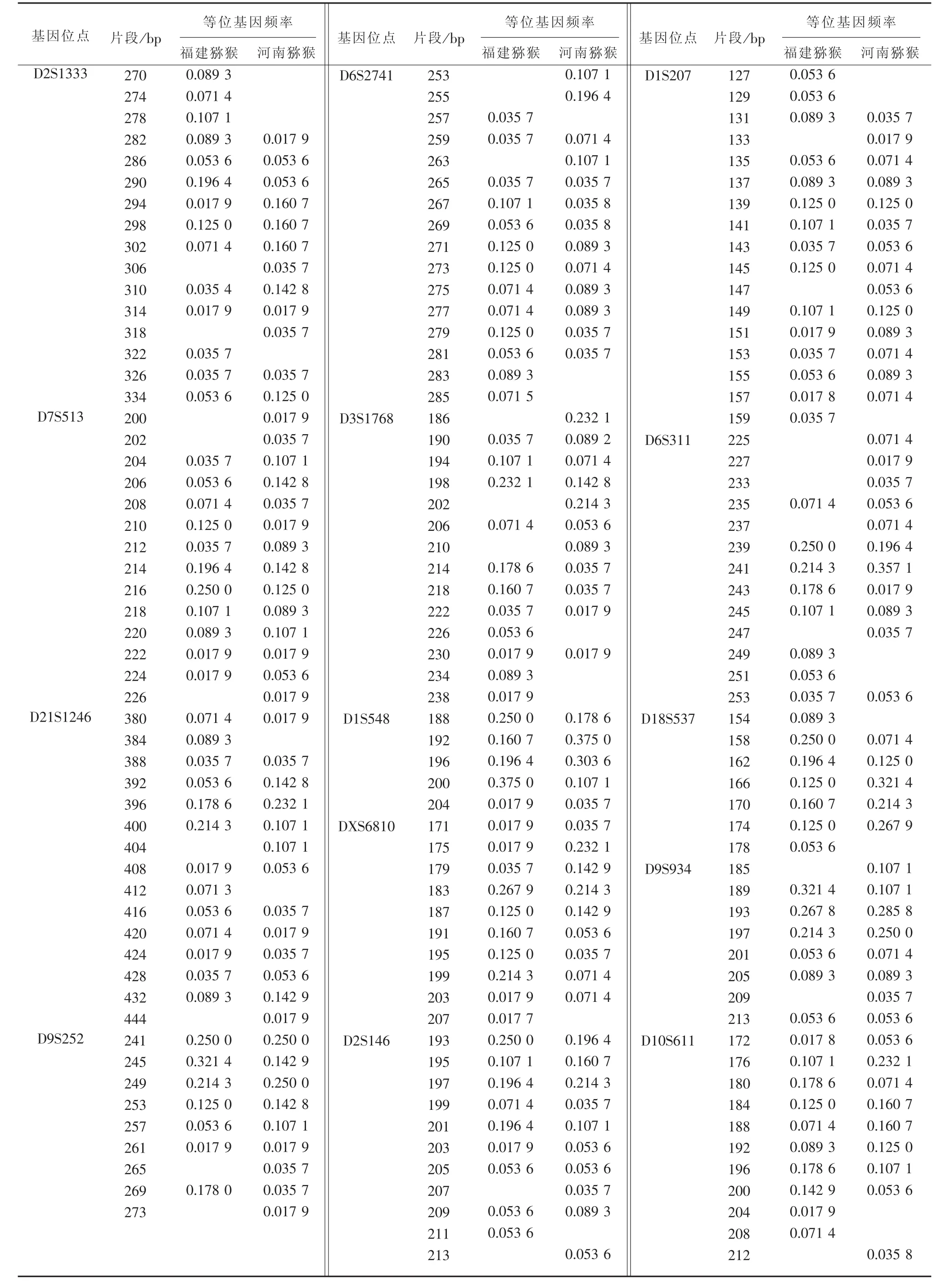
表1 福建猕猴和河南猕猴14个微卫星位点的等位基因频率信息
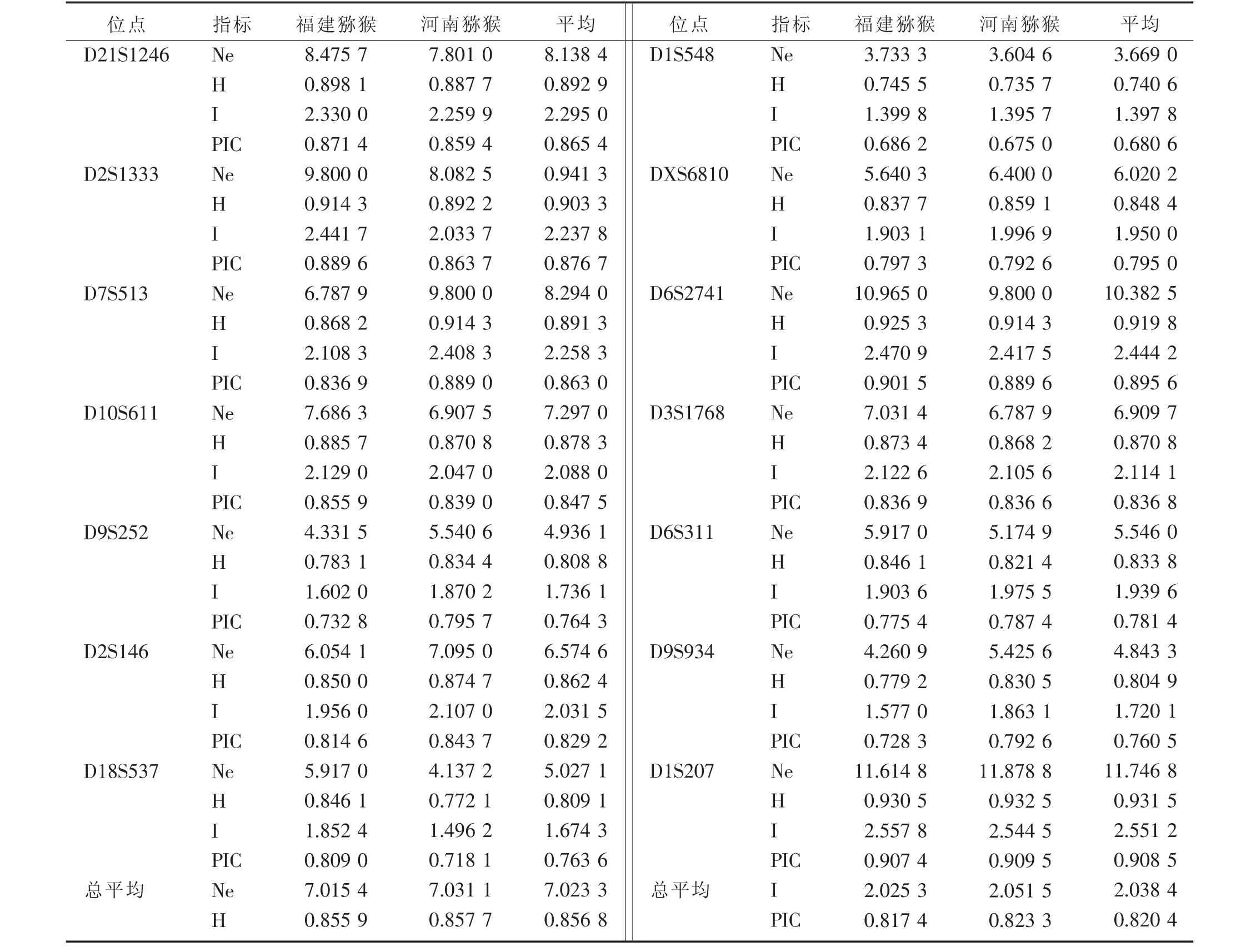
表2 福建猕猴和河南猕猴两群体14个微卫星位点的遗传多态性
本研究利用14个微卫星位点,分析了福建猕猴与河南猕猴两群体的遗传多态性,为今后两种群制定科学的繁殖措施,建立完善的遗传谱系和遗传质量监测方法及保护策略提供理论依据,对保护猕猴这一珍贵的实验动物具有重要的现实意义。
[1] 蒋学龙,王应祥,马世来.中国猕猴的分类及分布[J].动物学研究,1991,12(3):241-247.
[2] 皮道元,谢莉萍,卢晟盛,等.利用微卫星标记分析4个食蟹猴群体的遗传多样性[J]. 中国兽医学报,2011,31(3):444-448.
[3] SODHIM,MUKESH M,MISHRA B P,et al.Microsatellite analysis of genetic population structure of zebu cattle (Bos indicus)breeds from north-western region of India[J].Anim Biotechnol,2011,22(1):16-29.
[4] KORRIDA A,JADALLAH S,CHBEL F,et al.Patterns of genetic diversity and population structure of the threatened Houbara and Macqueen,sbustardsas revealed bymicrosatellitemarkers [J].Genet Mol Res,2012,11(3):3207-3221.
[5] 禹文海,和占龙,鲁绍雄,等.基于微卫星DNA标记的恒河猴遗传多样性研究[J].中国比较医学杂志,2013,23(3):21-25.
[6] HADFIELD R M,PULLEN JG,DAVIESK F,et al.Toward developing a genome-wide microsatellite marker set for linkage analysis in the rhesus macaque (Macaca mulatta):identification of 76 polymorphic markers [J].Am J Primatol,2001,54(4):223-231.
[7] KANTHASWAMY S,SMITH D G.Effects of geographic origin on captive Macaca mulatta mitochondrial DNA variation [J].Comp Med,2004,54(2):193-201.
[8] JEFFREY R,MACKENZIE B,ROY G,et al.A panel of 20 highly variable microsatellite polymorphisms in rhesusmacaques(Macaca mulatta)selected for pedigree or population genetic analysis [J].Am JPrimatol,2005,67(3):377-383.
[9] 黄晓峰.基于微卫星DNA的猕猴川西亚种遗传多样性研究[D].成都:四川农业大学,2008.
[10]李瑞生.用微卫星DNA标记技术建立猕猴遗传检测方法及对群体遗传多态性的分析[D].北京:中国人民解放军军事医学科学院,2009.
[11]徐玉蕊.安徽野生猕猴实验动物化及其种质特异性研究[D].合肥:安微大学,2013.
[12]王中洲.猕猴与科学实验[M].福州:福建科学技术出版社,l994:1-2.
[13]季芳,饶军华,刘晓明.应用微卫星标记对海南和广西恒河猴遗传多样性的研究[J].实验动物科学与管理,2006,23(2):26-30.
R-332
A
1000-338X(2017)05-0030-04
2017-07-03
福建省实验动物研究重点项目(2014Y0080)。
周建华(1969—),男,高级实验师,主要从事实验动物学研究。
王训立(1964—),男,研究员。 E-mail:wxl@fjtcm.edu.cn
