生物炭对土壤微生物C源代谢活性的影响
2017-11-23许晨阳金永亮付子腾闫恒年陈文怡陈思默耿增超
周 凤,许晨阳,金永亮,付子腾,闫恒年,陈文怡,陈思默,耿增超
生物炭对土壤微生物C源代谢活性的影响
周 凤,许晨阳,金永亮,付子腾,闫恒年,陈文怡,陈思默,耿增超*
(西北农林科技大学资源环境学院,农业部西北植物营养与农业环境重点实验室,陕西杨凌 712100)
为了探究外源生物炭输入量对根际、非根际土壤微生物功能多样性的影响,通过田间试验,采用Biolog-ECO检测法,分析了不同量生物炭输入下,根际、非根际土壤微生物C源代谢的平均颜色变化率(AWCD)、丰富度指数、Shannon-Winner指数、均匀度指数、Simpson指数等指标的变化.结果表明:外源生物炭的输入提高了根际土壤微生物的C源代谢活性,当输入量³40t/hm2时,达到显著水平;对非根际土壤微生物的C源代谢活性没有显著影响.同时,对根际、非根际土壤微生物的丰富度指数、Shannon-Wiener指数、均匀度指数均没有显著影响.外源生物炭的输入提高了根际土壤微生物对糖类、氨基酸类、羧酸类C源的利用能力;对非根际土壤微生物利用C源的能力无显著影响;有机碳是影响微生物C源代谢活性的主要因素,40t/hm2生物炭是供试土壤适宜的输入量.
生物炭;根际、非根际土壤;Biolog-ECO检测法;主成分分析;冗余分析
土壤微生物多样性是衡量土壤质量和作物生产力的重要指标[1-2],其对环境的作用主要是由群落代谢功能的差异引起的.根际指围绕于植物根系表面的土壤微域,是植物-土壤-微生物进行物质循环与能量流动的场所,其土壤的理化性质、微生物特性与非根际土壤有较大的差异[3-6].
近年来,生物炭作为土壤改良剂、肥料缓释载体、碳封存剂等备受关注,其施入土壤后能够有效的改善土壤理化性质,它的多孔隙结构为土壤微生物提供了有利的栖息环境,促进了土壤微生物的生长和繁殖[7].Jin[8]对农田不同区域分别施用0,1,12,30t/hm2由木材制成生物炭的试验结果表明,随着生物炭施用量的逐渐增加,土壤微生物组成出现明显差异,尤其是生物炭施用量高的根际土壤变化明显.Jiang等[9]的盆栽试验显示,添加生物炭可以增加可培养微生物的丰度、促进细菌基因结构的转变.而Grossman等[10]对森林土壤及武爱莲等[11]对褐土施用生物炭的研究结果与之差异较大.Nielsen等[12]通过调查26种微生物种群生态学特性的研究也证实,外源生物炭的输入能够改变土壤C循环.外源生物炭的输入对细菌和菌根真菌存在影响,但仅通过生物炭对部分微生物的作用而推断其整体效果是不够的,而且大多数研究都为生物炭的盆栽和短期田间试验,较长的也仅有2~3年,而生物炭在环境介质中的自然衰减过程可长达世纪之久[13],本研究以陕西关中塿土为供试土壤,通过田间试验,采用Biolog-ECO检测法探讨了根际、非根际土壤微生物C源代谢活性对不同量生物炭输入3a后的响应,以期为生物炭改良塿土的研究提供数据支撑和理论依据.
1 材料与方法
1.1 试验区概况
试验于陕西省杨凌示范区西北农林科技大学试验田(34°16′N,108°04′E,海拔458.6m)进行,其基本理化性质见表1.试验区地势平坦,属于暖温带大陆性季风气候,年均气温11~13℃,年降水量500~700mm,年均日照时数2196h,无霜期210d.土壤类型为褐土类,塿土亚类,红油土属,黄土母质,系统分类为土垫旱耕人为土,属石灰性土壤.

表1 供试土壤基本理化性质
1.2 试验材料
供试生物炭(废弃果树树干、枝条在450℃裂解炉中,限氧条件下裂解所得)由陕西亿鑫生物能源科技开发有限公司提供,其基本理化性质见表2.

表2 供试生物炭基本理化性质
1.3 试验设计
本试验采用随机区组设计,根据生物炭(于2012年4月27日田间试验开始前,磨细过1mm筛,一次性撒施于耕层土壤中并与之充分混匀,之后不再施用)的不同添加量,共设置5个处理,分别为B0(0t/hm2)、B20(20t/hm2)、B40(40t/hm2)、B60(60t/hm2)、B80(80t/hm2),每个处理3次重复,共15个小区,小区面积为1.35m×3.50m,各个小区之间均设有0.5m隔离保护带.2012年4月~2015年10月供试土壤共进行了7季作物的种植,分别为玉米-小麦-玉米-小麦-玉米-辣椒,2015年10月15日播种小麦(供试的品种为西农509,西北农林科技大学选育), 播种量为150kg/hm2,行间距为15cm,2016年6月3日收获.
1.4 土壤样品的采集与分析
土壤样品于冬小麦收获期,采用根系抖落法(挖取其完整根系并去除根系周围较大的非根际土壤团块,轻轻抖动附着于根系周围的土壤颗粒,并用镊子轻轻将残落根系拣出.)采集其根际土壤;采用对角线5点法采集0~20cm土层的非根际土壤.随后将新鲜土壤样品混合均匀,放入无菌袋中,于4℃冰箱中保存,测定其微生物功能多样性.
土壤微生物功能多样性采用Biolog-Eco检测法测定,取相当于5.0g风干土壤样品的新鲜土壤样品,加入装有45mL无菌生理盐水(0.85%)的三角瓶中,用无菌封口膜封口后在摇床(转速160r/min)上振荡30min,得到土壤样品的微生物悬浮液.静置片刻后吸取其上清液,在超净工作台上,采用十倍稀释法,用无菌生理盐水(0.85%)稀释浓度至10-3,随后用8通道加样器将稀释1000倍的土壤微生物悬浮液接种于Biolog-ECO微平板(ECO Micro Plate,美国Marix Technologies Corporation)上,每孔150μL.将接种后的Biolog- ECO微平板放入28℃生化培养箱中连续培养240h,(每个土壤样品均做3次重复)每24h用Biolog微生物自动读数装置读取Biolog-ECO微平板在590nm波长下的吸光值.
1.5 数据处理
土壤微生物代谢活性采用反应孔颜色的平均变化率(AWCD)表示,代表可培养微生物对不同底物(C源)的利用能力,计算公式如下:
AWCD= Σ (C-) /31
式中:AWCD为反应孔颜色的平均变化率;C为各反应孔在590nm下的吸光值;为Biolog-ECO 微平板对照孔A1的吸光值;C-<0的反应孔,计算中默认为零,即C-³0.
土壤微生物群落丰富度指数()采用反应孔(吸光值>0.25,则代表该孔的C源被利用,该孔为反应孔)的数目表示.
土壤微生物群落Shannon-Wiener指数(),代表微生物群落物种和个体分布的均匀程度.
= -Σ (P× lnP)
式中:为土壤微生物群落Shannon-Wiener指数;P为第个生物量占总生物量的比率,其中P= (C-) /Σ(C-),表示C源孔与对照孔A1的吸光值之差与整板总差的比值.
土壤微生物群落均匀度指数()采用微生物群落Shannon-Wiener指数与生物量总量对数的比值表示.
=/ln
式中:为土壤微生物群落均匀度指数;为土壤微生物群落Shannon-Wiener指数;为生物量总量,即丰富度指数.
土壤微生物群落Simpson指数(),又称为优势度指数,用于评估某些最常见种的优势度.
= 1-ΣP2
式中:为土壤微生物群落Simpson指数;P为第个生物量占总生物量的比率.
采用培养168h的吸光值进行土壤微生物功能多样性的主成分分析.数据矩阵包括15行、31列,分别代表实验设计中5个处理的15个样地、Biolog-Eco微平板上的31种C源.
采用种植作物前土壤有机碳、颗粒有机碳、易氧化有机碳、水溶性有机碳、微生物量碳这5个指标的数据作为典型变量,也就是环境变量,进行冗余分析(RDA).
试验数据采用Microsoft Excel 2013、SPSS 20.0 (采用Duncan多重比较检验法分析不同处理之间各指标的显著性差异,显著性水平设定为=0.05)、Canoco 5.0整理分析,图形采用Origin 9.0、Canoco 5.0绘制.
2 结果与分析
2.1 根际、非根际土壤微生物C源代谢活性
由图1可知,随着培养时间的延长,根际与非根际土壤微生物的AWCD值逐渐上升,表明其C源代谢活性逐渐增加.24h内各处理的AWCD值无明显变化,24h后快速上升,直至168h后变化趋于平缓,此时,根际土壤B20、B40、B60、B80的AWCD值分别为1.198、1.353、1.382、1.338,与B0的AWCD值1.099相比,分别增大了8.98%、23.14%、25.76%、21.76%, B40、B60、B80与B0的差异达到显著水平;非根际土壤B20、B40、B60、B80的AWCD值分别为0.9164、1.010、1.0195、1.089,与B0的AWCD值1.150相比,分别减小了20.28%、12.07%、11.32%、5.26%,但处理间的差异不显著,表明生物炭输入后,根际土壤微生物的C源代谢活性增加,从而提高了其对不同C源的利用效率,而非根际土壤微生物的C源代谢活性下降.根际土壤与非根际土壤相比,B20、B40、B60、B80的AWCD值分别增加了30.68%、33.87%、35.56%、22.87%,仅B40达到显著水平,B0的AWCD值则减小了4.60%,但差异不显著.随着生物炭输入量的增加,根际与非根际土壤微生物C源代谢活性之间的差异呈先上升后下降的变化趋势.这可能是由于生物炭输入土壤后,作物生长状况的改变会导致根系生长及其分泌物的变化,打破了原有的植物-土壤-微生物相互作用的平衡[14],从而引起根际、非根际土壤微生物之间的差异,Kuzyakov等[15]的研究表明,生物炭在根际可能主要通过共代谢的方式被微生物矿化,而Bais等[16]的研究显示,酸性的根系分泌物还会参与生物炭的非生物矿化过程.
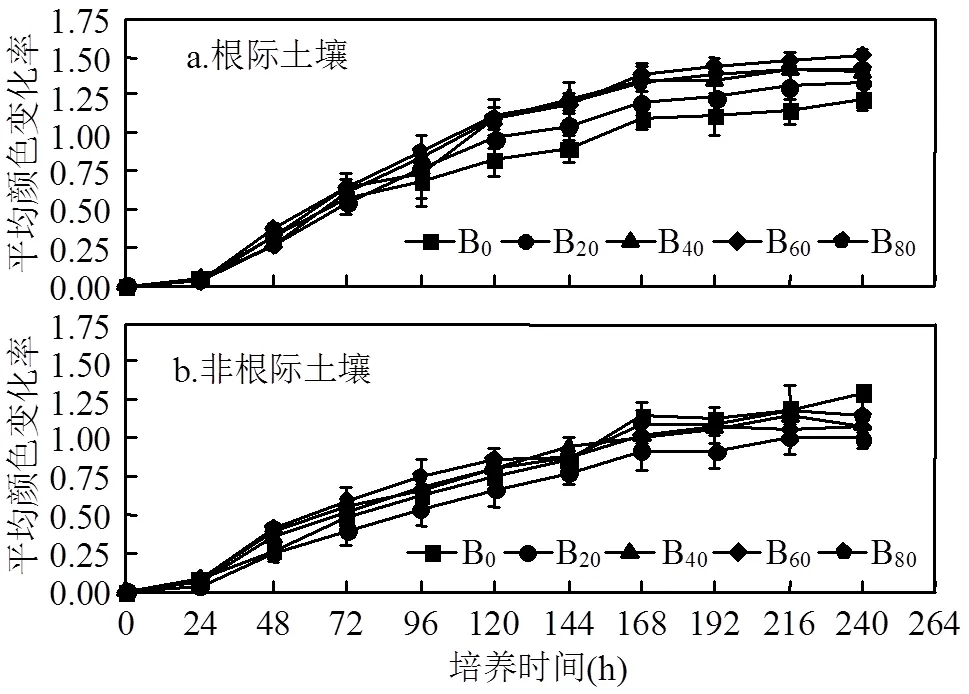
图1 根际、非根际土壤微生物平均颜色变化率 (N=96)
2.2 根际、非根际土壤微生物功能多样性指数
培养168~240h,不同处理根际、非根际土壤微生物AWCD值的升高幅度逐渐趋于平缓,表明土壤微生物生长减慢且步入了稳定期(图1).因此可以确定培养时间168h是所研究土壤微生物生长对数期和稳定期的临界值[17],因此,采用此时的吸光值进行土壤微生物功能多样性指数的计算.
由表3可知,随着生物炭输入量的增加,根际土壤微生物的丰富度指数呈现降低-升高-降低的变化趋势,Shannon-Wiener指数呈先升高后降低的趋势,B40的丰富度指数、Shannon-Wiener指数均为最高,但处理间的差异不显著,这与韩光明等[18]对白浆土、潮土、灰漠土和棕壤土中输入玉米芯生物炭的研究结果有差异,可能是由于生物炭类型、输入时间、土壤质地、所种植作物不同导致的.生物炭的输入对根际土壤微生物的均匀度指数、Simpson指数没有显著影响;但降低了非根际土壤微生物的丰富度指数、Shannon- Wiener指数和Simpson指数,其中处理间的丰富度指数、Shannon-Wiener指数差异不显著,B20的Simpson指数较B0降低了1.26%,达到显著水平,其它处理间差异不显著;同时生物炭的输入增加了其均匀度指数,处理间差异也不显著.这可能是由于土壤微生物功能多样性指数变异性较大, 处理间未达到显著性差异.

表3 不同量生物炭输入下根际、非根际土壤微生物功能多样性指数
注:数值均为平均值±标准差,不同小写字母表示差异显著(<0.05),=3.
根际土壤各处理的微生物丰富度指数、Shannon-Wiener指数、Simpson指数均高于非根际土壤,生物炭的输入则提高了差异的幅度,B40为根际土壤微生物丰富度指数、Shannon-Wiener指数、Simpson指数与非根际土壤差异最大的处理,但差异未达到显著水平.根际土壤B0、B40、B60、B80的微生物均匀度指数分别高于非根际土壤,B60为差异最大的处理,差异未达到显著水平;根际土壤B20的微生物均匀度指数则低于非根际土壤,差异也未达到显著水平.说明土壤微生物功能多样性在根际、非根际土壤间存在一定的差别,生物炭的输入会对差异产生明显的促进作用,同时揭示了生物碳输入后,缺少植物根系生长的非根际土壤可能会导致土壤微生物群落种类降低或活性减弱.这可能是由于缺少作物根系的土壤环境中,生物炭本身的毒性或其吸附周围环境中的有毒物质得不到缓减,只能作用于土壤微生物,从而影响其活性.
2.3 根际、非根际土壤微生物的C源代谢类型
根据Biolog-Eco微平板上C源官能团的不同将其分为6大类:其中糖类10种、氨基酸类6种、羧酸类7种、多聚物类4种、多酚化合物类2种、多胺类2种[19],通过对6大类C源吸光值的计算,可以明确土壤微生物对不同C源的利用率.采用培养168h的吸光值进行土壤微生物C源代谢类型分析.由表2可知,B0的吸光值均以氨基酸类C源的最高,根际土壤中,微生物对6大类C源的利用程度由大到小依次为氨基酸类>糖类>多聚物类>羧酸类>多胺类>多酚化合物类;非根际土壤微生物对6大类C源的利用程度则为氨基酸类>糖类>多胺类>羧酸类>多聚物类>多酚化合物类,表明氨基酸类、糖类是塿土中微生物比较偏好、利用率较高的C源.
外源生物炭的输入增加了根际土壤微生物对糖类、氨基酸类、羧酸类C源的利用能力,随着生物炭输入量的增加,根际土壤微生物对糖类C源的利用能力呈现先上升后下降的变化趋势,B40、B60的土壤微生物对糖类C源的利用能力与B0相比均达到显著水平,B60的土壤微生物对其利用能力最强;根际土壤微生物对氨基酸类C源的利用能力呈现逐渐上升的趋势,当生物炭输入量³40t/hm2时,与B0相比差异显著,B80的土壤微生物对其利用能力最强;根际土壤微生物对羧酸类C源的利用能力呈现上升-下降-上升的趋势,当生物炭输入量³40t/hm2时,与B0相比差异显著,B40的土壤微生物对其利用能力最强.外源生物炭输入的根际土壤中,微生物对多聚物类、多酚化合物类、多胺类C源的利用能力与对照相比没有显著差异.说明外源生物炭的输入改变了根际土壤微生物对六大类C源的利用情况,在一定程度上改变了根际土壤微生物群落结构,提高了微生物群落对糖类、氨基酸类、羧酸类C源的利用能力,增加了利用这2种C源的微生物数量、种类或活性.

表4 不同量生物炭输入下根际、非根际土壤微生物的C源类型分析
注:数值均为平均值±标准差,不同小写字母表示差异显著(<0.05),=3.
当生物炭输入量为20t/hm2时,非根际土壤微生物对6大类C源的利用能力均有所降低,随着生物炭输入量的继续增加,非根际土壤微生物对糖类、氨基酸类、羧酸类、多聚物类、多酚化合类C源的利用能力逐渐提高.当生物炭输入量增加为80t/hm2时,仅有羧酸类、多聚物类C源的利用能力高于对照,但处理间的差异均不显著.这可能是因为生物炭除了直接提供微生物生长场所以外,还引起了土壤理化性质的改变、养分含量及有效性增减[20-22],这些改变均会诱发不同微生物做出不同的生长代谢反馈,从而导致所利用C源类型的改变.
2.4 根际、非根际土壤微生物功能多样性主成分分析
对根际土壤微生物的C源代谢情况进行主成分分析,提取主成分相对应特征值大于1的前9个主成分,累积贡献率为90.052%.其中第1主成分(PC1)的特征根和贡献率分别为7.100和22.903%,第2主成分(PC2)的特征根和贡献率分别为4.608和14.865%,第3~9主成分的特征根和贡献率较小,分别为1.162~3.796和3.749%~ 12.245%,其中对PC1贡献较大的C源有10种,分别为氨基酸类4种(L-苯丙氨酸、甘氨酰-L-谷氨酸、L-天门冬酰胺、L-苏氨酸)、糖类2种(β-甲基-D-葡萄糖苷、D-木糖/戊醛糖)、羧酸类2种(衣康酸、D-葡糖胺酸)、多聚物类1种(吐温80)、多胺类1种(腐胺),对PC2贡献较大的C源有6种,分别为糖类3种(D-纤维二糖、α-D-乳糖、i-赤藓糖醇)、羧酸类2种(α-丁酮酸、D-苹果酸)、多酚化合物类1种(2-羟基苯甲酸)主要C源的利用类型为氨基酸类、糖类、羧酸类(表5);对非根际土壤微生物的C源代谢情况进行主成分分析,提取主成分相对应特征值大于1的前9个主成分,累积贡献率为90.939%.其中第1主成分(PC1)的特征根和贡献率分别为8.222和26.522%,第2主成分(PC2)的特征根和贡献率分别为4.030和13.002%,第3~9主成分的特征根和贡献率较小,分别为1.040~3.643和3.356%~ 11.751%,其中对PC1贡献较大的C源有7种,分别为糖类3种(D-木糖/戊醛糖、D-纤维二糖、α-D-乳糖)、氨基酸类2种(L-苏氨酸、甘氨酰-L-谷氨酸)、羧酸类2种(D-半乳糖醛酸、D-苹果酸),对PC2贡献较大的C源有4种,分别为糖类1种(i-赤藓糖醇)、氨基酸类1种(L-天门冬酰胺)、羧酸类1种(α-丁酮酸)、多胺类1种(腐胺)主要C源的利用类型为糖类、氨基酸类、羧酸类(表5).说明区分不同处理下,根际、非根际土壤微生物群落代谢差异的主要原因是对于糖类、氨基酸类、羧酸类利用的不同,土壤微生物的C源代谢类型分析中也表明糖类、氨基酸类是土壤微生物偏好、利用率较高的C源,土壤微生物对这两大类C源中的具体某一种或某几种C源的代谢差异也可能是导致根际、非根际土壤微生物C源代谢活性之间差异的原因.

表5 与PC1和PC2 相关性高的主要碳源
由图2可知,PC1、PC2轴将不同处理分为3类,根际土壤中,B60、B80分布在第1象限,B20、B40分布在第2象限, B0分布在第3象限;非根际土壤中,B0分布在第1象限,B20、B40分布在第2象限, B60、B80分布在第4象限;说明B20和B40、B60和B80土壤微生物C源代谢模式或功能具有相似性,这也揭示了生物炭的输入量对土壤微生物群落多样性具有不同的生态效应,在实际应用中要综合考虑土壤改良、环境修复与微生物群落结构组成及其主导的生物地球化学过程来确定生物炭的输入量.综合本课题组试验前期对土壤理化性质、植物生长状况、温室气体排放等[23-24]的研究和现有的结果表明, 40t/hm2生物炭是供试土壤-陕西关中塿土适宜的输入量.

图2 根际、非根际土壤微生物功能多样性主成分分析
2.5 根际、非根际土壤微生物功能多样性冗余分析
外源生物炭的输入改变了土壤中原有的有机碳组分[25],选取5个与有机碳组分相关的指标作为环境变量(本季作物种植前测定其化学性质,表6)来评价其与土壤微生物功能多样性的关系.
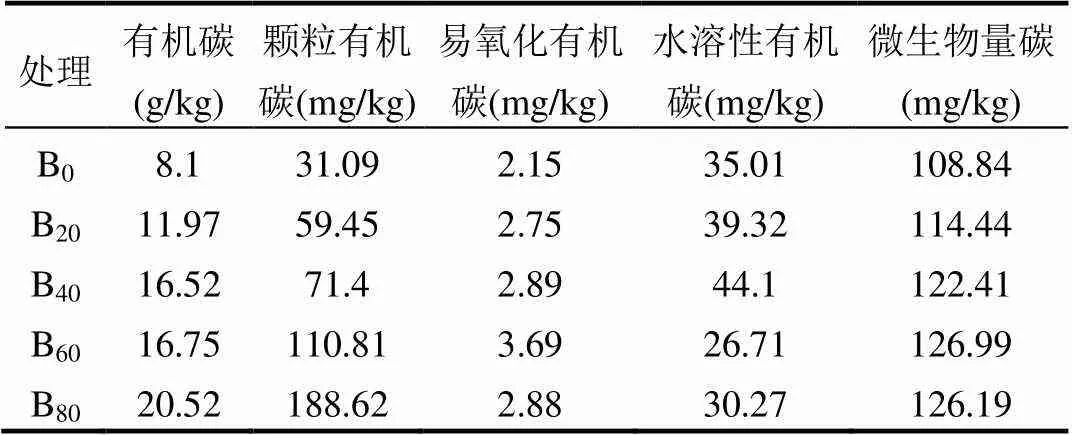
表6 环境变量的化学性质

虚线代表31种C源(用A1~4~H1~4表示);实线代表环境因子(用正体汉字表示);B0~80代表不同处理;向量越长,表明因子越重要,各向量之间的夹角余弦值代表各向量之间的相关系数,夹角越小,表明相关性越强;二者方向相同表明具有正相关关系,方向相反则具有负相关关系,垂直表示不相关
由图3可知,有机碳与易氧化有机碳、颗粒有机碳、微生物量碳之间均呈正相关关系,与水溶性有机碳呈负相关关系,原因可能是:①生物炭表面含有的功能基团可以通过专性吸附作用有效吸附土壤水溶性有机碳,为土壤微生物提供了丰富的食物来源,这也是生物炭的多孔结构能成为微生物良好栖息地的重要原因;②生物炭中含有大量的钙离子[26],能够络合水溶性有机碳[27],导致土壤中水溶性有机碳降低,从而使水溶性有机碳与易氧化有机碳、颗粒有机碳、微生物量碳所呈现的结果不同,本课题组的前期研究[25]结果表明,在生物炭输入土壤后前三季作物种植期内,生物炭显著降低了土壤水溶性有机碳,而在第四季作物收获后,生物炭对土壤水溶性有机碳的影响已不显著,这说明生物炭对土壤水溶性有机碳的影响会随时间的推移逐渐减弱.
根际土壤微生物功能多样性RDA分析显示,Axis1与Axis2的累积解释率达到54.69%,特征根分别为0.3828和0.1641,相关系数分别为0.9788 和0.7829,其中Axis1与水溶性有机碳呈正相关,与有机碳、易氧化有机碳、颗粒有机碳、微生物量碳均呈负相关; Axis2与有机碳、颗粒有机碳呈正相关,与易氧化有机碳、微生物量碳、水溶性有机碳呈负相关,且有机碳对根际土壤微生物C源代谢水平具有极显著影响,水溶性有机碳则对其具有显著影响.非根际土壤微生物功能多样性RDA分析显示,Axis1与Axis2的累积解释率达到41.84%,特征根分别为0.2628和0.1557,相关系数分别为0.9556和0.8367,其中Axis1与有机碳、易氧化有机碳、颗粒有机碳、微生物量碳呈正相关,与水溶性有机碳呈负相关; Axis2与有机碳、水溶性有机碳、易氧化有机碳、颗粒有机碳、微生物量碳均呈正相关.且有机碳对非根际土壤微生物C源代谢水平具有显著影响.说明土壤微生物C源代谢受环境变量的综合影响较大,其中有机碳是主要的环境变量.
2.6 讨论
本试验中,根际、非根际土壤微生物的C源代谢活性(AWCD)、丰富度指数、Shannon- Wiener指数、Simpson指数和均匀度指数、C源代谢类型均存在一定的差异,导致这种差异的原因主要有以下两点:①作物通过根系作用释放的糖类、氨基酸、多聚物等小分子有机物及其它有益分泌物,为土壤微生物提供了生长基质和有利的生长环境[28];②根系诱导根际土壤养分产生变化[29-31],大量试验表明,“根际效应”对土壤微生物群落、生态系统养分动态的分布与循环等具有重要影响[32-34],采用4种微生物功能多样性指数分析不同量生物炭输入下根际、非根际土壤差异的结果显示,除B20的均匀度指数低于非根际土壤外,根际土壤各处理的微生物丰富度指数、Shannon-Wiener指数、Simpson指数均高于非根际土壤,说明根际比非根际土壤微生物群落结构更为稳定[35].这与李春格等[36]的大豆连作试验与滕应等[37]的盆栽试验结果相近.外源生物炭的输入会促进根际、非根际土壤微生物的差异是因为:①生物炭能够影响微生物参与的与土壤有机碳库周转相关的生物地球化学循环过程,其对根际、非根际土壤环境条件的改变间接影响了土壤微生物的数量及种类[38-39],本文RDA分析中各处理环境变量化学性质的不同也证实了生物炭对微生物参与的与土壤有机碳库周转相关的生物地球化学循环过程的影响;②输入生物炭后,植物生长状况的改变导致根系分泌物和脱落物的变化,而影响到植物-土壤-微生物三者之间的相互作用[40],这在本课题组对生物炭输入量与植物生长状况相关关系的研究中得到了证实.③施加生物炭有助于丛枝菌根真菌及外生菌根真菌的定殖和孢子形成[41].Solaiman等[42]研究发现,每年输入0.6~6t 桉木生物炭的土壤两年后,小麦根部丛生菌根(AM)提高了20%~40%,而未添加生物炭土壤中的AM仅提高了5%~20%,生物炭对小麦丛生菌根的促进作用也可能是导致根际、非根际土壤微生物C源代谢活性差异的原因.根际与非根际土壤微生物功能多样性主成分分析结果显示,糖类、氨基酸类、羧酸类是控制C源代谢利用发生分异的主要C源,根际、非根际土壤微生物的C源代谢类型分析也得出相同的结果,但不同处理下,根际、非根际土壤微生物对上述三种C源中具体的代谢种类具有较大差异,这可能是由于非根际-根际的过程中,作物与微生物之间通过这些凋落物和根系分泌物建立起了新的平衡,导致微生物与植物协同进化,促进了根际土壤微生物多样性[43-44].生物炭的不同输入量将土壤微生物的C源代谢模式或功能分为3类,这可能是由于土壤微生物群落酶链反应速度和最终能达到的程度与群落内能利用单一C源微生物的数目和种类相关[45],相近的C/N也许是促成分类的主要原因,C/N通过限制土壤微生物的活性和其代谢的速率来影响其C源代谢模式或功能.根际、非根际土壤微生物功能多样性冗余分析结果表明,有机碳是影响土壤微生物C源代谢活性的主要环境变量,这与裴振等[46]研究盐生植被演替对土壤微生物C源代谢活性影响的试验结果相似.对水溶性有机碳而言,其对根际土壤C源代谢水平的显著性影响也说明了根际、非根际土壤微生物对土壤有机碳易变组分的利用形式也存在差异.鉴于Biolog-ECO检测法仅能检测可培养的微生物,不能全面反映土壤微生物的多样性,其内在的作用机制还需进一步研究.
3 结论
3.1 外源生物炭的输入提高了根际土壤微生物的C源代谢活性,当输入量³40t/hm2时,达到显著水平;对非根际土壤微生物C源代谢活性没有显著影响.外源生物炭的输入促进了根际、非根际土壤微生物C源代谢活性之间的差异.
3.2 外源生物炭的输入对根际、非根际土壤微生物的丰富度指数、Shannon-Wiener指数、均匀度指数没有显著影响,但增大了根际、非根际土壤微生物丰富度指数、Shannon-Wiener指数、Simpson指数之间的差异.
3.3 氨基酸类、糖类是塿土中微生物比较偏好、利用率较高的C源;外源生物炭的输入提高了根际土壤微生物对糖类、氨基酸类、羧酸类C源的利用能力;对非根际土壤微生物利用C源的能力无显著影响.
3.4 外源生物炭输入后,土壤有机碳是影响微生物C源代谢活性的主要因素.
[1] 徐秋芳,姜培坤,王奇赞,等.绿肥对集约经营毛竹林土壤微生物特性的影响[J]. 北京林业大学学报, 2009,31(6):43-48.
[2] Dey R, Pal K K, Tilak K V B R. Influence of soil land plant types on diversity of rhizobacteria [J]. Proceeding of the National Academy of Sciences India Section B: Biological Science, 2012,82(3):341-352.
[3] Singh B K, Munro S, Potts J M, et al.Influence of grass species and soil type on rhizosphere microbial community structure in grassland soils. Applied Soil Ecology, 2007,36(2):147-155.
[4] 胡 静,侯向阳,王 珍,等.割草和放牧对大针茅根际与非根际土壤养分和微生物数量的影响[J]. 应用生态学报, 2015, 26(11):3482-3488.
[5] 陆雅海,张福锁.根际微生物研究进展[J]. 土壤, 2006,38(2): 113-121.
[6] 曲同宝,王呈玉,庞思娜,等.松嫩草地4种植物功能群土壤微生物碳源利用的差异[J]. 生态学报, 2015,(17):5695-5702.
[7] 何绪生,耿增超,佘 雕,等.生物炭生产与农用的意义及国内外动态[J].农业工程学报, 2011,27(2):1-7.
[8] Jin H. Characterization of microbial life colonizing biochar and biochar-amended soils [D]. Ithaca, NY: Cornell University, 2010.
[9] Jiang L L, Han G M, Lan Y, et al. Corn cob biochar increases soil culturable bacterial abundance without enhancing their capacities in utilizing carbon sources in Biolog Eco-plates [J]. Journal of Integrative Agriculture, 2017,16(3):713-724.
[10] Grossman J M, O'Neill B E, Tsai S M, et al. Amazonian anthrosols support similar microbial communities that differ distinctly from those extant in adjacent, unmodified soils of the same mineralogy [J]. Microbial Ecology, 2010,60(1):192-205.
[11] 武爱莲,丁玉川,焦晓燕,等.玉米秸秆生物炭对褐土微生物功能多样性及细菌群落的影响[J]. 中国生态农业学报, 2016, 24(6):736-743.
[12] Nielsen U N, Ayres E, Wall D H, et al. Soil biodiversity and carbon cycling: a review and synthesis of studies examining diversity-function relationships [J]. European Journal of Soil Science, 2011,62(1):105-116.
[13] Hammes K, Schmidt M W. Changes of biochar in soil/Biochar for Environmental Management: Science and Technology [M]. London: Eorthscan, 2009:169-181.
[14] Ameloot N, Graber E R, Verheijen F G A, et al. Interactions between biochar stability and soil organisms: review and research needs [J]. European Journal of Soil Science, 2013,64:379-390.
[15] Kuzyakov Y, Subbotina I, Chen H Q, et al. Black carbon decomposition and incorporation into soil microbial biomass estimated by C-14labeling [J]. Soil Biology and Biochemistry, 2009,41:210-219.
[16] Bais H P, Weir T L, Perry L G, et al. The role of root exudates in rhizosphere interations with plants and other organisms [J]. Annual Review of Plant Biology, 2006,57:233-266.
[17] 贾 夏,董岁明,周春娟.微生物生态研究中Biolog Eco微平板培养时间对分析结果的影响[J]. 应用基础与工程科学学报, 2013,21(1):10-19.
[18] 韩光明.生物炭对不同类型土壤理化性质和微生物多样性的影响[D]. 沈阳:沈阳农业大学, 2013.
[19] 时 鹏,高 强,王淑平,等.玉米连作及其施肥对土壤微生物群落功能多样性的影响 [J]. 生态学报, 2010,30(22):6173-6182.
[20] Glaser B, Lehmann J, Zech W. Ameliorating physical and chemical properties of highly weathered soils in the tropics with charcoal-a review [J]. Biology and Fertility of soils, 2002,35(4): 219-230.
[21] Xu G, Wei L L, Sun J N, et al. What is more important for enhancing nutrient bioavailability with biochar application into a sandy soil: direct or indirect mechanism [J]. Ecological Engineering, 2013,52(2):119-124.
[22] Pietikainen J, Kiillila O, Fritze H. Charcoal as a habitat for microbes and its effect on the microbial community of the underlying humus [J]. Oikos, 2000,89(2):231-242.
[23] 尚 杰,耿增超,赵 军,等.生物炭对塿土水热特性及团聚体稳定性的影响[J]. 应用生态学报, 2015,26(7):1969-1976.
[24] 王月玲,耿增超,王 强,等.生物炭对塿土土壤温室气体及土壤理化性质的影响[J]. 环境科学, 2016,37(9):400-407.
[25] 王月玲,耿增超,尚 杰,等.施用生物炭后塿土土壤有机碳、氮及碳库管理指数的变化[J]. 农业环境科学学报, 2016,35(3):532- 539.
[26] Cao Xinde, Harris W. Properties of dairy-manure-derived biochar pertinent to its potential use in remediation [J]. Bioresource Technology, 2010,101(14):5222-5228.
[27] Römkensp F, Bril J, Salomons W. Interaction between Ca2+and dissolved organic carbon: implications for metal mobilization [J]. Applied Geochemistry, 1996,11(1/2):109-115.
[28] 安韶山,李国辉,陈利顶.宁南山区典型植物根际与非根际土壤微生物功能多样性[J].生态学报, 2011,31(18):5225-5234.
[29] Ma B, Zhou Z Y, Zhang C P, et al. The character of phosphorus concentrations in rhizosphere soil of super-xerophytic shrubs [J]. Acta Prataculturae Sinica, 2005,14(3):106-110.
[30] Barth R C, Klemmedson J O. Shrub-induced spatial patterns of dry matter, nitrogen, and organic carbon [J]. Soil Science Society of America Journal, 1978,42(5):804-809.
[31] Curl E A, Truelove B. The Rhizosphere [M]. Berlin-Heidelberg: Springer-Verlag, 1986.
[32] 张广帅,林勇明,马瑞丰,等.汶川地震灾区不同气候区土壤微生物群落碳源代谢多样性 [J]. 环境科学, 2015,36(2):669-6778.
[33] Zhang Z, Zhang X, Hao J, et al. Tillage and rotation effects on community composition and metabolic footprints of soil nematodes in a black soil [J]. European Journal of Soil Biology, 2015,66:40-48.
[34] Lammel D R, Nüsslein K, Tsai S M, et al. Land use, soil and litter chemistry drive bacterial community structures in samples of the rainforest and Cerrado (Brazilian Savannah) biomes in Southern Amazonia [J]. European Journal of Soil Biology, 2015,66:32-39.
[35] 丁秋祎,白军红,高海峰,等.黄河三角洲湿地不同植被群落下土壤养分含量特征 [J]. 农业环境科学学报, 2009,28(10):2092- 2097.
[36] 李春格,李晓鸣,王敬国.大豆连作对土体和根际微生物群落功能的影响[J]. 生态学报, 2006,26(4):1144-1150.
[37] 滕 应,黄昌勇,龙 健,等.复垦红壤中牧草根际微生物群落功能多样性[J]. 中国环境科学, 2003,23(3):295-299.
[38] 李 明,胡 云,黄修梅,等.生物炭对设施黄瓜根际土壤养分和菌群的影响[J]. 农业机械学报, 2016,47(11):172-178.
[39] 顾美英,刘洪亮,李志强,等.新疆连作棉田施用生物炭对土壤养分及微生物群落多样性的影响[J]. 中国农业科学, 2014, 47(20):4128-4138.
[40] Ameloot N, Graber E R, Verheijen F G A, et al. Interactions between biochar stability and soil organisms: review and research needs [J]. European Journal of Soil Science, 2013,64(4):379-390.
[41] Warnock D D, Lehmann J, Kuyper T W, et al. Mycorrhizal responses to biochar in soil-concepts and mechanisms [J]. Plant Soil, 2007,300(1/2):9-20.
[42] Solaiman Z M, Blackwell P, Abbott L K, et al. Direct and residual effect of biochar application on mycorrhizal root colonisation, growth and nutrition of wheat [J]. Australian Journal of Soil Research, 2010,48(7):546-554.
[43] 赵晓琛,刘红梅,皇甫超河,等.贝加尔针茅草原土壤微生物功能多样性对养分添加的响应[J]. 农业环境科学学报, 2014,(10): 1933-1939.
[44] Chen X, Li Z, Liu M, Jiang C, et al. Microbial community and functional diversity associated with different aggregate fractions of a paddy soil fertilized with organic manure and/or N P K fertilizer for 20years [J]. Journal of Soils and Sediments, 2015,15(2):292-301.
[45] Garland J L. Analysis and interpretation of community-level physiological profiles in microbial ecology [J]. FEMS Microbiology Ecology, 1997,24(4):289-300.
[46] 裴 振,孔 强,郭笃发.盐生植被演替对土壤微生物碳源代谢活性的影响[J].中国环境科学, 2017,37(1):373-380.
Effect of biochar on metabolic activity of soil microbial carbon.
ZHOU Feng, XU Chen-yang, JIN Yong-liang,FU Zi-teng, YAN Heng-nian, CHEN Wen-yi, CHEN Si-mo, GENG Zeng-chao*
(Key Laboratory of Plant Nutrition and Agri-environment in Northwest China, Ministry of Agriculture, College of Natural Resources and Environment, Northwest A&F University, Yangling 712100, China)., 2017,37(11):4202~4211
Field experiment was conducted to investigate the effect of biochar application on the functional diversity of microbial community in rhizosphere and bulk soils. The average well color development (AWCD) during microbial carbon metabolism, Richness index, Shannon-Wiener index, Evenness index, Simpson index of microorganisms in rhizosphere and bulk soils were analyzed by the biolog-ECO method under application of different amounts of biochar. Results showed that the metabolic activity of microbial carbon in rhizosphere soil was increased due to biochar application. When the biochar addition was equal or above 40t/hm2, the metabolic activity of microbial carbon was increased significantly. Biochar application had no significant effect on the metabolic activity of microbial carbon in bulk soil. Meanwhile, the Richness index, Shannon-Wiener index, Evenness index of microbial communities in both rhizosphere and bulk soils were not significantly affected. Biochar application enhanced the ability of soil organisms in rhizosphere to utilize carbohydrates, amino acids and carboxylic acids as carbon sources, while it did not significantly influence the carbon utilization ability of soil organisms in bulk soil. Organic carbon was the main factor that controlled the metabolic activity of microbial carbon.Biochar addition of 40t/hm2was the most suitable application amount.
biochar;rhizosphere and bulk soils;biolog-ECO method;principal component analysis;redundancy analysis
X53
A
1000-6923(2017)11-4202-10
周 凤(1992-),女,内蒙古自治区乌兰察布市人,西北农林科技大学土壤学专业硕士研究生,主要研究方向为土壤微生物.发表论文1篇.
2017-05-04
杨凌示范区科技计划项目(2015SF-03);西北农林科技大学“大学生创新性实验计划”项目(2201610712021)
* 责任作者, 教授, gengzengchao@126.com
