利用半肝切除再生模型研究单个肝细胞核内耐药鸭乙型肝炎病毒DNA的动态变化
2017-11-22沈国俊江小云曾小冬毛龙火付喜花
沈国俊, 江小云, 黄 洁, 曾小冬, 毛龙火, 付喜花
(1 九江市第三人民医院 肝病中心, 江西 九江 332000; 2 番禺区中心医院 感染科, 广州 511400)
利用半肝切除再生模型研究单个肝细胞核内耐药鸭乙型肝炎病毒DNA的动态变化
沈国俊1, 江小云1, 黄 洁1, 曾小冬1, 毛龙火1, 付喜花2
(1 九江市第三人民医院 肝病中心, 江西 九江 332000; 2 番禺区中心医院 感染科, 广州 511400)
目的利用半肝切除再生模型研究单个肝细胞核内耐药鸭乙型肝炎病毒(DHBV)DNA的动态变化规律。方法45日龄慢性DHBV感染鸭半肝切除后接种突变株转染上清,持续饲喂拉米夫定,定期采血及取肝组织标本,检测外周血病毒DNA水平及病毒株,流式细胞仪分选单个肝细胞核及增殖细胞核抗原(PCNA)阳性与阴性细胞核,巢式PCR扩增核内DHBV YMDD区,直接测序法检测是否存在突变。计数资料组间比较采用χ2检验和Fisher精确概率法。半肝切除前后PCNA的比较使用方差分析Welch法。结果半肝切除前单个核内病毒DNA及血清中克隆均为野生株;接种突变株转染上清后,在半肝切除术后1周时突变株感染的肝细胞核比率高于术后12周时的水平 (χ2=7.225,P<0.01);术前PCNA阳性肝细胞核比率为(0.84±0.36)%,术后1周时显著升至(42.26±6.48)%,术后12周时为(11.83±3.97)%,各时间点比较差异有统计学意义(F=190.832,P<0.001);术后1周时突变株感染的PCNA阳性细胞核比率高于术后12周时的水平,两组比较差异有统计学意义(χ2=7.063,P<0.01), 而术后PCNA阴性的细胞核突变株感染的比率极低。结论半肝切除可为耐药病毒提供复制空间,但耐药病毒在外周血及肝内未能形成优势毒株。
肝炎病毒, 乙型, 鸭; 抗药性, 病毒; 半肝切除; 肝再生
由于慢性鸭乙型肝炎病毒(DHBV)感染时肝内传播空间(DHBV未感染的肝细胞数量)的限制,耐药 DHBV 感染的肝细胞数量极低以致核内耐药的病毒DNA检测不到[1];但半肝切除后肝细胞快速再生可给耐药病毒提供传播空间[2]。本研究拟用鸭乙型肝炎慢性感染动物模型,先给予拉米夫定抑制体内的野生株病毒复制,并行半肝切除术观察肝细胞是否再生活跃;术后接种DHBV耐药株,检测血清与单个肝细胞核内病毒株的变化,了解游离耐药突变株能否感染新生肝细胞,能否在肝内快速传播成为优势株。
1 材料与方法
1.1 实验动物、主要试剂与仪器 45日龄慢性DHBV感染鸭(广州市白云区龙归镇孵化场)[3],血清DNA提取试剂盒(德国QIAGEN),固定破膜剂(美国invitrogen公司),鼠抗人PCNA单克隆抗体(美国eBioscience公司),流式PCNA二抗(羊抗鼠IgG,美国BD公司),PE标记(美国invitrogen公司)。罗氏Lightcycler®480实时荧光定量PCR仪,美国BECTON DICKINSON公司FACSAriaTM流式细胞分选系统。
1.2 实验动物分组、半肝切除术和病毒接种 将8只45日龄慢性DHBV感染鸭分为2组:治疗组5只,每只动物持续饲喂拉米夫定(20 mg·kg-1·d-1),每周采血1次;当血清DHBV DNA连续2次低于real-time PCR检测下限(3 log10拷贝/ml)时,行肝右叶半肝切除术;在维持抗病毒治疗下,分别于肝切后48 h和72 h静脉接种DHBV突变株转染上清各1 ml[4](real-time PCR定量DHBV DNA为8.16×107拷贝);术后继续给药12周,术后1周肝活组织检查及采血,术后4周及8周采血,术后12周采血处死所有动物,取出肝组织。未治疗组3只,行半肝切除并接种突变株转染上清,标本采集流程同治疗组。
1.3 血清DHBV DNA定量及病毒株的检测 血清DHBV DNA的提取详见试剂盒说明书,荧光定量 PCR的检测具体方法详见参考文献[3]。巢式PCR扩增血清DHBV DNA YMDD区段,引物由上海英骏生物公司合成(表1);巢式PCR扩增第1轮反应体系为20 μl (ddH2O 4.5 μl, 2×Buffer 10 μl, dNTPs 2 μl, PS1 0.2 μl, PS2 0.2 μl, KOD酶0.3 μl, 模板3 μl),反应条件:94 ℃预变性5 min,30 s后进入循环,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸40 s,35个循环后72 ℃再延伸5 min。巢式PCR扩增第2轮反应体系为50 μl (ddH2O 37 μl, 10×Buffer 5 μl, dNTPs 4 μl, DMF2 0.5 μl, DMR2 0.5 μl, Blend-taq 0.5 μl, 模板3 μl),反应条件:94 ℃预变性7 min, 30 s后进入循环,94 ℃变性30 s,54 ℃退火30 s,72 ℃延伸30 s,38个循环后72 ℃再延伸5 min。PCR产物经1%的琼脂糖电泳后凝胶回收;将扩增回收目的片段连接T载体,进行TA克隆的构建;再进行转化、铺板,挑取并PCR筛选阳性克隆;1%的琼脂糖凝胶电泳鉴定PCR产物阳性菌液送华大基因公司测序。

表1 DHBV DNA YMDD区段巢式PCR引物序列
1.4 肝细胞核的分离 称取10 mg冻存肝组织置入高压灭菌后的2 ml柱形玻璃研磨器中,加入1 ml匀浆液[终浓度为:10 mmol Tris HCl (pH 7.5), 3 mmol MgCl2, 0.25 mol Sucrose, 0.05%Triton X-100]。通过匀浆研磨处理,直至组织完全溶解 (研磨约10~15次),将研磨后的组织匀浆液转移至1.5 ml离心管中;低速离心收集细胞核 (2000 r/min,5 min),弃上清;加入1 ml匀浆液重悬细胞核沉淀团低速离心 (2000 r/min,5 min),弃上清;再次加入1 ml匀浆液重悬细胞核沉淀团低速离心 (2000 r/min,5 min)[5]。
1.5 肝细胞核PCNA的标记及流式分选 每份肝细胞核悬液准备2个5 ml流式管,分别加入PBS稀释100 ml(细胞核数约1×106),1管为同型对照、1管为PCNA标记。每个流式管中加入100 μl破膜A液,避光15 min后加入2 ml PBS洗涤2次,再加入100 μl破膜B液,另标记管中加入2 ml鼠抗人PCNA一抗,避光20 min;每管再加入2 ml PBS洗涤2次,然后加入100 μl PBS,其中标记管加入PE标记兔抗鼠IgG二抗5 μl,同型对照管加入6 μl PE标记的同型抗体,避光20 min;所有管均加入2 ml PBS洗涤后再加入300 μl PBS均匀混合。通过设定对应的PE荧光标志,先载入同型对照管,再放入标记检测管,调整阈值,在PE散点图中,对PCNA阳性及阴性肝细胞核2个亚群细胞依次设门,应用全自动细胞分选系统设置分选参数,分选无标记、PCNA标记阳性及PCNA标记阴性3类单个肝细胞核至每孔加有12 μl消化液[终浓度为:10 mmol Tris HCl (pH 7.5),0.1%Triton X-100,200 μg/ml蛋白酶K]的96孔板中。显微镜下确认每个孔内仅有1个细胞核[5]。
1.6 单个肝细胞核内DHBV DNA的YMDD区扩增和测序 分选后的96孔板于50 ℃温浴60 min,使蛋白酶K充分消化核膜,DNA从单个细胞核内释放出来,再经75 ℃、15 min灭活蛋白酶K;每孔再加入5个单位的EcoR Ⅰ,37 ℃酶切4~5 h,使cccDNA酶切成双链线性DNA,便于PCR扩增[5]。将处理后样品进行巢式PCR扩增单个核内DHBV YMDD区,反应体系及条件同上述。将第2轮PCR产物进行琼脂糖电泳,根据结果选取阳性样品送华大基因公司测序。
1.7 统计学方法 采用SPSS16.0软件进行处理。计数资料组间比较采用χ2检验,不满足χ2检验条件者采用Fisher精确概率法。半肝切除前后PCNA表达的比较采用方差分析Welch法。P<0.05为差异有统计学意义。
2 结果
2.1 外周血DHBV DNA水平的变化 慢性DHBV感染鸭外周血DHBV DNA平均水平为(7.17±0.53)log10拷贝/ml。治疗组持续口服拉米夫定16~22周,血清DHBV DNA水平低于3 log10拷贝/ml(检测下限);行半肝切除并接种突变株转染上清,术后1周时所有动物外周血病毒水平升高至(4.43±0.68)log10拷贝/ml,而在术后4、8和12周逐渐下降,并在第12周达最低水平,出现术后一过性反弹。而未治疗组动物整体维持高病毒血症状态(图1)。

图1半肝切除后接种突变株病毒外周血DHBV DNA水平的变化
2.2 血清中耐药突变株的比例变化 筛选2只治疗组动物(3号和23号)不同时间点血清中的阳性病毒株克隆各15个,直接测序法检测YMDD区段。结果显示半肝切除前血清中克隆均为野生株,接种突变株转染上清后,在术后1、4、8、12周,3号动物分别检测到6(40%)、3(20%)、1(6.7%)、1(6.7%)个突变株,23号动物分别检测到7(46.7%)、4(26.7%)、2(13.3%)、0个突变株(图2)。结果提示野生株始终为DHBV准种中的优势株,随接种时间的延长,突变株在血清中的比例降低,并未成为优势准种。
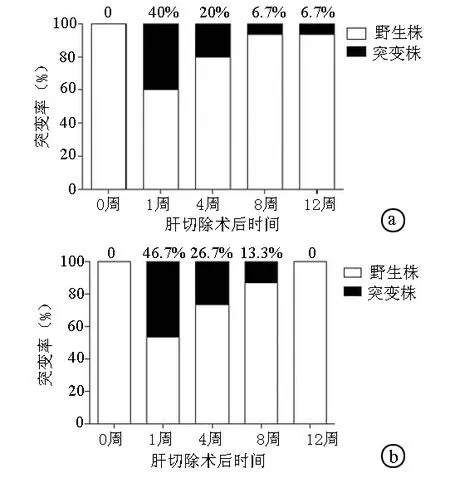
图2 半肝切除后血清中耐药突变株的比例变化 a:3号动物;b:23号动物
2.3 突变株感染的肝细胞核比例变化 流式分选各时间点肝组织标本的单个细胞核,巢氏PCR扩增单个核内DHBV DNA的YMDD区。基线时(肝右叶半肝切除术时)每只动物分别获取30个,术后1周及12周每只动物各获取90个阳性PCR产物直接测序。结果显示治疗组在接种突变株转染上清前所有动物单个核内DHBV均为野生株;术后1周时所有动物均有少量的肝细胞核感染了突变株(1.1%~7.8%),高于术后12周时感染突变株的比率(0~4.4%),两者比较差异有统计学意义(χ2=7.225,P<0.01)(表2)。未治疗组动物3个时间点均未发现突变株。

表2 半肝切除后突变株感染的单个肝细胞核比例的变化[例(%)]
2.4 PCNA表达阳性肝细胞核比例变化 PCNA染色单个肝细胞核悬液后,经流式分选仪分选,结果显示基线时PCNA阳性肝细胞比率极低(0.84±0.36)%,提示正常肝细胞稳定很少再生;术后1周时比率显著升高(42.26±6.48)%,有近一半的肝细胞增殖;但在术后12周时比率显著降低(11.83±3.97)%。各时间点PCNA表达阳性肝细胞比率差异有统计学意义(F=190.832,P<0.001)(表3)。

表3 半肝切除后PCNA阳性的肝细胞核比例变化(%)
2.5 突变株感染的不同标记的肝细胞核比例变化 采用巢氏PCR扩增治疗组动物术后PCNA标记阳性及阴性的单个核内DHBV DNA的YMDD区,每只动物各时间点分别获取30个阳性PCR产物直接测序。结果显示所有动物在术后1周时有少量PCNA阳性肝细核能检测到突变株(6.7%~16.7%),而术后12周时有3只动物极少部分PCNA阳性细胞核感染了突变株(0~6.7%),两组比较差异有统计学意义(χ2=7.063,P<0.01);在PCNA阴性的细胞核中,术后2个时间点各1只动物仅有1个细胞核检测到突变株(表4)。

表4 突变株感染的PCNA阳性及阴性单个肝细胞核比例的变化[例(%)]
3 讨论
核苷类药耐药突变是逆转录过程中随机发生的结果。在药物治疗与宿主免疫反应的选择压力下,耐药突变株在肝脏内大量复制并逐渐转为优势株[6]。cccDNA库中野毒株转为耐药突变株的效率与肝细胞再生速度密切相关[7]。目前有关cccDNA的检测仍存有争议,但研究证实核内病毒 DNA主要是以cccDNA的形式存在,能较直接反映cccDNA水平及状态[3]。
本研究发现,鸭半肝切除后,流式标记法检测肝组织PCNA的表达均较术前显著增多。PCNA是一种与细胞周期相关的增殖细胞核抗原,存在并合成于核内,其含量和表达强弱的变化与DNA合成及DNA复制的活跃程度一致,多用于反映细胞增殖程度和评价细胞增殖的状态[8]。鸭半肝切除后,肝细胞呈现出较强的再生能力,有大量新生肝细胞生成以恢复肝细胞数量和肝脏结构。本研究报道与兔和大鼠的肝再生模型[9]结论一致,下一步将采取免疫组化法进一步证实本结论。
基线时血清及单个核内病毒DNA均为野生株。半肝切除后,在肝细胞增殖活跃期接种耐药株病毒上清,血清中与单个肝细胞核内均检测到少量DHBV M512V突变株的存在,但未能成为优势株。以往研究证实慢性感染状态下,几乎每个肝细胞都感染了HBV,由于cccDNA半衰期与被感染肝细胞寿命较长,未感染的肝细胞数量较少。此外由于HBV感染肝细胞时存在重复感染排除现象,认为耐药突变株无法再感染野生株已感染的肝细胞,导致耐药病毒再感染肝细胞的机会很低[1]。这种重复感染排除现象使肝细胞核内DHBV毒株只有1种,而核内病毒形式主要为cccDNA和少量的rcDNA,因此可以推测本实验中肝细胞核内存在DHBV耐药株cccDNA。HBV耐药株是缺陷病毒,其复制活性低于HBV野生株,在同野生株的竞争中处于劣势,药物的选择压力是耐药产生的必要条件[10]。用野生株感染鸭中耐药M512V突变株不能自发产生,需要2年以上抗病毒治疗才会出现[1],并逐渐替代野生株成为优势株,因此可推测在半肝切术后1、12周时肝细胞核内检测的突变株为接种的游离DHBV突变株感染引起。本研究结果表明,核内耐药DHBV DNA感染肝细胞核数量并未随着拉米夫定治疗时间的延长而增加,而是逐渐减少,即观察时间内耐药毒株在肝内未能成为优势株。
本研究还发现耐药突变株主要感染新生的肝细胞。对于慢性DHBV感染鸭,即使野生型DHBV的复制已被核苷类似物充分抑制,但亲代肝细胞仍然存在DHBV cccDNA[11],因此半肝切除能否为耐药DHBV肝脏内传播提供足够的空间还取决于cccDNA从亲代肝细胞分配到子代肝细胞的几率。由于新生未感染的肝细胞较少,肝内病毒感染主要以野生株为主,突变株难以快速大量感染肝细胞,形成优势准种。
[1] WALTERS KA, JOYCE MA, ADDLSON WR, et al. Superinfection exclusion in duck hepatitis B virus infection is mediated by the large surface antigen[J]. J Virol, 2004, 78(15): 7925-7937.
[2] GUIDOTTI LG, MATZKE B, CHISARI FV. Hepatitis B virus replication is cell cycle independent during liver regeneration in transgenic mice[J]. J Virol, 1997, 71(6): 4804-4808.
[3] SHEN GJ, FU XH, ZHOU B, et al. Duck hepatitis B virus DNA copy numbers in isolated hepatocyte nuclei vary dramatically and decline under entecavir therapy[J]. Antiviral Therapy, 2013, 18(8): 987-996.
[4] FU XH, LIANG WF, WU XD, et al. Construction of a duck hepatitis B virus YMDD mutant and identification of its resistance phenotype[J]. J Southern Med Univ, 2011, 31(4): 633-636. (in Chinese)
付喜花, 梁蔚芳, 吴小东, 等. 鸭乙型肝炎病毒YMDD突变株体外耐药模型的建立[J]. 南方医科大学学报, 2011, 31(4): 633-636.
[5] ZHANG YY, ZHANG BH, THEELE D, et al. Single-cell analysis of covalently closed circular DNA copy numbers in a hepadnavirus-infected liver[J]. Proc Natl Acad Sci U S A, 2003, 100(21): 12372-12377.
[6] HU AR, HU T. Common mutations of hepatitis B virus and their clinical significance[J]. J Clin Hepatol, 2016, 32(8): 1463-1467. (in Chinese)
胡爱荣, 胡婷. HBV基因组常见突变及临床意义[J]. 临床肝胆病杂志, 2016, 32(8): 1463-1467.
[7] LITWIN S, TOLL E, JILBERT AR, et al. The competing roles of virus replication and hepatocyte death rates in the emergence of drug-resistant mutants: theoretical considerations[J]. J Clin Virol, 2005, 34(Suppl 1): s96-s107.
[8] TSENG JH, OUYANG CH, LIN KJ, et al. Significance of insulin signaling in liver regeneration triggered by portal vein ligation[J]. J Surg Res, 2011, 166(1): 77-86.
[9] TANOUE S, UTO H, KUMAMOTO R, et al. Liver regeneration after partial hepatectomy in rat is more impaired in a steatotic liver induced by dietary fructose compared to dietary fat[J]. Biochem Biophys Res Commun, 2011, 407(1): 163-168.
[10] FU XH, SHEN GJ, SUN CW, et al. Chronic infection of duck hepatitis B virus resistant to lamivudine[J]. J Pract Med, 2011, 27(10): 1743-1745. (in Chinese)
付喜花, 沈国俊, 孙春伟, 等. 鸭乙型肝炎病毒拉米夫定耐药突变株的慢性感染研究[J]. 实用医学杂志, 2011, 27(10): 1743-1745.
[11] DANDRI M, BURDA MR, WILL H, et al. Increased hepatocyte turnover and inhibition of woodchuck hepatitis B virus replication by adefovir in vitro do not lead to reduction of the closed circular DNA[J]. Hepatology, 2000, 32(1): 139-146.
引证本文:SHEN GJ, JIANG XY, HUANG J, et al. Dynamic changes in drug-resistant duck hepatitis B virus DNA in single hepatocyte nucleus after hemihepatectomy using a liver regeneration model[J]. J Clin Hepatol, 2017, 33(11): 2127-2131. (in Chinese)
沈国俊, 江小云, 黄洁, 等. 利用半肝切除再生模型研究单个肝细胞核内耐药鸭乙型肝炎病毒DNA的动态变化[J]. 临床肝胆病杂志, 2017, 33(11): 2127-2131.
(本文编辑:刘晓红)
Dynamicchangesindrug-resistantduckhepatitisBvirusDNAinsinglehepatocytenucleusafterhemihepatectomyusingaliverregenerationmodel
SHENGuojun,JIANGXiaoyun,HUANGJie,etal.
(LiverDiseaseCenter,ThirdPeople′sHospitalofJiujiangCity,Jiujiang,Jiangxi332000,China)
ObjectiveTo investigate the dynamic changes in drug-resistant duck hepatitis B virus (DHBV) DNA in single hepatocyte nucleus after hemihepatectomy using a liver regeneration model.MethodsDucks aged 45 days with chronic DHBV infection were inoculated with mutant DHBV after hemihepatectomy and then fed with lamivudine. Blood samples and liver tissue samples were collected at regular intervals. Viral DNA level in peripheral blood and viral strains were measured. Flow cytometry was used to isolate single hepatocyte nuclei and nuclei with or without proliferating cell nuclear antigen (PCNA). Nested-PCR was used for the multiplication of intranuclear DHBV YMDD region. Direct sequencing was used to determine the absence or presence of mutation. The chi-square test and the Fisher′s exact text were used for comparison of categorical data between groups. The Welch method was used for comparison of PCNA before and after hemihepatectomy.ResultsThere were wild strains in single hepatocyte nuclei and serum before hemihepatectomy. After inoculation with mutant strains, the percentage of hepatocyte nuclei infected with mutant strains decreased significantly from 1 week to 12 weeks after hemihepatectomy (χ2=7.225,P<0.01). The percentage of PCNA-positive hepatocyte nuclei was 0.84%±0.36% before surgery, significantly increased to 42.26%±6.48% at 1 week after surgery, and was 11.83%±3.97% at 12 weeks after surgery, and there was a significant difference between different time points (F=190.832,P<0.001). The percentage of PCNA-positive nuclei infected with mutant strains decreased significantly from 1 week to 12 weeks after surgery (χ2=7.063,P<0.01), while the percentage of PCNA-negative nuclei infected with mutant stains was extremely low after surgery.ConclusionHemihepatectomy may provide a replication space for drug-resistant virus, but drug-resistant virus cannot become dominant strains in the peripheral blood and the liver.
hepatitis B virus, duck; drug resistance, viral; single hepatocyte nuclei; liver regeneration
R512.62
A
1001-5256(2017)11-2127-05
10.3969/j.issn.1001-5256.2017.11.015
2017-05-03;
2017-06-05。
江西省青年科学基金计划(20142BAB215038)
沈国俊(1983-),男,主治医师,博士,主要从事病毒性肝炎基础与临床研究。
付喜花,电子信箱:xihuafu2008@126.com。
