《2017年美国国立综合癌症网络肝胆肿瘤临床实践指南(V2版)》更新要点及临床路径
2017-11-22余炯杰王明达译田审校
余炯杰, 王明达译, 杨 田审校
(1 上海第二军医大学东方肝胆外科医院 肝胆外科, 上海 200438;2 上海第二军医大学 临床医学系, 上海 200433)
《2017年美国国立综合癌症网络肝胆肿瘤临床实践指南(V2版)》更新要点及临床路径
余炯杰1,2, 王明达1译, 杨 田1审校
(1 上海第二军医大学东方肝胆外科医院 肝胆外科, 上海 200438;2 上海第二军医大学 临床医学系, 上海 200433)
肝肿瘤; 胆道肿瘤; 临床路径; 美国; 诊疗准则
美国国立综合癌症网络(NCCN)针对肝胆肿瘤指南综合了大量高质量的循证医学证据及专家共识,且更新十分及时,对于临床实践有重要的指导价值。在此对2017年《NCCN肝胆肿瘤临床实践指南(V2版)》的要点及临床路径进行摘译,以供临床参考。
1 关于内容的注释
1.1 英文缩写 见表1。
1.2 临床试验 NCCN认为任何肿瘤患者的最优疗法总是处于临床试验中,特别鼓励参与临床试验。
1.3 共识等级分类 除外特别标注的内容,所有推荐的等级均为2A。 NCCN证据及共识等级分类:(1)等级1:基于高水平证据,NCCN共识一致认为干预是适当的;(2)等级2A:基于较低水平证据,NCCN 共识一致认为干预是适当的;(3)等级2B:基于较低水平证据,NCCN 共识(非一致的标准)认为干预是适当的;(4)等级3:基于任何水平的证据,关于干预是否适当,NCCN 存在较大争议。
1.4 更新要点 2017年(V2版)较2016 年(V2版)临床路径的更新要点均在图中进行了注释,便于读者对比。
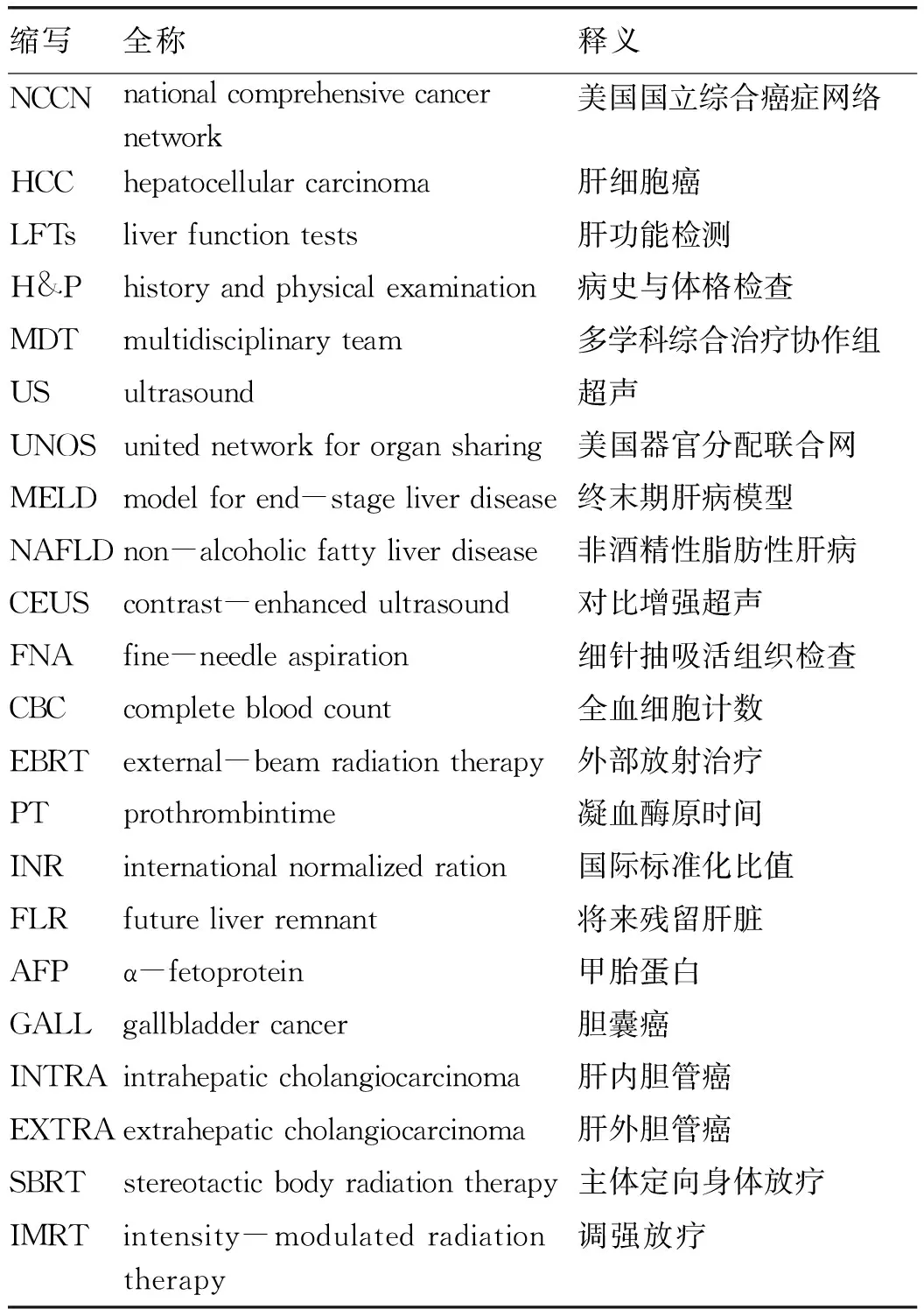
表1 部分英文缩写
2 肝细胞癌(HCC)
2.1 活组织检查的原则a(更新点a:新增加内容)
考虑进行活组织检查的指征如下。
2.1.1 首次活组织检查
(1)多相CT或MRI高度怀疑恶性但未达到影像学诊断HCC标准。
(2)达到影像学诊断HCC标准,但:①发生HCC的风险不高(例如患者无肝硬化、HBV感染、目前或之前无HCC病史);②患有心源性肝硬化、遗传性肝纤维化或由于血管异常病变(如布加综合征、遗传性出血性毛细血管扩张症或结节性再生性增生等)引起的肝硬化;③CA19-9或CEA升高,怀疑INTRA。
(3)在转移性肿瘤的临床决策中应当考虑。
(4)需要得到组织学病理分级或者分子分型。
(5)未经活组织检查的外科手术切除应进行多学科综合分析。
2.1.2 重复活组织检查
(1)非诊断性活组织检查。
(2)先前的活组织检查结果与影像学、生物指标或其他因素不符。
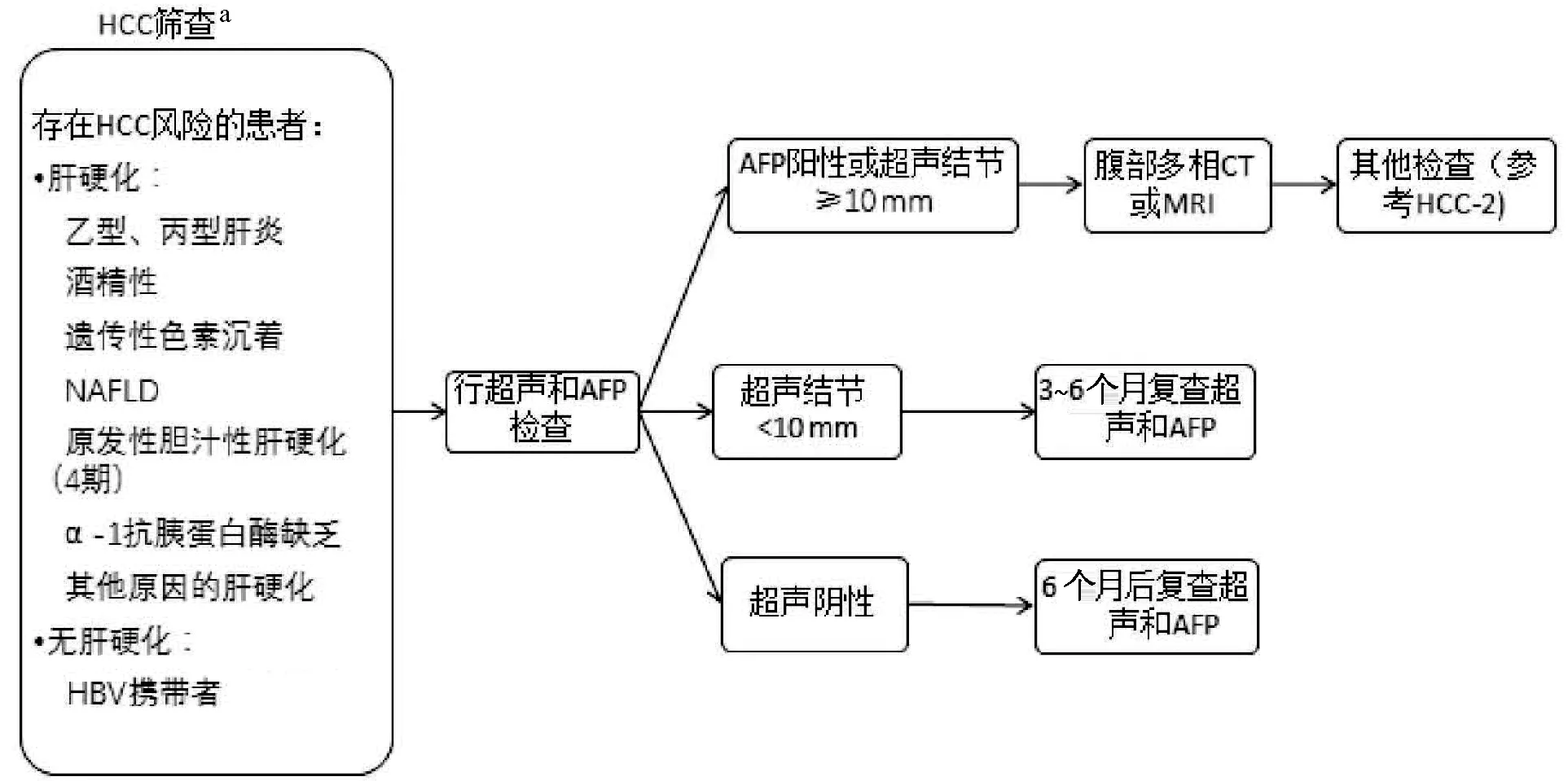
图1-1 HCC-1 更新:a,此处影像学筛查进行了广泛改动
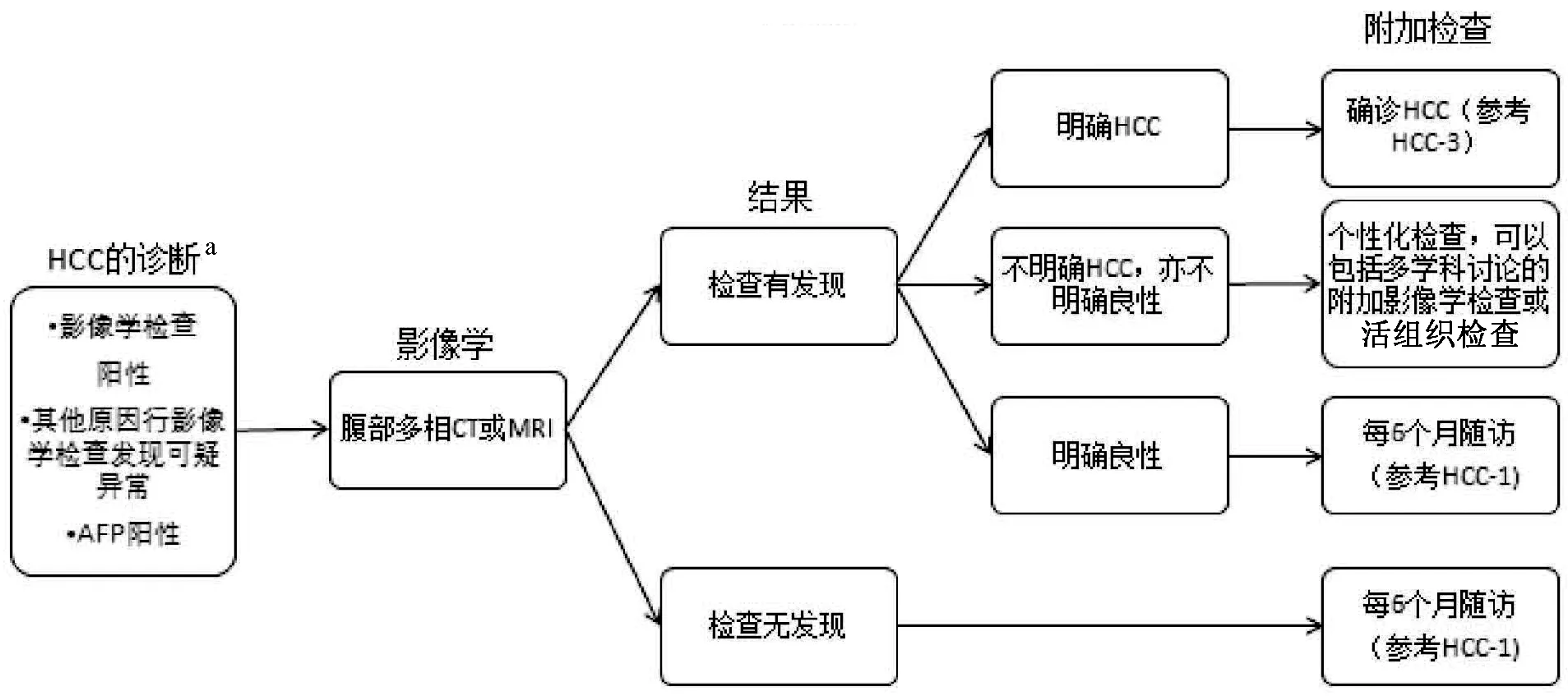
图1-2 HCC-2 更新:a,此处“HCC的诊断”整合了2016年V2版中HCC-2和HCC-3内容,并进行了广泛改动
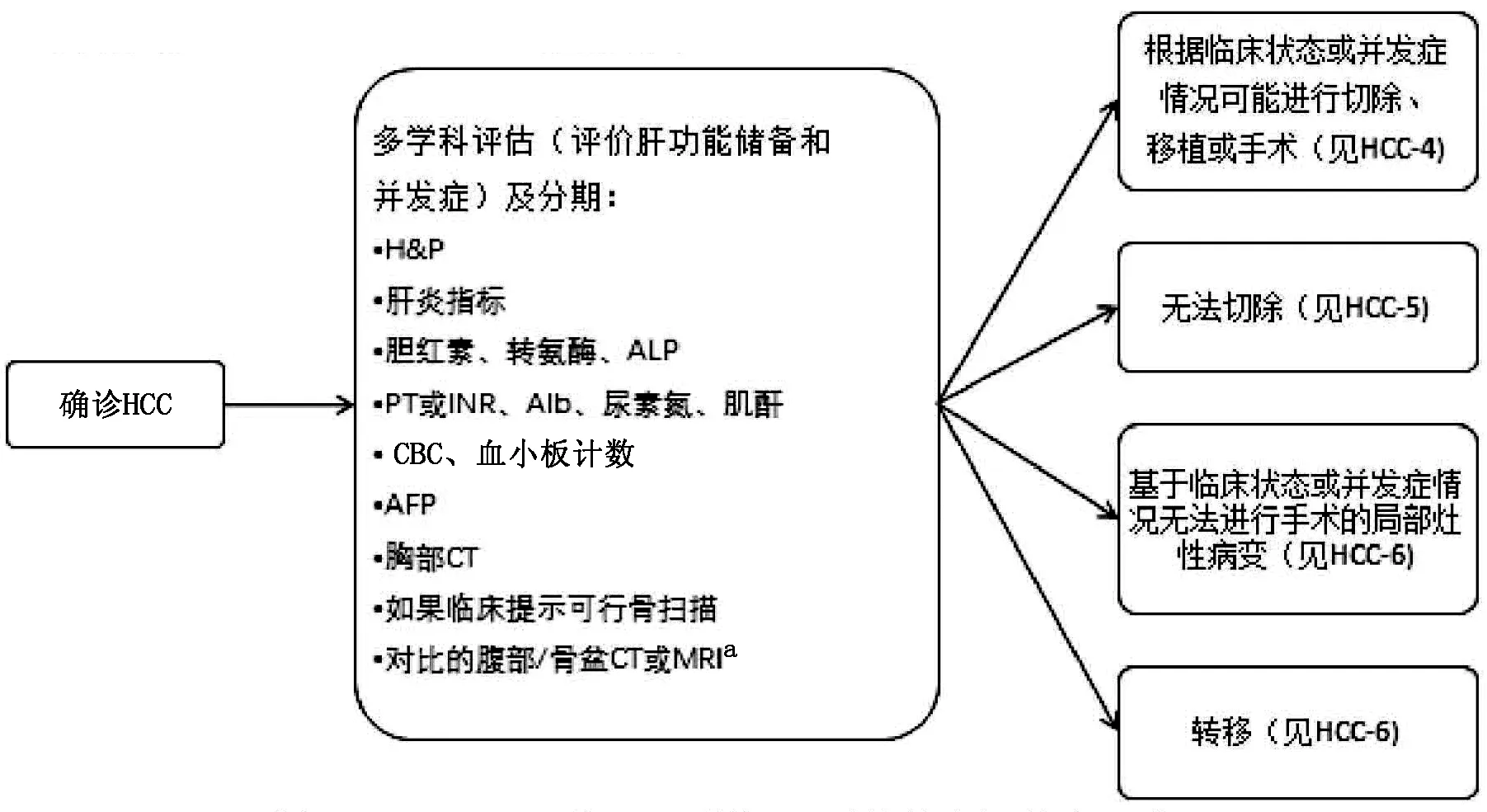
图1-3 HCC-3 更新:a,增加了“对比的腹部/骨盆CT或MRI”
2.2 手术的原则
(1)患者必须处于可耐受主要手术的健康状况。
(2)存在下列情形时,肝切除可作为可能的治疗方法:①适当的肝功能(通常为无门静脉高压症的Child-Pugh A级,但不包括少数可部分切除的轻度门静脉高压症患者);②无主要血管侵犯的实体肿块;③充足的FLR(至少20%的肝组织无肝硬化,且30%~40%为Child-PughA级肝硬化,并伴有充足的血管及胆道循环)。
(3)以下情况的肝切除是存在争议的,但可以考虑:①有限的可切除多点病变;②大血管侵犯。
(4)被考虑做主要切除的慢性肝病患者,术后门静脉血栓应加以考虑。
(5)达到UNOS标准(单个病灶≤5 cm,或2~3个病灶≤3 cm)应考虑进行肝移植(尸肝或活体捐赠)。对于肿瘤特征超出UNSO指南很少的患者存在较多争议,在一些机构其仍被认为是可以行肝移植的。此外,肿瘤特征超过Milan标准但达到前述标准的患者同样也可考虑接受肝移植。
(6)UNOS使用MELD评分评估肝病严重程度并区分肝移植分配优先度。MELD评分可采用MELD评分专用计算器计算(https://optn.transplant.hrsa.gov/resources/allocation-calculators/meld-calculator/)。
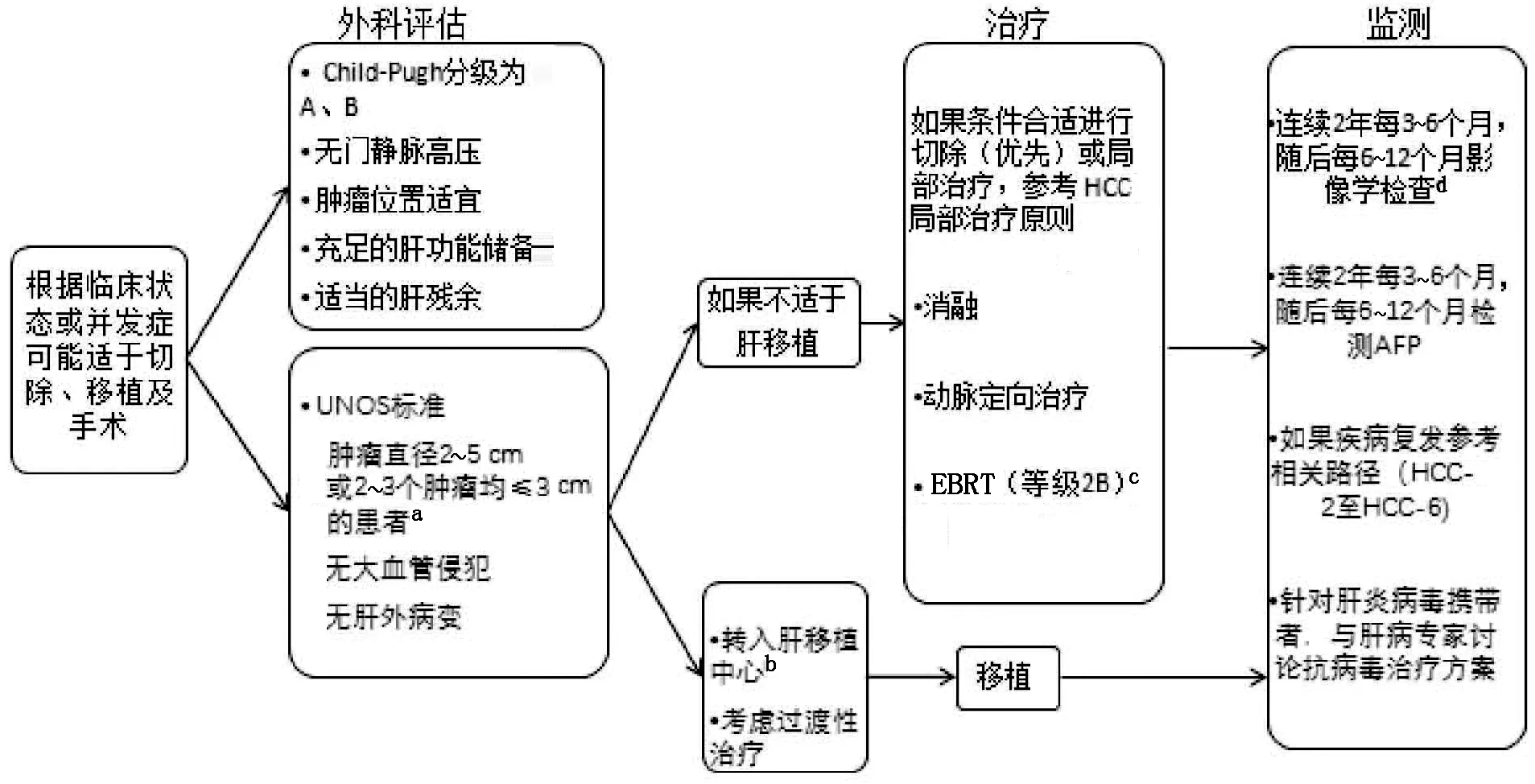
图1-4 HCC-4 更新:a,由“肿瘤直径≤5 cm或2~3个肿瘤均≤3 cm的患者”改为“肿瘤直径2~5 cm或2~3个肿瘤均≤3 cm的患者”;b,移除了“如果适于肝移植”;c,移除了“适形放疗或立体定位放疗”;d,此处脚注由“推荐MRI或多相CT扫描评估肝脏。根据临床提示考虑胸部影像学检查。”改为“推荐腹部多相MRI或多相CT扫描评估肝脏。考虑胸部影像学检查。”
(7)肝功能为Child-Pugh A级,符合UNOS标准及可切除的患者可考虑切除或移植。哪种初始治疗策略优先适宜于治疗这类患者存在争议,应由MDT评估。
2.3 HCC的局部治疗原则
所有HCC患者都应该评估是否有接受根治性治疗(肝切除、肝移植及针对较小肿瘤的消融)的可能性。对于无法行外科根治的患者,应当考虑局部治疗,局部治疗也可作为其他根治性治疗前的过渡治疗。局部治疗手段主要包括消融和肝动脉介入治疗2大类,此外还包括EBRT。其中,消融及肝动脉介入推荐等级为2A,EBRT为2B。
2.3.1 消融(射频、冰冻、经皮乙醇注射、微波)
(1)所有肿瘤都可进行消融。除了消融肿瘤外,热消融还能消融肿瘤边缘的正常组织,但是经皮乙醇注射不会对肿瘤边缘的正常组织产生影响。
(2)肿瘤位置应当位于经皮/腹腔镜/开腹消融操作的路径上。
(3)病变邻近大血管、胆管、膈肌及其他腹腔脏器时,操作应当格外谨慎。
(4)对于<3 cm的肿瘤,单用消融就可达到治愈。在经过选择的患者中,较小且位置合适的肿瘤可将消融作为治疗方式。3~5 cm的瘤体通过肝动脉介入治疗可能延长生存时间,对位置适宜的患者,肝动脉介入可联合消融作为治疗。
(5)对于>5 cm的不可切除/不可手术的病变,应考虑肝动脉介入治疗或系统化疗。
(6)索拉非尼不作为消融前的辅助治疗。
2.3.2 肝动脉介入治疗
(1)只要肿瘤的动脉血供能够被单独隔离,而不至于对非靶向组织产生过多影响,任何位置的肿瘤都可接受肝动脉介入治疗。
(2)肝动脉介入治疗手段包括经动脉栓塞术、经肝动脉化疗栓塞术、联合药物洗脱珠的经肝动脉化疗栓塞术及钇-90微球放射栓塞术。
(3)除非能够进行阶段性注射,否则胆红素> 3 mg/dl是所有肝动脉介入治疗的相对禁忌证。针对胆红素>2 mg/dl的患者应用钇-90微球放射栓塞术可增加放射性肝病的风险。
(4)门静脉主干栓子形成和肝功能Child-Pugh C级是肝动脉介入治疗的相对禁忌证。
(5)可由术者选择动脉栓塞术的造影终点。
(6)对于肝功能良好的患者,经证实肝动脉介入治疗后残留(复发),但不适于接受其他局部治疗,只要胆红素水平降至基线水平,即可应用索拉非尼。2项关于索拉非尼协同肝动脉介入治疗的安全性及有效性随机临床试验已证实并无明显获益,进一步探索联合其他治疗方案的Ⅲ期临床试验正在进行中。
2.3.3 外部照射放疗(EBRT)
(1)EBRT可以用于治疗病变无法切除或者由于并发症而无法手术的患者(推荐等级为2B)b。(更新点b:新增加了“EBRT推荐”内容)
(2)任何位置的肿瘤均可进行放疗(包括三维适形放疗、IMRT或SBRT)。
(3)有经验的临床中心推荐,对于肝内肿瘤,大剂量低分割光子或质子照射是一项可接受的治疗选择c。[更新点c:此处添加了参考文献:①TAO R, KRISHNAN S, BHOSALE PR, et al. Ablative radiotherapy doses lead to a substantial prolongation of survival in patients with inoperable intrahepatic cholangiocarcinoma: a retrospective dose response analysis[J]. J Clin Oncol, 2016, 34(3): 219-226;②HONG TS, WO JY, YEAP BY, et al. Multi-institutional phase Ⅱ study of high-dose hypofractionated proton beam therapy in patients with localized, unresectable hepatocellular carcinoma and intrahepatic cholangiocarcinoma[J]. J Clin Oncol, 2016, 34(5): 460-468;③BUSH DA, SMITH JC, SLATER JD, et al. Randomized clinical trial comparing proton beam radiation therapy with transarterial chemoembolization for hepatocellular carcinoma: results of an interim analysis[J]. Int J Radiat Oncol Biol Phys, 2016, 95(1): 477-482.]
(4)SBRT是一项采用大剂量放疗的先进低分割光子EBRT技术d。(更新点d:由“SBRT是一项采用大剂量放疗的先进EBRT技术”改为“SBRT是一项采用大剂量放疗的先进低分割光子EBRT技术”。)
(5)越来越多的证据支持SBRT在HCC患者中发挥作用。SBRT可替代上述消融/栓塞技术,或用于消融/栓塞治疗失败或存在禁忌证的患者。
(6)SBRT(1~5部分)常用于肿瘤数目为1~3个的患者e,只要有足够的健康肝脏,在肝脏放射耐受剂量允许的情况下,SBRT可用于体积更大或范围更广的病变,但要求没有肝外病变,或者肝外病变很小, 能够包含在一个治疗计划中。放疗对HCC的研究数据主要来源于肝功能Child-Pugh A级的患者,对于肝功能Child-Pugh B级或更差的患者的安全性数据仍有限。在进行剂量调整和严格的剂量限制后,对合并肝硬化的肝功能Child-Pugh B级HCC患者也可安全地进行放疗。对合并肝硬化的肝功能Child-Pugh C级的HCC患者,尚未证实放疗的安全性,因为很少有临床研究纳入Child-Pugh C级的患者。[更新点e:由“SBRT常用于1~3个肿瘤的患者”改为“SBRT(1~5部分)常用于肿瘤数目为1~3个的患者”。]

图1-5 HCC-5 更新:a,此处添加了“移植”治疗;b,此处添加了“如果疾病进展或使用索拉非尼后(只有Child-Pugh A)可使用瑞戈非尼(等级1)”;c,此处由“化疗:系统性;动脉内”改为“化疗:系统性(等级2B);动脉内”
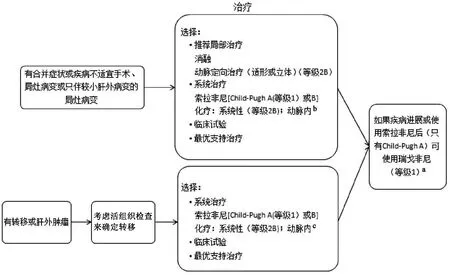
图1-6 HCC-6 更新:a,此处添加了“如果疾病进展或使用索拉非尼后(只有Child-Pugh A)可使用瑞戈非尼(等级1)”的治疗方法;b,在此处添加了“系统性(等级2B);动脉内”;c,在此处添加了“系统性(等级2B);动脉内”
(7)质子射线治疗在特定的情况下可作为合适的治疗选择。
(8)姑息性EBRT可控制和(或)预防转移性HCC(如骨或脑)并发症的相关症状。
3 GALL手术治疗和病理学原则f(更新点f:由“GALL手术治疗原则”标题改为“GALL手术治疗和病理学原则”)
3.1 手术中偶然发现
(1)如果没有专家,记录所有相关发现及转送患者至有专家的医疗中心。如果存在可疑肿块,活组织检查并非必须,因为活组织检查可导致腹膜种植转移。
(2)如果有专家及癌症的可信临床证据,应进行如后所述的最终手术。如果诊断不清,最终行手术切除前,在经选择的患者中可考虑冰冻切片活组织检查。
(3)切除的原则与关于放射状胆囊切除的相似,包括ⅣB和Ⅴ段,以及淋巴结清扫与拓展的肝及胆道切除,以尽可能达到切缘肿瘤阴性。

图2-1 GALL-1 更新:a,此处由“胆囊冰冻切除”改为“胆囊+可疑淋巴结冰冻切除”, 同时删除“考虑扩大的胆囊切除术”;b,此处由“胸部CT”改为“对比的胸部CT”;c,此处由“胆囊切除术+肝切除±淋巴结清扫±胆管切除”改为“胆囊切除术+肝切除±淋巴结清扫±恶性侵犯的胆管切除”
3.2 病理检查偶然发现
(1)由肝胆专业病理学专家重新进行病理学回顾和(或)告知手术者检查胆囊切除完整性、病变扩散标志、肿瘤位置及其他任何相关信息。回顾T分期、胆囊管边缘情况和其他边缘的病理学报告g。(更新点g:由“回顾手术记录和(或)告知手术者检查胆囊切除完整性、病变扩散标志、肿瘤位置及其他任何相关信息”改为“由肝胆专业病理学专家重新进行病理学回顾和(或)告知手术者检查胆囊切除完整性、病变扩散标志、肿瘤位置及其他任何相关信息。回顾T分期、胆囊管边缘情况和其他边缘的病理学报告”。)
(2)可使用诊断性腹腔镜检查,但只有较低的检出率。可在T3(或更高)分期、低分化或边缘阳性的胆囊切除术的肿瘤患者中得到较高的检出率。诊断性腹腔镜检查也应在影像学上有任何疑似转移且难以进行经皮肤活组织检查的患者中考虑使用。
(3)在决定手术切除前应重复行胸腔、腹腔及盆腔的横断面影像学检查。
(4)初始探查应排除位于腹腔动脉或主动脉-腔静脉的远处淋巴结转移,因其是进一步切除的禁忌。
(5)肝切除应当达到切缘阴性(镜下无恶性细胞),其通常包含Ⅳb及Ⅴ段。为达到切缘干净,一些患者可能需要超过Ⅳb及Ⅴ段的广泛切除。
(6)应当采用淋巴结清扫术来清除肝门的所有淋巴结。
(7)为达到边缘阴性可能需要胆道的切除。进行淋巴结清扫术的常规胆道切除已显示出可增加发病率且无明确证据证明可改善生存率。
(8)腹腔镜手术孔的种植仅为具有潜在转移性疾病的替代标志,切除腹腔镜手术孔并不能提高偶发癌变患者的预后或降低复发,在胆囊癌根治术中无需切除腹腔镜孔。

图2-2 GALL-2 更新:a,此处由“胸部CT”改为“对比的胸部CT”;b,此处由“肝切除+淋巴结清扫±胆管切除”改为“肝切除+淋巴结清扫±恶性侵犯的胆管切除”; c,此处增加了对于“胆囊管结节阳性”患者的2项新辅助化疗“基于氟尿嘧啶或吉西他滨的化疗方法;临床试验”
3.3 影像学上的肿块
表现为胆囊肿块或病变疑似GALL。
(1)应当对胸腔、腹腔及盆腔横断面影像学检查情况进行分期。
(2)如果存在疑似肿块,活组织检查并非必须,且应当实施完全切除。
(3)诊断不清晰的选择性患者,行胆囊切除术(包含手术中行冰冻切片检查)可能较为合理,如果病理证实为癌症即在此基础上行完全切除。
(4)按上述原则进行切除。

图2-3 GALL-3 更新:a,此处由“胸部CT”改为“对比的胸部CT”
3.4 GALL及黄疸
(1)GALL中黄疸的存在通常提示预后不良,这类患者需进行仔细的手术评估。
(2)虽然黄疸是相对禁忌证,但在有技术的中心可对选择性患者(愿意切除)尝试进行手术切除h。[更新点h:此处添加了参考文献:NISHIO H, EBATA T, YOKOYAMA Y, et al. Gallbladder cancer involving the extrahepatic bile duct is worthy of resection[J]. Ann Surg 2011, 253(5): 953-960.]
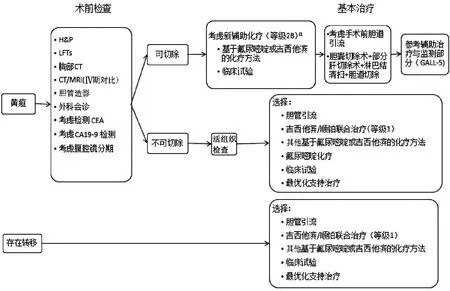
图2-4 GALL-4 更新:a,此处对黄疸患者增加了“考虑新辅助化疗”的路径
3.5 GALL放射治疗的原则i(更新点i:此部分为新增内容)
(1)辅助性放疗:术后使用传统三维适形RT或IMRT对于已切除EXTRA和GALL的患者是一项治疗选择。目标照射体积应该覆盖局部引流淋巴结(总量45 Gy,1.8 Gy每单位体积),以及手术切缘阳性的肿瘤基底区域(50.4~59.4 Gy,1.8 Gy每单位体积)。
(2)不可切除肿瘤的放疗:①无论肿瘤位置如何,所有肿瘤都应给予放疗(包括三维适形放疗、IMRT或SBRT);②传统标准剂量或高剂量分级放疗联合5-氟尿嘧啶为基础的化疗对肝内和肝外肿瘤都是可接受的;③低分割光子或质子照射对于肝内肿瘤而言是一项可接受的治疗选择,该治疗方式已被有经验的临床中心推荐;④SBRT(1~5次)对于肝内肿瘤是一项可接受的治疗方式。
4 INTRA手术的原则
(1)在进行确定的治疗性手术前活组织检查并非必须。在相适的临床特征基础上,影像学显示的可疑肿块应按照恶性病变治疗。
(2)应当考虑使用诊断性腹腔镜检查来排除不可切除的扩散性疾病。
(3)初始探查应当对多病灶肝病、淋巴结转移及远处转移进行评估。肝门外的淋巴结转移及癌症远处转移是切除的禁忌证。
(4)手术治疗的目的是达到阴性边缘的肝切除。为达到切缘阴性,在通常必要的部分切除外,锲状及分段器切除也都是适用的。
(5)肝门淋巴结清扫是合理的,因其可提供分期相关的信息。
(6)肝内多灶性病变通常是转移的标志,也是手术切除的禁忌证。多病灶(有限的)高选择性患者可考虑切除。
(7)显著肝门淋巴结转移提示预后不良,仅在高选择性患者中考虑切除。
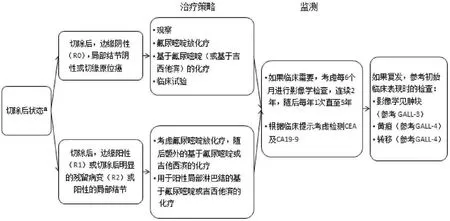
图2-5 GALL-5 更新:a,此处修改了页面整体路径,与EXTRA-2相一致
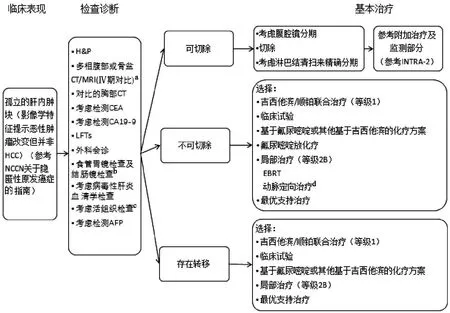
图3-1 INTRA-1 更新:a,由“CT/MRI(Ⅳ期对比)”改为“多相腹部或骨盆CT/MRI(Ⅳ期对比)”;b,由“食管镜检查及结肠镜检查”改为“食管胃镜及结肠镜检查”;c,由“活组织检查”改为“考虑活组织检查”;d,在“局部治疗”下属增加了“EBRT和动脉定向治疗”
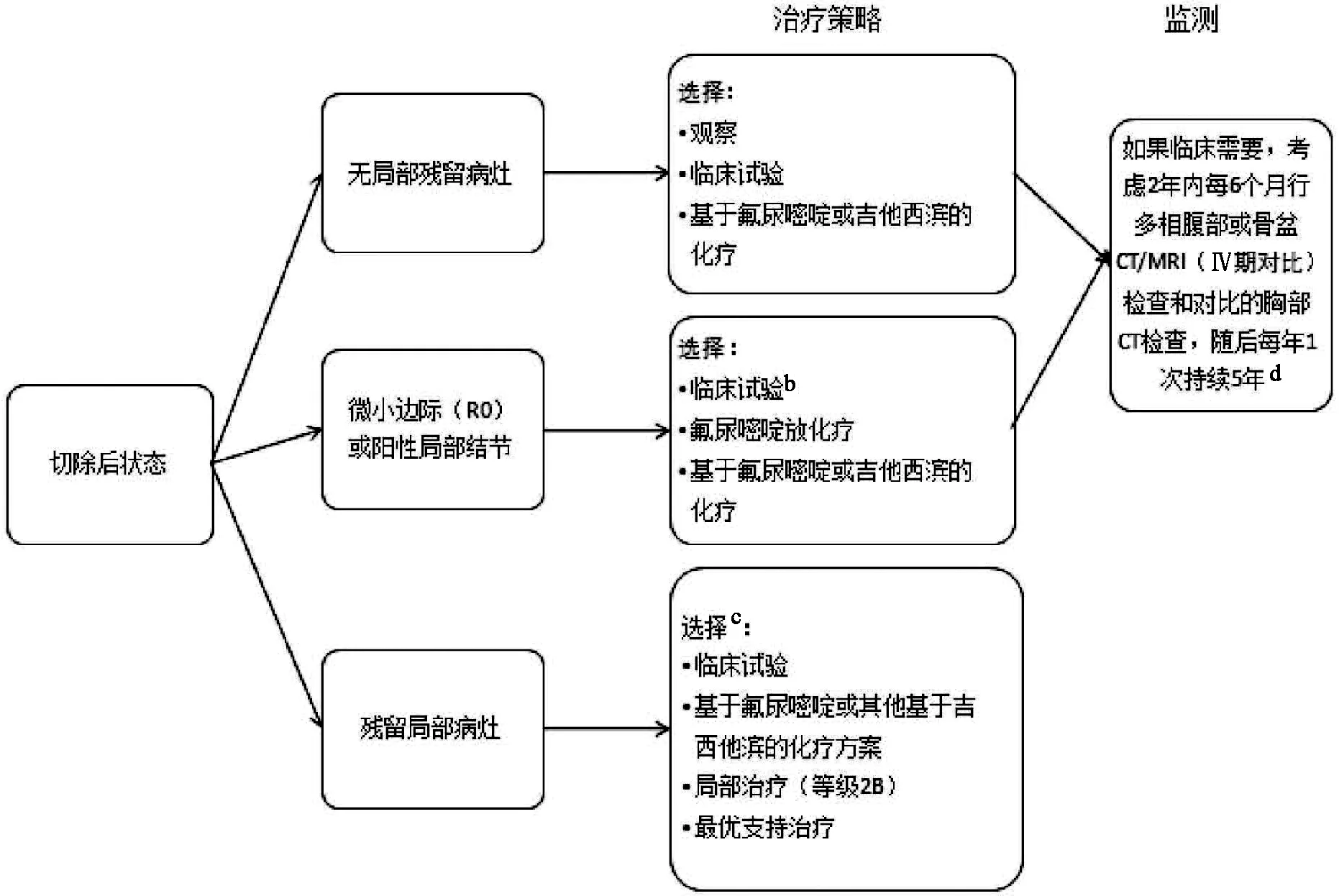
图3-2 INTRA-2 更新:a,标题由“辅助治疗”改为“治疗”;b,此处增加“临床试验”;c,由“吉西他滨/顺铂联合治疗(等级1)”改为“吉西他滨/顺铂联合治疗(等级2A)”,并将其移至脚注;d.由“影像学检查”改为“多相腹部或骨盆CT/MRI(Ⅳ期对比)检查和对比的胸部CT检查”
5 EXTRA手术的原则
5.1 一般原则
(1)手术的基本原则是达到阴性边缘的完全切除及区域淋巴结清扫。这通常需要胰十二指肠切除来处理远端胆道肿瘤,以及肝门肿瘤的主要肝切除。很少通过胆道切除及区域淋巴结清扫术切除中期胆囊肿瘤。
(2)应当考虑诊断性腹腔镜检查。
(3)某些情况下胆管肿瘤累及远端部分胆管,需实施肝切除合并胰胆管切除。相对疾病进程的存在,应当在并无显著并发症的非常健康的患者中实施手术。尽管如此,应在适当的临床状态下考虑采用可能的治疗方式。不推荐肝胰腺联合切除时行远端病变淋巴结清扫。
5.2 肝门胆管癌
(1)对可切除性的影像学评估的详细说明超出本指南范围,基本的原则是切除肿瘤及其侵犯的胆道支和半侧肝脏,以提高达到边缘阴性切除的几率。对侧肝脏需要保留完整的动静脉灌注及胆道引流。
(2)手术前规划的详细说明超出本指南范围,但需要评估以后的FLR,且需要评估胆道引流及FLR体积。在FLR较小的患者(并非所有)中,应当考虑采用FLR 手术前胆道引流及门静脉侧支栓塞。
(3)初始探查应当排除远处转移至肝脏、腹膜及远处淋巴结(超出肝门)这类肝切除的禁忌证,进一步探查必须确定局部的可切除性。
(4)从定义上来说,紧邻或侵入肝中央部位的肝门肿瘤,需要行肝切除术,包括胆汁融合,通常还需要尾叶切除。
(5)门静脉和(或)肝动脉的切除与重建对于完全切除是必需的,而且需要这方面的专家操作。
(6)通常采用胆肠Roux-en-Y吻合术进行胆道重建。
5.3 远端胆管癌
(1)初步评估来排除远处转移病变及局部可切除性。
(2)手术通常需要联合经典重建术的胰十二指肠切除。

图4-1 EXTRA-1 更新:a,由“CT/MRI(Ⅳ期对比)评估血管侵犯”改为“多相腹部或骨盆CT/MRI(Ⅳ期对比)评估血管侵犯”;b,此处增加“考虑血清IgG4以排除自身免疫性胆管炎”

图4-2 EXTRA-2 更新:a,此处增加了“临床试验”
[本文首次发表于NCCN.org(2017-05)]
引证本文:YU JJ, WANG MD, YANG T. Updated key points and clinical pathway for NCCN clinical practice guidelines in oncology: hepatobiliary cancers (Version 2.2017)[J]. J Clin Hepatol, 2017, 33(11): 2072-2082. (in Chinese)
余炯杰, 王明达, 杨田. 《2017年美国国立综合癌症网络肝胆肿瘤临床实践指南(V2版)》更新要点及临床路径[J]. 临床肝胆病杂志, 2017, 33(11): 2072-2082.
(本文编辑:邢翔宇)
UpdatedkeypointsandclinicalpathwayforNCCNclinicalpracticeguidelinesinoncology:hepatobiliarycancers(Version2.2017)
YUJiongjie,WANGMingda,YANGTian.
(DepartmentofHepatobiliarySurgery,EasternHepatobiliarySurgeryHospital,SecondMilitaryMedicalUniversity,Shanghai200438,China)
liver neoplasms; biliary tract neoplasms; clinical pathways; United States; practice guideline
R735.7; R735.8
B
1001-5256(2017)11-2072-11
10.3969/j.issn.1001-5256.2017.11.005
2017-06-25;
2017-06-25。
国家自然科学基金(81472284,81672699);上海市浦江人才计划(16PJD004)
余炯杰(1995-),男,主要从事肝胆外科相关研究。
杨田,电子信箱:yangtiandfgd@hotmail.com。
