内质网应激介导蜕皮甾酮对H2O2诱导的心肌细胞损伤的保护作用①
2017-11-22郭长磊吕风华王国戗
郭长磊 吕风华 王国戗
(新乡医学院第一附属医院心内科,新乡 453002)
内质网应激介导蜕皮甾酮对H2O2诱导的心肌细胞损伤的保护作用①
郭长磊 吕风华 王国戗②
(新乡医学院第一附属医院心内科,新乡 453002)
目的探讨蜕皮甾酮(EDS)如何通过调节内质网应激对过氧化氢(H2O2)诱导的心肌细胞损伤起保护作用。方法大鼠H9c2心肌细胞随机分为对照(Control)组,正常心肌细胞;H2O2组,不同浓度H2O2(1×10-3、1×10-4、1×10-5mol/L)诱导损伤细胞;EDS组,在H2O2组基础上,加入不同浓度的EDS(25、50、100 μmol/L)处理。MTT法和流式细胞术分别检测实验各组细胞活力及细胞凋亡率。Western blot检测各组细胞中Bcl-2、Bax、cleaved-caspase-3、caspase-4、caspase-7、caspase-12、GRP78和CHOP的蛋白水平,同时检测各组细胞中丙二醛(MDA)含量和超氧化物歧化酶(SOD)活性。结果与Control组相比,H2O2组的细胞活力减弱,凋亡率升高,MOD含量升高,SOD活性降低,GRP78和CHOP的表达升高(均P<0.05)。H2O2组加入EDS处理后,细胞活力提升,凋亡率下降,MOD含量降低,SOD活性升高,GRP78和CHOP的表达降低(均P<0.05)。结论通过抑制内质网的应激过程,蜕皮甾酮能减轻H2O2诱导的心肌细胞损伤。
内质网应激;蜕皮甾酮;心肌细胞;H2O2
目前,心脑血管疾病已成为我国仅次于恶性肿瘤的第二杀手[1,2],心肌细胞(Cardiomyocytes,CMs)损伤是参与多种心血管疾病发生发展的重要机制之一[3,4]。内质网是真核细胞中参与蛋白质组装、折叠和转运等的重要细胞器。在细胞中,蛋白质只能通过在内质网中正确折叠转运后才能发挥正常功能,而当细胞发生感染、炎症、过度氧化等造成的损伤时,内质网功能受损,蛋白质代谢障碍,最终会导致内质网应激(Endoplasmic reticulum stress,ERS)的产生[5]。研究表明过长时间或过强的内质网应激会导致细胞的保护机制不能与损伤相抗衡,致使细胞凋亡,进而影响多种心血管疾病发生[6,7]。蜕皮甾酮(Ecdysterone,EDS)是一类植物甾酮,具有抗氧化,促进核酸、蛋白质等的合成,改善微循环,减轻血管内皮损伤等作用[8]。最新研究表明蜕皮甾酮对多种疾病的细胞凋亡有抑制作用,且其对心脑血管疾病的防治也有一定效果,并最新研究表明蜕皮甾酮在心肌细胞的损伤中有保护作用,但是关于EDS对损伤的心肌细胞中内质网应激的影响还未见报道[9]。本文以过氧化氢(H2O2)诱导的心肌细胞为研究对象,探讨EDS抗心肌细胞损伤的作用及与内质网应激的关系。
1 材料与方法
1.1材料与试剂 大鼠H9c2心肌细胞购于美国模式培养物保藏所(American Type Culture Collection,ATCC);胰蛋白酶、胎牛血清和高糖DMEM培养基购自HyClone公司;蛋白Ⅰ抗和Ⅱ抗购于Pierce公司;AV/PI双染凋亡检测试剂盒购自BD公司。超氧化物歧化酶(Superoxide dismutase,SOD)和丙二醛(Malonaldehyde,MDA)检测试剂盒购自南京建成生物工程研究所。
1.2方法
1.2.1实验分组 心肌细胞H9c2培养于混合10%胎牛血清的高糖DMEM培养液中,并置于37℃,5% CO2培养箱中培养,细胞生长至90%融合状态后传达,取对数期生长状况良好的细胞进行随后实验。Control组细胞为正常培养的H9c2细胞;H2O2组为加入H2O2(浓度分别为1×10-3、1×10-4、1×10-5mol/L)培养的H9c2细胞;EDS组在H2O2组的基础上加入EDS(浓度分别为 25、50、100 μmol/L)进行心肌细胞培养。心肌细胞分组处理后各培养48 h,进行后续检测。
1.2.2MTT法检测细胞活力 各分组细胞加药后,分别在24、48及72 h用MTT法检测其细胞活力。各组H9c2细胞以6×104个/孔接种于96孔板,并且每组细胞设置3个复孔,继续培养24 h。弃去原培养液后每孔加入MTT(5 g/L)20 μl,置于37℃培养4 h。弃去上清,每孔加入150 μl二甲基亚砜(DMSO),振荡10 min使结晶充分溶解,使用酶标仪上检测各组细胞吸光度值A490,并计算细胞活力,细胞活力=处理组A490/对照组A490×100%。
1.2.3流式细胞术检测心肌细胞凋亡 各组H9c2细胞培养48 h后,用4℃预冷的PBS洗涤2次,随后加入含0.0.2% EDTA的0.25%胰酶消化并且收集细胞。加入1×Annexin V 结合缓冲液1 ml,800 r/min离心8 min后弃去上清,加入结合缓冲液200 μl重悬细胞。并在悬液中加入5 mg/L的Annexin V-FITC 10 μl以及PI 5 μl,混匀后37 ℃避光孵育 30 min。最后以激发波长488 nm,发射波长530 nm ,流式细胞仪检测细胞凋亡率。
1.2.4Western blot法检测蛋白水平 H9c2细胞培养48 h后收集细胞,加入RIPA细胞蛋白裂解液65 μl,提取细胞总蛋白,用BCA法测定蛋白浓度。总蛋白经SDS-PAGE电泳分离,电泳后转膜;5%脱脂奶粉室温封闭1 h后,分别加入1∶1 000稀释的山羊抗鼠Bcl-2、Bax、cleaved-caspase-3、caspase-4、caspase-7、caspase-12、GPR78(immunoglobulin binding protein)、CHOP(CCAAT/enhancer binding protein homologous protein)和β-actin的Ⅰ抗,4 ℃环境轻摇过夜。过夜后加入1∶100比例稀释的HRP-标记的兔抗山羊Ⅱ抗,室温下孵育1 h,漂洗3次;最后结果用X线胶片曝光分析,Image-Pro Plus软件处理,以待测蛋白与内参β-actin的灰度值比值作为蛋白的相对表达量。
1.2.5MDA含量的测定 用酶联法测定心肌中细胞的MDA含量。按照MDA试剂盒说明,收集各组处理过48 h的心肌细胞,加入20%的三氯乙酸(Trichloroacetic acid solution,TCA)孵育20 min,随后加入0.67%硫代巴比妥酸(Thiobar-bituric acid,TBA)和0.1 mol/L盐酸(HCl)置于95℃水浴1 h。随后离心,在532 nm波长处测量其吸光度值。
1.2.6SOD活性的测定 按照相关试剂盒使用说明完成超氧化物歧化酶(Superoxide dismutase,SOD)的活性检测。在分组处理48 h的心肌细胞中加入水溶性四氮唑盐工作液以及酶工作液,37 ℃下恒温孵育20 min,540 nm波长处测量其吸光度值

2 结果
2.1H2O2降低心肌细胞活力,EDS对抗H2O2的损伤作用 如图1所示,与对照组相比,H2O2处理能够显著抑制心肌细胞H9c2的活力,且其抑制效果具有药物浓度和时间依赖性,即H2O2浓度越高,处理时间越长,H9c2细胞活力越低,因此后续实验选用1×10-3mol/L为H2O2的诱导浓度。进一步检测不同浓度EDS处理H2O2诱导心肌细胞的活力变化,结果表明H9c2在EDS处理组的细胞活力显著升高,且呈浓度和时间依赖性,后续实验中选取100 μmol/L为EDS的处理浓度。
2.2EDS 对H2O2作用下心肌细胞形态的影响 为探讨EDS在H2O2诱导的心肌细胞损伤中的作用,采用100 μmol/L EDS处理1×10-3mol/L H2O2诱导的心肌细胞H9c2。如图2所示,H2O2组中的心肌细胞与Control组相比,细胞密度降低,部分细胞胞体变小变圆,生长状况明显降低;而EDS处理抑制了H2O2诱导的细胞生长状况下降。
2.3EDS抑制H2O2诱导的心肌细胞凋亡 流式细胞术检测细胞的凋亡水平,结果如图3A所示。1×10-3mol/L H2O2处理心肌细胞48 h后,H9c2细胞的凋亡率显著上升。用H2O2和EDS共同处理心肌细胞,其细胞凋亡率与H2O2组相比明显下降(P<0.05)。Western blot检测凋亡相关蛋白Bcl-2、Bax、caspase-4、caspase-7、caspase-12以及cleaved-caspase-3的蛋白水平变化(图3C),结果表明与Control组相比,H2O2组的Bcl-2的白表达水平显著降低,而Bax、caspase-4、caspase-7、caspase-12、cleaved-caspase-3 cleaved-caspase-4、cleaved-caspase-7和cleaved-caspase-12的表达显著升高。同时与H2O2组相比,EDS组的Bcl-2蛋白表达水平明显提升,Bax、caspase-4、caspase-7、caspase-12和cleaved-caspase-3的表达显著下降(P<0.05)。

图1 EDS对H2O2诱导的心肌细胞活力的影响Fig.1 Effect of EDS on H2O2 induced H9c2 cell activityNote: s.n=3.

图2 EDS对H2O2诱导的心肌细胞损伤的影响(×100)Fig.2 Effect of EDS on H2O2 induced H9c2 cell injury(×100)Note: The cells were observed under inverted microscope,n=3.
2.4EDS抑制H2O2诱导的心肌细胞内MDA水平升高以及SDO水平降低 检测分组处理的心肌细胞内MDA含量和SOD活性。结果表明H9c2细胞经H2O2处理后MDA的含量明显增加,SOD的活性显著降低(P<0.05)。同时在H2O2处理的心肌细胞中加入EDS,MDA含量显著降低,SOD活性提升(P<0.05),见图4。
2.5EDS抑制H2O2诱导的心肌细胞内内质网应激 为检测心肌细胞内的内质网应激水平,我们用Western blot实验检测了内质网应激标志蛋白GRP78及CHOP的表达。结果表明,GRP78及CHOP的表达在H2O2组中比在Control组中显著升高,并在经EDS处理后明显降低(P<0.05),见图5。

图3 EDS对H2O2诱导的心肌细胞凋亡的影响Fig.3 Effect of EDS on H2O2 induced H9c2 cell apoptosisNote: ±s.n=3.*.P<0.05 vs control group;#.P<0.05 vs H2O2 group.
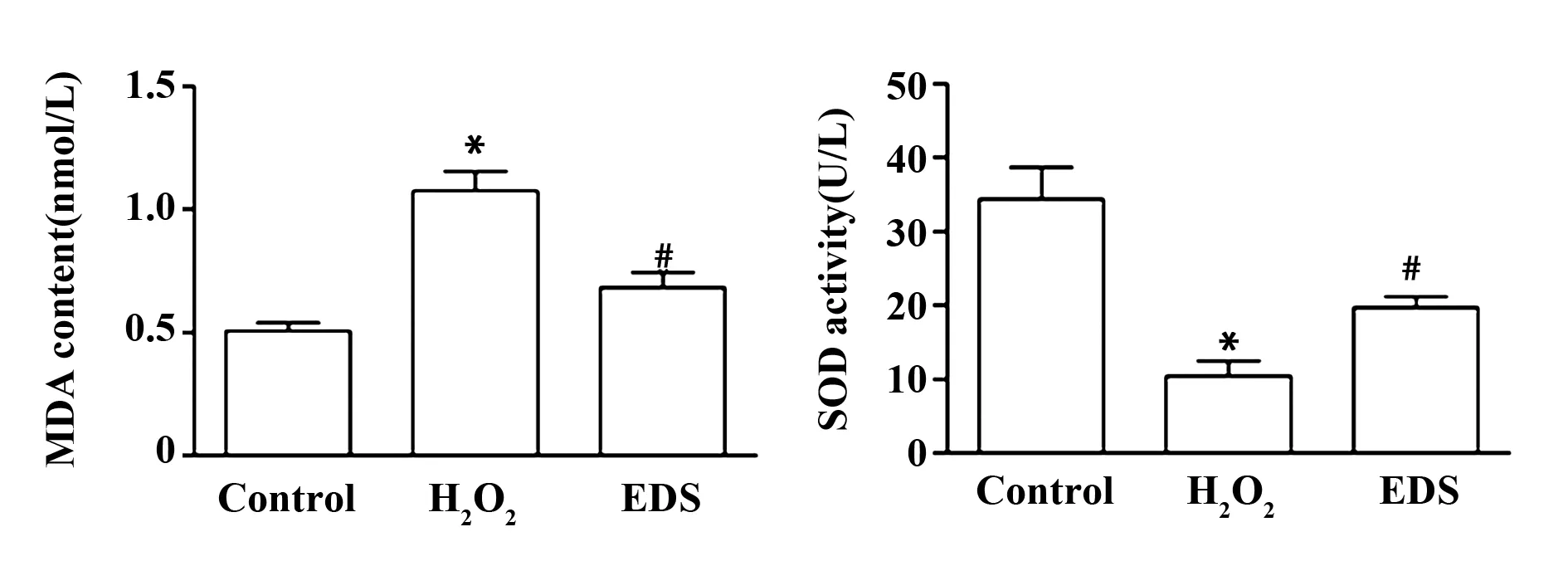
图4 EDS对H2O2诱导的心肌细胞中MDA和SOD水平的影响Fig.4 Effect of EDS on content of MDA and activity of SOD in H2O2 induced H9c2 cellsNote: ±s,n=3.*.P<0.05 vs control group;#.P<0.05 vs H2O2 group.
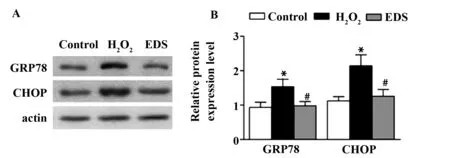
图5 检测GRP78和CHOP 表达的变化反映EDS对H2O2诱导的心肌细胞内质网应激的影响Fig.5 Effect of EDS on endoplasmic reticulum stress in H2O2 induced H9c2 cells by determining protein expression of GRP78 and CHOPNote: *.P<0.05 vs control group;#.P<0.05 vs H2O2 group.
3 讨论
EDS是广泛存在的一种类固醇激素,是许多中药如川牛膝、怀牛膝、桑叶、泽泻、白毛夏枯草等的有效成分。EDS对昆虫生长和分化有促进作用,可导致昆虫变态,而在哺乳动物中EDS也表现出能够调控能量代谢、细胞免疫和氧化应激等许多药理活性[10]。研究表明,EDS在缺氧的心肌细胞中具有抗凋亡作用[11]。心肌细胞的凋亡现象存在于多种心血管系统的生理和病理变化过程中,是参与并导致心血管疾病发生发展的重要细胞学基础[12,13]。内质网应激反应介导的细胞凋亡是参与心血管疾病发病的重要凋亡机制之一。EDS与内质网应激之间的作用在心肌细胞损伤中还未有研究。为此,本文以H2O2诱导的心肌细胞为损伤模型,观察EDS对心肌细胞损伤,内质网应激程度的影响,以期为以后的心血管疾病治疗提供新的理论依据。
为了探讨EDS保护心肌细胞损伤的机制,实验中我们采用H9c2心肌细胞进行传代培养,建立H2O2诱导损伤模型,观察EDS对H9c2心肌细胞生长的影响。结果表明EDS能够显著抑制H2O2引起的心肌细胞活力下降,说明EDS能减轻H2O2诱导的心肌细胞生长损伤,且其作用皆有浓度依赖性,与苏华等[9]的研究一致。细胞凋亡又称程序性死亡,是严格受到调控的细胞自主死亡形式。本研究结果显示H2O2可诱导心肌细胞凋亡升高,与其他研究者的报道一致[14]。促凋亡分子Bax以及抗凋亡蛋白Bcl-2分属于Bcl蛋白家族。研究表明Bcl-2过表达对多种因素诱导的细胞凋亡有抑制作用,同时Bax通过调节Bcl-2的活性而起到促凋亡作用[15]。Caspase-3 是细胞凋亡过程中关键的蛋白酶,在多种凋亡途径的下游充当效应蛋白,是重要的凋亡执行者[16]。本实验通过检测凋亡相关蛋白发现,H2O2能诱导Bax和cleaved-caspase-3的表达,同时促进凋亡蛋白caspase-4、caspase-7、caspase-12的表达,并抑制抗凋亡蛋白Bcl-2的表达,进一步说明H2O2能够诱导心肌细胞凋亡。同时,EDS处理可抑制H2O2诱导的凋亡,证明EDS能减轻H2O2诱导的心肌细胞损伤。
为了进一步探讨EDS减轻心肌细胞损伤的保护作用机制,本研究测定了各组细胞中MDA的含量和SOD的活性。MDA是脂质过氧化反应的产物之一,其含量的高低与细胞的过氧化程度相关[17]。SOD是一种重要的抗氧化酶,其活性高低由机体清除氧自由基的能力决定[18]。本研究用MDA含量和SOD活性来衡量H2O2诱导的心肌细胞损伤程度。结果显示与正常对照组相比,H2O2组的MDA含量明显增高,SOD显著下降,而与H2O2组相比,EDS组的MDA含量明显下降,SOD含量显著升高,这说明EDS对H2O2在心肌细胞中造成细胞损伤有逆转作用。
内质网应激是内质网腔错误折叠蛋白聚积所形成的一种适应性反应,一方面未折叠蛋白反应(Unfolded protein response,UPR)被激活来抵御外界刺激所造成的有害影响,另一方面当UPR不足以重新构建内质网稳态时,UPR通路将诱导细胞凋亡信号而引起细胞凋亡[19]。为研究EDS对H2O2诱导心肌细胞中内质网应激的影响,我们检测了内质网应激标志蛋白GRP78和CHOP的表达。GRP78又称免疫球结合蛋白,是公认的内质网应激信号系统的上游开关分子,是ERS的关键调节蛋白[20]。CHOP是ERS诱导的细胞凋亡的关键调节分子。正常细胞中CHOP的表达非常低,而在细胞受到刺激产生持久且过强的内质网应激反应时,其表达显著增加,从而诱导内质网相关性细胞凋亡,清除受损细胞[21]。本研究实验表明,与正常对照组相比,GRP78和CHOP的表达在H2O2组中显著升高,说明H2O2诱导的心肌细胞中发生内质网应激,对心肌细胞的凋亡有一定影响。此结果与沈志嘉等[14]的研究结果相一致。EDS组中GRP78和CHOP的表达比在H2O2组中明显下降,说明EDS处理能够降低H2O2诱导引起的内质网应激,从而抑制心肌细胞的凋亡。
综上所述,本研究结果证实H2O2能够引起心肌细胞内质网应激,诱导心肌细胞凋亡造成细胞损伤,而EDS处理可以通过抑制细胞中的内质网应激减轻心肌细胞损伤程度,说明EDS对心肌细胞损伤有一定的缓解作用。需要进一步在动物模型中研究,为EDS在心脑血管疾病的临床应用提供理论支持。
[1] Alghamdi M,Alqahtani B,Alhowti S.Cardiovascular complications among individuals with ampheta mine-positive urine drug screening admitted to a tertiary care hospital in Riyadh [J].J Saudi Heart Assoc,2016,28(3):129-135.
[2] 梁伟杰,何洁仪,张稳柱,等.硫化氢通过抑制坏死性凋亡对抗高糖引起的H9 c2心肌细胞损伤 [J].中国病理生理杂志,2016,32(3):385-391.
[3] Zeng GY,Xu XW,Liu HX.Experimental models of heart failure[J].Yao Xue Xue Bao,2002,37(7):579-585.
[4] 王 珏,黄伟聪,郑亮承,等.MicroRNA-24对心肌梗死后心肌细胞凋亡的调控作用 [J].中国病理生理杂志,2013,29(4):590-596.
[5] Cimellaro A,Perticone M,Fiorentino TV,etal.Role of endoplasmic reticulum stress in endothelial dysfunction [J].Nutr Metab Cardiovasc Dis,2016,26(10):863-871.
[6] Xu JQ,Chen B,Hu HX,etal.Lycopene protects against hypoxia/reoxygenation injury in mouse cardiomyocytes by inhibiting endoplasmic reticulum stress induced apoptosis[J].Zhonghua Xin Xue Guan Bing Za Zhi,2016,44(6):518-523.
[7] 陈 鹏,杨成明,曾春雨,等.心肌梗死后心力衰竭小鼠心肌组织内质网应激相关凋亡途径的研究 [J].中国病理生理杂志,2010,26(6):1069-1074.
[8] Pan Z,Niu Y,Liang Y,etal.beta-Ecdysterone protects SH-SY5Y cells against 6-hydroxydopa mine-induced apoptosis via mitochondria-dependent mechanism:involvement of p38MAPK-p53 signaling pathway [J].Neurotox Res,2016,30(3):453-466.
[9] 苏 华,谢睿彬,罗高湖,等.蜕皮甾酮减轻心肌细胞氧化应激损伤 [J].中国病理生理杂志,2016,32(12):2222-2227.
[10] 吴 霞,吴 旭,冯长江,等.蜕皮甾酮对急性肺损伤大鼠肺组织超微结构及IL-10mRNA表达的影响 [J].感染、炎症、修复,2012,13(4):207-211.
[11] 晋 军,典 岚.蜕皮甾酮对大鼠急性心肌梗塞侧支循环形成及VEGF产生的影响 [J].中国药理学通报,2000,16(4):459-461.
[12] Liang T,Zhang Y,Yin S,etal.Cardio-protecteffect of qiliqiangxin capsule on left ventricular remodeling,dysfunction and apoptosis in heart failure rats after chronic myocardial infarction [J].Am J Transl Res,2016,8(5):2047-2058.
[13] 梁 庆,李自成,邝素华,等.美托洛尔对心力衰竭大鼠心肌细胞磷酸化缝隙连接蛋白43表达及心肌细胞凋亡的影响 [J].中国病理生理杂志,2013,29(8):1352-1357.
[14] 沈志嘉,郑 桓,费 硕,等.白藜芦醇对H9c2心肌细胞抗氧化应激损伤的内质网应激机制研究 [J].中国新药杂志,2015,24(1):74-78.
[15] Tichy A.Apoptotic machinery:the Bcl-2 family proteins in the role of inspectors and superintendents [J].Acta Medica(Hradec Kralove),2006,49(1):13-18.
[16] Brentnall M,Rodriguez-Menocal L,De Guevara RL,etal.Caspase-9,caspase-3 and caspase-7 have distinct roles during intrinsic apoptosis [J].BMC Cell Biol,2013,14:32.
[17] Tao XY,Wang L,Gao WY,etal.The Effect of Inducible Nitric Oxide Synthase on Multiterritory Perforator Flap Survival in Rats [J].J Reconstr Microsurg,2016,23(9):643-649.
[18] Jiang YQ,Chang GL,Wang Y,etal.Geniposide prevents hypoxia/reoxygenation-induced apoptosis in H9c2 cells:improvement of mitochondrial dysfunction and activation of GLP-1R and the PI3K/AKT signaling pathway [J].Cell Physiol Biochem,2016,39(1):407-421.
[19] Jäger R,Bertrand MJ,Gorman AM,etal.The unfolded protein response at the crossroads of cellular life and death during endoplasmic reticulum stress [J].Biol Cell,2012,104(5):259-270.
[20] Panayi GS,Corrigall VM.Immunoglobulin heavy-chain-binding protein(BiP):a stress protein that has the potential to be a novel therapy for rheumatoid arthritis [J].Biochem Soc Trans,2014,42(6):1752-1755.
[21] Miyazaki-Anzai S,Masuda M,Demos-Davies KM,etal.Endoplasmic reticulum stress effector CCAAT/enhancer-binding protein homologous protein(CHOP)regulates chronic kidney disease-induced vascular calcification [J].J Am Heart Assoc,2014,3(3):e000949.
[收稿2017-05-12 修回2017-06-28]
(编辑 张晓舟)
EndoplasmicreticulumstressinfluencesprotectiveeffectofecdysteroneinH2O2inducedmyocardialinjury
GUOChang-Lei,LÜFeng-Hua,WANGGuo-Qiang.
DepartmentofCardiology,FirstAffiliatedHospitalofXinxiangMedicalCollege,Xinxiang453002,China
Objective:To study the role of endoplasmic reticulum stress(ERS)on ecdysterone(EDS)influenced protective effect in H2O2induced myocardial injury.MethodsThe H9c2 cells were randomly divided into control group(normal cells),H2O2groups(the cells treated with H2O2at concentrations of 1×10-3,1×10-4,1×10-5mol/L,respectively);EDS group(the cells were exposed to H2O2and treated with EDS at concentrations of 25,50,100 μmol/L respectively).The cell activity and apoptosis were measured by MTT assay and flow cytometry,respectively.The protein levels of Bcl-2,Bax,cleaved-caspase-3,caspase-4,caspase-7,caspase-12,GRP78 and CHOP were deter mined by Western blot.The MDA content and SOD activity were detected by the MDA and SOD detection kits.ResultsThe cell activity was decreased,cell apoptosis was increased,the content of MDA was elevated,the activity of SOD was inhibited and the protein expression of GRP78 and CHOP were increased in H2O2group as compared with control group,which were all significantly reversed by EDS treatment(P<0.05).ConclusionEcdysterone exhibits a protective effect on the cardiomyocytes with H2O2induced injury by inhibiting endoplasmic reticulum stress.
Endoplasmic reticulum stress;Ecdysterone;Cardiomyocytes;H2O2
10.3969/j.issn.1000-484X.2017.11.009
①本文为河南省医学科技攻关计划项目(201403141)。
②新乡医学院第一附属医院检验科,新乡 453002。
R542.2
A
1000-484X(2017)11-1642-05
郭长磊(1972年-),男,硕士,副主任医师,主要从事心血管疾病的基础与临床治疗研究,E-mail:guochanglei2017@163.com。
及指导教师:吕风华(1970年-),女,博士,主任医师,主要从事心血管疾病的基础与临床治疗研究,E-mail:ghy892017@163.com。