羧基化单壁碳纳米管对小鼠CIK细胞表型及功能的影响研究①
2017-11-22王英泽王巧兰曹晴晴
王英泽 王巧兰 杜 朝 曹晴晴 付 育
(河北科技大学生物科学与工程学院,石家庄 050018)
羧基化单壁碳纳米管对小鼠CIK细胞表型及功能的影响研究①
王英泽 王巧兰 杜 朝 曹晴晴 付 育
(河北科技大学生物科学与工程学院,石家庄 050018)
目的探讨羧基化单壁碳纳米管(SWCNT-COOH)对小鼠脾脏淋巴细胞诱导而成的CIK细胞表型及功能的影响。方法以不同浓度的SWCNT-COOH处理CIK细胞,采用倒置荧光显微镜观察细胞生长状态,MTS法测定杀伤效果,流式细胞术分析免疫表型。结果随着效靶比的增加,CIK的杀伤效果逐渐增强且最适效靶比为20∶1。用0.5 μg/ml SWCNT-COOH处理CIK细胞,CD3+CD4+、CD3+CD8+比例最高且均显著高于对照组(P<0.05),同时CIK杀伤小鼠黑色素瘤细胞B16、小鼠肝癌细胞H22和小鼠前列腺癌细胞RM-1的效果最佳。结论SWCNT-COOH可以显著增强CIK细胞的体外杀伤活性,具有潜在的肿瘤药物开发价值。
SWCNT-COOH;CIK细胞;肿瘤免疫;免疫表型
细胞因子诱导的杀伤细胞(Cytokine-induced killer cell,CIK)具有杀瘤作用强、增殖活性高、杀伤范围广、提高免疫力、刺激骨髓造血、毒副作用小等免疫特性,因此CIK细胞被认为是新一代肿瘤过继性免疫治疗的首选方案[1-4]。但单独的CIK细胞治疗效果不明显、存在体外扩增困难和可能潜在致癌性等缺陷,那么如何解除肿瘤患者体内的免疫抑制状态,使CIK细胞免疫治疗在体内更好地发挥抗肿瘤的疗效,有待于进一步研究探索[5-8]。
纳米碳管独特的尺寸及形状效应赋予了其广泛的应用范围。近年来,SWCNT-COOH所引起的机体免疫效应和机制的研究逐渐引起学者的关注[9-12]。Dong等[13]在探讨碳纳米管诱导的肺纤维化病理发展的调控机制的研究中发现,碳纳米管能有效激活CD4+T细胞群体中的Th2型细胞,促进Th2型细胞因子(IL-4和IL-13)的释放。Xue等[14]研究显示SWCNT可能通过在纹状体中的氧化反应增强细胞外多巴胺来治疗甲基苯丙胺成瘾的作用。Pulskamp等[15]对碳纳米管是否诱导机体产生炎症应答进行了相关研究,实验结果表明碳纳米管在体外能诱导炎症因子的释放。而SWCNT-COOH对CIK细胞表型和功能影响方面的研究却鲜有报道。因此,本研究利用SWCNT-COOH探讨其对CIK细胞功能的影响,以期能为提高CIK细胞的杀伤效果提供一种新的思路,为肿瘤的临床免疫治疗提供有价值的参考。
1 材料与方法
1.1实验材料、试剂 SWCNT由中国科学院纳米中心提供;B16、H22和RM-1细胞由本实验室冻存;昆明鼠从河北医科大学动物所购买;RPMI Medium 1640 basic(1×)(Gibco);青链霉素混合液(北京索莱宝科技有限公司);TRYPSIN/EDTA(Wisent);胎牛血清(HyClone);Mouse Lymphocyte Separation Medium(深圳市达科为生物工程有限公司);IFN-γ、CD3、IL-2(Miltenyi Biotec);PHA(Sigma);Anti-Mouse CD3e FITC、Anti-Mouse CD4 PE、Anti-Mouse CD8a(B7-1)PE-Cyanine5、Anti-Mouse CD4 FITC、Anti-Mouse CD25 PE、Anti-Mouse CD127 APC(eBioscience);CellTiter 96 AQueous One Solution Cell Prolifera(Promega)。
1.2实验方法
1.2.1SWCNT的羧基化程序[16-18]0.1 g SWCNT和100 ml混酸(体积之比98% H2SO4:68% HNO3=3∶1)37℃超声2 h,将得到的黑色悬浮液加水稀释至250 ml,通过布氏漏斗用0.22 μmol/L滤膜过滤,反复冲洗至pH≥4.5,室温干燥备用。
称取1 g SWCNT在加入0.5 wt%胆酸钠表面活性剂的10 ml磷酸缓冲液(20 mmol/L,pH7.0)中溶解,超声2 h。300 g离心15 min并去除聚集度高的碳管,最终得到分散性较好的SWCNT-COOH分散液。紫外定量测定浓度,备用。
1.2.2细胞培养 小鼠肿瘤细胞系的培养:B16、H22和RM-1使用含10%FBS的1640培养基,在5% CO2、37℃条件下培养,取对数生长期的细胞用于实验。
脾脏淋巴细胞的分离与诱导:取体重20 g左右的昆明鼠,断颈处死,取脾脏,按照小鼠淋巴细胞分离液的厂家说明书的方法,制备脾脏淋巴细胞。将细胞密度调整为5×106个/ml,同时加入IFN-γ(50 ng/ml),24 h后加入CD3、IL-2和PHA(工作浓度分别为100 ng/ml、30 ng/ml和10 μg/ml),以后隔天补加等体积新鲜培养基,并添加IL-2(工作浓度30 ng/ml),以获得CIK细胞。
1.2.3流式细胞术分析免疫表型 六孔板每孔接种体外培养至第5天的CIK细胞5×106个,用不同浓度的SWCNT-COOH处理24 h。收获细胞后,用PBS漂洗,再以相应抗体避光孵育30 min,上机检测。
1.2.4MTS法测定杀伤效果 效靶比优化:96孔板每孔接种B16细胞5×103个,4 h后按个数比5∶1、10∶1、20∶1、40∶1和50∶1接种CIK与B16细胞,24和48 h测定杀伤效果。
细胞毒性检测:96孔板每孔接种小鼠肿瘤细胞5×103个,每组设定3个复孔。4 h后按最适效靶比20∶1加入经SWCNT-COOH处理24 h后的CIK细胞,并以单独的CIK和小鼠肿瘤细胞作为对照,24 h和48 h测定杀伤效果。细胞存活率(%)=(实验组A493值-实验空白组A493值)/(对照组A493值-对照空白组A493值)×100%。

2 结果
2.1CIK细胞诱导效果的检测 CIK细胞大部分呈圆形,少数细胞表面有突起,生长主要以团簇状增殖[19,20]。在细胞因子的作用下,脾脏淋巴细胞已被诱导成为CIK细胞(图1)。CD3是可以鉴定CIK细胞成熟度的标志物,因为其在抗肿瘤疗效中起重要作用。诱导培养5 d的CIK细胞处理组CD3+比例为96.0%,明显高于新分离的脾脏淋巴细胞处理组,表明该体系已成功将小鼠脾脏淋巴细胞诱导成为CIK细胞(图2)。
2.2SWCNT-COOH对CD4+、CD8+T细胞和Treg细胞比例的影响 CIK细胞的主要效应细胞为CD3+CD4+、CD3+CD8+表型的T 淋巴细胞和控制体内自身免疫反应性抑制肿瘤免疫应答的T细胞(Treg,CD4+CD25+CD127-)亚群[21,22]。结果显示,0.5 μg/ml SWCNT-COOH使CD4+T细胞比例(28.2%)显著升高(P<0.05);而更高浓度的碳纳米管的加入,效果相反,产生了抑制作用(图3)。CD8+T细胞比例变化与CD4+T细胞比例的变化趋势一致。随着SWCNT-COOH剂量的增加,Treg细胞比例呈逐渐降低的趋势(图4)。这说明SWCNT-COOH在低浓度下能够消除Treg细胞对CD4+、CD8+型T细胞的抑制作用,从而使CIK细胞能更好地发挥其作用。

图1 细胞因子诱导的脾脏淋巴细胞的生长状态Fig.1 Growth status of splenic lymphocyte induced by cytokineNote: Eyepiece ×10;objective ×20.A.1 d;B.2 d;C.3 d;D.4 d;E.5 d.

图2 细胞因子诱导的小鼠脾脏CD3+型T细胞的比例Fig.2 Ratio of CD3+ T cell in mouse splenic lymphocyte induced by cytokine
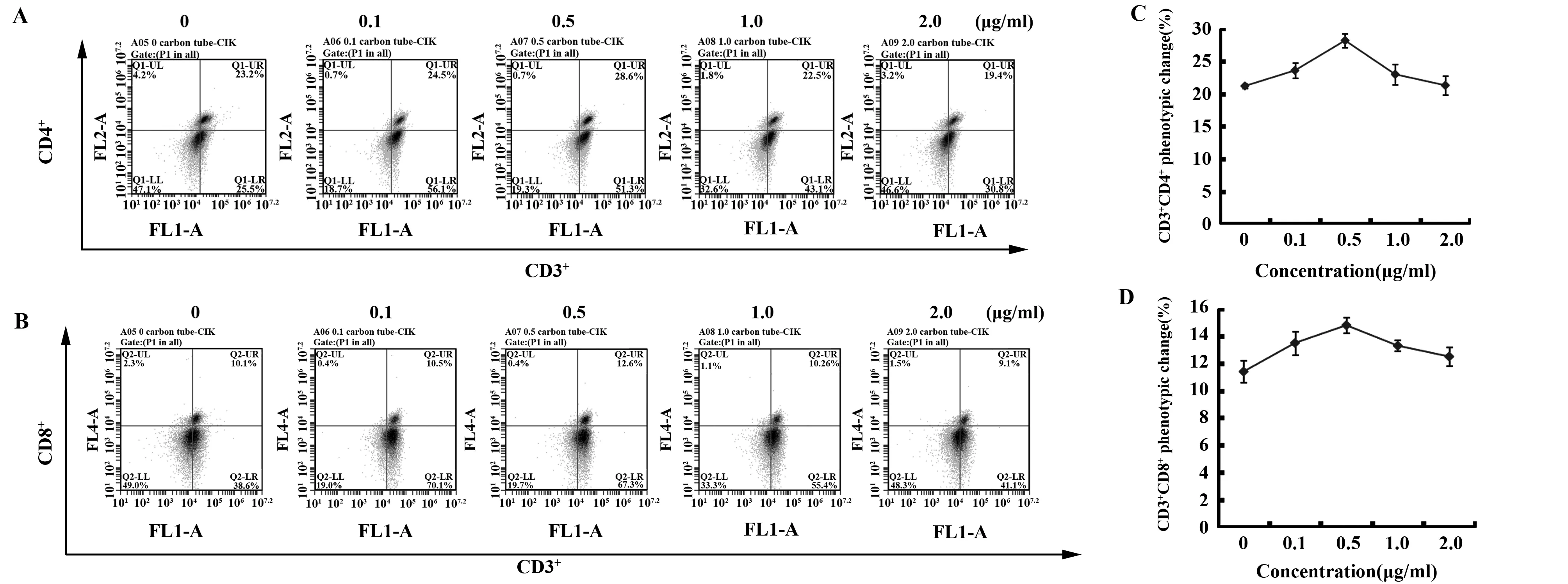
图3 SWCNT-COOH对CIK细胞CD3+CD4+、CD3+CD8+表型的影响Fig.3 Effect of carboxylated single-walled carbon nanotubes on phenotype of CD3+ CD4+ and CD3+ CD8+ in CIK cellsNote: A.CD3+ CD4+ phenotype in CIK cells;B.CD3+ CD8+ phenotype in CIK cells;C.Summary of data as in Fig.A;D.Summary of data as in Fig.B.
2.3CIK杀伤B16细胞效靶比的优化 如图5所示,随效靶比的增加,CIK对B16细胞的杀伤效果逐渐增强。值得注意的是,当效靶比为20∶1时,CIK对B16细胞的杀伤效果分别达到40.8%、43.8%,显著高于5∶1、10∶1时的杀伤效果(P<0.05),但更高的效靶比并不能使杀伤效果进一步显著增强。在考虑细胞用量及密度的前提下,确定CIK杀伤B16细胞的最优效靶比为20∶1。
2.4SWCNT-COOH对CIK细胞杀伤效果的影响 本实验用SWCNT-COOH处理培养至第5天的CIK细胞24 h,然后再去杀伤小鼠肿瘤细胞,此时的培养基中会存有浓度减半的SWCNT-COOH。因此,检测SWCNT-COOH对小鼠肿瘤细胞的毒性影响,以确定碳纳米管的安全用量。 结果表明, 随着SWCNT-COOH浓度的增加,对3种小鼠肿瘤细胞活力的抑制作用逐渐增强,存在浓度依赖效应(图6)。在SWCNT-COOH的浓度为1.0 μg/ml时,细胞抑制率均小于25%,故在以下实验中以2.0 μg/ml浓度为最高作用剂量,观察染毒细胞形态及其他各指标的变化。

图4 SWCNT-COOH对Treg细胞比例的影响Fig.4 Effect of carboxylated single-walled carbon nanotubes on ratio of Treg cellsNote: A.CD4+ phenotype in CIK cells;B.CD25+ CD127-phenotype in CIK cells;C.Summary of data as in Fig.A and Fig.B.The phenotype of Treg cells is CD4+CD25+CD127-.

图6 SWCNT-COOH对小鼠肿瘤细胞的毒性测定Fig.6 Determination of toxicity of carboxylated single-walled carbon nanotubes to mouse tumor cellsNote: A.Inhibition of B16 cell(%);B.Inhibition of H22 cell(%);C.Inhibition of RM-1 cell(%).

图5 CIK杀伤B16细胞效靶比的优化Fig.5 Optimization for effect target ratio of CIK killing B16 cells
为证实CIK细胞对小鼠肿瘤细胞的杀伤效果,本实验采用了3种小鼠肿瘤细胞系(B16、H22和RM-1细胞)进行验证。随着SWCNT-COOH浓度的升高,CIK细胞对B16、H22和RM-1细胞的抑制率均呈先升高后下降的趋势(图7)。当SWCNT-COOH的浓度为0.5 μg/ml时,CIK对3种小鼠肿瘤细胞的抑制率分别达到最大值,且显著高于对照组(P<0.05),而当SWCNT-COOH浓度提高到1 μg/ml和2 μg/ml时,CIK对3种肿瘤细胞的抑制率均出现下降趋势。我们推测碳纳米管在高浓度下,对CIK细胞产生一定的毒性作用,进而影响了其对肿瘤细胞的杀伤效果。这与SWCNT-COOH影响CIK细胞表型CD4+、CD8+T细胞和Treg细胞比例变化的实验结果基本一致,综上,SWCNT-COOH能通过改变T淋巴细胞的表型比例来影响CIK细胞的杀伤效果,主要表现在提高CD4+、CD8+T细胞比例和降低Treg细胞比例方面。
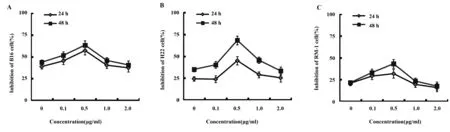
图7 SWCNT-COOH对CIK细胞杀伤效果的影响Fig.7 Effect of carboxylated single-walled carbon nanotubes on cytotoxicity of mouse tumor cellsNote: A.Inhibition of B16 cell(%);B.Inhibition of H22 cell(%);C.Inhibition of RM-1 cell(%).
3 讨论
碳纳米管在水溶液中难分散、易聚集,将其应用于生物体系中使它们丧失了纳米材料的许多优势,诸如尺寸效应、表面效应等,也给我们的实际应用带来很大困难。因此,对碳纳米管的功能化修饰尤显重要。通过化学修饰(表面添加官能团,如羧基化、氨基化、氢化、氟化等)和非共价修饰(表面结合溶解剂,不改变化学结构),可增强纳米材料的亲水性,使其更均匀稳定地分散在介质中[16,22]。本研究所采用的碳纳米管均经过羧基化修饰,分散性、生物相容性良好,能很好地应用于我们的试验体系中。
近年来,癌症免疫治疗的发展备受关注[23,24]。研究表明,CIK细胞对多种癌细胞株系均具有杀伤效应。更重要的是,CIK细胞能够迁移至肿瘤组织处,识别异常脉管系统和肿瘤细胞,启动免疫反应、杀伤肿瘤细胞[3]。虽然CIK 细胞的免疫疗法取得了一定成效,但寻求提高CIK 细胞治疗效果的有效方法依然是目前研究的热点[1-8,25]。本研究结果表明,经低浓度的SWCNT-COOH处理的CIK细胞,可以显著提高CD3+CD4+、CD3+CD8+型T细胞的比例(P<0.05),显著降低Treg细胞比例(P<0.05),能够增强CIK细胞对肿瘤细胞的杀伤力。利用纳米颗粒的独特性质开发纳米药物、纳米药物载体等新型治疗肿瘤的手段,极大拓展了纳米材料的应用领域,同时也为临床治疗恶性肿瘤提供了一种新的思路。
[1] Coulie PG,Van den Eynde BJ,van der Bruggen P,etal.Tumour antigens recognized by T lymphocytes:at the core of cancer immunotherapy [J].Nat Rev Cancer,2014,14:135-146.
[2] Sangiolo D.Cytokine induced killer cells as promis-ing immunotherapy for solid tumors [J].J Cancer,2011,2:363-368.
[3] Wei F,Rong XX,Xie RY,etal.Cytokine-induced killer cells efficiently kill stem-like cancer cells of nasopharyngeal carcinoma via the NKG2D-ligands recognition [J].Oncotarget,2015,6(33):35024-35039.
[4] Mu Y,Wang WH,Xie JP,etal.Efficacy and safety of cord blood-derived dendritic cells plus cytokine-induced killer cells combined with chemotherapy in the treatment of patients with advanced gastric cancer:a randomized Phase II study [J].Onco Targets Therapy,2016,9:4617-4627.
[5] Rong X,Wei F,Li A,etal.Effective activity of cytokine induced killer cells against hepatocel-lular carcinoma including tumor-initiating cells[J].Med Hypotheses,2015,84:159-161.
[6] 陈 娟,卢光琇.CIK细胞的生物特性和应用研究新进展[J].肿瘤药学,2014,4(3):166-171.
[7] 谢晓冬,丁震宇.CIK过继细胞免疫治疗恶性肿瘤技术临床应用现状[J].解放军医药杂志,2015,27(1):7-12.
[8] 叶真龙,金华君,钱其军.CIK细胞联合治疗恶性肿瘤的最新研究进展[J].解放军医药杂志,2015,27(1):25-30.
[9] Peer D,Karp JM,Hong S,etal.Nanocarriers as an emerging platform for cancertherapy[J].Nat Nanotechnol,2007,2:751-760.
[10] Pescatori M,Bedognetti D,Venturelli E,etal.Functionalized carbon nanotubes as immunomodulator systems[J].Biomaterials,2013,34:4395-4403.
[11] Dumortier H.When carbon nanotubes encounter the immune system:Desirable and undesirable effects[J].Advanced Drug Delivery Rev,2013,65:2120-2126.
[12] Dong J,Ma Q.Suppression of basal and carbon nanotubeinduced oxidative stress,inflammation and fibrosis in mouse lungs by Nrf2[J].Nanotoxicology,2016,10(6):699-709.
[13] Dong J,Ma Q.In vivo activation of a T helper 2-driven innate immune response in lung fibrosis induced by multi-walled carbon nanotubes[J].HHS Public Access,2016,90(9):2231-2248.
[14] Xue X,Yang JY,He Y,etal.Aggregated single-walled carbon nanotubes attenuate the behavioural and neurochemical effects of methampheta mine in mice[J].Nat Nanotechnol,2016,11(7):613-620.
[15] Pulskamp K,Diabate S,Krug H F.Carbon nanotubes show no sign of acute toxicity but induce intracallular reactive oxygen species in dependence on conta minants[J].Toxicol Letters,2007,168(1):58-74.
[16] Wang LR,Zhang LH,Xue X,etal.Enhanced dispersibility and cellular transmembrane capability of single-wall:carbon nanotubes by polycyclic organic compounds as chaperon[J].Nanoscale,2012,4:3983-3989.
[17] Xue X,Wang LR,Sato Y,etal.Single-walled carbon nanotubes alleviate autophagic/lysosomal defects in primary glia from a mouse model of Alzheimer′s disease[J].Nano Letters,2014,14:5110-5117.
[18] Ma XW,Zhang LH,Wang LR,etal.Single-walled carbon nanotubes alter cytochrome c electron transfer and modulate mitochondrial function[J].ACS Nano,2012,6(12):10486-10496.
[19] 张秋堂,福 丽,张绍林,等.PHA对CIK细胞形态、免疫表型的影响[J].郑州大学学报(医学版),2004,39(6):1032-1034.
[20] 牧 莹,王伟华,陈双峰,等.脐血来源DC-CIK对结肠癌细胞HT29的杀伤作用[J].山东医药,2016,56(40):13-16.
[21] 罗 虎,周向东.CIK细胞及其在肺癌治疗中的研究进展[J].中国肺癌杂志,2011,14(12):954-959.
[22] 林检生,赵婷婷,宋小萍,等.SWCNT-COOH的制备及其血液相容性研究[J].中国临床解剖学杂志,2015,33(1):51-54.
[23] Visvader JE,Lindeman GJ.Cancer stem cells:current status and evolving complexities[J].Cell Stem Cell,2012,10:717-728.
[24] Thorne SH,Negrin RS,Contag CH.Synergistic antitumor effects of immune cell-viral biotherapy[J].Science,2006,311:1780-1784.
[25] Schmidt TL,Negrin RS,Contag CH.A killer choice for cancer immunotherapy[J].Immunol Res,2014,58:300-306.
[收稿2017-04-26 修回2017-06-30]
(编辑 张晓舟)
EffectsonphenotypeandfunctionofmouseCIKcellstreatedwithcarboxylatedsingle-walledcarbonnanotubes
WANGYing-Ze,WANGQiao-Lan,DUChao,CAOQing-Qing,FUYu.
CollegeofBiologicalScienceandEngineering,HebeiUniversityofScienceandTechnology,Shijiazhuang050018,China
Objective:To investigate the effect on the phenotype and function of CIK cells induced from splenic lymphocyte in mice treated with carboxylated single-walled carbon nanotubes.MethodsCIK cells were treated with carboxylated single-walled carbon nanotubes at different concentrations.Cell growth status was observed using inverted fluorescence microscopy.The killing effect was determined by MTS method.Immunophenotype was analyzed by flow cytometry.ResultsWith the increase of the effect target ratio,the killer rate of CIK was gradually enhanced and the optimal effect target ratio was 20∶1.With the increase of the dose of carboxylated single-walled carbon nanotubes,the proportion of Treg cells decreased.When CIK cells were treated with 0.5 μg/ml carboxylated single-walled carbon nanotubes(CNTs),the proportion of CD3+CD4+and CD3+CD8+was significantly higher than that of the control group(P<0.05),and the killing effects of CIK anchieved best results to B16 cells,H22 cells and RM-1cells.ConclusionThe carboxylated single-walled carbon nanotubes enhanced the ability of CIK cells to kill tumor cells,significantly which provide has potential value in tumor drug development.
Carboxylated single-walled carbon nanotubes;CIK cells;Tumor immunity;Immunophenotype
10.3969/j.issn.1000-484X.2017.11.004
①本文受国家自然科学基金面上项目(81171455)、国家自然科学基金青年项目(31100715、81402305)、河北省自然科学基金青年项目(C2013208005)、河北省高等学校科学技术研究项目(QN2014043)和河北科技大学五大平台开放基金课题资助。
R730.51
A
1000-484X(2017)11-1616-06
王英泽(1977年-),男,博士,副教授,硕士生导师,主要从事纳米材料的免疫效应研究,E-mail:yingze-wang@126.com。
及指导教师:杜 朝(1969年-),男,博士,副教授,主要从事分子生物学相关研究,E-mail:duchao-pku@126.com。