我国药物临床试验监管博弈现状分析
2017-11-22胡正东方志华
胡正东 方志华
我国药物临床试验监管博弈现状分析
胡正东 方志华
近年来,我国药物临床试验由以前的监管不足转变为严格监管,但却出现监管效率低下、药企研发积极性降低等问题.文章在分析利益相关者的基础上,针对出现的新问题,构建了我国药物临床试验监管博弈模型,求出了其纳什均衡解,并对均衡结果进行深入分析,进而从4个方面提出了改善我国药物临床试验监管现状的政策建议,包括:调整上位法的处罚上限;提升单位监察成本的平均监察能力;增加药监部门常规监管的财政预算;提高药物临床试验投资方的纯收益.
药物临床试验;药物监管;博弈;利益相关者
药物临床试验是指任何在人体(病人或健康志愿者)进行的药物系统性研究,其目的是检验试验药物的安全性和有效性.为了确保药物临床试验过程和结果的科学可靠,药物临床试验各相关机构必须接受国家食品药品监督管理总局(China Food and Drug Administration, CFDA)等药监部门的监管.长期以来,我国药物临床试验的监管大多流于形式,虚构病例或偷换血样等造假现象[1]时有发生,以至于试验数据不被国际广泛认可[2].这种状况不仅损害了病人的健康权益,同时也潜在地威胁着每一个人的生命安全.鉴于情势的严峻性和后果的严重性,我国药物临床试验监管政策日渐严格,药物临床试验质量随之日益提高.
但随着近些年来药物临床试验严格监管政策的深入推进,又有一些新的问题出现.其中最明显的问题是"双低现象",即监管效率低下和新药研发积极性降低.监管效率低下方面,2015年药物临床试验申报积压高峰期多达22 000多件,尽管采取诸多措施,2016年12月仍积压8 200多件[3].新药研发积极性降低方面,2016年度CFDA的药审中心新接收药品注册申请仅有3 779件,较2015年度8 211件下降了54%[3].相关业内人士认为,只有大型药企仍可进行新药研发,小型药企应谋重组[4].显而易见,上述情形与国家"十一五"规划确定的重大新药创制战略部署的目标背道而驰,严重阻碍了我国医药事业的改革和发展.
从管理学的角度来看,这种"双低"现象是由药物临床试验监管过程中不同利益相关者之间的激烈博弈所导致的.那么,这些利益相关者有哪些?他们之间的利益博弈存在何种均衡? 这个均衡对药物临床试验监管又有何种对策提示?这些问题看似简单,实质上却非常复杂.通过文献梳理发现,国内外关于这方面的研究还相当少.本文针对上述问题,以博弈论为分析工具,力图在理论和实践方面为我国药物临床试验监管中存在的"双低"现象问题的解决做出有益探索.
1 我国药物临床试验监管的利益相关者分析
利益相关者是指任何能够影响组织目标的实现或者受组织目标实现影响的团体或个人.药物临床试验监管过程中涉及的利益相关者由监管方和被监管方共同组建.监管方主要是由国家药品监管机构、期刊杂志和行业协会等组成的社会公益共同体.被监管方主要是指由药物临床试验机构(我国多为三级甲等医院)和药物临床试验申办者(新药研发制药企业)组成的利益共同体.一方面,申办者是药物临床试验的投资者和受益者,其新药上市诉求能否被CFDA审批通过直接受药物临床试验机构的实验结果影响.另一方面,药物临床试验机构会获得相应申办者提供的实验经费、劳务费和其他费用.
药物临床试验过程中,监管方与被监管方之间存在着明显的利益冲突.就被监管方来说,药物临床试验申办者的目的是以尽可能少的资金投入使新药能顺利通过CFDA审批;试验机构的目的是在获取关于新药疗效和安全性数据的前提下尽可能增加收益.药物临床试验申办者和试验机构双方为实现各自目的,都有试图规避监管以获取最大利益的动机.就监管方来说,其目的与被监管方不同,主要在于确保实验数据的科学可靠,维护社会公众的生命健康权益.他们会对药物临床试验实施监管,如果存在试验过程操作不规范、受试者受损害和数据不可靠等情况,试验药物就有可能被延迟或禁止上市.有研究者[5]认为,药物临床试验过程中监管方与被监管方之间存在着明显的利益对抗和冲突,这是有一定道理的.但监管方与被监管方之间并不是绝对的对抗和冲突,而应该是处于一种矛盾与合作的动态均衡状态.因为如果是一种绝对性的对抗和冲突,被监管方就不可能接受监管方的监管,那么监管行为就不可能发生.美国弗吉尼亚大学著名管理学家爱德华.弗里曼指出,要做一个有效的战略家,就必须综合均衡各个利益相关者的利益要求[6].从经济学角度来看,监管方与被监管方利益诉求都具有其合理性,所以我们应该考虑药物临床试验过程中双方利益对抗中的均衡问题.
博弈论作为矛盾和合作的规范研究,是系统研究决策主体的行为发生直接相互作用情况下的决策以及这种决策均衡的理论[7],正因为如此,其为药物临床试验过程中监管方与被监管方之间的利益博弈提供了切实可行的分析工具.
2 我国药物临床试验监管博弈模型的构建与分析
2.1 相关假设
(1)把监管方设为A,被监管方设为B,他们在博弈中都是理性的.
(2)A的纯策略为"严格监管(S)"与"一般性监管(G)";B的纯策略为"大量作假 (L)"与"很少作假 (F)".
(3)A"严格监管"时的成本为cS,"一般性监管"时的成本为cG,并且cS>cG;B"大量作假"时的试验成本为tL,"很少作假"时的试验成本为tF,并且tL (4)药物临床试验完成后,A可获得社会公共收益合计为h,B可获得收益为r. (5)若A在监管过程中发现B作假,B将受到惩罚,其损失记为-u;并假设A将刚好获得这笔相应的收益,其值记为+u. 令h、 r、u在博弈双方不同的策略组合下分别取不同大小的值,由此可得我国药物临床试验博弈模型,如表 1所示. 表1 我国药物临床试验监管博弈矩阵 通过进一步对我国药物临床试验监管博弈矩阵分析得知: (1)当B很少作假时,不管A采取何种监管策略,B所受的处罚u往往都很小,试验成果为B所带来的正当收益r和A所带来的公共收益h都不受其影响.可近似认为u4=u2=0,r4=r2,h4=h2. (2)当B大量作假时,A采取的监管策略决定了对B处罚u的大小,也影响了试验结果为B所带来的收益r和为A所带来的公共收益h的大小.可近似认为:u1为较大值,u3=0;r1=0,r3为较大值,因为r3含不正当收益,所以r3>r4;h1=0,h3为较大负值,应计为-h3. 综上所述,我国药物临床试验监管博弈矩阵可简化为如下表2. 表2 我国药物临床试验监管博弈矩阵简表 我们假设r4> tF,否则B不会实施药物临床试验.如果-h3-cG≥u1-cS,或者说cS-cG≥u1+h3,即当B大量作假时,A"严格监管"相比较于"一般性监管"所增加的监察成本(cS-cG)不足以或刚好用获得处罚与挽回社会损失之和(u1+h3)来补偿时,通过划线法求出的监察博弈纯策略纳什均衡为(一般性监管,大量作假).这个均衡的存在既不利于医药行业的良性循环,更将严重损害社会公共利益,它并不具备现实合理性.所以,在药物临床试验监管实践过程中往往要求-h3-cG 然而,这样就不存在纯策略纳什均衡了,其逻辑轨迹如下:①如果A实施"一般性监管",B就会严格偏好于"大量作假";②一旦B"大量作假",A就会严格偏好于"严格监管";③当A实施"严格监管"时,B立即会严格偏好于很少作假;④然而一旦B很少作假时,A又会严格偏好于"一般性监管". 因此,A和B两个参与者的博弈必须存在混合策略纳什均衡,其计算过程如下. 令x和y分别表示A"严格监管"和B"大量作假"的概率,则A的预期支付为: B的预期支付为: 写出一阶条件并解之,得A最优反应式: 综上所述,A和B博弈的混合策略纳什均衡为: 2.4.1 基于监管方最优反应式分析 监管方最优反应式为: 当监管方实施"一般性监管",被监管方大量作假时被监管方的不合法纯收益r3-tL,与被监管方很少作假时的正当纯收益r4-tF之间的差距越小,与监管方实施"严格监管"被监管方大量作假时被监管方的负值纯收益-u1-tL的差距越大,那么监管方可以较小概率实施严格监管.反之,监管方应以较大概率实施严格监管.如果监管方希望节药监察成本而选择较小概率实施严格监管,那么应该尽可能增大r4-tF之值,使-u1-tL的值尽可能小.再根据前文r4>tF这一假设,则r4-tF>-u1-tL,即r3-tL在分子中影响力大于其在分母中的影响力,这样就应该使r3-tL的值尽可能小.由于被监管方大量作假时的成本tL主要由被监管方自己掌控,所以监管方应采取措施使r4-tF的值尽可能大,u1尽可能大, r3尽可能小. 2.4.2 基于被监管方最优反应式分析 2.4.3 基于双方混合策略纳什均衡分析 首先,上述监管方和被监管方混合策略纳什均衡两个分式的分母中都含有u1,当增大u1取值时,既有利于监管方以较小概率选择"严格监管",也有利于被监管方以较小概率选择"大量作假". 其次,增加监管方一般性监管的成本cG,有利于被监管方以较小概率选择"大量作假".同时也有利于监管方以较小概率选择"严格监管",因为增加监管方一般性监管成本cG,即使被监管方仍然选择"大量作假",其收益r3也能有效降低,一定程度上扼制了被监管方希望获得超额非法收益的侥幸心理.并且对监管方的纯负值收益-h3-cG不会产生较大影响,因为一般性监管成本cG的增加往往可以带来社会收益-h3的增大,即社会损失h3的减小. 再次,提高被监管方很少作假时的纯收益r4-tF,除前文提到的有利于监管方以较小概率选择严格监管,减小严格监管成本cS,还有利于降低被监管方投资获利的高风险性,进而引导其以较小概率实施"大量作假". 上文提示增大对作假被监管方的处罚力度对药物临床试验监管非常重要.然而,我国目前药物临床试验监管领域却存在一个明显的问题,即上位法(《药品管理法》)的处罚上限难以对被监管方形成有效威慑.虽然上位法(《药品管理法》)处罚上限设定的主观目的是避免监管机构权力寻租,其必要性非常明显,但其客观上却导致对被监管方的处罚力度不够、违法成本过低等不良后果.因此,在当前我国药物临床试验需要严格监管的时代境遇下,为了有效增大对被监管方作假的处罚力度,上位法(《药品管理法》)应考虑调整对被监管方作假的处罚上限. 我国药物临床试验监管过程中,不仅监管效率非常低下,监察成本也一直居高不下.上文对混合策略纳什均衡的分析结果提示,提升单位监察成本的平均监察能力非常重要.提升我国药物临床试验监管的单位监察成本的平均监察能力,就要从以下几个方面努力:第一,逐步淡化药物临床试验机构资格认定在监管体系中的比重,将监管重心转移到项目监管,建立专业的高素质监察队伍.第二,鼓励受试者及其家属、行业协会、期刊杂志、社会公众等群体参与到对药物临床试验的监管中来.第三,设立独立的伦理委员会机构,使其具有独立行使药物临床试验伦理审查的权力.第四,应采取措施充分发挥申办者对药物临床试验质量的监督和把关作用,因其对自己申请的药物临床试验应承担一切后果. 国家药监部门常规监管财政预算确保药物临床试验一般性监管的顺利进行.增加常规监管财政预算,实施较严格的常规监管策略,有利于从根本上提高我国药物临床试验的监管水平,也有利于降低后期监察申请专项资金或增加预算的概率.国家对药监部门常规监管财政预算划拨应采取较为宽松的政策. 国家应思考投资方降低成本和提高收益的相关举措.降低成本方面可以采取以下几个措施:第一,对社会有重大意义的创新型药物临床试验,国家应有相应扶持政策;第二,CFDA及其各级地方机构应注重对申办者和研究者的规范化、高水平专业技术化的培训和多角度的沟通;第三,简化审批流程.提高收益方面应做到以下几点:第一,减少行政干预,建设健康有序的医药市场环境;第二,密切跟踪新上市药品质量,撤销问题严重药品的上市资格,保护市场份额;第三,加强医药领域专利和知识产权的保护,注重相关政策的研究制定和布局实施. [1] 项铮.药品临床试验数据将受"第三方稽查"[N]. 科技日报,2013-10-24(011). [2] 中国药物临床试验现状和发展调研报告(摘要)[J]. 中国处方药,2009, 4 : 33-34. [3] 国家食品药品监督管理总局药品评审中心. 2016年度药品评审报告[EB/OL]. (2017-03-17) [2017-08-11].http://www.cde.org.cn/news.do?method=viewInfoCommon&id=313842, html. [4] 郑莹莹.大企业仍新药研发,小药企谋重组[N].医药经济报,2016-03-09(001). [5] 杨帆,王梦媛,陶田甜,等.药物临床试验中主要利益相关者的完全信息静态博弈分析[J].中国新药杂志,2016, 12 : 1391-1395. [6] (美) R. 爱德华.弗里曼(R. Edward Freeman)著.王彦华,梁豪译.战略管理利益相关者方法 a stakeholder approach[M].上海:上海译文出版社,2006 : 2, 55. [7] 肖条军.博弈论及其应用[M].上海:上海三联书店,2004 : 1, 73-74. Status analysis on regulation games of clinical drug tests in China Hu Zhengdong, Fang Zhihua. Fang Zhihua, Email: 335483077@qq.com Over recent years, the regulations on clinical drug tests have become strict from being weak in the past, but problems like low regulation efficiency, reduction of pharmaceutical enterprises' R&D enthusiasm, etc. arise at the same time. Based on the analysis on stakeholders and aiming at the new problems, the paper sets up a regulation game model of clinical drug tests in China,obtains its Nash equilibrium solution, conducts in-depth analysis on the equilibrium results, and then brings forward policy suggestions for improving the current situation of regulations on clinical drug tests in China; the suggestions include to adjust the upper punishment limit of higher-level law, improve the average supervision capability of unit supervision cost, and increase the financial budget of drug supervision authority's conventional regulations and the net income of clinical drug test investors. Clinical drug test; Drug regulation; Game; Stakeholder 10.3969/j.issn.2095-7432.2017.06.002 410208 长沙,湖南中医药大学(胡正东、方志华);桂林医学院(方志华) 方志华,Email: 335483077@qq. com 2017-08-30)2.2 模型构建


2.3 模型求解
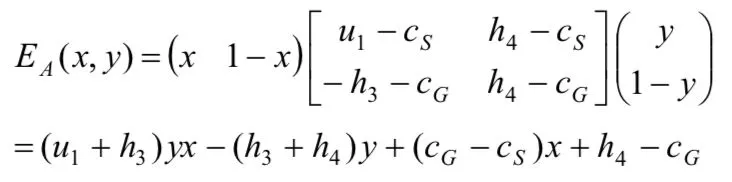
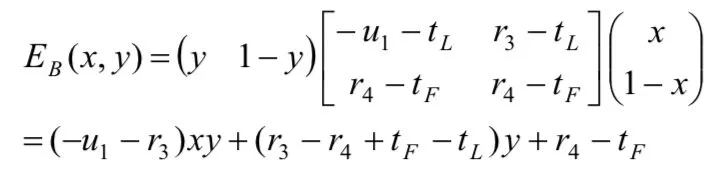
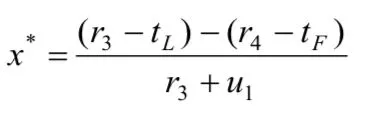
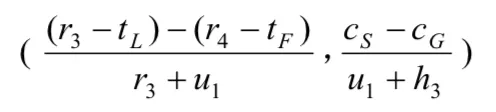
2.4 结果分析
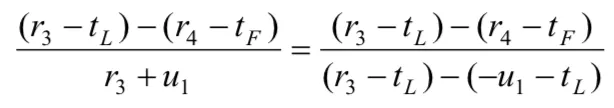
3 政策建议
3.1 调整上位法的处罚上限
3.2 提升单位监察成本的平均监察能力
3.3 增加药监部门常规监管的财政预算
3.4 提高药物临床试验投资方的纯收益
Hunan University of Chinese Medicine (Hu Zhengdong, Fang Zhihua), Changsha City 410208, China;Guilin Medical University (Fang Zhihua)
