细鳞鲑幼鱼n-3 HUFA需求量的研究
2017-11-21牛化欣胡宗福于建华李树国
常 杰,牛化欣,胡宗福,于建华,李树国
(内蒙古民族大学动物科学技术学院,内蒙古通辽 028000)
细鳞鲑幼鱼n-3HUFA需求量的研究
常 杰,牛化欣,胡宗福,于建华,李树国
(内蒙古民族大学动物科学技术学院,内蒙古通辽 028000)
为确定细鳞鲑(Brachymystaxlenok)n-3 HUFA需求量以减少鱼油使用和降低养殖成本,研究饲料中不同水平的n-3 HUFA对细鳞鲑的生长性能、体成分和肌肉脂肪酸组成的影响。以脱脂鱼粉、脱脂豆粕、明胶和酪蛋白为主要蛋白源,通过调节饲料中的猪油和浓缩油EPA、DHA水平,使饲料n-3HUFA的含量分别达到0.25%、0.50%、0.75%、1.00%、1.25%、1.50%,配制出6种等氮等能的试验饲料(D 0.25、D 0.50、D 0.75、D 1.00、D 1.25和D 1.50),分别投喂细鳞鲑幼鱼(60.0 g± 2.8 g) 84 d。结果显示:饲料中n-3HUFA不同水平对细鳞鲑成活率和饲料系数没有显著影响,但是显著影响了其末重(FW)、增重率(WGR)和特定生长率(SGR)。随着添加饲料中n-3HUFA水平的升高,FW、WGR和SGR有先升高后下降的趋势,且3者在饲料中n-3HUFA水平为0.75%均最大。随着饲料中 n-3 HUFA 水平的升高,鱼肌肉18∶1n-9 的含量逐渐下降,而 22∶6n-3的水平相应升高。结果表明,以WGR为评价指标时,用二次曲线模型推测出细鳞鲑对饲料n-3 HUFA的需求量约为0.69%。
细鳞鲑(Brachymystaxlenok);n-3 HUFA;脂肪酸组成;营养需求量
脂肪和脂肪酸是鱼类生长发育所必需的主要营养物质[1],其中的高不饱和脂肪酸(n-3 HUFA,主要包括二十碳五烯酸EPA和二十二碳六烯酸DHA)在鱼类营养生理、代谢、免疫和抗病力过程中发挥着重要的作用[2]。不同鱼类对n-3 HUFA的需求差别很大,一般对淡水鱼而言,亚油酸(LA)、亚麻酸(LNA)、二十碳五烯酸(EPA)和二十二碳六烯酸(DHA)是其必需脂肪酸(EFA)[3]。细鳞鲑(BrachymystaxlenokPallas)属鲑科细鳞鱼属,主要分布于我国黑龙江、吉林、辽宁、河北、内蒙古、新疆和秦岭一带河流中,是一种具有较高经济价值和营养价值的冷水性名贵鱼类,已列入中国国家二级重点保护水生野生动物[4-6]。近几年,我国各地如东北、秦岭、河北等地区已相继成功进行细鳞鲑人工繁殖和苗种培育,目前已在北方地区广泛养殖和人工放流[7,8],但在其养殖饲喂过程中,大多投喂虹鳟鱼饲料和小杂鱼,严重影响了细鳞鲑的健康生长。因此,配制营养全面、优质高效的配合饲料对其健康养殖具有重要的作用。在饲料中添加不同浓度的高不饱和脂肪酸(n-3 HUFA),研究HUFA水平对细鳞鲑生长、饲料利用、肌肉成分和脂肪酸组成的影响,确定细鳞鲑n-3 HUFA需求量,以期为选用适宜的脂肪源来配制生产细鳞鲑饲料提供理论依据。
1 材料与方法
1.1 实验饲料配制
以脱脂鱼粉、脱脂豆粕、明胶、酪蛋白为主要蛋白源,精制EPA油、精制DHA油和猪油为脂肪源,并调节EPA和DHA油和猪油含量,使饲料中n-3 HUFA的含量分别为0.25、0.50、0.75、1.00、1.25、1.50%,配制成6种等氮等能饲料。实验饲料配方和营养成分如表1所示。将各原料进行混合和粉碎,使其全部通过80目筛;微量成分采取逐级扩大法添加,与各原料混合均匀后,用DS32-II型双螺杆制粒机(济南赛信膨化机械有限公司)挤压成颗粒饲料(直径2.5 mm,长4.0 mm),50 ℃烘干后放入-20 ℃冰箱中保存备用。
1.2 饲养实验
养殖实验在内蒙古民族大学实验楼冷水鱼养殖室进行,室内设空调,使室内温度恒定在(15±2)℃,循环水养殖系统设有制冷机。实验鱼取自中国水产科学研究院黑龙江水产研究所实验基地(辽宁丹东凤城),室内驯化暂养12 d,选取规格均匀的细鳞鲑幼鱼270尾,平均体质量为(60.0 ± 2.8 )g,随机分成6个组,每组3个重复,每个重复15尾鱼,放养在水体为150 L循环水系统养殖桶内,系统水流速度为80~100 L/h。养殖用水为经曝气、消毒、制冷后的饮用自来水,水温(16±2) ℃,DO > 7.5 mg/L,氨氮浓度< 0.25 mg/L,pH值7.6±0.2,每3 d换水或补水1/3的量。养殖周期为84 d。每天投喂3次(8:00、13:30、18:30),每次饱食投喂。

表1 实验饲料配方及营养成分 Tab.1 Composition and nutrition levels of experimental diet %(dry weight)
1) 每千克饲料含有:VB125 mg,VB245 mg,VB620 mg,VB120.l mg,VK310 mg,肌醇800 mg,VB360 mg,烟酸200 mg,叶酸20 mg,生物素1.2 mg,VA 32 mg,VD36.7 mg,VC 2 150 mg,乙氧基喹啉150 mg,次粉16 480 mg。
2) 每千克饲料含有:NaF 2 mg,KI 8 mg,CoCl2·6H2O(1%) 50 mg,CuSO4·5H2O 10 mg,FeSO4· H2O 80 mg,ZnSO4· H2O 50 mg,MnSO4·H2O 60 mg,MgSO4·7H2O 1 200 mg,Ca (H2PO4)2·H2O 3 000 mg,NaCl 10 mg,沸石粉 5 530 mg。
1.3 采样及分析
实验结束停喂24 h后,用浓度为100 mg/L 的MS-222麻醉,对鱼计数、量体长和称重;每桶随机取5尾鱼解剖,分别剥离出各自肌肉,合并后放在标号的封口袋中,置于-20 ℃冰箱保存,备测肌肉常规成分和脂肪酸含量。
1.3.1 生长性能
成活率 = (Nt/N0)×100%;
增重率(WGR) =[(Wt-W0)/W0]×100%;
特定生长率(SGR) =[(lnWt- lnW0)×100%]/t;
饲料系数(FCR) =FI/(Wt-W0);
蛋白质效率(PER) =[(Wt-W0)/PI]×100
上述公式中Nt和N0分别代表试验初鱼总尾数和试验后鱼尾数,Wt和W0分别是鱼体末均湿重和初始均湿重,t为养殖天数,FI代表饲料摄食量,PI代表蛋白摄食量。
1.3.2 营养成分和脂肪酸测定
饲料和肌肉水分、粗蛋白、粗脂肪和粗灰分按国际标准 AOAC(1995)方法分析测定[9]。取部分已制备好的肌肉样品冷冻干燥后用于脂肪酸分析。脂肪酸:抽提总脂肪酸采用Folch等[10]的测定方法,分别用1 mol/L KOH-甲醇和0.5 mol/L硫酸甲醇溶液使脂肪酸甲酯化,再用正庚烷萃取脂肪酸甲酯。样品皂化甲酯化后,用Thermo ScientificTMTRACE 1310 气相色谱仪(Thermo Fisher Scientific,U.S.A)进行分析。
1.4 数据处理
结果以平均值±标准差(Mean ± SD)表示,数据处理与分析采用SPSS17.0分析软件进行ANOVA单因子方差分析和采用t检验进行显著性检验,采用Duncan’s法进行多重比较分析,以P<0.05作为差异显著性判断标准,同时采用二次回归曲线模型来确定细鳞鲑幼鱼对饲料中n-3 HUFA的需要量。
2 结果
2.1 饲料中n-3 HUFA水平对细鳞鲑生长性能、成活率和饲料利用的影响
饲料n-3 HUFA对细鳞鲑生长性能、成活率和饲料利用的影响见表2。细鳞鲑的末均质量(FW)、增重率(WGR)和特定生长率(SGR)均随n-3 HUFA水平的升高有先升高后降低的趋势。D 0.75组细鳞鲑FW显著高于D 0.25、D 1.25、D 1.50组,分别提高了7.54%、12.85%和14.88%,但与D 0.50和D 1.00组没有显著性差异。D 0.75组细鳞鲑WGR和SGR显著高于D 0.25、D 1.25和D 1.50组,WGR分别提高了13.73%和8.13%、22.70%和14.66%,32.45%和19.82%,但与其他各组没有显著性差异。饲料不同n-3 HUFA水平对细鳞鲑成活率、饲料系数和蛋白质效率没有显著影响。在饲料脂肪为18%水平下,通过饲料n-3 HUFA水平与细鳞鲑增重率之间的关系,采用二次曲线模型评价了细鳞鲑n-3 HUFA最适需求量为0.69%。以增重率为评价指标之间的关系,采用二次曲线模型拟合后得到细鳞鲑n-3 HUFA最适需求量为0.69%。

表2 饲料n-3 HUFA水平对细鳞鲑幼鱼生长、存活和饲料利用的影响Tab.2 Effect of dietary n-3 HUFA on the growth performance,survival and feed utilization of juvenile B.lenok

图1 饲料中n-3 HUFA水平对细鳞鲑增重率的影响Fig.1 Effect of dietary n-3 HUFA on weight gain rate of B.lenok
2.2 饲料中n-3 HUF水平对细鳞鲑肌肉常规成分的影响
如表3所示,细鳞鲑肌肉水分含量在73.87%~74.96%,粗蛋白含量在16.94%~17.85%,粗脂肪含量在3.17%~3.70%,灰分含量在1.33%~1.41%。各饲料n-3 HUF水平对细鳞鲑肌肉水分、粗蛋白、粗脂肪和灰分含量没有显著性影响。
2.3 饲料中n-3 HUF水平对细鳞鲑肌肉脂肪酸组成的影响
细鳞鲑肌肉脂肪酸含量较高的是C16∶0、C18∶1n-9、C18∶2n-6、C22∶6n-3、C18∶0、C18∶3n-3和C20∶5n-3。在表4细鳞鲑肌肉脂肪酸组成中,饲料n-3 HUFA水平对C16∶0、C18∶1n-9、C18∶3n-3、C20∶5n-3、C22∶6n-3、n-3 HUFA含量和DHA/EPA比值有显著性影响,而对其他脂肪酸含量没有显著性影响。随着饲料n-3 HUF水平的升高,肌肉中C20∶5n-3含量也在显著增加,而C22∶6n-3含量先升高至18.51%再降低。肌肉中n-3 HUFA含量在D1.25组达到最大,除D 1.50组外,显著高于其他各组,此外,饲料中n-3 HUFA含量与肌肉中n-3 HUFA含量存在二次曲线y=-10.793x2+28.928x+ 1.147 4,R2=0.981 2(图 2),表明随着饲料中n-3 HUFA含量升高,肌肉中n-3 HUFA含量逐渐升至最高,再降低。
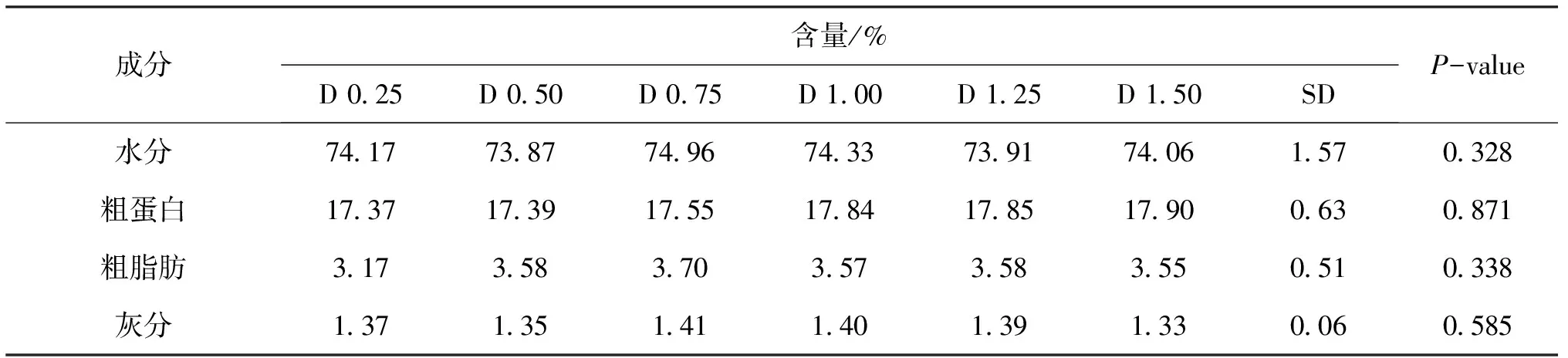
表3 饲料中n-3 HUFA水平对细鳞鲑肌肉营养成分的影响Tab.3 Effect of dietary n-3 HUFA on the muscle composition of B.lenok

表4 饲料n-3 HUFA水平对细鳞鲑肌肉脂肪酸组成的影响Tab.4 Effect of dietary n-3 HUFA on fatty acids composition of muscle in B.lenok

续表4

图2 饲料中n-3 HUFA水平与细鳞鲑肌肉中n-3 HUFA含量的关系Fig.2 Relationship between dietary n-3 HUFA levels and muscle n-3 HUFA content of B.lenok
3 讨论
3.1 细鳞鲑对n-3 HUFA需求量的特性
已有研究表明,鱼类对饲料中脂肪含量、脂肪种类及其比例要求不同,鱼类对脂肪酸尤其n-3 HUFA需求量也不同[11]。一般认为,淡水鱼的EFA有LA、LNA、EPA和DHA 4种,但对不同种类的淡水鱼来说,这4种EFA的添加效果却有差异[3]。本研究在饲料脂肪水平18%和DHA/EPA比例1.5的情况下,添加不同水平的n-3 HUFA,对细鳞鲑生长性能具有重要影响。在84 d的生长养殖实验中,不同含量的n-3 HUFA可提高细鳞鲑增重率和特定生长率,当饲料中 n-3 HUFA水平为0.75%(D 0.75组)时,细鳞鲑的FW、WGR和SGR最大,显著高于D 0.25组和D 1.50组,与其他各组间没有显著性差异。这说明 n-3 HUFA是细鳞鲑生长所必需的脂肪酸。以WGR为评价指标,通过二次曲线模型评估出了细鳞鲑n-3 HUFA的适宜需要量为0.69%。这与在马苏大马哈鱼(Oncorhynchusmasou)[12]、虹鳟(Oncorhynchusmykiss)[13]、陆封型大西洋鲑(Salmosalar)[14]等冷水性淡水鱼类中取得的结果相似,略低于黄鳍鲷(Sparusauratd)[15]、大菱鲆(Scophthalmusmaximus)[16]、军曹鱼(Rachycentroncanadum)[17]、黑鲷(Sparusmacrocephlus)[18]、斜带石斑鱼(Epinephluscoioides)[19]等一些海水鱼类。
生存环境(淡水、河口、海洋)可能是影响鱼类EFA需求差异的主要因素[20],如黄斑蓝子鱼(Siganuscanaliculatus)[21]、金钱鱼(Scatophagusargus)[22]。EFA在渗透调节中的作用机制揭示了这些营养素如何影响不同水生环境的鱼类[20]。也有研究表明陆封型淡水养殖大西洋鲑鱼对n-3 LC-PUFA需求低于在海水养殖中同类的需要[14]。本实验研究对象细鳞鲑是陆封型的一种鲑科鱼类,其EFA的需求及其脂肪酸合成能力可能与洄游性鲑科鱼类有区别。
饲料中过量的 n-3 HUFA 会抑制淡水鱼[23]和部分海水鱼的生长[24],在本实验中饲料中含0.69%的n-3 HUFA对细鳞鲑生长性能最好,超过该水平时则发现抑制了细鳞鲑的生长,这与在草鱼(Ctenopharyngodonidellus)[23]、星斑川鲽(Platichthysstellatus)[24]中的研究结果相似。适量的n-3 HUFA对大西洋鲑线粒体和肌肉组织氧化保护较好,过多会增加其机体的氧化损伤[25]。本研究表明,饲料中添加高含量的n-3 HUFA(>0.69%)影响了细鳞鲑的生长,其影响机理和机体代谢机制有待于进一步的研究。
3.2 饲料中n-3 HUF水平对细鳞鲑肌肉营养成分的影响
随饲料中n-3 HUFA含量的升高,鱼肌肉水分几乎没有变化,粗蛋白质含量略有逐渐增加的趋势,粗脂肪和灰分含量则呈现先升高后下降趋势,但各组之间并没有显著性差异。牙鲆肌肉中粗脂肪随着饲料中EPA和DHA的升高增加,但更高的EPA、DHA含量并没有进一步增加其肌肉的粗脂肪含量[26],与本实验结果一致。细鳞鲑粗脂肪含量随着饲料中n-3 HUFA含量的升高有先升高后下降的趋势,D 0.75组(0.75%)含量最高, 但与其他各组并没有产生显著差异。这说明饲料中的n-3 HUFA水平在一定范围内,对细鳞鲑肌肉粗脂肪含量的影响不显著。有大量研究表明,饲料n-3 HUFA水平对鱼机体的脂肪代谢产生一定的作用[27,28],而对细鳞鲑的影响机制有待进一步研究。
3.3 饲料中n-3 HUFA水平对细鳞鲑肌肉脂肪酸组成的影响
诸多研究表明,饲料中脂肪酸水平和组成对鱼体组织(如肝脏和肌肉)中脂肪酸组成有显著的影响[25,29]。在本实验中,饲料脂肪源以猪油为主体,添加精制EPA和DHA来调节饲料中n-3 HUFA的水平,因此饲料中脂肪酸组成及含量主要体现在猪油脂肪酸组成和EPA、DHA水平上,由于猪油作为主要饲料的脂肪源,饲料脂肪酸主要含有C16∶0、C18∶0、C18∶1n-9和C18∶2n-6。饲料对细鳞鲑肌肉C16∶0、C18∶1n-9和C18∶2n-6的影响较为显著,而对C18∶0影响不明显,表明肌肉中C18∶0含量较为稳定。饲料中饱和C16∶0、18∶0脂肪酸和单不饱和脂肪酸不仅可作为机体的能量物质,而且也是细胞膜磷脂的组成成分,一定程度上受饲料脂肪酸含量的影响[15]。本实验结果显示,随着投喂n-3 HUFA水平逐渐升高的饲料,可使细鳞鲑肌肉EPA和DHA的含量逐渐升高。这与在大西洋鲑[30]、虹鳟[31]、马苏大马哈鱼[13]和真鲷[16]的研究报道一致。同时,细鳞鲑肌肉中的EPA含量随着饲料中n-3 HUFA水平的升高而不断积累,而当饲料n-3 HUFA水平高于0.75%时,肌肉DHA水平保持在一个相对稳定的水平,这与朱庆国等[19]斜带石斑鱼幼鱼的研究一致,然而与刘兴旺等[8]的关于军曹鱼肌肉EPA积累的结果有些差异,其原因与饲料中EPA与DHA的比例及不同鱼类对EFA的需求和利用效能的不同所致。因此,细鳞鲑饲料中适宜的EFA种类(LA、LNA、EPA和DHA)及比例有待研究。从饲料中n-3 HUFA含量与肌肉中n-3 HUFA含量存在二次曲线y=-10.793x2+28.928x+1.1474,R2=0.9812关系来看,随着饲料中n-3 HUFA水平的升高,细鳞鲑肌肉n-3 HUFA的含量积累到一定的含量,并不再升高,这与肌肉中DHA的积累是一致的,并与EPA不同。同时,饲料中DHA/EPA比恒定约为1.5,随着饲料中n-3 HUFA含量的升高,肌肉中DHA/EPA比显著下降,其比值大于饲料中的比值,也大于本课题组测定的野生细鳞鲑肌肉中DHA/EPA比值(2.34)[6],但D1.5组与养殖的比值类似(4.94)[6]。因此,如何在细鳞鲑饲料中添加合理的EPA和DHA比例及其对饲料中n-3 HUFA需求和肌肉DHA/EPA的影响,也需进一步研究。
4 结论
饲料中添加适量的n-3 HUFA增加细鳞鲑的生长性能和改善肌肉的脂肪酸组成,尤其是EPA和DHA的含量。以增重率为评价指标,根据二次曲线模型,细鳞鲑对n-3 HUFA适宜需要量为0.69%。
[1]Tocher D R.Fatty acid requirements in ontogeny of marine and freshwater fish[J].Aquacult Res,2010,41(5):717-732.
[2]艾庆辉,严 晶,麦康森.鱼类脂肪与脂肪酸的转运及调控研究进展[J].水生生物学报,2016,40(4):859-868.
[3]彭祥和,徐 韬,林仕梅,等.不同水平亚麻籽油对罗非鱼肝功能和脂质代谢的影响[J].淡水渔业,2016,37(1):73-79.
[4]范兆廷.冷水性鱼类养殖学[M].北京:中国农业出版社,2008:42-43.
[5]常 杰.冷水鱼养殖与营养调控研究[M].北京:中国农业科学技术出版社,2015:58-63.
[6]祁保霞,高庆全,徐革锋,等.贝尔湖野生细鳞鱼和养殖细鳞鱼主要营养成分比较[J].营养学报,2016,38(4):414-416.
[7]牟振波,李永发,徐革锋,等.细鳞鱼全人工繁育技术的研究[J].水产学杂志,2013,26(1):15-18.
[8]常 杰,徐革锋,李树国,等.温度与盐度对细鳞鲑仔、稚鱼存活和生长的影响[J].水生态学杂志,2016,37(5):108-112.
[9]AOAC.Official Methods of Analysis 16th ed.[S].Arlington,1995.
[10]Folch J,Lees M,Sloane-Stanley G H S.A simple method for the isolation and purification of total lipids from animal tissues[J].J Biol Chem,1957,226(1):497-509.
[11]Committee on the Nutrient Requirement of Fish and Shrimp,National Research Council.Nutrient Requirements of fish and shrimp[M].National Academies Press,2011.
[12]Thongrod S,Takeuchi T,Satoh S,et al.Requirement of Yamane (Oncorhynchusmasou) for essential fatty acids[J].Nippon Suisan Gakkaishi,1990,56(8):1255-1262.
[13]Watanabe T,Ogino C,Koshiishi Y,et al.Requirement of rainbow trout for essential fatty acids[J].Bull Jap Soc Sci Fish,1974,40:497-497.
[14]Betancor M B,Olsen R E,Solstorm D,et al.Assessment of a land-locked Atlantic salmon (SalmosalarL.) population as a potential genetic resource with a focus on long-chain polyunsaturated fatty acid biosynthesis[J].Biochimica Biophysica Acta,2016,1861(3):227-238.
[15]Ibeas C,Cejas J,Gmez T,et al.Influence of dietary n- 3 highly unsaturated fatty acids levels on juvenile gilthead seabream growth and tissue fatty acid composition[J].Aquaculture,1996,142(14):221-235.
[16]Bell1 J G,Tocher D R,Farndale B M,et al.Sargent effects of essential fatty acid-deficient diets on growth,mortality,tissue histopathology and fatty acid compositions in juvenile turbot (Scophthalmusmaximus)[J].Fish Physiol Biochem,1999,20(3):263-277.
[17]刘兴旺,谭北平,麦康森,等.饲料中不同水平 n-3 HUFA 对军曹鱼生长及脂肪酸组成的影响[J].水生生物学报,2007,31(2):191-195.
[18]马晶晶,邵庆均,许梓荣,等.n-3 高不饱和脂肪酸对黑鲷幼鱼生长及脂肪代谢的影响[J].水产学报,2009,33 (4):639-649.
[19]朱庆国,林建斌,黄种持,等.饲料中不同水平 n-3 HUFA对斜带石斑鱼幼鱼生长及肌肉脂肪酸组成的影响[J].广东海洋大学学报,2012,32(4):20-27.
[20]Li Y Y,Monroig O,Zhang L,et al.Vertebrate fatty acyl desaturase with delta 4 activity[J].PNAS,2010,107(39):16840-16845.
[21]谢帝芝,徐树德,陈 芳,等.黄斑蓝子鱼 LC-PUFA 合成代谢与渗透压调节的关系研究[J].中国水产科学,2015,22(5):950-959.
[22]Xie D Z,Chen F,Lin S Y,et al.Long-chain polyunsaturated fatty acid biosynthesis in the euryhaline herbivorous teleost Scatophagus argus:Functional characterization,tissue expression and nutritional regulation of two fatty acyl elongases[J].Comp Biochem Physiol,Part B,2016,198(1):37-45.
[23]Ji H,Li J,Liu P.Regulation of growth performance and lipid metabolism by dietary n-3 highly unsaturated fatty acids in juvenile grass carp,Ctenopharyngodonidellus[J].Comp Biochem Physiol,Part B.2011,159(1):49-56.
[24]Lee S M,Lee J H,Kim K D.Effect of dietary essential fatty acids on growth,body composition and blood chemistry of juvenile starry flounder (Platichthysstellatus)[J].Aquaculture,2003,225(2):269-281.
[25]Ostbye T K,Kjr M A,Rora A M B,B,et al.High n-3 HUFA levels in the diet of Atlantic salmon affect muscle and mitochondrial membrane lipids and their susceptibility to oxidative stress[J].Aquacult Nut,2011,17(2):177-190.
[26]薛 敏,李爱杰,张显娟.牙鲆幼鱼对EPA 和DHA的营养需求[J].水产学报,2004,28(3):285-291.
[27]Thomassen M S,Rein D,Berge G M,et al.High dietary EPA does not inhibit Δ5 and Δ6 desaturases in Atlantic salmon (SalmosalarL.) fed rapeseed oil diets[J].Aquaculture,2012,360(1):78-85.
[28]Glencross B D.Exploring the nutritional demand for essential fatty acids by aquaculture species[J].Rev Aquacult,2009,1(2):71-124.
[29]牛化欣,雷霁霖,常 杰,等.野生和不同饲料养殖牙鲆营养品质比较[J].营养学报,2013,35(5):508-510.
[30]Ruyter B,Røsjø C,Einen O,et al.Essential fatty acids in Atlantic salmon:time course of changes in fatty acid composition of liver,blood and carcass induced by a diet deficient in n-3 and n-6 fatty acids[J].Aquacult Nut,2000,6(2):109-117.
[31]Codabaccus M B,Ng W K,Nichols P D,et al.Restoration of EPA and DHA in rainbow trout (Oncorhynchusmykiss) using a finishing fish oil diet at two different water temperatures[J].Food Chem,2013,141(1):236-244.
Requirementofdietaryn-3highlyunsaturatedfattyacidsforjuvenileBrachymystaxlenok
CHANG Jie,NIU Hua-xin,HU Zong-fu,YU Jian-hua,LI Shu-guo
(CollgeofAnimalScienceandTechnology,InnerMonglliaUniversityfortheNationalties,Tongliao,028000InnerMongllia,China))
In order to determine the demand of n-3 highly unsaturated fatty acids (HUFA),to reduce fish oil content in feed and reduce the cost of culture,the experiment was evaluated to the effects of different dietary levels n-3 HUFA on growth performance,body composition and fatty acid composition of muscle.The content of n-3HUFA in feed were 0.25,0.50,0.75,1.00 and 1.25% by adjusting the contents of EPA and DHA in feedstuff and defatted fishmeal,defatted soybean meal,gelatin and casein as the main protein source (D 0.25,D 0.50,D 0.75,D 1.00,D 1.25,and D 1.50).Fish were fed on six experimental feeds (60.0 ± 2.8 g) for 84 d.The results showed that n-3HUFA had no significant effect on survival rate and feed conversion rate (P>0.05),but had significant effects on final weight (FW),weight gain rate (WGR) and specific growth rate (SGR).FW,WGR and SGR increased firstly and then decreased with increasing dietary n-3HUFA levels,and maximum value of FW,WGR and SGR were obtain at D 0.75 group.The content of muscle 18∶1n-9 gradually decreased,while the level of 22∶6n-3 increased accordingly.In summary,WGR as an evaluation index,the requirement for n-3 HUFA of trout is about 0.69% of diet by the second-order polynomial regression analysis.
Brachymystaxlenok;n-3 HUFA;fatty acids composition;nutrient requirement
2017-04-29 ;
2017-08-29
国家自然科学基金(31260638,31360640和31460692);内蒙古自治区高等学校“青年科技英才资助计划”项目(NJYT-14-B13)
常 杰(1980-),女,教授,主要从事水产动物营养与免疫研究。E-mail:changjieouc@163.com
牛化欣。E-mail:niuhx@imun.edu.cn
S963.16
A
1000-6907-(2017)06-0081-07
