磁性壳聚糖微球吸附苹果汁有机酸的动力学及热力学特性
2017-11-20姜飞虹袁亚宏任婷婷孟掉琴岳田利
姜飞虹,袁亚宏,任婷婷,孟掉琴,岳田利※
磁性壳聚糖微球吸附苹果汁有机酸的动力学及热力学特性
姜飞虹1,2,3,袁亚宏1,2,3,任婷婷1,2,3,孟掉琴1,2,3,岳田利1,2,3※
(1. 西北农林科技大学食品科学与工程学院,杨凌 712100;2. 农业部农产品质量安全风险评估实验室(杨凌),杨凌 712100;3. 国家杨凌农业综合试验工程技术研究中心,杨凌 712100)
为充分利用中国丰富的苹果资源,开发多品类的苹果深加工产品,以磁性壳聚糖微球为吸附剂,通过磁分离技术,吸附获得苹果汁中的天然有机酸,并对其吸附过程进行研究。利用Lagergren准一级动力学方程、准二级动力学方程、Elovich方程及内扩散方程对吸附反应动力学过程进行拟合;利用Langmuir等温吸附模型、Freundlich等温吸附模型及Temkin等温吸附模型对吸附等温数据进行拟合,并对其吸附反应热力学特性进行分析。通过比较线性拟合方程的决定系数,发现磁性壳聚糖微球吸附苹果汁中有机酸的动力学过程更加符合Lagergren准二级动力学模型,吸附温度越高,吸附速率常数和初始吸附速率越大,但平衡吸附量越低。等温吸附过程更加符合Langmuir等温吸附模型,表明该吸附过程更趋向于单分子层的化学吸附。298 K时,有机酸的饱和吸附量可达到188.679 2 mg/g,表明磁性壳聚糖微球是苹果汁中有机酸的1种高效吸附剂。热力学参数Δ°<0,Δ°<0,Δ°>0,表明磁性壳聚糖微球对苹果汁有机酸的吸附过程为熵增加的可自发进行的放热过程。动力学及热力学结果为磁性壳聚糖微球吸附苹果汁有机酸的研究提供了理论基础与技术支持。
吸附;动力学;热力学;磁性壳聚糖微球;有机酸;苹果汁
0 引 言
中国是苹果生产大国,2014年中国苹果种植面积230.72万hm2,产量4 092.3万t,均居世界首位[1-2]。虽然中国苹果资源极为丰富,但仍以鲜食为主,加工量低,且主要产品为浓缩苹果汁,加工种类单一,附加值低。因此调整苹果产业结构、开发多品类的苹果深加工产品迫在眉睫。苹果中含有丰富的有机酸,部分苹果品种的总有机酸含量可达到10 mg/g以上,是有机酸的天然来源之一[3-5]。苹果汁中的有机酸具有多种保健价值,特别是L-苹果酸能够捕获自由基,具有抗氧化[6]、抗疲劳、保护肝脏和心脏、改善人体对药物的吸收等众多功能[7],可以用于食品和保健品的研发。因此,可以利用丰富的苹果资源来生产天然有机酸。但是传统有机酸提取方法,包括钙盐沉淀法[8]和有机试剂萃取法[9]等,均引入外加试剂,后续处理复杂,有机酸回收成本较高。
磁分离技术是近几年研究的热门技术,因为磁性材料具有良好的磁响应性能,使分离过程具有操作简单、分离快速、分离效率高、可反复利用等众多优点,被广泛应用于蛋白的吸附与固定、酶的分离纯化、重金属与染料去除、靶向药物、生物传感器以及免疫检测等方 面[10-11]。壳聚糖表面含有氨基和羟基等功能基团,是1种天然可降解的碱性多糖,价廉易得、无毒无害、生物相容性好。近些年来,已有研究利用壳聚糖来吸附分离水溶液中的有机酸,并取得一定研究进展[12-13]。但是壳聚糖在酸性溶液中易流失,与溶液分离困难,难以直接利用,因此考虑将壳聚糖与磁性材料相结合,制备磁性壳聚糖微球。既可以利用壳聚糖层的氨基基团来吸附苹果汁中的有机酸,又可以利用磁性材料的磁响应性在磁场作用下实现快速分离,提高分离效率,弥补一般传统分离方法的不足。近几年来,有学者利用球状壳聚糖树脂、磁性壳聚糖微球等相关吸附材料对茶多酚、苹果多酚、重金属、染料等物质分别进行了吸附动力学与热力学研究[14-17]。但目前利用磁性壳聚糖微球吸附苹果汁中有机酸并进行吸附性能研究还尚未见文献报道。因此,本文主要对苹果汁有机酸吸附过程的动力学和热力学进行分析,旨在为磁性壳聚糖微球吸附苹果汁有机酸的吸附体系研究提供理论基础与技术支持。
1 材料与方法
1.1 材料与试剂
浓缩苹果汁(可溶性固形物70%):购自陕西海升果业有限公司;壳聚糖(脱乙酰度90%以上):购自西安沃尔森生物技术有限公司;AB-8大孔脱色树脂:购自上海源叶生物技术有限公司。
六水合氯化铁(FeCl3·6H2O)、四水合硫酸亚铁(FeSO4·4H2O)、冰乙酸(99.7%)、质量浓度25%~28%的氨水、体积分数25%的戊二醛、体积分数33%的浓盐酸、氢氧化钠等,均为分析纯;液体石蜡、失水山梨糖醇酐单油酸酯(span-80)、石油醚(沸程60~90℃)、丙酮,均为化学纯。
1.2 仪器与设备
磁感应强度1T磁铁;SHZ-B型水浴恒温振荡器:上海博讯实业有限公司医疗设备厂;JB90-S数显恒速强力电动搅拌器:上海梅颖浦仪器仪表制造有限公司。
1.3 方法
1.3.1 Fe3O4纳米颗粒的制备
利用化学共沉淀法[18]制备Fe3O4磁核,其化学反应方程式如下
Fe2++2Fe3++8NH3·H2O→Fe3O4↓+8NH4++4H2O (1)
将0.05 mol/L的Fe2+溶液与0.1 mol/L Fe3+溶液混合,在氮气保护下强力搅拌,用氨水调节pH值至10,继续搅拌10 min。80 ℃水浴熟化30 min,冷却至室温,磁分离,并用蒸馏水反复洗涤至中性备用。
1.3.2 磁性壳聚糖微球的制备
配制200 mL质量分数4%的壳聚糖醋酸溶液,与Fe3O4磁流体按质量比4∶3混合均匀后,缓慢滴加到均匀的油相(40 mL span-80,300 mL液体石蜡,300 mL石油醚)中。于室温下以转速1 200 r/min搅拌30 min,先加入10 mL 6.25%的戊二醛溶液反应1 h,再加入 10 mL 6.25%的戊二醛溶液反应2 h。所得产物依次用石油醚、丙酮、0.1 mol/L氢氧化钠溶液、蒸馏水洗涤至中性,60 ℃烘干备用[19]。
1.3.3 苹果汁有机酸的测定
苹果汁有机酸含量的测定方法按照GB/T12456- 2008食品中总酸的测定[20]。
1.3.4 吸附动力学与热力学研究
1)吸附试验
准确称取0.500 0 g磁性壳聚糖微球,加入30 mL经浓缩苹果汁稀释至有机酸浓度2.32 mg/mL的澄清苹果汁,分别置于298、318、338 K 3个温度梯度下进行振荡吸附,计算不同吸附时间下的吸附量Q,并以Q对吸附时间作图,得到3种温度下的吸附动力学曲线。同时,将经过脱色处理的浓缩苹果汁分别稀释至不同的有机酸浓度:2.782 4、3.744 5、4.649 6、5.772 6、6.892 2、 7.814 1 mg/mL。取不同有机酸浓度的苹果汁各30 mL,加入0.500 0 g磁性壳聚糖微球,分别置于298、318、 338 K 3个温度梯度下振荡吸附90 min(根据吸附动力学曲线初步确定吸附平衡时间为70~80 min,振荡90 min可保证达到吸附平衡)。将达到吸附平衡后的样品放置在磁铁旁,在磁场作用下,具有磁性的壳聚糖微球吸附剂与苹果汁基质可以完全分离。定量吸取澄清液体,根据国标测定其剩余有机酸含量[20],计算得到有机酸平衡吸附量Q,并以Q对平衡时有机酸浓度C作图,得到3个温度下的吸附等温线。单位吸附量Q的计算公式如下
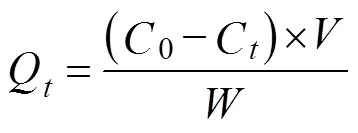
式中Q为时刻有机酸的单位吸附量,mg/g;0为苹果汁有机酸的初始浓度,mg/mL;C为时刻苹果汁有机酸的浓度,mg/mL;为苹果汁总体积,mL;为磁性壳聚糖微球的加入量,g。
2)吸附动力学模型
分别采用Lagergren准一级反应动力学方程、准二级反应动力学方程[15, 21-22]、Elovich方程[23]及内扩散方 程[24-26]对不同温度下的有机酸吸附动力学过程进行线性拟合分析。
Lagergren准一级反应动力学方程见公式(3)
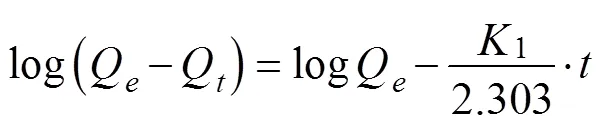
式中1为Lagergren准一级反应动力学速率常数,min-1;Q为有机酸的平衡吸附量,mg/g;为吸附时间,min。
Lagergren准二级反应动力学方程见公式(4)
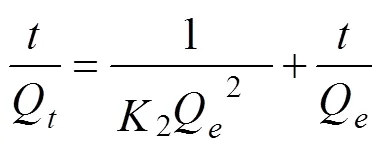
式中2为准二级反应动力学速率常数,g/(mg·min)。
Elovich方程见公式(5)
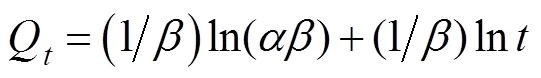
式中为初始吸附速率,mg/(g·min);为解吸常数, g/mg。
内部扩散模型见公式(6)
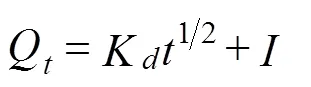
式中K为内部扩散速率常数,mg/(g·min1/2);代表边界层厚度对吸附过程影响的常数,mg/g。
3)等温吸附模型
为了进一步描述有机酸吸附过程中的吸附平衡关系,本研究选择Langmuir吸附等温方程[15,27]、Freundlich吸附等温方程[15,28]及Temkin吸附等温方程[29]对有机酸吸附过程进行模拟。
Langmuir吸附等温方程见公式(7)
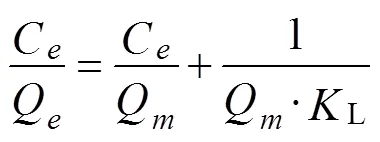
式中Q为理论单分子层饱和吸附量,mg/g;L为Langmuir常数,mL/mg;C为吸附平衡时有机酸浓度,mg/mL。
Langmuir等温线的另一个基本特征可以用分离系数L来描述。L的计算公式(8)[30]如下
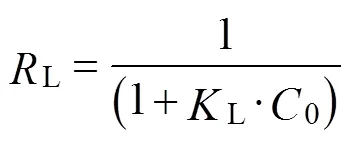
式中L为Langmuir吸附平衡常数,mL/mg。
Freundlich吸附等温方程见公式(9)
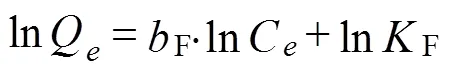
式中F表示Freundlich最大吸附量,mg/g;F表示Freundlich吸附平衡常数,g/(mg·min)。
Temkin吸附等温方程见公式(10)
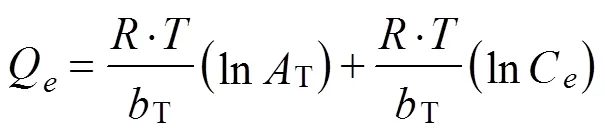
式中T表示吸附强度,J/mol;T为平衡结合常数,mg/mL;为理想气体常数,8.314 J/(mol·K);为绝对温度,K。
4)吸附热力学性质
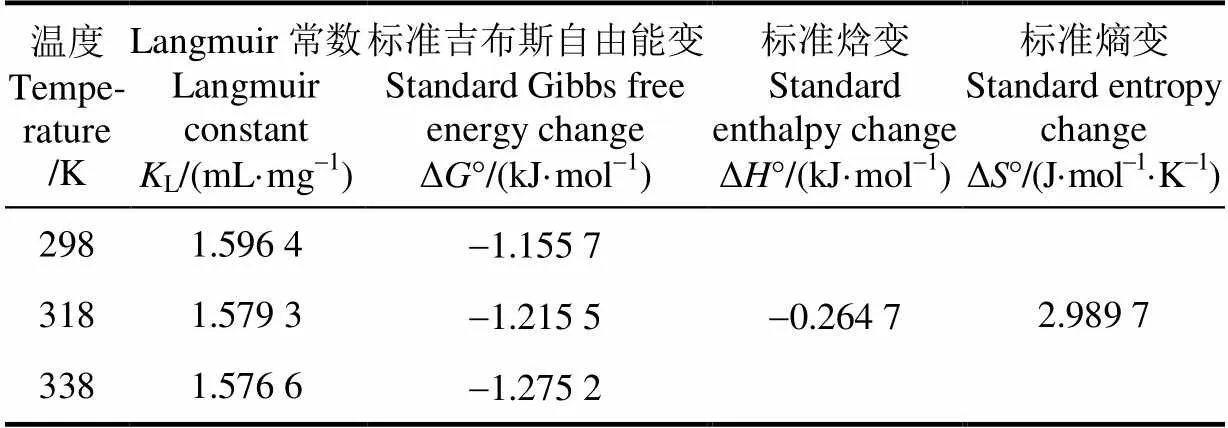
利用不同温度下获得的吸附等温线数据对吸附过程的热力学参数进行计算。根据范特霍夫方程(Van’t Hoff equation),朗缪尔常数(L)被用于确定标准吉布斯自由能变(Δ°)、标准焓变(Δ°)及标准熵变(Δ°),如公式(11)、(12)所示[15]。
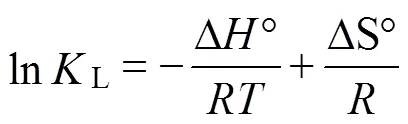
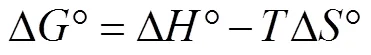
1.4 数据处理
采用IBM SPSS Statistics 21统计分析软件进行方差分析(ANOVA),邓肯氏多重域检验确定数据间的差异,显著水平设为0.05,每个样品重复测定3次,取其平均值。采用绘图软件Origin 9.0 进行相关图表的绘制以及模型的拟合。
2 结果与分析
2.1 吸附动力学结果与分析
2.1.1 吸附动力学曲线
不同温度下磁性壳聚糖微球吸附苹果汁有机酸的动力学曲线见图1。由图1可知,吸附温度越高,初始吸附速率越高,达到吸附平衡所需要的时间越短。在3个温度下,有机酸的吸附量(Q)随着吸附时间的增加呈上升趋势,前40 min吸附速率较高,70 min后,吸附量不再发生显著性变化(>0.05),从而达到吸附平衡。吸附初期,吸附剂表面与溶液中的有机酸存在较大的浓度差,导致吸附速率较高[31]。随着吸附的进行,浓度梯度减小,有效吸附位点数也减少,导致吸附速率变低,吸附逐渐达到平衡。同时,随着温度的升高,平衡吸附量逐渐减小(分别为112.374 9、105.558 4、100.424 9 mg/g),这也间接表明吸附过程为放热反应,升高温度不利于反应的进行。而根据有机酸吸附反应方程(13),有机酸在吸附过程中,解离出的酸根离子通过静电相互作用与质子化氨基形成了新的离子键,而键的形成一般是放热反应,这也解释了为什么温度升高,有机酸的吸附量反而会下降。

式中MCMs-NH2代表磁性壳聚糖微球;H+A-代表苹果汁中有机酸;A-代表有机酸根离子。
2.1.2 吸附动力学模型的构建
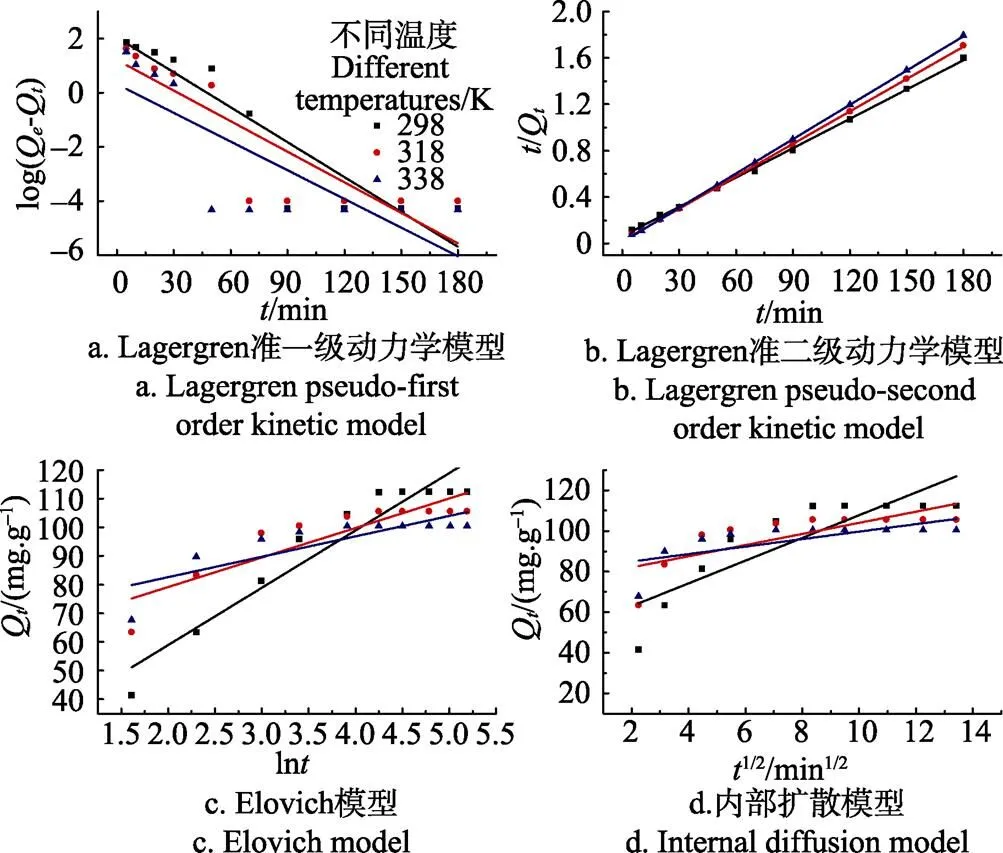
图2为磁性壳聚糖微球吸附苹果汁有机酸的4种动力学方程拟合曲线,数据拟合的相关参数见表1、表2。
注:Qe为有机酸平衡吸附量,mg·g-1;Qt为t时刻有机酸吸附量,mg·g-1;t为吸附时间,min。
由表1、表2可知,在4种吸附动力学模型中,Lagergren准二级反应动力学模型的决定系数(2)在各温度下均是最高的(2>0.998),并且根据该模型计算得到的平衡吸附量(Q,cal)与试验实际得到的平衡吸附量(Q,exp)最接近,表明磁性壳聚糖微球对苹果汁有机酸的吸附动力学过程更加符合Lagergren准二级吸附动力学模型,吸附速率由吸附剂表面未被占用的吸附空位数目的平方值决定,有机酸吸附过程受化学吸附控制,吸附过程涉及吸附剂与吸附质之间的电子共用或电子转 移[15,21,32];且吸附温度越高,吸附速率常数越大,平衡吸附量越低。
对于Elovich模型,代表初始反应速率常数,由表2可知,随着温度的升高而增大,表明提高温度可以提高初始反应速率。在温度298 K时,Elovich模型(2= 0.904 5)优于内部扩散模型(2=0.710 5),表明磁性壳聚糖微球对苹果汁有机酸的吸附更趋向于1个受反应速率和外部扩散综合控制的非均相过程,而不是简单的一级反应[33]。Weber和Morris提出的内部扩散模型[26],认为吸附过程包括溶质分子通过扩散作用从液相向固相颗粒表面运动,进入到颗粒内部孔隙中的过程,内部扩散阻力将会直接影响吸附性能[24-25]。根据内部扩散模型,如果内部扩散参与了吸附过程,那么Q-1/2的拟合结果应该是线型的;如果该拟合线过原点,那么颗粒内扩散是吸附过程的限速步骤[23,34]。图2d显示3个温度下的拟合曲线均未经过原点,表明磁性壳聚糖微球对苹果汁有机酸的吸附过程并不是主要由内部扩散步骤控制。
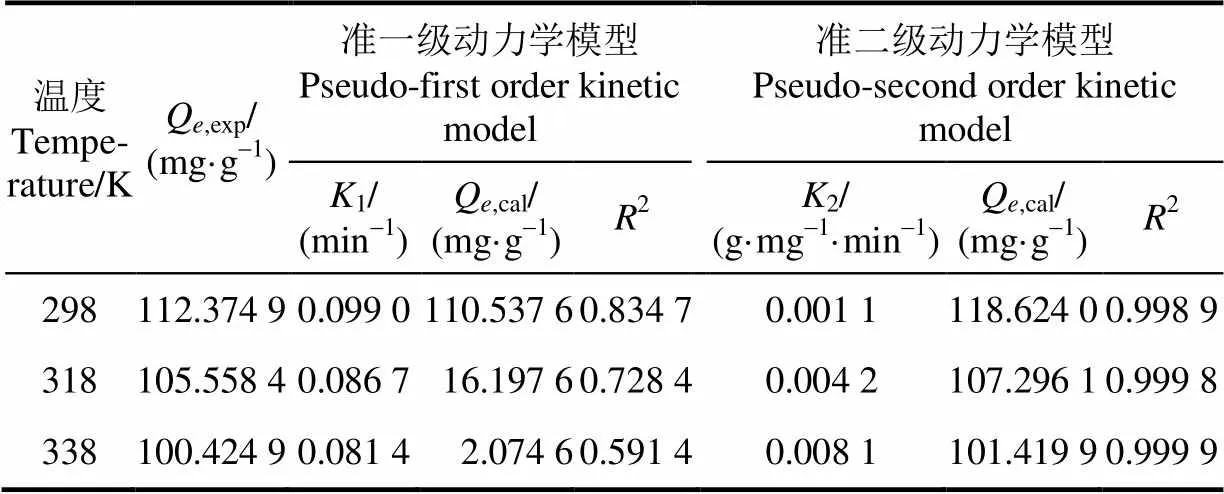
表1 Lagergren反应动力学模型基本参数及相关系数
注:Q,exp为试验实际得到的有机酸平衡吸附量,mg·g-1;Q,cal为模型计算出的有机酸平衡吸附量,mg·g-1;1为Lagergren准一级反应动力学速率常数,min-1;2为Lagergren准二级反应动力学速率常数,g·mg-1·min-1;2为模型决定系数。
Note:Q,expis experimental adsorption capacity of magnetic chitosan microspheres at equilibrium, mg/g;Q,calis calculated adsorption capacity of magnetic chitosan microspheres at equilibrium, mg·g-1;1is rate constant for Lagergren pseudo-first order kinetic model, min-1;2is Lagergren pseudo-second order kinetic model, g·mg-1·min-1;2represents coefficient of determination.
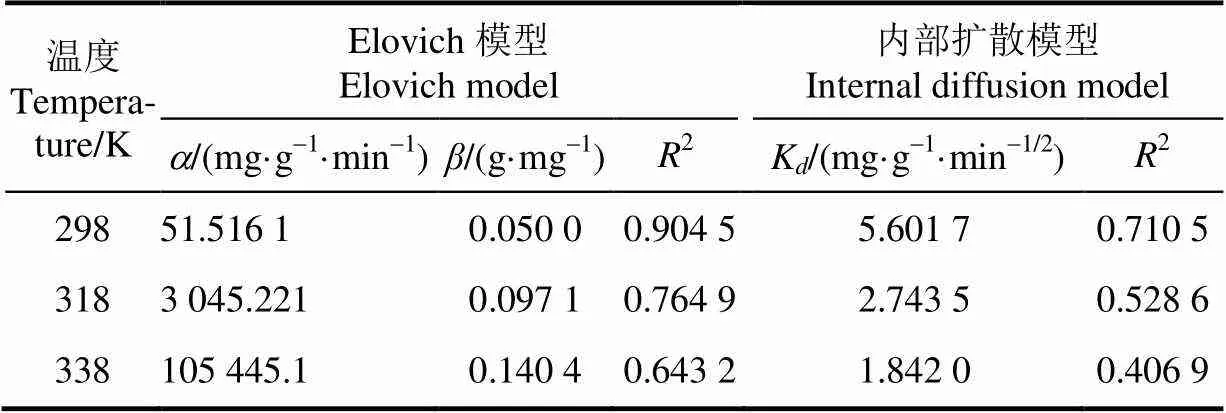
表2 Elovich模型和内部扩散模型基本参数及相关系数
注:为初始吸附速率,mg·g-1·min-1;为解吸常数,g·mg-1;K为内部扩散速率常数,mg·g-1·min-1/2。
Note:is initial absorbing rate, mg·g-1·min-1;is desorption rate constant, g·mg-1;Kis internal diffusion rate constant, mg·g-1·min-1/2.
2.2 吸附热力学结果与分析
2.2.1 吸附等温线
利用磁性壳聚糖微球吸附不同浓度的苹果汁有机酸,所得吸附等温线见图3。由图3可知,在3个不同温度(298、318、338 K)下,随着有机酸平衡浓度(C)的增大,平衡吸附量(Q)均呈增加趋势。但当浓度增大到一定程度后,磁性壳聚糖微球表面有限的吸附位点成为了吸附过程的限制因素,使得吸附量不再随着有机酸平衡浓度的增大而增大。3个温度下,平衡吸附量(Q)的大小关系为 298 K>318 K>338 K,即温度越高,平衡吸附量反而降低,这也与吸附动力学曲线的结果相一致,间接证明该吸附过程为放热反应。
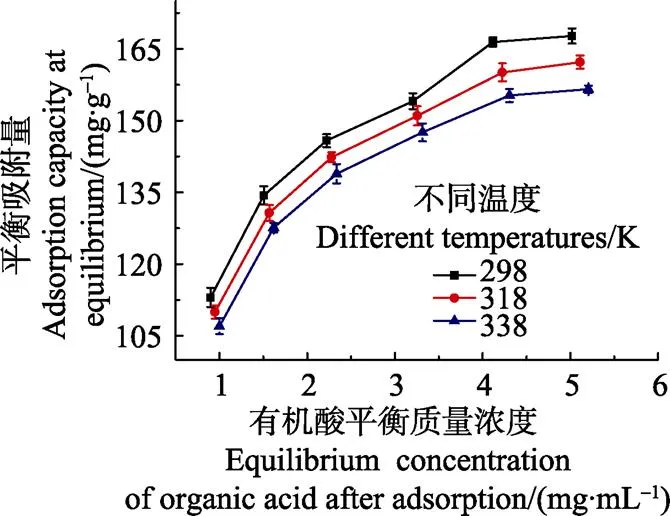
图3 不同温度下的吸附等温线
2.2.2 等温吸附模型的构建
将磁性壳聚糖微球对苹果汁有机酸的等温吸附数据分别用Langmuir吸附等温方程[15]、Freundlich吸附等温方程[15]、Temkin吸附等温方程[29]进行拟合,拟合结果见图4a、4b、4c;分别根据拟合方程的斜率和截距,计算各模型的等温吸附常数,结果见表3;同时可以根据Langmuir吸附等温模型的吸附平衡常数L来计算分离系数L,结果见图4d。
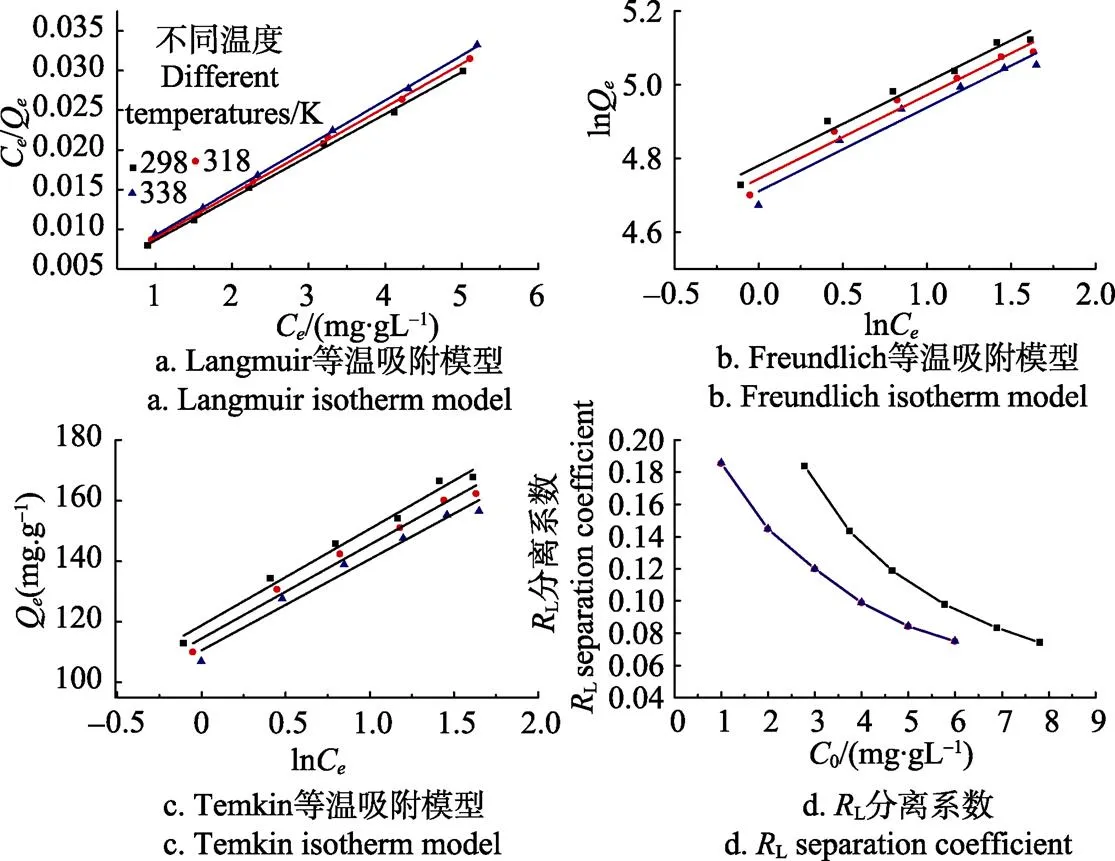
注:Ce是吸附平衡时有机酸浓度,mg·mL-1;C0为初始有机酸浓度,mg·mL-1;RL为分离系数。
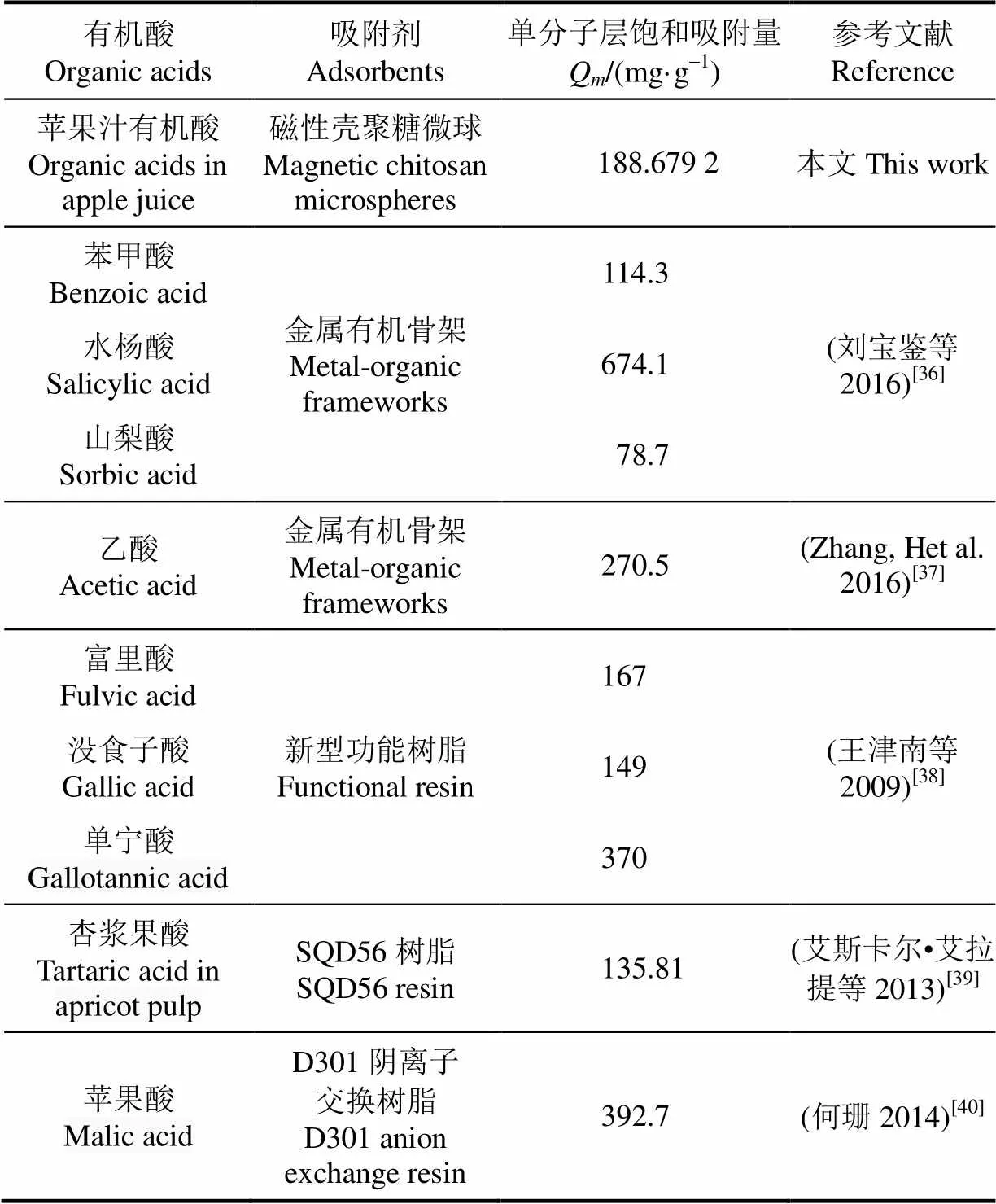
对于Langmuir模型,L是衡量磁性壳聚糖微球-有机酸复合物稳定性的1个重要参数[29]。由表3可知,Langmuir模型的吸附平衡常数L随着温度的升高而降低,饱和吸附量Q也逐渐下降,说明升高温度不利于微球对有机酸的吸附。根据L计算得到的分离系数L值可以用来表示吸附过程进行的难易程度(L>1:不宜;L=1:线性;0<L<1:较宜;L=0,不可逆)[30]。由图4d可知,L值均在0~1范围之内,表明磁性壳聚糖微球对苹果汁有机酸的吸附作用较易进行。并且318 K和338 K两个温度下的分离系数曲线基本重合,表明磁性壳聚糖微球对有机酸的吸附能力在超过318 K时,受温度的影响变化不大。对于Freundlich模型,F值也可以用来表示吸附发生的难易程度(F>1:不易;0 表3 磁性壳聚糖微球对苹果汁有机酸的等温吸附常数 注:L为Langmuir常数,mL·mg-1;为单分子层饱和吸附量,mg·g-1;F为Freundlich最大吸附量,mg·g-1;F为Freundlich吸附平衡常数,g·mg-1·min-1;T为平衡结合常数,mg·mL-1;T表示吸附强度,J·mol-1。 Note:is Langmuir constant, mL·mg-1;is monolayer saturation adsorption capacity, mg·g-1;Fis Freundlich maximal adsorption capacity, mg·g-1;Fis Freundlich adsorption equilibrium constant, g·mg-1·min-1;Tis equilibrium association constant, mg·mL-1;Tis adsorption intensity, J·mol-1. 本研究中通过Langmuir等温吸附模型计算获得磁性壳聚糖微球对苹果汁有机酸的最大吸附量(Q)为188.679 2 mg/g,表明磁性壳聚糖微球作为1种磁性吸附材料对苹果汁中的有机酸具有较高的吸附量。目前有机酸吸附材料的研究主要集中在功能树脂以及金属有机骨架等方面。表4是不同种类吸附剂对单一有机酸及杏浆果酸单分子层饱和吸附量(Q)的比较结果[35-40]。由表4可知,磁性壳聚糖微球对苹果汁有机酸的吸附量大大高于SQD56树脂对杏浆中有机酸的吸附量。金属有机酸骨架与功能型树脂对不同种类有机酸的吸附能力并不相同,吸附量有高有低。除金属有机骨架对水杨酸、功能型树脂对单宁酸以及D301离子交换树脂对苹果酸的最大饱和吸附量大于磁性壳聚糖微球的吸附量外,这几种吸附剂对其它几种单一有机酸的吸附量均低于磁性壳聚糖微球。值得注意的是,磁性壳聚糖微球吸附剂是由Fe3O4磁性物质和壳聚糖外壳2部分共同组成,其中用于有机酸吸附的壳聚糖只占磁性微球总质量的1部分。磁性壳聚糖微球对苹果汁有机酸具有较高的吸附量是因为在微球表面的氨基形成具有特定结构的吸附位点,而这种结构导致了磁性微球表面几乎所有的空闲位点都是可用的。此外,磁性壳聚糖微球可以在外加磁场作用下,快速从果汁溶液中分离,并且可以反复使用,是1种针对果汁中有机酸吸附的环保经济型吸附剂。 2.2.3 吸附热力学性质 根据公式(11)、公式(12)计算得出的Δ°、Δ°及Δ°值如表5所示。由表5可知,在不同温度下,吸附过程的标准吉布斯自由能变均为负(Δ°<0),表明吸附过程可以自发进行,且标准吉布斯自由能越小自发程度越大[14]。同时,吸附过程标准焓变小于零(Δ°<0),表明磁性壳聚糖微球对苹果汁有机酸的吸附是放热过程,升高温度不利于吸附的进行[41],这与等温吸附数据拟合结果所得参数L、F值变化反映的结果相一致。吸附过程的标准熵变为正值(Δ°>0),说明磁性壳聚糖微球对苹果汁有机酸的吸附是熵推动过程,吸附过程中固液界面的混乱度增大[30,34,42]。 表4 不同种类吸附剂对有机酸的单分子层饱和吸附量(Qm)比较 表5 磁性壳聚糖微球对苹果汁有机酸的吸附热力学参数 1)不同温度(298、318、338 K)下,随着吸附时间的延长,磁性壳聚糖微球对苹果汁中有机酸的吸附量呈现上升趋势,且在前40 min吸附速率较快,在70 min时基本达到了吸附平衡。同时,研究结果表明:吸附温度较低时,吸附效果较好,3个温度下的平衡吸附量分别为112.374 9、105.558 4、100.424 9 mg/g。 2)不同温度(298、318、338 K)下,磁性壳聚糖微球吸附苹果汁中有机酸的反应动力学过程更加符合Lagergren准二级反应动力学方程(决定系数2>0.998)。相对内部扩散模型,Elovich模型具有更高的相关性,表明磁性壳聚糖微球吸附苹果汁有机酸的过程是由反应速率和外部扩散等共同控制的综合过程。 3)不同温度(298、318、338 K)下,Langmuir等温吸附模型(决定系数2>0.998)能更好的对等温吸附数据进行拟合,说明磁性壳聚糖微球对有机酸的吸附是基于单分子层的化学吸附,298 K时,微球的饱和吸附量可以达到188.679 2 mg/g。由吸附热力学结果可知,Δ°<0,Δ°<0,表明该吸附过程是可以自发进行的放热过程,温度的增加不利于吸附反应的进行;Δ°>0,表明该吸附反应是熵推动过程,吸附过程中固液界面的混乱度增大。 [1] 中华人民共和国农业部. 中国农业统计资料[M]. 北京:中国农业出版社,2015. PRC Agriculture Ministry. China Agriculture Statistical Report[M]. Beijing: China Agriculture Press, 2015. (in Chinese with English abstract) [2] 中华人民共和国国家统计局. 中国统计年鉴-2015[M]. 北京:中国统计出版社,2015. National Statistics Bureau. China Statistical Yearbook[M]. Beijing: China Statistic Press, 2015. (in Chinese with English abstract) [3] 冯娟,任小林,田建文. 不同产地富士苹果多酚、可溶性糖及有机酸的对比研究[J]. 食品科学,2013,34(24): 125-130. Feng Juan, Ren Xiaolin, Tian Jianwen. Comparative contents of polyphenols, soluble sugars and organic acids in fuji apples from different growing regions[J]. Food Science, 2013, 34(24): 125-130. (in Chinese with English abstract) [4] 梁俊,郭燕,刘玉莲,等. 不同品种苹果果实中糖酸组成与含量分析[J]. 西北农林科技大学学报,2011,39(10):163-170. Liang Jun, Guo Yan, Liu Yulian, et al. Analysis of contents and constituents of sugar and organic acid in different apple cultivars[J]. Journal of Northwest A&F Univertisy, 2011, 39(10): 163-170. (in Chinese with English abstract) [5] 郑丽静. 山东苹果中可溶性糖、有机酸的研究[D]. 北京:中国农业科学院,2015. Zheng Lijing. Research on Characteristics of Sugar-acid Compositionsand Their Relationship with Taste in Apple Fruits[D]. Beijing: Chinese Academy of Agricultural Sciences, 2015. (in Chinese with English abstract) [6] 张菊梅,吴清平. L-苹果酸的生理功能及应用前景[J]. 微生物学通报,1997,24(2):116-117. Zhang Jumei, Wu Qingping. The physiological functions of L-malic acid and application prospects[J]. Journal of Microbiology, 1997, 24(2): 116-117. (in Chinese with English abstract) [7] 吴军林,吴清平,张菊梅,等. L-苹果酸的生物学功能研究新进展[J]. 食品工业,2015,36(9):225-228. Wu Junlin, Wu Qingping, Zhang Jumei, et al. New studies and progress of biological function of L-malate[J]. The Food Industry, 2015, 36(9): 225-228. (in Chinese with English abstract) [8] Heding L G, Gupta J K. Improvement of conditions for precipitation of citric acid from fermentation mash[J]. Biotechnology and Bioengineering, 1975, 17(9): 1363-1364. [9] 庞荣丽,方金豹,郭琳琳,等. 水果果实中主要有机酸提取条件的优化[J]. 中国农业科学,2014,(13):2625-2633. Pang Rongli, Fang Jinbao, Guo Linlin, et al. Extraction conditions optimization of main organic acids from fruits[J]. Scientia Agricultura Sinica, 2014, (13): 2625-2633. (in Chinese with English abstract) [10] Liang Yuanyuan, Zhang Liming, Li Wei, et al. Polysaccharide-modified iron oxide nanoparticles as an effective magnetic affinity adsorbent for bovine serum albumin[J]. Colloid and Polymer Science, 2007, 285(11): 1193-1199. [11] Liu Xianqiao, Xing Jianmin, Guan Yueping, et al. Synthesis of amino-silane modified superparamagnetic silica supports and their use for protein immobilization[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2004, 238(1): 127-131. [12] 邢东阳. 交联壳聚糖树脂吸附低浓度有机酸的行为[D]. 广州:华南师范大学,2005. Xing Dongyang. The Studies on Adsoroption Behaviors of Low Concentration Organic Acids on Crosslinked Chitosan Resin[D]. Guangzhou: South China Normal University, 2005. (in Chinese with English abstract) [13] 夏彩芬. 静态吸附法研究交联壳聚糖树脂对有机酸的吸附热力学行为[D]. 广州:华南师范大学,2005. Xia Caifen. Study on Adsorption and Thermodynamics Behavior of Organic Acid onto Crosslinked Chitosan Resin by Static Adsorptive Method[D]. Guangzhou: South China Normal University, 2005. (in Chinese with English abstract) [14] 袁亚宏,蔡露阳,岳田利,等. 磁性壳聚糖微球吸附苹果渣多酚的动力学及热力学分析[J]. 农业工程学报,2012,28(16):264-269. Yuan Yahong, Cai Luyang, Yue Tianli, et al. Kinetics and thermodynamics analysis of apple polyphenols adsorption by aminatedmagnetic chitosan microspheres[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2012, 28(16): 264-269. (in Chinese with English abstract) [15] Chen C Y, Chang J C, Chen A H. Competitive biosorption of azo dyes from aqueous solution on the templated crosslinked-chitosan nanoparticles[J]. Journal of Hazardous Materials, 2011, 185(1): 430-441. [16] Chen A H, Liu S C, Chen C Y, et al. Comparative adsorption of Cu(II), Zn(II), and Pb(II) ions in aqueous solution on the crosslinked chitosan with epichlorohydrin[J]. Journal of Hazardous Materials, 2008, 154(2): 184-191. [17] 李海燕,汪东风,Siaka D,等. 球状壳聚糖树脂对茶多酚的吸附热力学和动力学研究[J]. 茶叶科学,2009,29(4):313-318. Li Haiyan, Wang Dongfeng, Siaka D, et al. Thermodynamics and kinetics of tea polyphenols adsorption onto resins of chitosan microspheres[J]. Journal of Tea Science, 2009, 29(4): 313-318. (in Chinese with English abstract) [18] Mehta R V, Upadhyay R V, Charles S W, et al. Direct binding of protein to magnetic particles[J]. Biotechnology Techniques, 1997, 11(7): 493-496. [19] Denkbaş E B, Kiliçay E, Birlikseven C, et al. Magnetic chitosan microspheres: preparation and characterization[J]. Reactive and Functional Polymers, 2002, 50(3): 225-232. [20] 中国食品发酵工业研究员. 食品中总酸的测定: GB/T12456-2008[S]. 北京:中国标准出版社,2008: 6 [21] Chen A H, Chen S M. Biosorption of azo dyes from aqueous solution by glutaraldehyde-crosslinked chitosans[J]. Journal of Hazardous Materials, 2009, 172(2-3): 1111-1121. [22] Lagergren S. About the theory of so-called sorption of soluble substances[J]. Kungl. Svenska Vetenskapsakademiens Handlingar, 1898, 24(4): 1-39. [23] Aroua M K, Leong S P, Teo L Y, et al. Real-time determination of kinetics of adsorption of lead(II) onto palm shell-based activated carbon using ion selective electrode[J]. Bioresource Technology, 2008, 99(13): 5786-5792. [24] Ozer A, Akkaya G, Turabik M. Biosorption of acid blue 290 (AB 290) and acid blue 324 (AB 324) dyes on spirogyra rhizopus[J]. Journal of Hazardous Materials, 2006, 135(1-3): 355-364. [25] Mall I D, Srivastava V C, Agarwal N K, et al. Removal of congo red from aqueous solution by bagasse fly ash and activated carbon: Kinetic study and equilibrium isotherm analyses[J]. Chemosphere, 2005, 61(4): 492-501. [26] Morris J C, Weber W J. Removal of biologically resistant pollutants from waste waters by adsorption[J]. Advances in Water Pollution Research, 1964, 269(22): 231-266. [27] Langmuir I. The Adsorption of gases on plane surfaces of glasses, mica and platinum[J]. Journal of the American Chemical Society, 1918, 40(9): 1361-1403. [28] Freundlich H. Over the adsorption in solution[J]. Journal of Physical Chemistry A, 1906, 57(25): 385-471. [29] Yue Tianli, Guo Caixia, Yuan Yahong, et al. Adsorptive removal of patulin from apple juice using Ca-alginate- activated carbon beads[J]. Journal of Food Science, 2013, 78(10): 1629-1635. [30] Öztürk A, Malkoc E. Adsorptive potential of cationic basic yellow 2 (BY2) dye onto natural untreated clay (NUC) from aqueous phase: Mass transfer analysis, kinetic and equilibrium profile[J]. Applied Surface Science, 2014, 299: 105-115. [31] Chen A H, Huang Y Y. Adsorption of remazol black 5 from aqueous solution by the templated crosslinked-chitosans[J]. Journal of Hazardous Materials, 2010, 177(1-3): 668-675. [32] Ho Y S, McKay G. The kinetics of sorption of divalent metal ions onto sphagnum moss flat[J]. Water Research, 2000, 34(3): 735-742. [33] Mall I D, Srivastava V C, Agarwal N K. Removal of orange-G and methyl violet dyes by adsorption onto bagasse fly ash-kinetic study and equilibrium isotherm analyses[J]. Dyes and Pigments, 2006, 69(3): 210-223. [34] Özer A, Akkaya G, Turabik M. The biosorption of acid red 337 and acid blue 324 on enteromorpha prolifera: The application of nonlinear regression analysis to dye biosorption[J]. Chemical Engineering Journal, 2005, 112(2): 181-190. [35] Wang Zhouli, Yue Tianli, Yuan Yahong, et al. Kinetics of adsorption of bovine serum albumin on magnetic carboxymethyl chitosan nanoparticles[J]. International Journal of Biological Macromolecules, 2013, 58(7): 57-65. [36] 刘宝鉴,杨帆,邹远兴. 金属有机骨架材料对水中有机酸的吸附性能[J]. 化工环保,2016,36(3):268-271. Liu Baojian, Yang Fan, Zou Yuanxing. Adsorption of organic acids from aqueous solution onto metal-organic frameworks[J]. 2016, 36(3): 268-271. (in Chinese with English abstract) [37] Zhang Huanhuan, Lan Xiaoyu, Bai Peng, et al. Adsorptive removal of acetic acid from water with metal-organic frameworks[J]. Chemical Engineering Research and Design, 2016, 111: 127-137. [38] 王津南,李爱民,许丽,等. 复合功能树脂对水体中天然有机酸的吸附[J]. 高等学校化学学报,2009,30(5): 1046-1051. Wang Jinnan, Li Aimin, Xu Li, et al. Adsorption of natural organic acids using bi-function resin[J]. Chemical Journal of Chinese Universities, 2009, 30(5): 1046-1051. (in Chinese with English abstract) [39] 艾斯卡尔·艾拉提,黄桂东,姬中伟,等. 杏浆中果酸吸附性能的研究[J]. 食品科学,2013,8(34):118-123. Ailati A, Huang Guidong, Ji Zhongwei, et al. Adsorption properties of alpha hydroxy acids from apricot sauce[J]. Food Science, 2013, 8(34): 118-123. (in Chinese with English abstract) [40] 何珊. 大孔树脂分离发酵苹果酸的静态吸附工艺研究[J]. 化工时刊,2014,28(5):12-14. He Shan. Study on the static adsorption process of the abstraction of malic acid from fermentation broth by macroporous resin[J]. Chemical Industry Times, 2014, 28(5): 12-14. (in Chinese with English abstract) [41] Demiral H, Demiral İ, Tümsek F, et al. Adsorption of chromium(VI) from aqueous solution by activated carbon derived from olive bagasse and applicability of different adsorption models[J]. Chemical Engineering Journal, 2008, 144(2): 188-196. [42] Wang B E, Hu Y Y, Xie L, et al. Biosorption behavior of azo dye by inactive CMC immobilized Aspergillus fumigatus beads[J]. Bioresource Technology, 2008, 99(4): 794-800. 姜飞虹,袁亚宏,任婷婷,孟掉琴,岳田利. 磁性壳聚糖微球吸附苹果汁有机酸的动力学及热力学特性[J]. 农业工程学报,2017,33(21):307-314. doi:10.11975/j.issn.1002-6819.2017.21.038 http://www.tcsae.org Jiang Feihong, Yuan Yahong, Ren Tingting, Meng Diaoqin, Yue Tianli.Adsorption kinetics and thermodynamics characters of organic acids from apple juice by magnetic chitosan microspheres[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2017, 33(21): 307-314. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2017.21.038 http://www.tcsae.org Adsorption kinetics and thermodynamics characters of organic acids from apple juice by magnetic chitosan microspheres Jiang Feihong1,2,3, Yuan Yahong1,2,3, Ren Tingting1,2,3, Meng Diaoqin1,2,3,Yue Tianli1,2,3※ (1.712100; 2.712100,; 3.712100,) The aim of this research was to study the kinetics and thermodynamics of organic acids adsorption from apple juice by magnetic chitosan microspheres. Magnetic chitosan microspheres of 0.500 g were accurately added to 30 mL clarified apple juice in which organic acid concentration was 2.32 mg/mL. Oscillatory adsorption of organic acids by magnetic chitosan microspheres was carried out at 3 temperature gradients (298, 318 and 338 K) respectively and the adsorption amount at different adsorption time was calculated. The adsorption kinetic curves at 3 temperatures were obtained by plotting the organic acid adsorption amounts with the adsorption time. At the same time, 0.500 g magnetic chitosan microspheres were accurately added to 30 mL clarified apple juice with different initial concentrations of organic acid (2.782 4, 3.744 5, 4.649 6, 5.772 6, 6.892 2, and 7.814 1 mg/mL). Oscillatory adsorption was respectively carried out at 3 temperature gradients until adsorption equilibrium was reached and the adsorption capacity at equilibrium was determined after magnetic separation under a magnetic field. The adsorption capacity at equilibrium was plotted with the organic acid concentration at equilibrium after adsorption to obtain adsorption isotherms under 3 temperature gradients. The Lagergren pseudo-first-order kinetic model, Lagergren pseudo-second-order kinetic model, Elovich model and internal diffusion model were used to fit the adsorption kinetic data. Three isothermal adsorption models (Langmuir, Freundlich and Temkin) were used to analyze adsorption thermodynamics properties. According to the adsorption kinetic curves, it was seen that initial adsorption rate tended to increase with the increasing of the temperature. Meanwhile adsorption amount at equilibrium (112.374 9, 105.558 4, and 100.424 9 mg/g) decreased with the increasing of the temperature, which demonstrated that the adsorption process was exothermic and higher temperature impeded the adsorption reactivity. By comparing the correlation coefficient, it was found that adsorption kinetic process conformed to the Lagergren pseudo-second-order kinetic model better (2>0.998). The adsorption constant declined gradually with the temperature increasing, which also offered a proof of heat release about the adsorption process. Also, the equilibrium adsorption amount calculated by the Lagergren pseudo-second-order kinetic model was close to the data obtained from the experiment. Adsorption thermodynamics conformed to Langmuir isothermal adsorption model (2>0.998), which indicated that the adsorption process was a monolayer chemical adsorption. Thermodynamic parameters Gibbs free energy change and standard enthalpy change were below zero, and standard entropy change was above zero, which indicated that the adsorption of organic acid to magnetic chitosan microspheres was a spontaneous and exothermic process along with the increasing of entropy. The kinetics and thermodynamics process can provide technical basis for the adsorption process of organic acid from apple juice using the magnetic chitosan microspheres. adsorption; kinetics; thermodynamics; magnetic chitosan microspheres; organic acid; apple juice 10.11975/j.issn.1002-6819.2017.21.038 TS201.2 A 1002-6819(2017)-21-0307-08 2017-04-25 2017-10-09 国家重点研发计划(2017YFD0400702);国家自然科学基金(31371814);港澳台科技合作专项项目(2015DFT30130) 姜飞虹,博士研究生,主要从事食品生物技术研究。 Email:jiangfeihong2009@163.com ※通信作者:岳田利,教授,主要从事食品发酵工程及食品安全控制技术研究。Email:yuetl@nwafu.edu.cn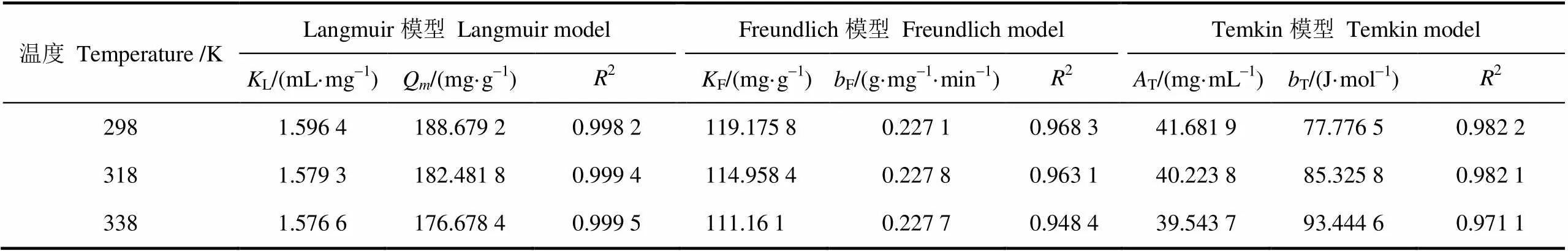
3 结 论
