鲍放养密度对循环水养殖水质的影响及生物滤器净化效果
2017-11-20高霄龙李文亚徐建平郝静薇
高霄龙,刘 鹰,李 贤,李文亚,徐建平,郝静薇
鲍放养密度对循环水养殖水质的影响及生物滤器净化效果
高霄龙1,2,刘 鹰3※,李 贤1,李文亚4,徐建平4,郝静薇3
(1. 中国科学院海洋研究所,青岛266071;2. 中国科学院大学,北京100049; 3. 大连海洋大学,大连116023;4. 青岛理工大学,青岛266033)
该文以皱纹盘鲍(Ino)循环水养殖的排放水体为研究对象,以提高水循环系统综合利用率为目标,比较了鲍(壳长为(38.34±1.63)mm,体质量(7.97±0.42)g)在高(500个/m2)、中(300个/m2)、低(100个/m2)密度下养殖水环境的变化特点,并综合评价了移动床曝气生物滤器的水处理效果。研究表明:放养密度对水体中总氨氮(TAN)、亚硝酸盐氮(NO2–-N)、总氮(TN)、总磷(TP)、磷酸盐(PO43–-P)浓度和可培养异养细菌总数均有显著影响(<0.05),依次表现为高密度组>中等密度组>低密度组。中、高密度组硝酸盐氮(NO3–-N)、化学需氧量(COD)浓度和弧菌总数并没有显著差异(>0.05),但均显著高于低密度组(<0.05)。现行工况下(水循环率、温度、水力负荷等),生物滤器对TAN、NO2–-N、NO3–-N、TN、PO43–-P、TP、COD的平均去除率分别为16.40%、15.81%、2.93%、12.22%、2.91%、6.48%、9.47%。该生物滤器对养殖排放水中能够对鲍产生明显毒害作用的TAN、NO2–-N处理效果较好,使其均维持在安全的浓度范围内,满足实际生产需求。但对NO3–-N、TN的脱除以及低浓度PO43–-P和COD的处理效率相对较低。因此,综合经济和生态效益等多方面因素,在该试验的多层、立体循环水养殖系统内,将皱纹盘鲍的密度设定为500个/m2时是较为合适的。
水产养殖;水质;净化;皱纹盘鲍;密度;生物滤器
0 引 言
皱纹盘鲍(Ino)是中国重要的海产经济贝类,2015年鲍的养殖产量达到了12.8万t,养殖产量占世界总产量的90%以上[1]。但在养殖产业快速发展的同时,很多问题日益凸显,例如水环境污染加剧、自然灾害频发、海上养殖空间受限等[2]。面对这一系列问题,如何转变养殖生产方式,探寻新的集约化发展道路是产业未来发展的关键。而鲍的封闭循环水养殖可能是实现高密度、大规格、健康苗种培育的主要途径之一。
中国鲍的封闭循环水养殖依然处于起步阶段,相较于发达国家而言还有较大差距。Vivanco-Aranda等[3]对比了流水养殖和循环水养殖对红鲍()生长和存活的影响,结果发现循环水养殖模式下鲍的生长速率和存活率均显著高于流水养殖。Huchette等[4]发现黑唇鲍()的放养密度与水体中的氨氮浓度成正相关,而氨氮浓度则与鲍的生长速率成显著负相关,较高的氨氮浓度是抑制鲍生长的主要因素。Naylor等[5]认为pH值、溶解氧浓度与水体流速成正相关,游离氨和亚硝酸盐浓度则与流速成负相关,低pH值和氨氮浓度的不断增加是制约中间鲍()循环水养殖的首要限制因素。与传统的流水养殖模式相比,循环水养殖具有以下优势:1)减少水资源利用和污水排放;2)降低外来疾病感染和水质污染风险;3)保障苗种安全性和产品品质;4)实现精确、自动化管理与控制,提高生产效率的同时降低劳动强度[6-7]。因此,在循环水养殖系统中,基于鲍的生理生态学特点,选择一种高效、稳定的水处理方法并从优化养殖水环境的角度确定科学合理的放养密度对实现循环水系统高效运行尤为重要。
因此,本研究在自主设计的多层、立体循环水养殖系统中,选用移动床生物滤器作为养殖排放水处理单元,探讨不同放养密度下水质因子的动态变化规律,评价移动床生物滤器的水处理效果,以期为实现养殖水环境优化和该系统的规模化生产应用提供基础参数。
1 试验材料与方法
1.1 试验装置与鲍鱼暂养
试验在中国山东省青岛市中国科学院海洋研究所内开展,所用装置为4套多层、立体的循环水养殖系统。该装置由养殖系统和水处理系统2部分组成,其中养殖系统共有3层,由养殖槽、打孔隔板、进水管、排水管、造浪斗等构成;水处理系统包括过滤箱、倾斜隔板、集污槽、调温箱、换热器、制冷机、水泵、紫外线消毒装置、泡沫分离器、射流泵、曝气盘、生物罐、气泵、氧气锥、氧气瓶等(图1)。装置中水流首先通过进水管流入造浪斗(高25 cm,体积6 L),当造浪斗中的水位到达一定深度后,自动翻转将水倾倒入养殖槽中。养殖槽(长、宽、高各为1.8 m、0.6 m、0.35 m)一分为三,打孔隔板通过卡子固定在槽体内侧。过滤箱(体积0.13 m³)由两部分组成,上部为铺放不同孔径生化棉的过滤斜板,斜板(与水平方向夹角60°)通过卡槽固定在过滤槽内侧,两块斜板上生化棉的孔径由大到小层级过滤。槽体另一端底部有排水口,排水口直接连接集污槽,残饵、粪便沉积在集污槽底部,通过打开底部排污阀收集残饵。养殖槽排放水经过滤箱流入调温箱内,水在调温箱(体积0.216 m³)内经制冷机、换热器处理将温度控制在17 ℃。水泵将水流从上端抽入泡沫分离器,期间通过紫外线灯(30 W)对水体进行杀菌消毒。处理后的水流进入生物罐,罐底布放连接气泵(额定功率138 W)的曝气盘连续曝气,生物罐中布放圆形多孔流化床悬浮聚乙烯填料(直径3.5 cm,厚度0.3 cm,比表面积:1 500 m2/m3,孔隙率:80%,布放体积为生物滤池体积的1/2。)进行生物过滤。随后水流进入连接有氧气瓶的氧气锥内,补充液氧(1~1.5 L/min),使水体溶解氧质量浓度>6 mg/L。最后水流由氧气锥流出返回进水管,完成整个循环。
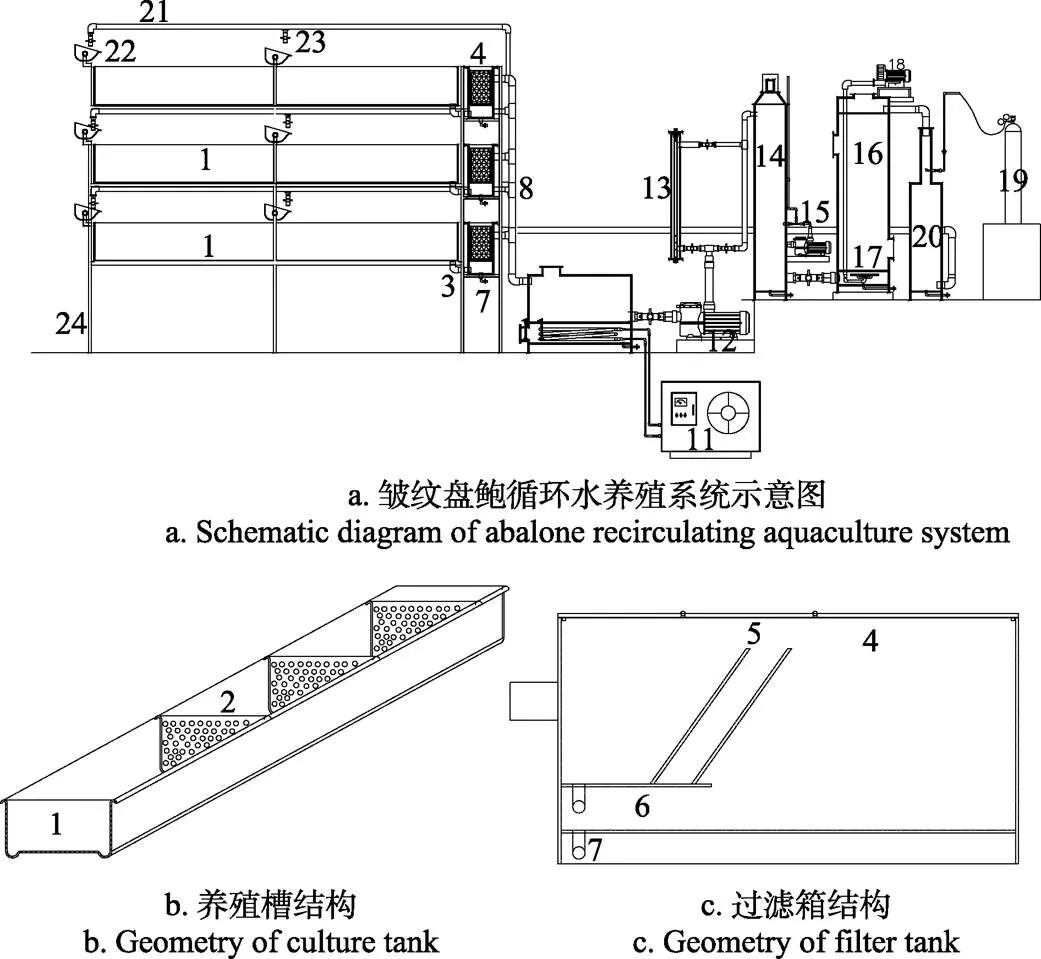
1. 养殖槽 2. 打孔隔板 3. 排水口 4.过滤箱 5. 倾斜隔板 6. 集污槽 7. 排水阀 8. 排水管 9. 温控箱 10. 热交换器 11.制冷机 12. 水泵 13. 紫外线消毒装置 14. 蛋白质分离器 15. 射流泵 16. 生物箱 17. 曝气盘 18.气泵 19. 氧气瓶 20. 氧气锥 21. 进水管 22. 造浪装置 23. 进水口 24. 养殖架
试验用皱纹盘鲍均为人工孵化的同一批苗种,购买回试验室后按照设定密度放入4套循环水系统中的不同养殖槽内暂养15 d。暂养期间温度控制在17 ℃,盐度(30±1)´10-3,pH值为7.9,溶解氧质量浓度>6 mg/L,光周期为自然光周期。养殖用水取自自然海区经沉淀、砂滤后使用。暂养期间,每天下午17:00点投喂新鲜海带(Aresch)1次,投喂量按照鲍湿体质量的5%计算,以保证其达到饱食状态。
1.2 试验方法
1.2.1 试验设计
本试验共设有3个密度组(基于前期预试验和相关研究报道),每套养殖系统每一层的放养密度分别为370、1 110、1 850个/m3,以单位面积计算分别为100、300和500个/m2,各密度组均设4个重复。试验共进行45 d(5月15日-5月29日),所用鲍壳长为(38.34±1.63)mm,体质量(7.97±0.42)g。每天下午17:00投喂新鲜海带()1次,投喂量按照鲍湿体质量的5%计算,以保证其达到饱食状态。每日投饵后停止水体循环进而停止造浪斗翻转,投饵结束30 min后,系统重新开始循环。每套系统的水体日循环率为18次,水体流速350 L/h。每一养殖槽内均布放3块“W形”附着基(高15 cm),以增大附着面积、避免底部沉积的废物带来不利影响。每隔10 d对过滤棉和集污槽底部进行清洗,并添加3%海水以弥补水分蒸发。试验期间水体温度为(18±0.42)℃,盐度(29±1)´10-3,pH值为7.8±0.2,溶解氧质量浓度为(7.8±0.2)mg/L,光周期为自然光周期。
1.2.2 样品采集
试验过程中,每天使用YSI-556MPS便携式多参数水质测量仪 (Yellow Springs Instruments Inc., Ohio, USA) 对4套系统中的水体温度、盐度、pH值、溶解氧浓度进行测定。每隔3 d在各养殖密度组的出水口处采集水样,对总氨氮(TAN)、亚硝酸盐氮(NO2–-N)、硝酸盐氮(NO3–-N)、总氮(TN)、磷酸盐(PO43–-P)、总磷(TP)、化学需氧量(COD)的浓度和可培养细菌总数、弧菌数量等进行测定。为减少误差,化学营养盐和微生物指标取样时间均为早08:00,每个取样点均取3次重复水样。可培养细菌总数和弧菌总数取样时均使用已灭菌的塑料瓶,并将4套平行系统相同取样点的水样按照同一比例混合均匀后立即进行梯度稀释,接种于可培养细菌2216E培养基和弧菌专用TCBS培养基上,并做3个重复平板,于28 ℃恒温培养后进行菌落计数。
同时,为评价生物滤器运行工况对养殖排放水的处理效果,在系统既定运行工况下,每隔3 d测定该循环水养殖系统生物滤器的进、出水池中的TAN、NO2–-N、NO3–-N、TN、PO43–-P、TP、COD,取样时间也为早08:00,每个取样点均取3次重复水样。
1.2.3 样品测定
水质监测方法参照海洋监测规范[8],其中总氨氮:纳氏试剂分光光度法;亚硝酸盐氮:萘乙二胺分光光度法;硝酸盐氮:锌镉还原法;总氮、总磷:碱性过硫酸钾法;磷酸盐:磷钼蓝分光光度法;化学需氧量:碱性高锰酸钾法;采用CFU法对可培养异养细菌总数(2216培养基)和弧菌总数(TCBS培养基)进行测定。
生物滤器各污染物去除率()计算公式:=(o–G)/o×100%
式中为污染物去除率,%;o为生物滤器进水检测指标浓度,mg/L;G为生物滤器出水检测指标浓度,mg/L。
1.3 统计分析
采用SPSS18.0软件进行统计分析,利用单因素方差分析(One-ANOVA)和Turkey多重比较分析各密度组中相关水质指标的差异。试验结果均表示为平均值±标准差(Mean ± SD),显著性水平为<0.05。
2 试验结果与分析
2.1 不同放养密度下水质指标变化规律
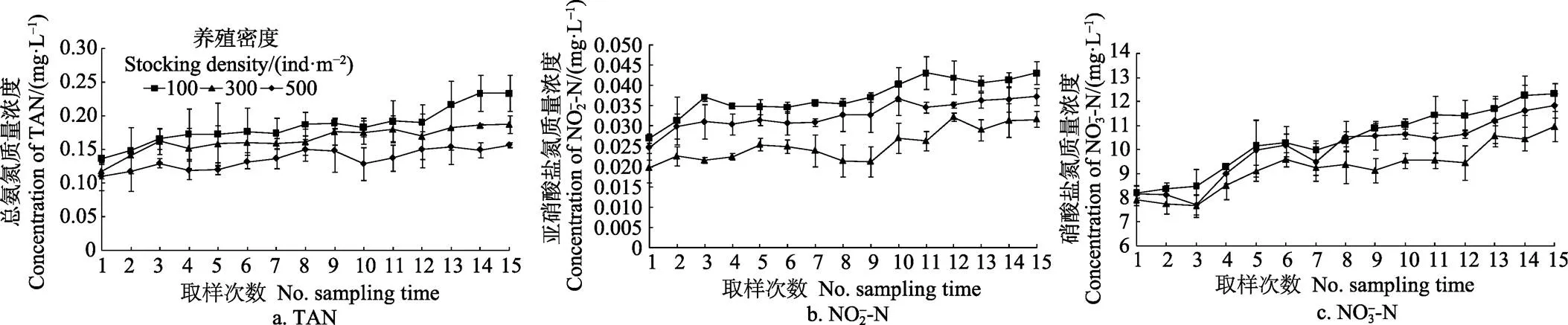
各密度组总氨氮浓度随时间均呈上升趋势(图2)。高、中、低密度组均在第15次取样时质量浓度达到最大值,分别为(0.233±0.027)、(0.187±0.013)和(0.157±0.004)mg/L。各密度组间总氨氮浓度差异显著(>0.05)。第14和15次采样时,低密度组中总氨氮浓度均显著低于中、高密度组(<0.05)。各密度组间亚硝酸盐氮浓度也有显著差异(<0.05),高、中、低密度组平均质量浓度分别为0.037、0.033和0.025 mg/L。除第1、2、8、10次采样时间外,其他时间点高密度组中亚硝酸盐氮的浓度均显著高于中密度组(<0.05)。且在低密度组中亚硝酸盐氮质量浓度始终显著低于中、高密度组(<0.05)。硝酸盐氮浓度均随密度增加而升高,且均在末次水样测定中达到最大值,高、中、低密度组依次为(12.311±0.432)、(11.822±0.509)和(10.964±0.625)mg/L。除第1、2、5、7次采样时间外,其他各时间点高密度组中硝酸盐氮的浓度均显著高于低密度组。而除第3和12次采样时间外,其他各时间点中、高密度组间硝酸盐氮浓度均没有显著性差异(>0.05)。
放养密度对水体中总氮浓度也有显著影响(< 0.05),高、中、低密度组平均质量浓度分别为16.275、14.842和12.874 mg/L。除第4、5、7、12和14次采样时间外,其他时间点低密度组中总氮浓度均显著低于高、中密度组(<0.05,图3)。而在第2、3、6、9、10、11次采样时,中、高密度组间总氮浓度并没有显著差异(>0.05)。
注:第一次取样时间为5月18日,每隔3 d取1次样。下同。
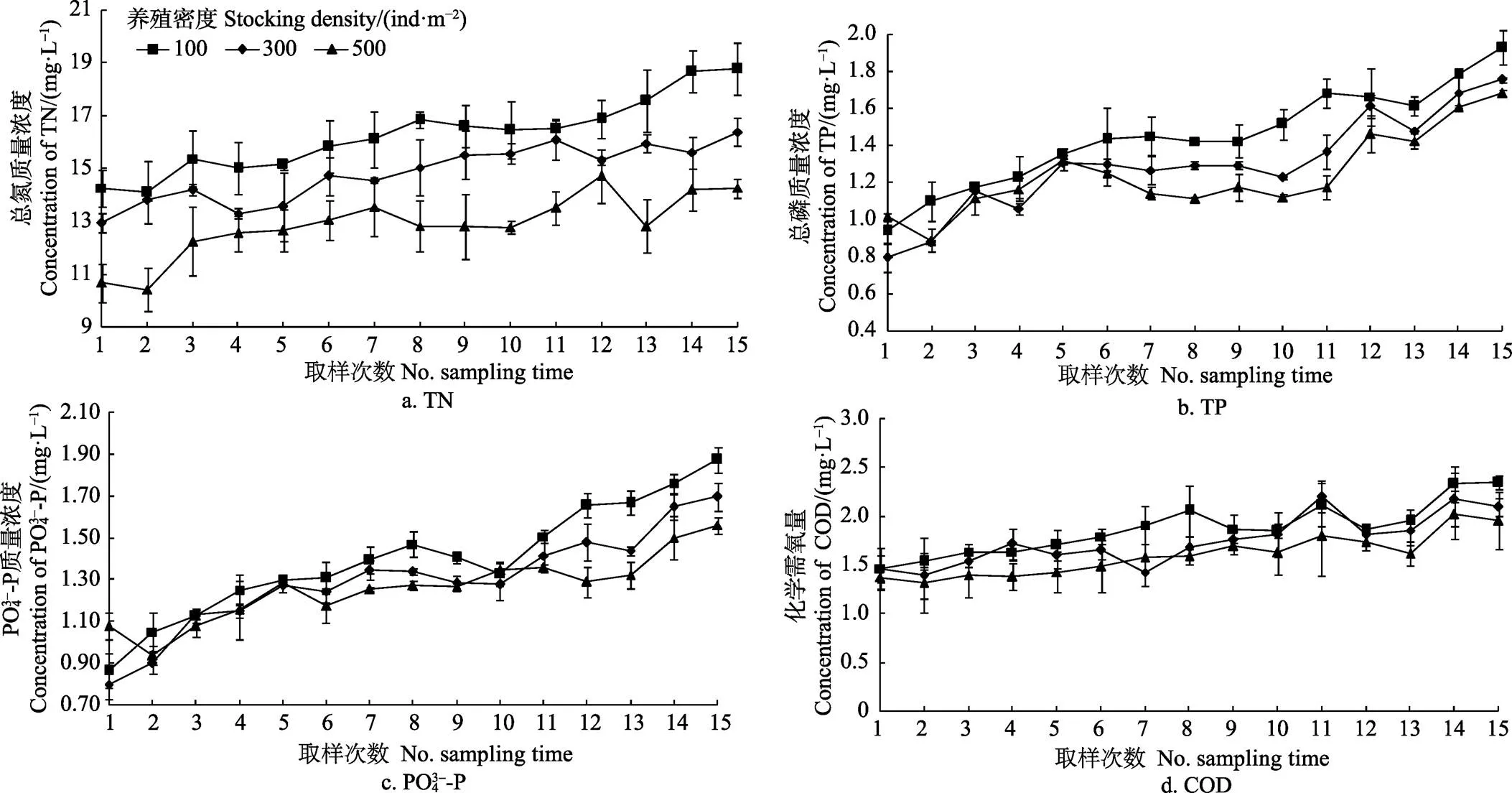
图3 不同密度组总氮、总磷、PO43–-P和化学需氧量COD浓度变化情况
总磷和磷酸盐浓度也随采样时间延长而逐渐升高,且在各密度组间差异显著(<0.05)。试验结束时,各密度组中总磷和磷酸盐浓度均达到最大值,且在高密度组中均显著高于中、低密度组(<0.05)。各密度组间化学需氧量浓度也有显著差异(<0.05)。高、中、低密度组化学需氧量质量浓度平均为1.873、1.747、1.600 mg/L。第7、8、15次取样时,高密度组中化学需氧量浓度均显著高于中、低密度组(<0.05)。
各密度组异养细菌总数也随时间延长而呈上升趋势,且高、中、低密度组间异养细菌总数差异显著(<0.05,图4)。除第2和11次采样外,其他各时间点高密度组异养细菌总数均显著高于中、低密度组(<0.05)。且除第1、10、11次采样时间外,其他各时间点低密度组异养细菌总数均显著低于中密度组(<0.05)。各密度组间弧菌总数也有显著差异(<0.05,图4)。第1、2、3、5次取样时,各密度组间弧菌总数并没有显著差异(>0.05)。第6次取样至试验结束,中、高密度组弧菌总数均显著高于低密度组(<0.05)。
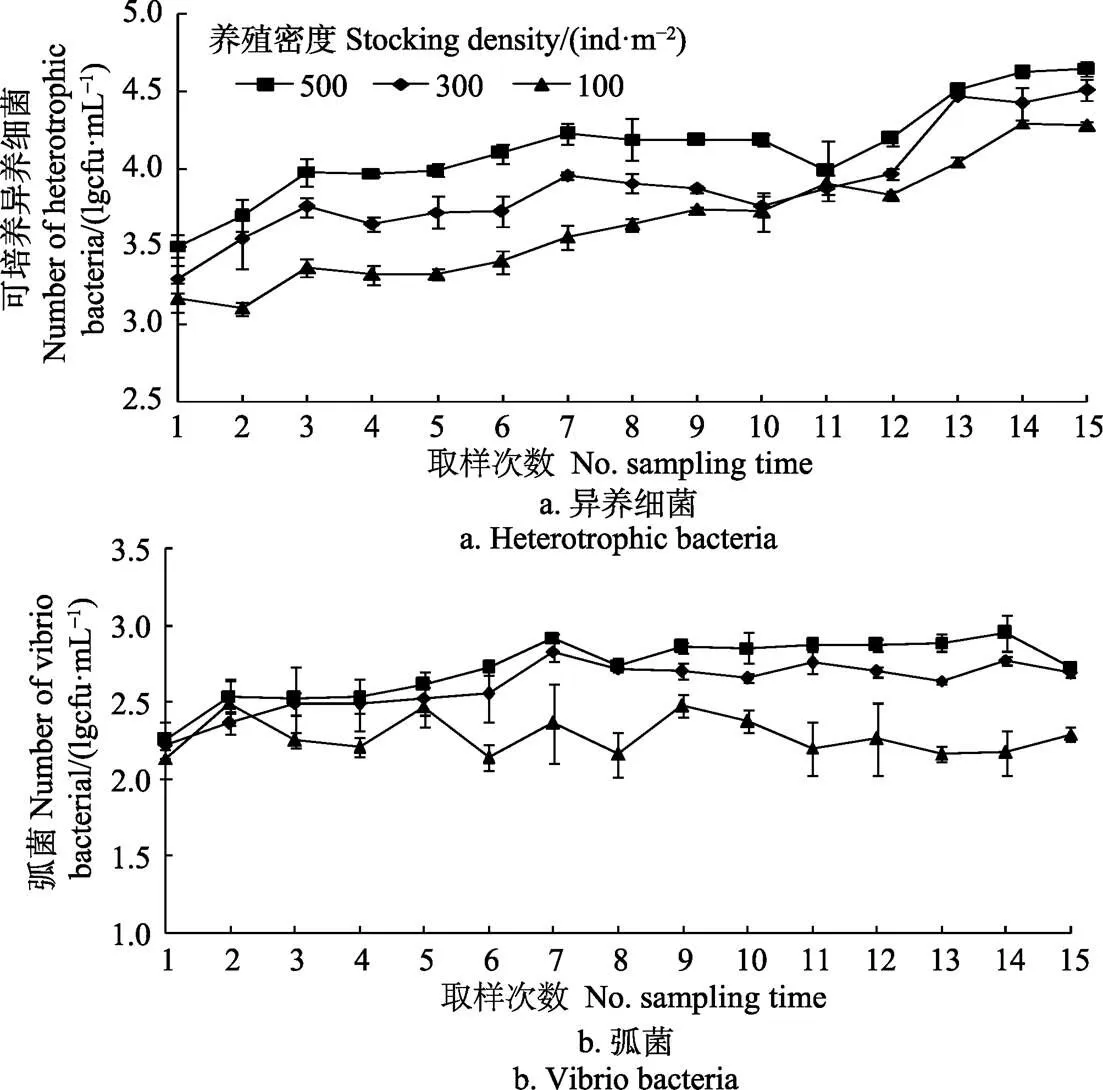
图4 不同密度组可培养异养细菌和弧菌对数变化情况
2.2 生物滤器水处理效果分析
生物滤器进水为3个密度组的混合出水,进水总氨氮平均质量浓度为0.157 mg/L,第15次取样时浓度达到最大值,为0.192 mg/L。总氨氮平均去除率为16.4%,在末次水样测定时总氨氮去除率与第8和14次相比没有显著差异(>0.05),但显著高于其他时间点(<0.05,图5)。进水亚硝酸盐氮平均质量浓度为0.029 mg/L,在第14次测定时浓度达到最大值。生物滤器对亚硝酸盐氮的平均去除率为15.81%,第14次水样测定时的去除率与第5和13次时相比差异并不显著(>0.05),但显著高于其他时间点(<0.05)。生物滤器对硝酸盐氮的去除率范围为–6.65%~7.23%,平均去除率为2.93%。末次取样时对硝酸盐氮的去除率达到最大,与第1、2、11、12次时相比差异显著(<0.05)。
生物滤器进出水总氮平均质量浓度分别为14.10、12.38 mg/L,总氮去除率波动范围较大(4.27%~18.72%),平均去除率为12.22%(图6)。在第13次取样中总氮去除率达到最大(18.72%),但与第10次取样时的去除率相比差异并不显著(>0.05)。总磷进水平均质量浓度为1.305 mg/L,出水平均质量浓度为1.216 mg/L。总磷去除率不稳定,在第2次取样时为负值,第12次取样时达到最大值(11.75%),平均去除率为6.48%。磷酸盐去除率变化范围也较大,平均去除率为2.91%,在第1、7次取样测定时均为负值,在第14次取样时达到最大值(6.66%),但与12、13、15次取样时相比差异并不显著(>0.05)。生物滤器进水COD质量浓度平均值为1.660 mg/L,出水平均值为1.500 mg/L,平均去除率为9.47%。第9次取样时对COD的去除率最低,但与第12、13次取样时相比并没有显著差异(>0.05)。
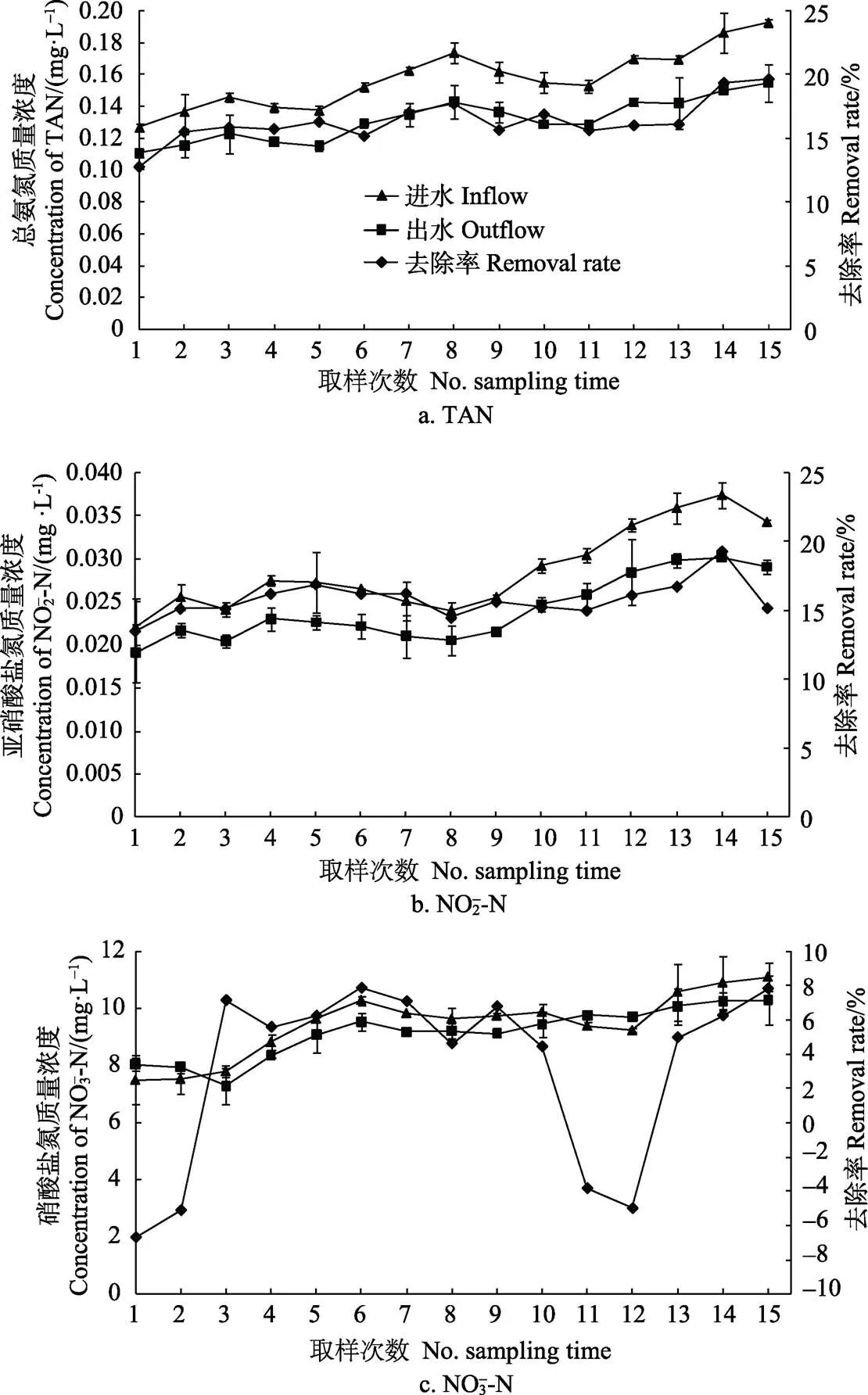
图5 生物滤器对总氨氮、亚硝酸盐氮、硝酸盐氮的去除率
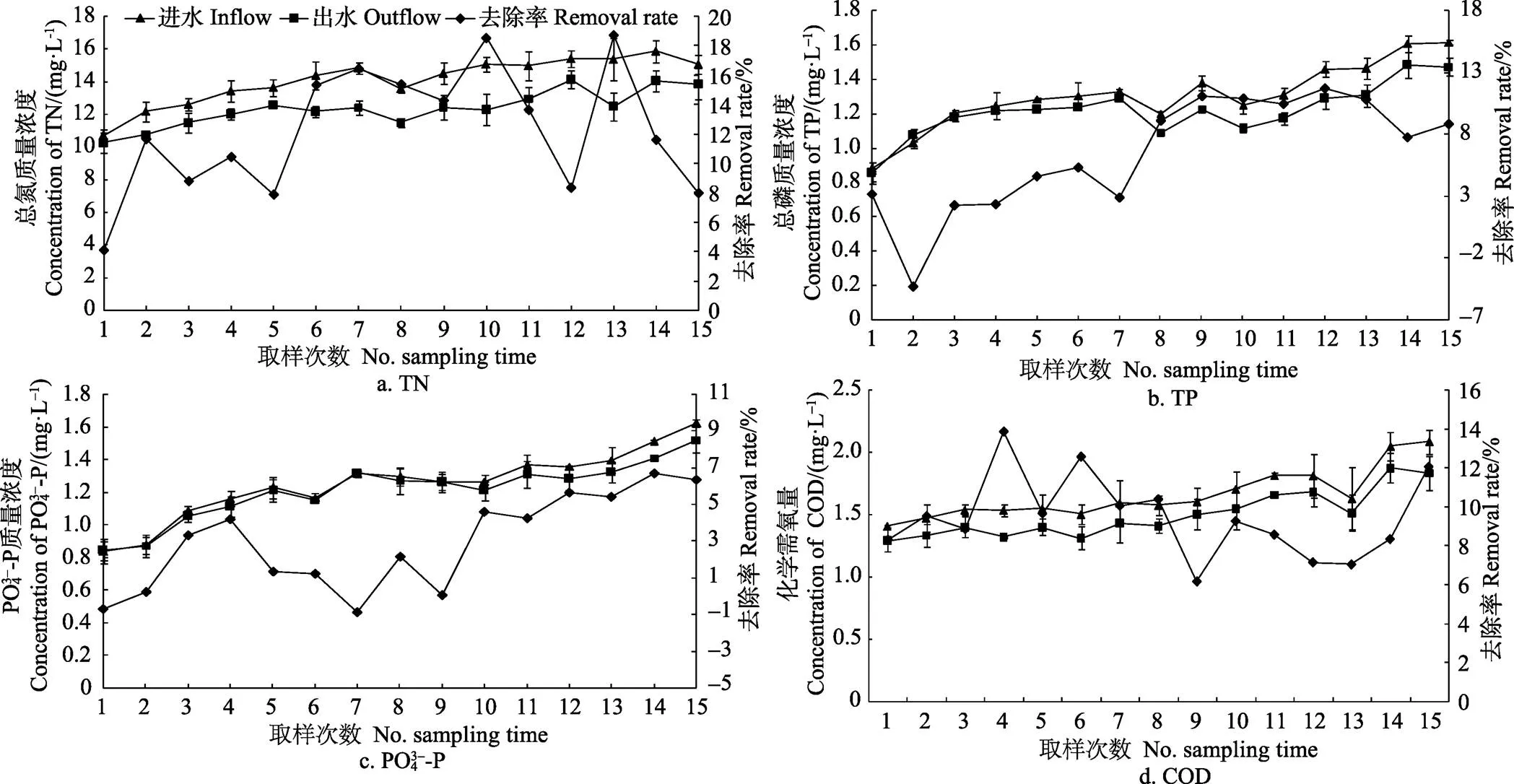
图6 生物滤器对总氮、总磷、PO43–-P和化学需氧量的去除率
3 讨 论
随着现代科技水平的迅速发展,以资源和劳动密集、水处理设施落后为特征的传统养殖模式不断受到冲击,已经不符合当今水产养殖资源节约、生态环境保护的要求,中国水产养殖逐渐朝着高度集约化、低排放乃至零排放的方向发展[9]。在过去的30 a里,随着皱纹盘鲍养殖技术日趋成熟,中国工厂化养鲍产业迈入了一个新的发展时期[10]。同时,中国工业化养殖在综合技术运用、环保节能等方面更是不断创新突破,例如吴垠等[11]设计的立体抽屉式循环水养殖系统,使得幼鲍()养殖密度高达流水式养殖模式的6~9倍,海水加热耗能仅为流水式养殖加热耗能的1/7,通过养殖排放水的循环利用更是对海洋生态环境起到了保护作用。
养殖排放水中的污染物由富含蛋白质等营养物质的剩余饵料和含有大量C、N、P等元素的代谢产物组成。对养殖生物而言,总氨氮和亚硝酸盐氮逐渐富集并达到一定程度后会产生明显的毒害作用,所以控制水体中氮的平衡尤为重要[12]。鲍和绝大多数水生生物一样都是氨排泄生物,Cripps 和Bergheim[13]通过研究多种养殖生物代谢排入到水体中污染物的量发现,绝大多数的氮是通过养殖生物的新陈代谢作用后最终回到水体。而含氮排泄物主要有氨态氮、尿素、尿酸、氨基酸及某些胺类化合物等[14]。本试验中总氨氮主要来源于鲍的粪便、残余饵料等在微生物作用下的分解释放。随着鲍放养密度的增加,投喂量和粪便等相应增加,进而使各密度组中的总氨氮浓度有明显差异,这与王华等[15]关于不同密度对养殖水体水质影响的研究结果相一致。总氨氮经硝化细菌作用后更多地转化为NO2–,这无疑增加了水体中NO2–的来源,故随放养密度增加NO2–浓度也逐渐升高。但试验过程中各密度组亚硝酸盐氮质量浓度均未超过0.1 mg/L,处于鲍正常的耐受安全浓度范围内,并未对鲍产生胁迫作用[16]。与总氨氮和亚硝酸盐氮相比,硝氮毒性很小,但也有研究表明高浓度的硝氮会对养殖对象的生长产生抑制作用,因此认为应将硝氮质量浓度控制在50 mg/L以下的安全浓度范围内[17]。本试验用循环水养殖系统各密度组中硝氮质量浓度最大值为12.31 mg/L,处于安全浓度范围内,经观察也未对鲍的正常生长和存活等产生不利影响。
活性磷酸盐是水中磷的主要形式。水体中磷主要来源于饵料中磷的溶失和鲍自身磷的代谢,其中饲料中磷的溶失是水体中磷含量升高的主要诱因。试验中所用饵料以植物性原料为主,含有的磷通常以植磷酸等形式存在,其中的磷仅15%~30%能够被养殖对象利用,其余的均溶于水中或以颗粒态存在[18]。研究发现,各密度组中磷酸盐浓度随时间而不断升高,均在各密度组末次水样中达到最大值。COD是表征水体中有机质含量的一个重要指标,反映了水体有机污染程度。COD对养殖生物是一种潜在的威胁,因在特定的条件下会消耗大量的氧气,水体缺氧后将会释放出更多氨、硫化氢等有毒有害物质,使细菌、寄生虫等快速繁殖,加快水质恶化进程,增大病害发生风险[19],所以对养殖水环境中COD浓度的监测是十分必要的。试验过程中高、中密度组间的COD浓度并没有明显差异,但均显著高于低密度组。第15次取样时,高密度组中COD浓度达到最大值,说明随着放养密度不断增大,鲍的粪便和代谢产物等也不断增加。
循环水养殖系统是一个复杂的生态系统,由于残饵以及代谢产物使养殖水体腐殖质积累,形成细菌的天然培养基,易使细菌大量繁衍[20-21]。微生物作为各种有机物质的主要分解者,直接将各类生物大分子和氨基酸等分解成无机物,在物质循环和能量流动中发挥着重要作用[22]。弧菌属细菌(spp.)是一类广泛引起养殖生物发病的病原体,多数弧菌是海水养殖生物最常见且危害最为严重的细菌性病原之一。水体中弧菌数量达到一定的临界值时将会引起养殖动物发病,造成巨大经济损失[23-24]。近年来,皱纹盘鲍()各种病害爆发,由弧菌引发的疾病在爆发的细菌性疾病中占据了很大比例。Nicolas等[25]发现哈维氏弧菌()可导致绿鲍()养殖大面积减产,该菌感染被认为是野生绿鲍出现季节性大面积死亡的主要原因。水质恶化、病害爆发与微生物的种类和数量有一定关系。在杂色鲍()育苗过程中,“脱板症”出现前后养殖池水体中及附着基上异养细菌数量差异可达2个数量级[26]。本试验中高、中密度组异养细菌总数和弧菌总数均显著高于低密度组,但各密度组中鲍均生长良好,未有病害发生。张兰河等[27]、吕军仪等[28]的研究也发现可培养异养细菌和弧菌总数与无机营养盐TAN、NO2–-N等在各密度组间的变化趋势类似。因此对二者进行动态监测,可为预测养殖环境微生物结构变化、疾病预防、保障水产动物健康养殖提供参考依据。
总氨氮浓度是循环水处理系统设计中最主要的控制因素,生物硝化脱氮是当今排放水处理技术研究的重点,而移动床生物滤器是此方法的典型应用[29-30]。总氨氮去除主要依靠填料表面生物膜上硝化细菌和反硝化细菌的联合作用,其去除效果与水温、水力停留时间和进水总氨氮浓度的高低等影响因素有关。本研究发现在水温等因素一定的工况条件下,影响总氨氮去除率的主要因素是进水浓度,当进水总氨氮浓度升高时,水处理系统对其去除率也有明显增大的趋势。这和Kim等[31]认为当总氨氮质量浓度在2.5 mg/L以下时,总氨氮去除速率受其自身浓度的限制,动力学方程为一级反应式的研究结果相似。硝化反应的基质浓度—亚硝酸盐氮进水浓度越低,硝化反应越不易进行,如试验中发现去除率随进水亚硝酸盐氮浓度升高而增大。生物滤器进水亚硝酸盐氮浓度和总氨氮浓度相似,均随时间变化逐渐升高,一方面是有机氮在微生物分解作用下使得亚硝酸盐氮浓度升高,另一方面可能是在生物净化过程发生了亚硝酸盐氮积累现象。养殖排放水负荷(总氮含量及水体中各种氮的不同形态分布)、硝化细菌和亚硝化细菌等微生物活性及硝化动力学等因素均可能造成亚硝酸盐氮在系统中的积累现象[32-33]。与硝酸细菌相比,亚硝酸细菌对环境的适应性较强,当亚硝酸细菌活性高于硝酸细菌时,即总氨氮转化为亚硝酸盐氮的速率大于亚硝酸盐氮转化为硝酸盐的速率时,易产生亚硝酸盐氮积累现象。试验前期亚硝酸盐氮浓度较低可能造成生物膜上亚硝酸细菌未获得充足营养而大量繁殖,导致前期亚硝酸盐氮未及时氧化。而当反应器中亚硝酸盐氮积累从开始到停止的时间大于生物滤器水力停留时间,也会导致系统中亚硝酸盐氮浓度的增大。硝氮进水浓度随时间延长而逐渐增加,这和循环水系统普遍反硝化作用较弱或者不具备反硝化功能有关,造成硝氮在系统中富集。循环水系统根据水体环境特点及经济因素,大多采用异养反硝化脱氮。由于异养反硝化以有机碳为碳源,在缺氧条件下脱氮[34],而本养殖水体的C/N较低,在高密度养殖条件下为保证养殖对象所需足够的溶解氧,水体处于富氧状态,反硝化作用受到抑制,硝氮无法进一步还原为氮气从系统中脱除,甚至会转化为毒性更高的亚硝酸盐氮。研究表明,当DO在0.2~1 mg/L时,TAN仅能氧化为NO2–;DO高于1 mg/L 时发生硝化反应;而厌氧反硝化在DO <0.2 mg/L时才发生[35]。故在始终曝气充氧的环境下,反硝化细菌的厌氧反硝化受阻,脱氮不彻底,这也是当今循环水养殖系统中硝酸盐普遍难以去除的主要原因。
养殖排放水中磷酸盐含量低,且磷对养殖生物的危害较小,所以当前在海水养殖排放水的处理上较少关注除磷效率。试验过程中,生物滤器对磷酸盐的去除效果并不明显。由于生物除磷主要是依靠聚磷菌厌氧释磷、好氧聚磷的过程来达到除磷的目的。聚磷菌属于好氧菌,在充氧条件下其性能可以较好地发挥,但是释磷过程需要在厌氧过程中才能完成,而本试验系统中溶解氧质量浓度一直维持在7.8 mg/L左右,聚磷菌释磷受阻。同时微生物间的竞争也可能使聚磷菌在生长过程中处于劣势,不能得到很好的增殖,使除磷效果不显著[36]。所以进水中的磷酸盐浓度随后期更多溶解性无机磷的加入而处于升高趋势。
化学需氧量反映了水中还原性物质的量,其中包括大量有机物,有机物增多会通过额外溶解氧的消耗影响硝化性能,对总氨氮、亚硝酸盐氮等污染物质的去除效率造成影响,所以控制水中有机物含量尤为重要[37-38]。生物滤器一方面可以通过前置过滤装置截留大量悬浮有机大颗粒物质,另一方面利用生物膜上异养菌的同化作用去除细微有机物,从而达到降低COD的目的。皱纹盘鲍养殖排放水属于低浓度排放水,试验结果也表明生物滤器进出水中COD降幅差异不明显,系统对低浓度还原性污染物去除效率较低。降解有机物的异养菌和氧化氨态氮的硝化细菌间存在的空间、溶解氧和营养物质的竞争,可能导致本系统生物滤器发挥较高硝化功能的同时有机物降解效率反而降低。
综上所述,在本试验构建的多层、立体循环水养殖系统内,高密度组TAN、NO2–-N、TN、TP、PO43–-P浓度虽然显著高于中、低密度组,但移动床曝气生物滤器在现行工况下对TAN和NO2–-N等表现出了良好的去除效率,使之维持在养殖生物安全的耐受浓度范围内,且未对鲍的生长产生不利影响。500个/m2密度组鲍的存活率和体质量特定生长率分别为91.7%/和0.32%/d,因此在本试验的循环水养殖系统内,将皱纹盘鲍的密度设定为500个/m2是本试验设计的最高密度。
4 结 论
本研究聚焦不同养殖密度下皱纹盘鲍循环水养殖系统的水质变化特点,并进一步对该系统生物滤器水处理效果进行了综合评价。相关结论如下:
1)高、中、低密度组间TAN、NO2–-N、TN、TP、PO43–-P浓度差异显著(<0.05),均表现为高密度组>中密度组>低密度组。高、中密度组间NO3–-N、COD浓度并没有显著差异,但均显著高于低密度组(<0.05)。
2)高、中、低密度组可培养异养细菌总数均随养殖密度的增加而逐渐增大,各密度组间异养细菌总数差异显著(<0.05),表现为:高密度组>中密度组>低密度组。中、高密度组间弧菌总数并没有显著差异,但均显著高于低密度组(<0.05)。
3)现行工况下,移动床曝气生物滤器对养殖排放水中的TAN、NO2–-N、NO3–-N、TN平均去除率分别为16.4%、15.81%、2.93%、12.22%,PO43–-P、TP平均去除率分别为2.91%、6.48%,COD平均去除率为9.47%。该系统可以有效去除养殖排放水中对鲍产生明显毒害作用的TAN和NO2–-N,但对NO3–-N的脱除、低浓度PO43–-P和COD的处理效率较低。因此,后期可通过调整运行参数、优化排放水处理工艺(如多种生物滤器组合、新型填料的选择)等措施提高养殖生产效率,促进水产养殖业健康、可持续良性发展。
[1] 中华人民共和国农业部渔业局. 2016 年中国渔业统计年鉴[M]. 北京:中国农业出版社,2016.
[2] Wu F C, Zhang G F. Pacific abalone farming in China: Recent innovations and challenges[J]. J Shellfish Res, 2016, 35(3): 703-710.
[3] Vivanco-Aranda M, Gallardo-Escárate C J, del Río-Portilla M A. Low-density culture of red abalone juveniles,Swainson 1822, recirculating aquaculture system and flow-through system[J]. Aquac Res, 2011, 42(2): 161-168.
[4] Huchette S M H, Koh C S, Day R W. Growth of juvenile blacklip abalone () in aquaculture tanks: Effects of density and ammonia[J]. Aquaculture, 2003, 219(1/2/3/4): 457-470.
[5] Naylor M A, Kaiser H , Jones C L W. Water quality in a serial-use raceway and its effect on the growth of South African abalone,Linnaeus, 1758[J]. Aquac Res, 2011, 42(7): 918-930.
[6] Dalsgaard J, Lund I, Thorarinsdottir R, et al. Farming different species in RAS in Nordic countries: current status and future perspectives[J]. Aquacult Eng, 2013, 53: 2-13.
[7] McKenzie D J, Höglund E, Dupont-Prinet A, et al. Effects of stocking density and sustained aerobic exercise on growth, energetics and welfare of rainbow trout[J]. Aquaculture, 2012, 338-341: 216-222.
[8] 中国国家标准化管理委员会. GB 17378.4-2007 海洋监测规范第4部分:海水分析[S]. 北京:中国标准出版社,2007.
[9] 刘鹰. 海水工业化循环水养殖技术研究进展[J]. 中国农业科技导报,2011,13(5):50-53. Liu Ying. Research progress on marine industrial recirculating aquaculture technology[J]. Journal of Agricultural Science and Technology, 2011, 13(5): 50-53. (in Chinese with English abstract)
[10] 王志松,张明,李洪臣,等. 我国工厂化养鲍技术现状与展望[J]. 水产科学,2005,24(3):42-43. Wang Zhisong, Zhang Ming, Li Hongchen, et al. The current status and pespectives of artificial culture of abalone in China[J]. Fisheries Science, 2005, 24(3): 42-43. (in Chinese with English abstract)
[11] 吴垠,孙建明,柴雨,等. 多层抽屉式循环水幼鲍养殖系统及养殖效果[J]. 农业工程学报,2012,28(13):185-190. Wu Yin, Sun Jianming, Chai Yu, et al. Recirculating aquaculture system with multi-layer drawer culture tanks for juvenile abalone and its effects[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2012, 28(13): 185-190. (in Chinese with English abstract)
[12] 迟爽,曾勇,赵振军,等. 刺参养殖池塘的水质变化[J]. 济南大学学报:自然科学版,2013,27(3):239-244. Chi Shuang, Zeng Yong, Zhao Zhenjun, et al. Variation of water quality in culture ponds for[J]. Journal of University of Jinan: Sci & Tech, 2013, 27(3): 239-244. (in Chinese with English abstract)
[13] Cripps S J, Bergheim A. Solids management and removal for intensive land-based aquaculture production systems[J]. Aquacult Eng, 2000, 22(1/2): 33-56.
[14] Gao X L, Zhang M, Tian H Q, et al. Effect of LED light quality on respiratory metabolism and activities of related enzymes of[J]. Aquaculture, 2016, 452: 52-61.
[15] 王华,李勇,陈康,等. 工厂化养殖半滑舌鳎生长、摄食和水质的变化特征及规律[J]. 水生态学杂志,2009,2(4):52-59. Wang Hua, Li Yong, Chen Kang, et al. The feature and rule of change of growth and feed intake ofand water quality in industrial culture with recirculation aquaculture system[J]. Journal of Hydroecology, 2009, 2(4): 52-59. (in Chinese with English abstract)
[16] Harris J O, Maguire G B, Edwards S, et al. Effect of ammonia on growth rate and oxygen consumption rate of juvenile greenlip abalone,Donovan[J]. Aquaculture, 1998, 160(3/4): 259-272.
[17] Boyd E. Guide lines for aquaculture effluent management at the farm-level[J]. Aquaculture, 2003, 226(1/2/3/4): 101-112.
[18] 张文艺,冯国勇,张采芹,等. 水生植物-菌藻-生物膜复合生态系统污染物去除特性[J]. 环境化学,2013,32(11):2193-2201. Zhang Wenyi, Feng Guoyong, Zhang Caiqin, et al. Pollutant removal characteristics in aquatic plants-algae-bacteria- biofilm complex ecosystem[J]. Environmental Chemistry, 2013, 32(11): 2193-2201. (in Chinese with English abstract)
[19] 马晓娜,李甍,孙国祥,等. 贝藻混养对大西洋鲑养殖排放水的生物滤除[J]. 海洋科学,2016,40(1):32-39. Ma Xiaona, Li Meng, Sun Guoxiang, et al. Biological purification of Atlantic salmon () wastewater with the polyculture of bivalves and macroalgae[J]. Marine Sciences, 2016, 40(1): 32-39. (in Chinese with English abstract)
[20] 李烁寒. 不同对虾养殖模式细菌数量动态与环境变化的比较[D]. 广州:暨南大学,2009. Li Lihan. Comparison of Bacterial Quantitative Dynamics and Environmental Changes in Differing Shrimp Culture Models[D]. Guangzhou: Jinan University, 2009. (in Chinese with English abstract)
[21] 刘颖,李丽,孙大川,等. 循环水养鳗系统生物过滤器中微生物群落的代谢特性[J]. 水产学报,2015,39(10):1539-1548. Liu Ying, Li Li, Sun Dachuan, et al. Carbon metabolism of microbial communities in biofilters of recirculating aquaculture system cultured with[J]. Journal of Fisheries of China, 2015, 39(10): 1539-1548. (in Chinese with English abstract)
[22] 李卓佳,李烁寒,杨莺莺,等. 凡纳滨对虾高位池养殖水体细菌变动及其与理化因子的关系[J]. 南方水产,2010, 6(4):6-12. Li Zhuojia, Li Lihan, Yang Yingying, et al. Bacteria variation inhigh level ponds and its relation with physical-chemical factors[J]. South China Fisheries Science, 2010, 6(4): 6-12. (in Chinese with English abstract)
[23] 吴后波,潘金培. 弧菌属细菌及其所致海水养殖动物疾病[J]. 中国水产科学,2001,8(1):89-93. Wu Houbo, Pan Jinpei. Progress in studies of vibriosis in aquaculture[J]. Journal of Fishery Sciences of China, 2001, 8(1): 89-93. (in Chinese with English abstract)
[24] 杨少丽,王印庚,董树刚. 海水养殖鱼类弧菌病的研究进展[J]. 海洋水产研究,2005,26(4):75-83. Yang Shaoli, Wang Yingeng, Dong Shugang. Progress of research on vibriosis in marine cultured fish[J]. Maine Fisheries Research, 2005, 26(4): 75-83. (in Chinese with English abstract)
[25] Nicolas J L, Basuyaux O, Mazurié J, et al., a pathogen of the abalone[J]. Dis Aquat Organ, 2002, 50(1): 35-43.
[26] 王江勇,王瑞旋,刘广锋,等. 杂色鲍幼苗大规模死亡与细菌数量的关系[J]. 南方水产,2005,1(1):57-61. Wang Jiangyong, Wang Ruixuan, Liu Guangfeng, et al. The relationship between extensive death of larvae of abaloneReeve and number of bacteria[J]. South China Fisheries Science, 2005, 1(1): 57-61. (in Chinese with English abstract)
[27] 张兰河,左正艳,王旭明. 固相反硝化系统中微生物群落结构的研究进展[J]. 生物技术通报,2015,31(1):39-45. Zhang Lanhe, Zuo Zhengyan, Wang Xuming. Research progress on microbial community structure in solid-phase denitrification systems[J]. Biotechnology Bulletin, 2015, 31(1): 39-45. (in Chinese with English abstract)
[28] 吕军仪,林强,邓钢,等. 动物性饵料对养殖水体中菌数和理化因子的影响[J]. 中山大学学报:自然科学版,2007,46(2):59-62. Lü Junyi, Lin Qiang, Deng Gang, et al. Studies on the variation of the environmental factors in culturing water when fed the animal foods to the Seahorse,Bleeker[J]. Acta Scientiarum Naturalium Universitatis Sunyatseni, 2007, 46(2): 59-62. (in Chinese with English abstract)
[29] 宋奔奔,刘鹰,石芳永,等. 四种填料滤器处理养鱼排放水的硝化性能[J]. 农业工程学报,2010,26(11):231-236. Song Benben, Liu Ying, Shi Fangyong, et al. Nitrification of biofilters packed with four different substrates for treating mariculture wastewater[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2010, 26(11): 231-236. (in Chinese with English abstract)
[30] Yan H J, Saito T, Regan J M. Nitrogen removal in a single-chamber microbial fuel cell with nitrifying biofilm enriched at the air cathode[J]. Water Res, 2012, 46(7): 2215-2224.
[31] Kim S K, Kong I, Lee B H, et al. Removal of ammonium-N from a recirculation aquacultural system using an immobilized nitrifier[J]. Aquacult Eng, 2000, 21(3): 139-150.
[32] 张延青,刘鹰,石芳永,等. 海水生物滤器除氮性能及硝化动力学研究[J]. 环境工程学报,2010,4(8):1697-1703. Zhang Yanqing, Liu Ying, Shi Fangyong, et al. Study on total ammonia nitrogen removal performance of marine biofilters and nitrification kinetics[J]. Chinese Journal of Environmental Engineering, 2010, 4(8): 1697-1703. (in Chinese with English abstract)
[33] Emparanza E J M. Problems affecting nitrification in commercial RAS with fixed-bed biofilters for salmonids in Chile[J]. Aquacult Eng, 2009, 41(2): 91-96.
[34] Eding E H, Kamstra A, Verreth J A J, et al. Reporting standards for biofilter performance studies[J]. Aquacult Eng, 2006, 34(3): 234-260.
[35] Hynes R K, Knowles R. Production of nitrous oxide by Nitrosomonas europaea: Effects of acetylene, pH and oxygen [J]. Can J Microbiol, 1984, 30(11): 1397-1404.
[36] 张寒冰,黄凤莲,周艳红,等. 生物膜法处理养殖排放水的研究[J]. 生态环境,2005,14(1):26-29. Zhang Hanbing, Huang Fenglian, Zhou Yanhong, et al. Treatment of aquaculture wastewater by the biological film process[J]. Ecology and Environment, 2005, 14(1): 26-29. (in Chinese with English abstract)
[37] Zhu S M, Chen S. An experimental study on nitrification biofilm performances using a series reactor system[J]. Aquacult Eng, 1999, 20(4): 245-259.
[38] Zhu S M, Shen J Z, Ruan Y J, et al. The effects of different seeding ratios on nitrification performance and biofilm formation in marine recirculating aquaculture system biofilter[J]. Environ Sci Pollut R, 2016, 23(14): 14540-14548.
高霄龙,刘 鹰,李 贤,李文亚,徐建平,郝静薇. 鲍放养密度对循环水养殖水质的影响及生物滤器净化效果[J]. 农业工程学报,2017,33(21):244-252. doi:10.11975/j.issn.1002-6819.2017.21.030 http://www.tcsae.org
Gao Xiaolong, Liu Ying, Li Xian, Li Wenya, Xu Jianping, Hao Jingwei. Effects of stocking density on water quality ofIno in recirculating aquaculture and purification effect of biofilter[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2017, 33(21): 244-252. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2017.21.030 http://www.tcsae.org
Effects of stocking density on water quality ofIno in recirculating aquaculture and purification effect of biofilter
Gao Xiaolong1,2, Liu Ying3※, Li Xian1, Li Wenya4, Xu Jianping4, Hao Jingwei3
(1.266071,; 2.100049,; 3.116023,; 4.266033,)
This paper focused on the wastewater discharged from the aquaculture ofIno (), targeted at improving the comprehensive utilization rate of water circulation system, compared the changing characteristics of the aquaculture water environment between the high density (HD) group (500 m–2), the medium density (MD) group (300 m–2) and the low density (LD) group (100 m–2), and evaluated the water treatment effect of moving bed aerating biofilter. Results showed that stocking density had a significant effect on the concentration of total ammonia (TAN), nitrite nitrogen (NO2–-N), total nitrogen (TN), total phosphorus (TP) and phosphate (PO43–-P) (<0.05), and the degree of effect could be ranked as: HD > MD > LD. The total number of heterotrophic bacteria in each density group increased over time; except the 2ndand 11thsampling, the total number of heterotrophic bacteria in the HD group at other time points was significantly higher than that in the MD and LD group (<0.05). The MD and HD group showed no significant difference in the concentration of nitrate nitrogen (NO3–-N) and chemical oxygen demand (COD) (>0.05), but were significantly higher than that in LD group (<0.05). At the 1st, 2nd, 3rdand 5thsampling, no significant difference in respect of the total number ofwas identified among the density groups (>0.05), and from the 6thsampling to the end of the experiment, the total number ofin the MD and HD group was significantly higher than that in the LD group (<0.05). In current conditions (water circulation rate, temperature, hydraulic loading), the average removal rate of biofilter for TAN, NO2–-N, NO3–-N, TN, PO43–-P, TP, COD was 16.40%, 15.81%, 2.93%, 12.22%, 2.91%, 6.48% and 9.47% respectively. At the point of the last sampling, no significant difference in respect of the removal rate of TAN was identified compared with the 8thand 14thsampling, but it was significantly higher than that in any other time point (<0.05). At the point of the 14thsampling, no significant difference in respect of the removal rate of NO2–-N was identified compared with the 5thand 13thsampling, but it was significantly higher than that in any other time point (<0.05). The biofilter had a better treatment effect on TAN and NO2–-N which produce an obvious toxic effect on abalone in the aquaculture wastewater. However, it had a relatively low treatment efficiency on the removal of NO3–-N, TN and the low-concentration PO43–-P and COD. Therefore, in view of the multiple factors including economic and ecological benefits, it will be more appropriate to set the density ofas 500 m–2in the multi-layer, three-dimensional recirculating aquaculture systems.
aquaculture; water quality; purification;Ino;density; biofilters
10.11975/j.issn.1002-6819.2017.21.030
S969.36
A
1002-6819(2017)-21-0244-09
2017-06-02
2017-10-14
国家自然科学基金(31472312, 31672673);国家贝类产业技术体系项目(CARS-48);江苏省重点研发计划(BE2015325)
高霄龙,男,博士,研究方向:养殖生态学研究。 Email:18354292961@163.com
※通信作者:刘 鹰,男,研究员,研究方向:水产工程及生态学。 Email:yingliu@dlou.edu.cn
