脉冲射频技术用于神经病理性疼痛的治疗参数研究进展*
2017-11-20贾怡童
贾怡童 罗 芳
(首都医科大学附属北京天坛医院疼痛中心,北京100050)
·特约综述·
脉冲射频技术用于神经病理性疼痛的治疗参数研究进展*
贾怡童 罗 芳Δ
(首都医科大学附属北京天坛医院疼痛中心,北京100050)
脉冲射频(pulsed radiofrequency, PRF)技术具有微创、安全、副作用少的优点,在治疗神经病理性疼痛(neuropathic pain, NP)方面具有巨大的潜力和临床应用价值。然而,目前PRF的镇痛效果仍待提高,理想的PRF参数、最佳的治疗部位等临床参数尚未确立。不少学者设计了体外蛋清实验以及动物模型对PRF不同的输出电压、治疗时间、电流波形、作用部位等进行了比较和观察,并取得了一定的成果,如在神经损伤后尽早进行PRF治疗镇痛作用越好,采用正弦波治疗效果更好等,但相关的临床研究较少,且鲜有明确的治疗效果。本文综述PRF技术治疗NP的实验和临床研究进展,旨在为提高PRF临床疗效提供有益的指导,争取让非毁损的PRF技术成为更多NP病人的一种治疗选择,改善NP病人的预后,提高其生活质量。
脉冲射频;神经病理性疼痛;治疗
1997年,Sluijter在国际疼痛学会欧洲联合会第二次年会上首次提出脉冲射频(pulsed radiofrequency, PRF)这种治疗慢性疼痛的新型技术[1]。该技术应用间断性的(脉冲频率为2 Hz)、短时的(电流持续作用时间为20 ms)、频率为500 KHz的高频交流电作用于靶组织,可能通过调节神经功能来达到缓解疼痛的目的。虽然一个周期内高频电流在持续作用的20 ms内使靶组织接受到高电压(最早提出的输出电压为45 V)并可产生热量,但在随后的480 ms的间歇期内热量被消散,从而保证电极尖端的温度不超过42℃,因此不会造成靶组织的热损伤。
近年来,PRF技术得到全世界许多开展疼痛治疗医生的关注。目前,国内外学者相继报道PRF技术应用于多种慢性疼痛性疾病获得比较满意的疗效。神经病理性疼痛(neuropathic pain, NP)是由躯体感觉神经系统的损伤或疾病而直接造成的。临床上NP可表现为颈神经根性疼痛、腰神经根性疼痛、三叉神经痛、舌咽神经痛、肋间神经痛、坐骨神经痛、带状疱疹后神经痛、残肢痛和幻肢痛等[2]。PRF技术微创、安全、副作用少的优点使其在治疗NP方面具有巨大的潜力和临床应用价值。
临床观察显示对于多种NP而言,PRF已经成为一种比较有效的治疗技术。然而,目前PRF的镇痛效果仍待提高,理想的PRF参数、最佳的治疗部位等临床参数尚未确立。本文综述PRF技术治疗NP的实验和临床治疗参数研究进展,旨在为提高PRF临床疗效提供有益的指导,争取让非毁损的PRF技术成为更多NP病人的一种治疗选择。
一、PRF技术治疗NP参数的实验研究
1. PRF治疗NP的机制研究进展
目前,PRF治疗NP的机制还不十分明确。陈旧的观点曾认为PRF是通过产生一定的热量导致神经组织的损伤从而阻断神经纤维的传导治疗NP的[3]。近年来形成的共识是PRF通过射频电流产生的电场效应导致靶神经组织的分子结构发生变化从而达到缓解疼痛的目的[4]。特别是近年来,很多学者对PRF治疗NP的分子生物学机制进行了系列研究。
Park等[5]对NP动物模型分别进行PRF治疗和假治疗,在进行PRF治疗后的第12天发现,PRF治疗组机械痛敏显著降低、脊髓背角小胶质细胞标记分子免疫反应降低,但冷痛敏和胶质纤维酸性蛋白的表达无明显变化。由此认为,PRF治疗降低疼痛模型机械痛敏的机制与抑制脊髓背角小胶质细胞的激活有关。Liu等[6]将坐骨神经慢性缩窄性损伤模型(chronic constriction injury, CCI)大鼠随机分为PRF治疗组和假手术对照组,于PRF治疗前后检验各组大鼠背根神经节(dorsal root ganglion, DRG)中超极化激活-环核苷酸门控的阳离子(hyperpolarizationactivated cyclic nucleotide-gated, HCN)通道的表达水平。结果显示,PRF治疗组DRG中HCN1和HCN2的表达水平明显增高。由此推断,PRF可通过调节HCN的表达来治疗疼痛。Yeh等[7]也进行了相关的实验,他们推断PRF最有可能通过下调胰岛素样生长因子-2 (insulin-like growth factors-2,IGF-2)以及抑制细胞外调节蛋白激酶(extracellular regulated protein kinases, ERK)的活性以持久缓解NP。Jia等[8]报道PRF作用于大鼠坐骨神经CCI模型可以显著降低该模型的机械痛敏和热痛敏,并认为PRF治疗NP的机制与显著上调NP模型脊髓背角和受压迫的坐骨神经组织中胶质细胞源性神经营养因子(glia cell line-derived neurotrophic factor,GDNF)的表达有关。Choi等[9]发现PRF治疗坐骨神经分支选择损伤(spared nerve injury, SNI)模型后30天肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和白细胞介素-6 (interleukin-6, IL-6)均上调,同时PRF治疗组Aδ和C纤维的损伤明显大于Aβ纤维,因此推断PRF的作用机制与促进炎性因子的表达、阻断Aδ纤维和C纤维的传导有关。
近年来,尽管PRF治疗NP的机制研究有所进展,但是仍然缺乏比较完善的解释。所有关于该技术治疗机制的研究均局限在探讨痛觉回路上NP模型可能涉及的受体、神经递质等的变化上,但PRF,NP相关因子,疼痛行为学三者之间确切的关系还需要实验进一步阐明,特别是有待应用基因敲除、特异性拮抗等技术进一步明确PRF治疗NP的机制。当然,PRF治疗NP的作用可能存在多种机制,这些机制可能并非孤立,有待开展涉及多方位的机制研究工作。
2. PRF治疗NP参数的研究
目前,PRF技术治疗NP的实验研究涉及多种NP模型,包括CCI模型、脊神经结扎(spinal nerve ligation, SNL)模型、SNI模型、带状疱疹后神经痛(postherpetic neuralgia, PHN)模型等。最早提出的PRF参数是脉冲频率2 Hz、输出电压45 V、电极尖端温度42℃、每次发出射频电流持续20 ms、治疗时间120 s。由于使用的射频疼痛治疗仪型号、性能不同,不同的学者在进行实验研究时参数并不完全一致。近年来,研究者逐渐发现PRF的输出电压、波形、治疗时间、作用部位等都可能影响PRF的治疗效果。因此,关于PRF的治疗参数等研究逐渐开展起来。
(1)不同的温度
Heavner等[10]采用10 ms、2 Hz的射频电流进行新鲜蛋清实验,比较了42℃、60℃、65℃和70℃PRF的热凝效果,结果发现在42℃PRF时没有凝固物形成,但60℃以上即使是PRF模式也会产生凝固物,提示在进行PRF治疗时应控制好电极尖端温度,防止发生组织变性。国内学者[11]用Baylis疼痛射频治疗仪在37℃恒温水浴箱内进行新鲜蛋清实验,观察自动脉冲射频模式下设定不同温度时组织相关参数的变化。结果发现,设定温度在42至50℃之间时,随着设定温度的升高,电极尖端实际温度和输出电压也随之升高,蛋清的电阻仅略微下降,蛋清组织未发生凝固现象。当设定温度50℃以上时,自动脉冲射频模式下脉冲频率2 Hz、脉宽20 ms,实际的组织温度达不到设定的温度仅为50℃左右,因此,未能形成凝固物。然而,当设定脉冲频率为4 Hz、温度为60℃及以上时,由于组织实际温度达到60℃及以上,肉眼可以观察到蛋清的凝固变性,提示临床上改进PRF参数时应注意组织实际的温度,一旦达到60℃及以上就可能导致组织损伤,带来治疗后的麻木等不良反应,运动神经损伤还会出现肌肉力量下降。
(2)不同的输出电压
Yeh等[12]将大鼠随机分组并采用不同的输出电压进行PRF实验观察,SNI+PRF-45 V组进行2 Hz、20 ms、42℃、45 V的PRF治疗,SNI+PRF-60 V进行2 Hz、20 ms、42℃、60 V的PRF治疗,研究结果发现两组都获得了显著的镇痛效果,两组间机械痛敏和冷痛敏无明显差异。因此,改变输出电压是否能改善PRF的治疗效果,我们还无从得知。
(3)不同的治疗开始时间
Yeh等[7]还对神经损伤后开始治疗的时间进行了对照实验,将PRF治疗分成即刻治疗组和延迟治疗组,前者是在坐骨神经损伤后立即进行PRF治疗,延迟治疗组是在坐骨神经损伤后14天再进行PRF治疗,结果发现即刻治疗组具有更好的镇痛效果。该结果提示PRF治疗NP模型可能存在治疗窗,临床上应尽早采用PRF治疗才可能得到更好的治疗效果。
(4)不同的脉冲波形
Lin等[13]比较不同的PRF波形作用于大鼠DRG治疗NP的效果,发现正弦波的治疗效果显著优于直方波。研究结果提示,临床上也应探讨更为理想的脉冲波形、通过选择适当的PRF电流波形来提高治疗NP的效果。
(5)不同的治疗时间
不同的学者在实验中进行PRF的治疗时间也不同,Park等[5]的治疗时间为180 s,Yeh等[7]的治疗时间为360 s,Liu等[6]的作用时间为480 s,而Lee等[14]的实验中作用时间为120 s、间隔一段时间进行了第二次PRF治疗,这些实验结果证明PRF治疗2 min或8 min均具有显著的缓解疼痛的效果。Van Zundert等[15]的动物实验则对治疗时间进行了直观的比较,分别观察了2 min和8 minPRF作用于大鼠DRG的效果,发现延长治疗时间并未提高疗效。而Tanaka等[16]的研究结果正相反,随着PRF的治疗时间从2 min提高到6 min,治疗疼痛的效果也显著地改善。目前矛盾的实验研究结果可能与采用不同的NP模型、实验误差等有关。究竟延长PRF的治疗时间是否能够提高PRF的治疗效果,仍待进一步评价。
(6)不同的治疗部位
此外,不同学者进行PRF治疗时的作用部位也不尽相同。Perret等[4]制作了SNL模型,将42℃、2 Hz、输出电压25V的PRF电流作用于大鼠的DRG,治疗后14天PRF治疗组大鼠机械刺激缩足阈值明显高于对照组。Lee等[14]观察了PRF治疗大鼠坐骨神经CCI模型后的效果,将42℃、2 Hz的PRF电流作用于坐骨神经上120s,在治疗后的12小时和第7天检测大鼠的机械缩足频率和热缩足反应潜伏期,结果显示大鼠的缩足频率降低、缩足反应潜伏期延长。刘益鸣等[17]对大鼠坐骨神经CCI模型进行PRF治疗,治疗后1、7和14天测定大鼠疼痛行为学变化。结果显示,实验组的热痛阈逐渐升高,痛觉过敏和痛觉超敏比例逐渐降低。除了直接将射频电流作用于损伤节段相对应的DRG[5]和受压迫的坐骨神经[8,12]外,Liu等[6]制作了CCI模型,直接将PRF作用于损伤的坐骨神经邻近皮肤表面,也取得了良好的治疗效果。
目前,对于同一种NP模型,PRF治疗DRG、神经干和神经末梢均有治疗有效的报道,然而,在同一种NP模型上更理想的治疗部位未见评价;不同种类NP模型各自理想的治疗部位也未见研究。
二、PRF治疗NP的临床治疗参数研究
1. PRF治疗NP的临床观察
近年来,PRF作为一项比较新颖的微创介入技术广泛应用于NP的临床治疗,包括胸神经根性疼痛、坐骨神经痛、腰骶神经根性疼痛以及幻肢痛等(见表1)。Ökmen[18]等将慢性腰背痛病人分为了三组,分别进行激光治疗、脉冲射频以及连续射频,并进行为期一年的随访观察。结果显示,激光治疗的远期疼痛缓解效果最好,但脉冲射频治疗效果优于连续射频,考虑到激光治疗具有一定的创伤性,笔者认为脉冲射频也是治疗疼痛不错的选择。Magistroni等[19]报道,1名左侧臂丛神经损伤疼痛病人经过外科开放性手术、治疗参数的药物治疗及康复训练等疼痛均无缓解,剧烈疼痛严重影响正常生活,该病人接受PRF治疗后疼痛得到了很大程度的缓解。West等[20]对4例幻肢痛的病人进行了PRF治疗后病人的疼痛程度缓解了80%以上,且对假体耐受性也有一定程度的提高。Uchida等[21]应用PRF治疗了3例乳腺癌手术后胸神经根性疼痛的病人,证实PRF对乳腺癌病人术后的顽固性神经痛有良好的治疗效果。Vigneri等[22]报道了34例腰骶神经根性疼痛的病人接受PRF治疗后6个月,PRF的疼痛缓解作用仍然存在。
然而,由于临床研究受到各方面的限制,多数报道为临床病例的观察性研究,目前缺乏循证医学证据等级比较高的随机双盲对照研究。PRF治疗NP的疗效有待开展大规模、多中心、治疗参数的临床研究,为该技术的临床应用提供最高级别的证据支持。
2. 不同的治疗参数、作用部位等治疗参数研究
目前PRF治疗多种NP病人均有比较满意的病例报道,但是疗效仍然有待进一步提高。国内外学者已经注意到PRF的脉冲剂量可能与其疗效有关,因此,目前临床上逐步开展了探讨PRF的治疗参数的研究。
(1)不同的电压
Luo等[23]发现,PRF治疗三叉神经痛或眶下神经痛时,术中输出电压与治疗后病人的疼痛评分呈负相关。因此,提高PRF的输出电压可能提高PRF治疗NP的疗效。2015年,Fang等一项随机对照研究提出半月神经节高电压较标准电压PRF治疗三叉神经痛的疗效显著提高[24]。然而,PRF的输出电压与疗效之间的量效关系、高电压PRF对其它类型NP的疗效尚未涉及,也缺乏多中心、随机、对照研究的证据。高电压PRF技术的物理学、作用机制和生物学效应均值得进一步研究以明确这一具有临床应用前景的技术的科学基础。而且,仍需深入的离体及在体实验研究评价高电压使神经组织产生的病理生理学变化。
(2)不同的温度
传统的42℃PRF治疗三叉神经痛的效果并不明显,维持时间短且复发率高,因此国内学者[25]对32例42℃标准PRF治疗效果欠佳、不愿意接受微血管减压术、射频热凝术和γ刀等治疗的三叉神经痛病人进行了50℃的PRF治疗,试图通过改变作用温度来提升治疗效果。结果显示32例病人经50℃PRF治疗后3个月内均获得满意的疼痛缓解,3个月时疼痛缓解率为96.9%,此研究提示我们,在进行传统的PRF治疗效果不满意时,适当提高射频电流的温度是一项可供参考的途径,而不必一定用损伤程度较高的热凝毁损术。当然,临床上升高温度PRF推广应用的前提条件还需通过神经电生理技术深入探索其安全性。
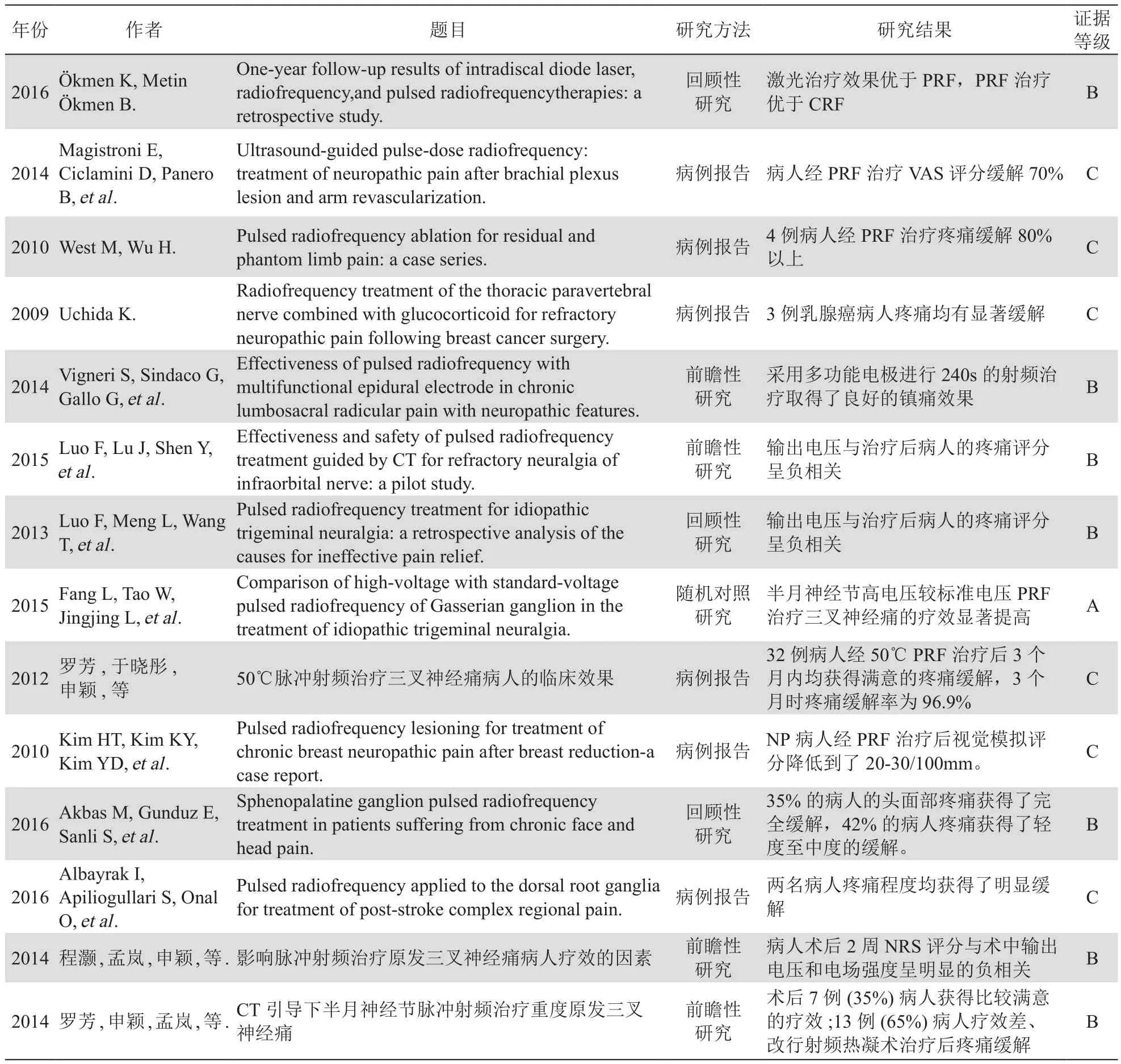
表1 PRF治疗神经病理性疼痛的临床研究进展
(3)不同的治疗时间和治疗次数
Vigneri等[22]选取了患有腰骶神经痛的34例病人进行PRF治疗,结果发现采用多功能电极进行240 s的射频治疗取得了良好的镇痛效果。另外还有一些学者进行两次PRF治疗,如Uchida等[21]在对乳腺癌术后难治性NP病人进行PRF治疗时,采用2 Hz、20 ms、42℃的射频电流先后进行了120 s和240 s的两次射频治疗,结果发现4名病人的疼痛程度得到了80%以上的改善。Kim等[26]在对乳房缩小术后NP病人进行治疗时,对T4神经根进行了两次120 s的PRF治疗,结果发现视觉模拟评分(visual analogue scale, VAS)降低到了20~30/100 mm。Akbas等[27]采用PRF治疗病人的头面部疼痛,采用2 Hz、0.5~0.7 V、42℃的射频电流作用于蝶腭神经节,并进行4次120 s的脉冲射频循环,最后35%的病人的头面部疼痛获得了完全缓解,42%的病人疼痛获得了轻度至中度的缓解。然而,临床上对PRF治疗参数、治疗次数的比较研究很少,在今后的研究中相关学者可以在这方面深入探索。
(4)不同的治疗部位
临床上PRF治疗NP时大多以相应节段的DRG为作用靶点[22,26],部分临床观察性研究中PRF直接作用于神经干上[19,28],都取得了比较满意的治疗效果。显而易见的是,外周神经PRF操作简便,穿刺风险小,具有一定的优势。但外周神经PRF的治疗效果是否优于DRG还未见相关报道。
(5)影像技术引导
另外,为了提高PRF的疗效,很多学者开始采用超声引导下进行操作。Magistroni等[19]在超声下对臂丛神经损伤的病人进行了PRF治疗,结果显示,病人的疼痛评分降低了70%。国内学者[29]则在CT引导下对三叉神经痛的病人进行PRF治疗,也取得了良好的镇痛效果。
3. 不良反应和并发症研究
PRF适用于慢性神经性疼痛、手术后疼痛和晚期肿瘤疼痛等多个领域,是一种微创介入技术,与药物治疗相比,具有起效快、针对性强的优点,与连续射频(continuatinal radiofrequency, CRF)相比,安全性高、对神经毁损小。在大多数文献中[19,22],均阐明PRF治疗后未出现明显的不良反应和并发症。程灏等[28]的临床研究中报道1例病人半月神经节PRF治疗三叉神经痛后出现了恶心、呕吐,数小时后即恢复。总体看来,PRF的不良反应小、安全性高,可作为NP的常规治疗方法,值得在临床上推广应用。
三、展望
近年来,关于PRF治疗NP的报道越来越多,学者对于PRF的作用机制、治疗效果的研究也逐渐深入。由于PRF的作用机制尚未明确,因此尚无提高PRF疗效的机制上的切入点。尽管对于PRF的治疗参数等进行了对照,除了认为提高PRF的输出电压可能是提高疗效的方法外,其他提高PRF疗效的治疗参数尚未明确。同时,虽然PRF治疗NP动物模型的研究不断完善,但大多都是简易的CCI、SNL模型,对于三叉神经痛等较复杂的模型也未见报道。
总之,PRF治疗NP领域还有很多方面需要探索,在今后的研究中,笔者认为可以对如何通过调整参数以及治疗部位来改善PRF的治疗效果进行实验设计,尤其是需要丰富相关的临床实验,并探索出一套系统的治疗参数,为NP病人探寻更加理想的治疗策略。
[1]Sluijter ME. Non-thermal radiofrequency procedures in the treatment spinal pain. Pain in Europe; 2nd Annual Congress of the European federation of IASP Chapters,Barcelona, 1997, 326.
[2]Lopez-Jornet P, Molino-Pagan D, Parra-Perez P,et al.Neuropathic Pain in Patients with Burning Mouth Syndrome Evaluated Using painDETECT. Pain Med, 2017,pii:pnw 304.
[3]Munglani R. The longer term effect of pulsed radiofrequency for neuropathic pain. Pain, 1999, 80: 437 ~439.
[4]Perret DM, Kim DS, Li KW,et al. Application of pulsed radiofrequency currents to rat dorsal root ganglia modulates nerve injury-induced tactile allodynia.Anesth Analg, 2011, 113:610 ~ 616.
[5]Park HW, Ahn SH, Son JY,et al. Pulsed radiofrequency application reduced mechanical hypersensitivity and microglial expression in neuropathic pain model. Pain Med, 2012, 13:1227 ~ 1234.
[6]Liu Y, Feng Y, Zhang T. Pulsed radiofrequency treatment enhances dorsal root ganglion expression ofhyperpolarization-activated cyclicnucleotide-gated channels in a rat model of neuropathic pain. J Mol Neurosci, 2015, 57:97 ~ 105.
[7]Yeh CC, Sun HL, Huang CJ,et al. Long-term antiallodynic effect of immediate pulsed radiofrequency modulation through down-regulation of Insulin-Like Growth Factor 2 in a neuropathic pain model. Int J Mol Sci, 2015, 16:27156 ~ 27170.
[8]Jia Z, Ren H, Li Q,et al. Pulsed radiofrequency reduced neuropathic pain behavior in rats associated with upregulation of GDNF expression. Pain Physician,2016, 19:49 ~ 58.
[9]Choi S, Choi HJ, Cheong Y,et al. Internal-specific morphological analysis of sciatic nerve fibers in a radiofrequency-induced animal neuropathic pain model.PLoS One, 2013, 8:e73913.
[10]Heavner JE, Boswell MV, Racz GB. A comparison of pulsed radiofrequency and continuous radiofrequency on thermocoagulation of egg white in vitro. Pain Physician, 2006, 9:135 ~ 137.
[11]罗芳, 于晓彤, 李多依, 等. 应用蛋清实验探讨脉冲射频的频率及温度参数的安全性. 中国疼痛医学杂志,2012, 18(12):742 ~ 745.
[12]Yeh CC, Wu ZF, Chen JC,et al. Association between extracellular signal-regulated kinase expression and the anti-allodynic effect in rats with spared nerve injury by applying immediate pulsed radiofrequency. BMC Anesthesiol, 2015, 15:92.
[13]Lin WT, Chang CH, Cheng CY,et al. Effects of low amplitude pulsed radiofrequency stimulation with different waveform in rats for neuropathic pain. ConfProc IEEE Eng Med BiolSoc, 2013, 2013:3590 ~ 3593.
[14]Lee JB, Byun JH, Choi IS,et al. The effect of pulsed radiofrequency applied to the peripheral nerve in chronic constriction injury rat model. Ann Rehabil Med, 2015,39:667 ~ 675.
[15]Van Zundert J, de Louw AJ, Joosten EA,et al. Pulsed and continuous radiofrequency current adjacent to the cervical dorsal root ganglion of the rat induces late cellular activity in the dorsal horn. Anesthesiology, 2005,102: 125 ~ 131.
[16]Tanaka N, Yamaga M, Tateyama S,et al. The effect of pulsed radiofrequency current on mechanical allodynia induced with resiniferatoxin in rats. Anesth Analg, 2010,111:784 ~ 790.
[17]刘益鸣, 张挺杰, 冯艺. 脉冲射频对CCI大鼠背根神经节HCN通道的影响. 中国疼痛医学杂志, 2013,19(6):323 ~ 329, 335.
[18]Ökmen K, Metin Ökmen B. One-year follow-up results of intradiscal diode laser, radiofrequency, and pulsed radiofrequency therapies: a retrospective study. Lasers in Medical Science, 2016, 21:Epub ahead of print.
[19]Magistroni E, Ciclamini D, Panero B,et al. Ultrasoundguided pulse-dose radiofrequency: treatment of neuropathic pain after brachial plexus lesion and arm revascularization. Case Rep Med, 2014, 2014:429618.
[20]West M, Wu H. Pulsed radiofrequency ablation for residual and phantom limb pain: a case series. Pain Pract,2010, 10:485 ~ 491.
[21]Uchida K. Radiofrequency treatment of the thoracic paravertebral nerve combined with glucocorticoid for refractory neuropathic pain following breast cancer surgery. Pain Physician, 2009, 12:E277 ~ 283.
[22]Vigneri S, Sindaco G, Gallo G,et al. Effectiveness of pulsed radiofrequency with multifunctional epidural electrode in chronic lumbosacral radicular pain with neuropathic features. Pain Physician, 2014, 17: 477 ~486.
[23]Luo F, Meng L, Wang T,et al. Pulsed radiofrequency treatment for idiopathic trigeminal neuralgia: a retrospective analysis of the causes for ineffective pain relief.Eur J Pain, 2013, 17:1189 ~ 1192.
[24]Fang L, Tao W, Jingjing L,et al. Comparison of highvoltage with standard-voltage pulsed radiofrequency of Gasserian ganglion in the treatment of idiopathic trigeminal neuralgia. Pain Pract, 2015, 15:595 ~ 603.
[25]罗芳, 于晓彤, 申颖, 等. 50℃脉冲射频治疗三叉神经痛病人的临床效果. 中国疼痛医学杂志, 2012,18(3): 144 ~ 147.
[26]Kim HT, Kim KY, Kim YD,et al. Pulsed radiofrequency lesioning for treatment of chronic breast neuropathic pain after breast reduction-a case report. Korean J Anesthesiol, 2010, 59:S238 ~ 241.
[27]Akbas M, Gunduz E, Sanli S,et al. Sphenopalatine ganglion pulsed radiofrequency treatment in patients suffering from chronic face and head pain. Braz J Anesthesiol, 2016, 66:50 ~ 54.
[28]程灏, 孟岚, 申颖, 等. 影响脉冲射频治疗原发三叉神经痛病人疗效的因素. 中国疼痛医学杂志, 2014,20(7):467 ~ 471.
[29]罗芳, 申颖, 孟岚, 等. CT引导下半月神经节脉冲射频治疗重度原发三叉神经痛. 中国疼痛医学杂志,2014, 20(5):324 ~ 327.
10.3969/j.issn.1006-9852.2017.07.001
北京市医院管理局临床医学发展专项经费资助(XMLX201707)、北京市卫生系统高层次人才(学科骨干)项目(2014-3-035)
△通讯作者 13611326978@163.com
