有机阴离子转运多肽OATP1A2介导芬太尼的转运*
2017-11-20杨惠雯黄利华欧阳文
杨惠雯 张 帆 黄利华 韩 睿 欧阳文 向 红 廖 琴△
(1中南大学湘雅三医院麻醉科,长沙410013;2中南大学湘雅三医院实验中心,长沙410013)
有机阴离子转运多肽OATP1A2介导芬太尼的转运*
杨惠雯1张 帆1黄利华2韩 睿1欧阳文1向 红2廖 琴1△
(1中南大学湘雅三医院麻醉科,长沙410013;2中南大学湘雅三医院实验中心,长沙410013)
目的:建立稳定表达有机阴离子转运多肽1A2 (organic anion-transporting polypeptide 1A2,OATP1A2)的HEK293细胞株,体外研究OATP1A2是否转运芬太尼(Fentanyl)。方法:用脂质体转染法将pIRES2-ZsGreen1-OATP1A2质粒转染至HEK293细胞中,G418 (600 mg/ml)筛选单克隆阳性细胞,采用Western blot、RT-PCR证实HEK293-OATP1A2构建成功;用不同浓度的探针药物非索非那定(Fexofenadine, FEX)验证HEK293-OATP1A2的转运功能;运用不同浓度的芬太尼孵育细胞,另取两组用相同浓度的芬太尼孵育的细胞,分别加或不加抑制剂柚皮素(Naringenin, 100 µg/mL)进行HEK293-OATP1A2转运实验。结果:FEX浓度为1、10、100 nM时HEK293-OATP1A2实验组与HEK293-VC对照组,FEX的吸收值均有显著的统计学差异(P< 0.05),且FEX浓度为100 nM时,实验组对FEX的吸收值是对照组的2.8倍;加入抑制剂柚皮素组FEX吸收值较不加抑制剂时减少了66.8±0.6%。芬太尼转运结果显示,芬太尼浓度为1、10、100、1000 nM时实验组与对照组比较,芬太尼的吸收值均有显著的统计学差异(P< 0.05),且芬太尼浓度为1000 nM时,实验组对芬太尼的吸收值是对照组的2.2倍;加入抑制剂组芬太尼的吸收值较未加抑制剂组减少了86.5±0.5% (P< 0.05)。结论:成功建立了稳定表达OATP1A2的 HEK293 细胞株,体外研究发现OATP1A2能介导芬太尼的转运。
有机阴离子转运体多肽1A2;芬太尼;底物;转运功能;过表达
芬太尼(fentanyl)是临床麻醉和各类急、慢性疼痛治疗中常用的阿片类药物。临床研究发现,芬太尼的镇痛效应和不良反应有显著的个体差异。遗传变异是造成镇痛药物标准剂量下个体药效和不良反应差异的主要原因[1]。中枢神经系统内阿片类药物的有效浓度是决定阿片类药物镇痛效应和副作用的关键,但阿片类药物需要穿过血脑屏障,与中枢神经系统的阿片受体结合才能发挥效应[2]。研究显示血脑屏障上有多种转运体,特别是血脑屏障上的ATP结合盒外排转运蛋白(ATP-binding cassette ef fl ux transporters, ABC)和摄入型溶质转运蛋白[solute carrier (SLC) in fl ux transporters]能有效调节脑内的药物浓度,对药物在中枢神经系统的分布和清除起决定性作用[3]。其中ABC转运体主要负责药物从脑组织向血的转运,SLC转运体主要负责药物从血向脑组织的转运[4]。
有机阴离子转运体(organic anion transporters,OATPs, 人类;Oatps, 啮齿动物)属于摄入型溶质转运蛋白家族主要成员,其编码基因统称为SLCO/Slco[4,5]。动物实验发现,Oatp竞争性抑制剂普伐他汀(Pravastatin)对芬太尼脑/血浆分配系数的影响远大于P糖蛋白(P-glycoprotein, P-gp)竞争性抑制剂维拉帕米对其的影响[6]。该研究提示血脑屏障Oatp的表达可能在芬太尼的跨血脑屏障转运中扮演了重要的角色。然而,人类血脑屏障OATP能否转运芬太尼至今尚未见报道。
目前,人类OATP家族已鉴定出OATP1A2、1B1、1B3、1C1、2A1、2B1、3A1、4A1、4C1、5A1和6A1共11个亚型,血脑屏障上主要表达的亚型是OATP1A2[4,5]。有学者发现OATP1A2转运内源性阿片肽δ阿片受体激动剂脑啡肽([D-penicillamine2,5]encephalin, DPDPE)、δ-啡肽 II (deltorphin II)[7]。我们推测芬太尼可能主要通过分布在血脑屏障的OATP1A2转运。为此,我们构建OATP1A2的过表达质粒(pIRES2-ZsGreen1-OATP1A2)并转染HEK293细胞,用不同浓度的芬太尼孵育这些细胞,并用高效液相色谱-串联质谱法(HPLC-MS/MS)测定细胞内芬太尼的浓度,发现OATP1A2过表达显著增加了细胞内芬太尼的浓度,通过体外实验初步证明OATP1A2能直接转运芬太尼。本研究为进一步探索OATP1A2的基因多态性在芬太尼镇痛效应及副作用个体差异中的作用,提供了前期的研究基础。
方 法
1. 实验材料与设备
重组质粒pIRES2-ZsGreen1-OATP1A2及对照质粒pIRES2-ZsGreen1由长沙赢润生物技术有限公司构建,OATP1A2从cDNA文库中扩增,引物为F: ctagctagcgccaccatgggagaaactgagaaaag, R: ccgctcgagttacaatttagttttcaatt。人胚胎肾脏细胞293 (Human Embryonic Kidney 293 cells, HEK293)购自中南大学湘雅医学院细胞库。细胞培养箱(Thermo371型,赛默飞世尔科技公司,美国),荧光显微镜(Olympus CX23,奥林巴斯公司,日本),实时荧光定量PCR仪(7900型,Applied Biosystems公司,美国)。液相色谱系统:超高效液相色谱仪带自动进样器和柱温箱(Applied Biosystems公司,美国);MS/MS系统:质谱仪(API4000型,Applied Biosystems公司,美国),带电喷雾离子化源(ESI)。精密天平(AB-265S型,梅特勒公司,日本);WH-2微量漩涡混合器(沪西分析仪器公司,上海)。
2. 药品与试剂
枸橼酸芬太尼标准品(100 mg,中国药品生物制品检定所)由中南大学药理研究所赠送;内标D5-芬太尼对照品(100 µg/ml,Sigma公司);盐酸非索非那定(100 mg,中国药品生物制品检定所);柚皮素(20 µg,大连美仑公司)、甲醇、乙腈、甲酸(500 ml,湖南汇虹试剂有限公司)均为色谱纯。胎牛血清(FBS)、DMEM (Dulbecco's modi fi ed Eagle's medium)高糖培养基以及转染用低血清培养基OPTI-MEM均购自美国Gibco公司;Lipofectamine™ 2000(1.5 ml,美国 Invitrogen公司);PBS缓冲液、青链霉素双抗和胰酶消化液购自Hyclone公司;抗体OATP1A2购自Abcam公司;小鼠抗β-actin抗体、山羊抗兔IgG/HRP二抗购自中杉金桥公司。氨苄青霉素和G418购自Sigma公司。提取总RNA的试剂盒购自Omega公司,反转录试剂盒购自赛默飞公司。BCA Protein Assay Kit和RIPA裂解液(强)购自碧云天公司。
3. 方法
(1)HEK293细胞培养
用含有10% FBS、1%双抗(100 U/ml青霉素和100 µg/ml链霉素)DMEM高糖培养基以温度37℃,5%CO2和95% 湿度孵育细胞。加入0.25%胰酶消化液按照1:3传代。
(2)G418筛选浓度确定
按照赵欣等的方法[8],在转染前对HEK293细胞进行剂量-反应分析,以确定G418杀死细胞的最低浓度。①在12孔板的每孔中加入100 µl细胞悬浮液(5×106cells/l),每孔中再加入900 µl含10%胎牛血清的DMEM培养基;②12孔依次加入0~11 µl 100 mg/ml的G418溶液(终浓度为0~1 100 µg/ml完全培养基,以 100 µg/ml梯度增加 ),将培养板在5% CO2、37℃培养箱温育。每3 d用含相应G418的新鲜培养基更换培养基;③10 d后以杀死所有细胞的G418最低浓度600 µg/ml为筛选浓度。
(3)HEK293细胞的转染
① 转染前细胞准备:转染前1 d,采用0.25%胰酶消化,将处于对数生长期的细胞制备成单细胞悬液,以约1×104细胞接种12孔培养板1孔,加含10%胎牛血清的DMEM培养基1 ml,在37℃、5%CO2饱和湿度培养箱中,待细胞生长至铺满培养板70%~80%。
② 脂质体/DNA复合物制备:根据Invitrogen Lipofectamine™ 2000说明书配制A液为1.6 µg纯化的pIRES2-ZsGreen1-OATP1A2 (或者pIRES2-ZsGreen1)质粒稀释于低血清OPTI-MEM培养基100 µl,B 液 为 Lipofectin2000 4 µl稀 释 于 OPTIMEM培养基100 µl,轻轻混合A、B液形成脂质体/DNA复合物,室温放置20 min。
③ 转染:用2 ml无血清DMEM培养基漂洗3次,然后将AB液缓缓加入12孔培养板中,摇匀,37℃、5% CO2细胞培养箱中放置4 h,加入10%胎牛血清的DMEM培养基1 ml,置入培养箱中培养。
(4)HEK293抗性细胞的筛选:转染后第2 d,用0.25%胰酶100 µl消化细胞,1孔细胞传至2个90 mm培养皿中。第3 d再加入G418进行持续加压筛选,用含10%胎牛血清的DMEM培养基每3 d更换一次。未转染质粒的HEK293细胞为对照组,继续培养约2周,待对照细胞全部死亡时,得到G418抗性细胞的稳定克隆。在基因转染组形成细胞集落后用克隆柱随机转移24个细胞集落,分别转种到2块12孔板。荧光显微镜下观察荧光蛋白表达情况,初步判断稳定表达OATP细胞的存活率。将稳定表达的组分一部分冻存保种,一部分传代,继续下一步实验。
(5)PCR方法验证质粒的OATP1A2序列和鉴定OATP1A2 mRNA的表达
用长沙赢润生物技术公司提供的上述克隆引物对重组质粒进行PCR扩增来验证质粒的OATP1A2序列。收集稳定转染的HEK293-OATP1A2、对照组HEK293-VC(空白质粒转染组)以及con-HEK293组(未做任何处理的细胞组),用E.Z.N.A. Total RNA Kit I(R6934-01 50 preps,OMEGA)提取细胞总RNA,取2 µg,以逆转录反应合成的cDNA为模板,用OATP1A2引物(见表1)进行PCR扩增,以β-actin为内参。25 µl反应体系包括0.5µl cDNA,7.5 µl SYBR Green PCR master mix 和上、下游引物各75 nM;PCR扩增程序为:95℃预变性5 min,94℃变性1 min,55℃退火1 min,循环35次;最后72℃延伸10 min。OATP1A2的Ct值(Cycles threshold)首先用相应的内参标准化(∆Ct=CtOATP1A2-Ctβ-Actin),2-Δt计算相应标本的相对表达量。对照组(con-HEK293或者HEK293-VC) 基因OATP1A2的表达与实验组(HEK293-OATP1A2)差异用下列公式计算 2-ΔΔCt(ΔΔCt =ΔCtEXP– ΔCtCONTROL)。
(6) Western blot鉴定OATP1A2蛋白的表达
收集稳定转染的HEK293-OATP1A2、HEK293-VC以及con-HEK293细胞,提取蛋白,采用BCA法进行蛋白质含量测定。取等量变性后的蛋白样品进行凝胶电泳,电泳结束后用转膜装置进行转膜,将膜于注射液中注射2 h。TBST洗三次,每次10 min,加一抗后,4℃孵育过夜。第2天,37℃孵育二抗1 h,加入ECL化学发光液后,用化学发光成像系统(Quant350,GE公司)分析。
(7) 转运吸收实验
按照Cvetkovic M和Glaeser H等的方法[9-11],用OATP1A2的已知底物非索非那定(Fexofenadine,FEX) (Km=6)[12],对稳定表达OATP1A2的细胞系进行底物转运的吸收实验。将过表达组(HEK293-OATP1A2)和对照组(HEK-VC)细胞分别以5×105个/孔接种至两组12孔板,每个浓度重复3次(FEX:1、10、100 nM;培养至 1×106个细胞,在 500 µl的培养介质中冲洗(磷酸盐缓冲液+ 2%FCS);然后用含有FEX 1、10、100 nM的100 µl的培养基在旋转振荡器中以37℃、450 rpm的转速进行最适时长的吸收时间15 min(选择呈线性关系的时间段内最大的值作为所有吸收实验的时间,使之保持在线性范围内)。先收集细胞外液,即直接吸收培养基,每个浓度一式三份收集于EP管保存;再用1 ml的冰冷PBS冲洗细胞三次,加入500 µl甲醇后收集细胞至EP管,用超声细胞碎裂仪捣碎细胞,最后将混合液离心3 000 rpm、4℃,10 min,取上清液,-20℃冷冻储存待分析。在含有100 nM FEX(或者100 nM芬太尼)的吸收溶液中加入OATP1A2特异性抑制剂柚皮素100 µg/ml,按照上述方法再进行一组吸收实验,作为加抑制剂情况下底物转运的吸收实验。芬太尼按照同样的方法进行实验。每组重复三次,整个实验过程重复两次。
(8)HPLC-MS/MS法测定药物浓度
芬太尼和FEX的浓度测定参考田莹莹和Mandery K等报道的方法[13,14]。样品去蛋白处理后,加入双倍体积含有内标的甲醇溶液。色谱分离采用菲罗门分析柱(synergiTM Polar-RP 80A 150 mm ×2.0 mm, 4 µm),流动相为甲醇:乙酸铵(含0.2%甲酸)=(9:1, V/V),柱温40℃,流速200 µl/min。进样量为2 µl,每个样品运行5 min。质谱条件为电喷雾电离源(ESI),检测方式为正离子方式、多离子反应监测(MRM),用于定量分析的离子为芬太尼m/z 337.1→ 188.2,FEX m/z 502.5→ 466.3,D5-芬太尼m/z 342.2→188.2。芬太尼和FEX的内标均为D5-芬太尼。芬太尼和FEX的标准曲线范围均(5~1 000) ng/ml。每一浓度水平的QC样品的日内精密度(RSD) < 15%,日间精密度(RSD) < 15%,准确度在85%~115%之间。分析软件为Analyst 1.5.1 software (AB, Singapore)。

表1 用于实时荧光定量PCR的引物序列Table 1 Nucleotide sequences of primers used in real-time quantitative PCR
4. 统计分析
OATP1A2介导芬太尼和FEX转运的各组间百分比分析运用GraphPad Prism 5.0软件统计。OATP1A2介导的芬太尼净吸收为OATP1A2过表达组和空白细胞组吸收值的差值;采用双因素方差分析和Dunnett's多项比较检验统计 HEK293-OATP1A2和HEK293-VC介导的芬太尼和FEX吸收差异;抑制剂的影响采用非配对t检验和Welch's矫正分析。实验结果均以均数±标准差(±SD)表示,P< 0.05为差异有统计学意义。
结 果
1. pIRES2-ZsGreen1-OATP1A2重组质粒的验证
将质粒DNA的PCR产物进行琼脂糖凝胶电泳检测,结果显示:在2013 bp处有特异的条带,结果与OATP1A2基因大小一致(见图1A)。用NheI、XhoI双酶切重组质粒,结果显示:切出约2013 bp的OATP1A2片段和约5300 bp的载体片段,与预期一致(见图1B)。同时,将PCR产物测序所得的序列在NCBI中进行序列比对,显示构建序列与目的基因序列完全一致,编码氨基酸序列100%正确,说明pIRES2-ZsGreen1-OATP1A2构建成功。

图1 pIRES2-ZsGreen1-OATP1A2质粒的PCR验证A:pIRES2-ZsGreen1-OATP1A2质粒DNA PCR电泳条带在2013 bp左右与OATP1A2大小一致,说明为目的条带;B:酶切pIRES2-ZsGreen1-OATP1A2重组质粒后电泳条带与载体、目的基因的大小均一致。Fig.1 Verification of pIRES2-ZsGreen1-OATP1A2 plasmid by PCR method A: The electrophoresis shows that the band of the PCR products of OATP1A2 plasmid is about 2013 bp, which is consistent with the size of OATP1A2; B: The products of restriction endonuclease digestion were consistent with the sizes of the plasmid vector and the objective gene.
2. HEK293-OATP1A2过表达细胞稳定株的建立与验证
我们参考 Jörg König和 Mitchell E. Taub等的方法[15,16],采用脂质体法转染质粒到HEK293细胞后选择过表达的克隆细胞,然后通过标记抗生素筛选得到稳定过表达OATP1A2蛋白及带有荧光蛋白标记的空载质粒的HEK293细胞株。荧光显微镜下可见两组细胞的荧光蛋白,初步证明稳定株转染成功(见图2)。进一步确定目的基因是否表达,我们首先通过荧光定量PCR对HEK293-OATP1A2组、HEK293-VC组、con-HEK293组 的mRNA表达情况进行了检测,结果显示HEK293-OATP1A2组相对表达量明显高于后两组,说明OATP1A2的mRNA过表达成功(见图3A);然后采用Western blot检测三组样品的蛋白表达情况,电泳结果显示HEK293-OATP1A2组的蛋白条带最明显(见图3B),运用Image J软件分析,结果显示HEK293-OATP1A2组的灰度值明显高于后两者,说明OATP1A2蛋白过表达成功(见图3C);而上述两个实验均显示后两组之间无明显差异,提示质粒载体本身对于细胞的OATP1A2基因表达没有明显影响。最后运用已知底物FEX[9]作为探针药物验证HEK293细胞过表达的OATP1A2蛋白的功能,FEX的吸收实验和吸收抑制试验结果显示,在100 nM的浓度时过表达OATP1A2组对FEX的转运吸收是HEK293-VC组的2.8倍;且HEK293-OATP1A2组和HEK293-VC组吸收百分比有明显的统计学差异(P< 0.05;Df = 2)(见图4A);观察抑制OATP1A2表达后FEX的吸收情况,加入抑制剂组吸收值为12.03±0.14 nmol/ (1×106)个细胞,对照组为36.24±0.28 nmol/ (1×106)个细胞,二者有明显的统计学差异(P< 0.05,见图4B)。
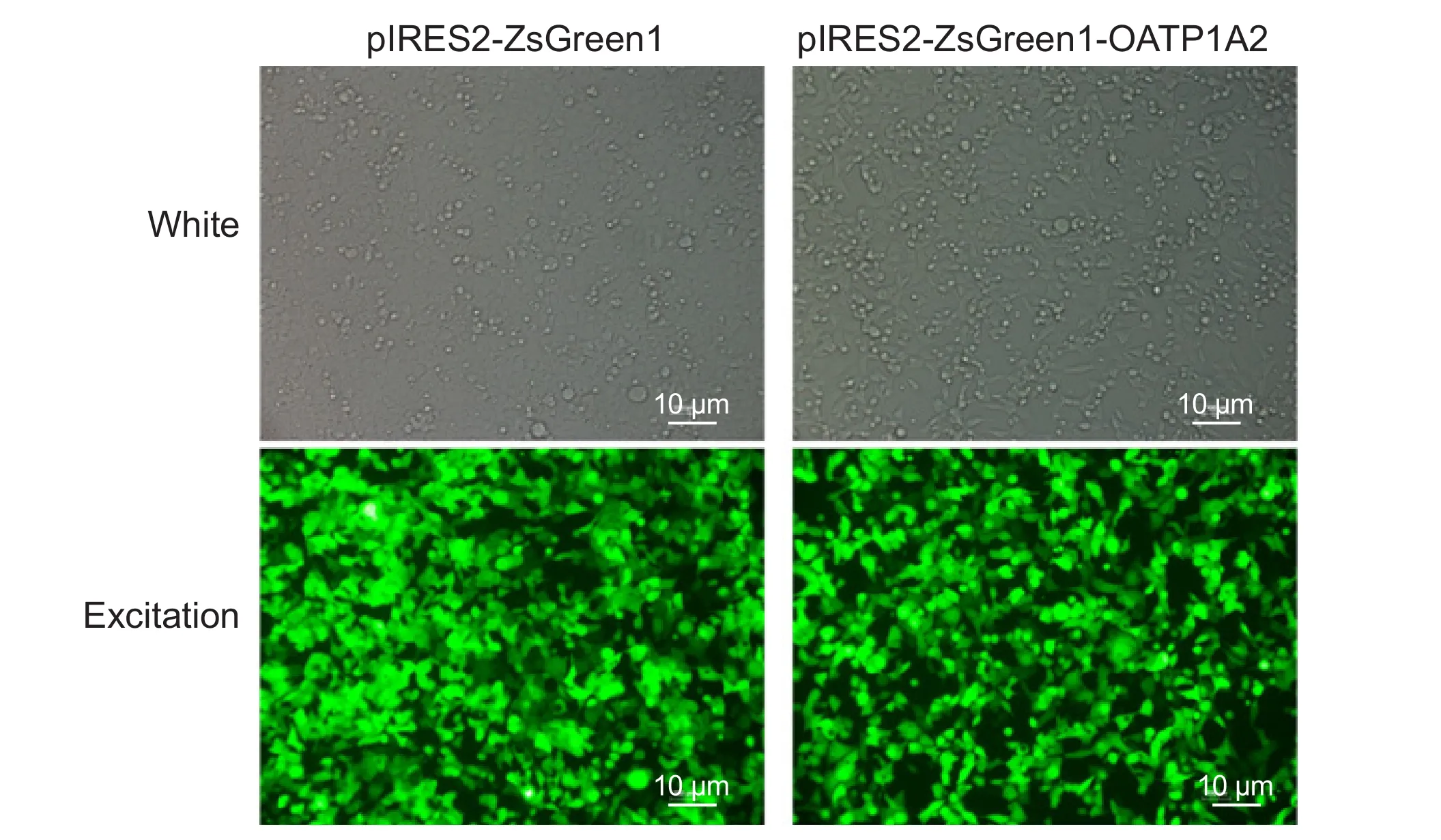
图2 pIRES2-ZsGreen1和pIRES2-ZsGreen1-OATP1A2脂质体法转染HEK293细胞48 h后荧光显微镜下(10×)细胞状态(Bar=10 µm),转染率> 80%Fig.2 HEK293 cells were transfected with pIRES2-ZsGreen1 and pIRES2-ZsGreen1-OATP1A2 using liposome transfection. After 48 hours, we observed the HEK293-VC cells (left) and HEK293-OATP1A2 cells (right) using white light and excitation light under fl uorescence microscope(10×) (Bar=10 µm). The transfection ef fi ciency according to green fl uorescence was above 80%.
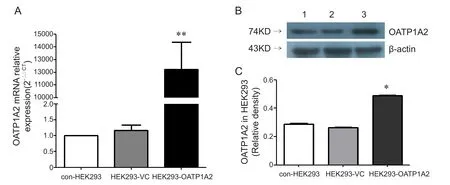
图3 过表达OATP1A2成功的细胞株HEK293-OATP1A2表达特征 (±SD)A:Q-PCR结果显示稳定表达OATP1A2的细胞株mRNA相对表达量显著高于空白质粒转染组(HEK293-VC)和未转染组(con-HEK293) (**P < 0.01);B:Western blot结果1、2、3(分别代表con-HEK293、HEK293-VC和HEK293-OATP1A2)蛋白条带均在74KD左右且与OATP1A2大小一致,但3号最明显,1和2号信号较低;C:灰度值相对量分析结果:HEK293-OATP1A2组明显升高 (*P < 0.05).Fig.3 Characterization of the HEK293-OATP1A2 cell line overexpressing OATP1A2 (±SD)A: Increased expression of OATP1A2 mRNA in HEK293 cells that stably expressing OATP1A2 compared with HEK293 cells transfected with the empty vector (**P < 0.01). B: Western blot of OATP1A2 in HEK293-OATP1A2, HEK293-VC, and con-HEK293 cells. At molecular mass of approximately 74kDa, strong signal was detected for HEK293-OATP1A2 cells, and weak signals were also detectable for HEK293-VC and con-HEK293 cells. C: The relative density of HEK293-OATP1A2 was signi fi cantly higher than that of the control group (*P < 0.05).
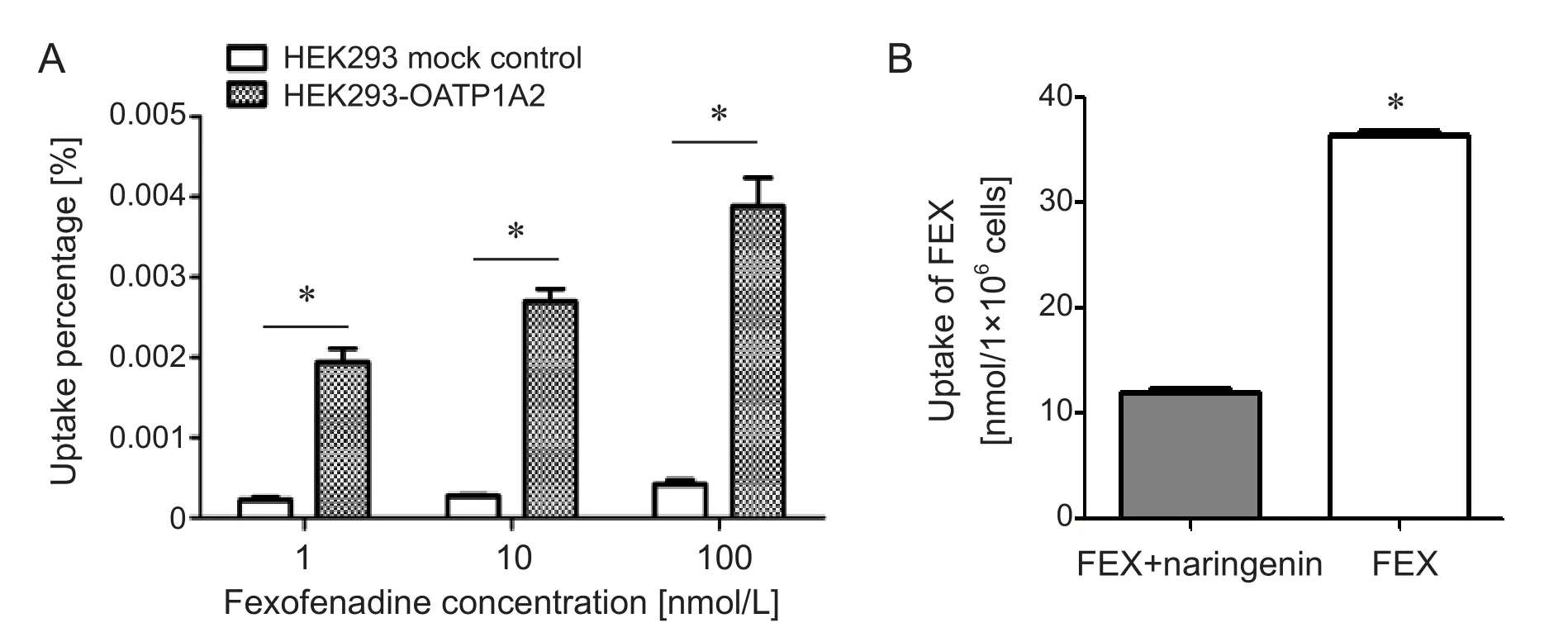
图4 A:HEK293-OATP1A2组较HEK293-VC组的FEX的转运显著升高 (*P < 0.05, F=36);B:加入OATP1A2特异性抑制剂柚皮素后,FEX的转运显著降低(*P < 0.05)。说明OATP1A2介导FEX的转运,验证了过表达细胞株的OATP1A2转运功能正常。Fig.4 A: Uptake percentage of FEX into HEK293-OATP1A2 and HEK293-VC cells. The HEK293-OATP1A2 cells showed a signi fi cantly higher uptake(2.8-fold) of FEX compared with HEK293-VC cells (*P < 0.05, F = 36). B: The uptake of FEX was signi fi cantly reduced compared with presence of inhibitor naringenin (100 µg/ml) (*P < 0.05). The transport function was normal by the uptake experiment of probe substrate in the HEK293 cell line stably expressing OATP1A2.
3. 芬太尼的转运吸收
为了验证芬太尼是否为OATP1A2的底物,我们选择过表达OATP1A2的细胞与空白质粒转染的细胞采用浓度梯度进行吸收实验,参考Ziesenitz等[17]所采用的芬太尼浓度1、10、100、1000 nM;同时进行半数效量序贯法检测芬太尼的细胞毒性,按剂量等比级数分为4~6组。实验从最可能接近ED50的剂量开始,将细胞接种至96孔板,选择OATP1A2转运底物常用的浓度范围5、10、100、150、300µM;显微镜下观察达到一半细胞死亡时的药物浓度,该浓度为最大用药浓度,约为100~150 µM。为排除芬太尼对细胞的药物毒性影响,我们所采取的浓度小于最大用药浓度。预实验发现吸收时间在15 min内吸收呈直线相关,因此选择吸收时间为15 min。我们的研究显示两组的吸收百分比有显著的统计学差异(P< 0.05; Df=3),且浓度为1 000 nM时过表达OATP1A2组对芬太尼的转运吸收是对照组HEK293-VC的2.2倍 (见图5A)。分别在HEK293-OATP1A2组加入100 nM芬太尼和100 nM芬太尼与40 µM的柚皮素(100 µg/mL)进行吸收实验,观察抑制OATP1A2表达后芬太尼的吸收情况,加入抑制剂组吸收值为2.62±0.06 nmol/(1×106)个细胞,对照组为19.39±0.23 nmol/(1×106)个细胞,二者有明显的统计学差异(P< 0.05,见图5B)。
讨 论
芬太尼是人工合成的µ阿片受体激动剂,起效快、效能高、作用时间短,广泛应用于临床麻醉与急慢性疼痛的治疗[6,18]。早在1999年,Henthorn TK等学者[19]发现芬太尼摄取入牛脑微血管内皮细胞和牛肺动脉内皮细胞的过程均主要是通过载体介导的主动转运,而不是被动扩散,但芬太尼的转运具体是由什么载体介导,作者未作深入的探究。此后有学者给Sprague-Dawley大鼠分别静脉注射芬太尼和P-gp竞争性抑制剂维拉帕米、Oatp竞争性抑制剂普伐他汀,然后采用高效液相色谱质谱联用法检测脑和肺内芬太尼浓度,发现Oatp竞争性抑制剂普伐他汀对芬太尼脑/血浆分配系数的影响远大于P-gp竞争性抑制剂维拉帕米对其的影响[6]。该研究提示血脑屏障Oatp可能在芬太尼的跨血脑屏障转运中扮演了重要的角色。但是,人类血脑屏障OATP能否转运芬太尼目前尚未见报道。

图5 A:HEK293-OATP1A2组较HEK293-VC组芬太尼的转运显著升高(F=8.7, *P=0.042);B:加入OATP1A2特异性抑制剂柚皮素后,芬太尼的转运显著降低 (*P < 0.05)Fig.5 A: Uptake percentage of fentanyl into HEK293-OATP1A2 and HEK293-VC cells. The HEK293-OATP1A2 cells showed a signi fi cantly higher uptake of fentanyl (F=8.7, *P=0.042) compared with HEK293-VC cells. B: The uptake of fentanyl had a significant reduction in HEK293-OATP1A2 cells compared with presence of inhibitor naringenin (*P < 0.05).
OATPs/Oatps属于摄入型溶质转运蛋白家族主要成员。目前,人类OATP家族已鉴定出11个亚型[4],其中OATP1A2是OATP家族中底物谱最广泛的成员,既可以转运阴离子化合物,也可以转运中性和阳离子化合物[20],包括内源性阿片肽δ-阿片受体激动剂DPDPE、deltorphin II、胆汁酸、类固醇及其结合物、甲状腺激素、HIV蛋白酶抑制剂、多柔比星以及多西紫杉醇等[15,21~24]。OATP1A2主要表达在血脑屏障[12,25]毛细血管内皮细胞顶侧,体外研究显示,其在底物型药物透血脑屏障中起重要作用[26]。因此,我们推测OATP1A2亚型能介导芬太尼的跨血脑屏障转运。
据国际转运体联合会的推荐,证明某物质是摄入型转运体的底物的第一个条件是过表达该转运体的细胞株底物吸收量显著高于对照组;第二个条件是已知抑制剂可以抑制过表达组细胞株对底物的摄取[11]。HEK293细胞是目前研究药物转运体与底物关系常用的体外模型之一[27]。为了证实我们的推测,我们首先建立稳定过表达OATP1A2的细胞株HEK293-OATP1A2,通过荧光显微镜观察HEK293-OATP1A2组与HEK293-VC组质粒载体标记物绿色荧光蛋白的表达量,初步判断二者转染率均大于80%,对照组稍高于实验组可能是因为实验组的目的基因影响了荧光蛋白基因的表达;荧光定量PCR检测出HEK293-OATP1A2组OATP1A2 mRNA表达显著高于HEK293-VC对照组;Western blot检测HEK293-OATP1A2组和HEK293-VC组的目的蛋白表达也有显著的统计学差异;这些都验证了稳定表达株建立成功。然后,运用OATP1A2的已知底物FEX作为探针药物验证稳定过表达细胞株的转运功能,一方面进行HEK293-OATP1A2组与HEK293-VC组的FEX吸收实验,另一方面运用过表达组细胞在加入抑制剂情况下进行FEX的吸收实验,采用HPLC-MS/MS法测定细胞内FEX的浓度,结果显示实验组与对照组有显著的统计学差异,与Mirjana Cvetkovic和Maki Shimizu研究[4]一致,表明OATP1A2过表达细胞株的转运功能正常。最后,用同样的OATP1A2过表达细胞株对芬太尼进行浓度梯度吸收实验,HPLC-MS/MS法测定细胞内药物的浓度,结果显示HEK293-OATP1A2组胞内芬太尼浓度显著高于HEK293-VC组;同时向HEK293-OATP1A2细胞株培养基中加入抑制剂柚皮素进行吸收实验,结果显示抑制有效,表明芬太尼是OATP1A2的底物。
我们首次通过体外实验证明有机阴离子转运多肽OATP1A2介导阿片类药物芬太尼的转运,并首次发现OATP1A2特异性抑制剂柚皮素能减少细胞对芬太尼的吸收。我们的研究结果为进一步探究芬太尼的作用机制提供基础,同时对芬太尼的靶向治疗和个体化用药有着重要的指导意义。
[1]郭一飞. 遗传药理学. 中国疼痛医学杂志, 2011,17(6): 345 ~ 348.
[2]Xiao Y, Deng J, Liu X,et al. Different Binding Sites of Bovine Organic Anion-Transporting Polypeptide1a2 Are Involved in the Transport of Different Fluoroquinolones. Drug Metabolism and Disposition, 2014, 42(8):1261 ~ 1267.
[3]Chan GN, Hoque MT, Bendayan R. Role of nuclear receptors in the regulation of drug transporters in the brain. Trends Pharmacol Sci, 2013, 34(7): 361 ~ 372.
[4]Roth M, Obaidat A, Hagenbuch B. OATPs, OATs and OCTs: the organic anion and cation transporters of the SLCO and SLC22A gene superfamilies. Br J Pharmacol, 2012, 165(5): 1260 ~ 1287.
[5]Ronaldson PT, Davis TP. Targeted drug delivery to treat pain and cerebral hypoxia. Pharmacol Rev, 2013,65(1):291 ~ 314.
[6]Elkiweri IA, Zhang YL, Christians U,et al. Competitive Substrates for P-Glycoprotein and Organic Anion Protein Transporters Differentially Reduce Blood Organ Transport of Fentanyl and Loperamide: Pharmacokinetics and Pharmacodynamics in Sprague-Dawley Rats.Anesthesia & Analgesia, 2009, 108(1): 149 ~ 159.
[7]Gao B, Hagenbuch B, Kullak-Ublick GA,et al. Organic anion-transporting polypeptides mediate transport of opioid peptides across blood-brain barrier. J Pharmacol Exp Ther, 2000, 294(1):73 ~ 79.
[8]赵欣, 杨向军, 白霞, 等. 稳定表达hHCN2基因HEK293细胞系的建立. 中国应用生理学杂志,2006(2): 254 ~ 256.
[9]Cvetkovic M, Leake B, Fromm MF,et al. OATP and P-glycoprotein transporters mediate the cellular uptake and excretion of fexofenadine. Drug Metab Dispos,1999, 27(8):866 ~ 871.
[10]Shimizu M, Fuse K, Okudaira K,et al. Contribution of OATP (organic anion-transporting polypeptide) family transporters to the hepatic uptake of fexofenadine in humans. Drug Metab Dispos, 2005, 33(10): 1477 ~ 1481.
[11]Glaeser H, Bujok K, Schmidt I,et al. Organic anion transporting polypeptides and organic cation transporter 1 contribute to the cellular uptake of the fl avonoid quercetin.Naunyn Schmiedebergs Arch Pharmacol, 2014, 387(9):883 ~ 891.
[12]Zhou Y, Yuan J, Li Z,et al. Genetic Polymorphisms and Function of the Organic Anion-Transporting Polypeptide 1A2 and Its Clinical Relevance in Drug Disposition.Pharmacology, 2015, 95(3-4): 201 ~ 208.
[13]田莹莹, 王医成, 武惠斌,等. HPLC-MS-MS法测定人血浆中芬太尼浓度及其生物等效性研究. 中国临床药理学与治疗学, 2012, 17(7): 785 ~ 790.
[14]Mandery K, Bujok K, Schmidt I,et al. In fl uence of the fl avonoids apigenin, kaempferol, and quercetin on the function of organic anion transporting polypeptides 1A2 and 2B1. Biochemical Pharmacology, 2010,80(11):1746 ~ 1753.
[15]Konig J, Glaeser H, Keiser M,et al. Role of Organic Anion-Transporting Polypeptides for Cellular Mesalazine(5-Aminosalicylic Acid) Uptake. Drug Metabolism and Disposition, 2011, 39(6): 1097 ~ 1102.
[16]Taub ME, Mease K, Sane RS,et al. Digoxin Is Not a Substrate for Organic Anion-Transporting Polypeptide Transporters OATP1A2, OATP1B1, OATP1B3, and OATP2B1 but Is a Substrate for a Sodium-Dependent Transporter Expressed in HEK293 Cells. Drug Metabolism and Disposition, 2011, 39(11): 2093 ~ 2102.
[17]Ziesenitz VC, König SK, Mahlke N,et al. Fentanyl Pharmacokinetics is not Dependent on Hepatic Uptake by Organic Anion-Transporting Polypeptide 1B1 in Human Beings. Basic Clin Pharmacol Toxicology, 2013, 113(1):43 ~ 48.
[18]Ikeda K, Ide S, Han W,et al. How individual sensitivity to opiates can be predicted by gene analyses. Trends Pharmacol Sci, 2005, 26(6): 311 ~ 317.
[19]Henthorn TK, Liu Y, Mahapatro M,et al. Active transport of fentanyl by the blood-brain barrier. J Pharmacol Exp Ther, 1999, 289(2): 1084 ~ 1089.
[20]余娜, 马全武, 邱慧清, 等. 有机阴离子转运多肽1A2基因多态性的研究进展. 沈阳药科大学学报,2016(07): 592 ~ 598.
[21]Hartkoorn RC, Kwan WS, Shallcross V,et al. HIV protease inhibitors are substrates for OATP1A2, OATP1B1 and OATP1B3 and lopinavir plasma concentrations are influenced by SLCO1B1 polymorphisms. Pharmacogenetics and Genomics, 2010, 20(2): 112 ~ 120.
[22]Forster S, Thumser AE, Hood SR,et al. Characterization of rhodamine-123 as a tracer dye for use in in vitro drug transport assays. PLoS One, 2012, 7(3):25 ~ 33.
[23]Iusuf D, Hendrikx JJ, van Esch A,et al. Human OATP1B1, OATP1B3 and OATP1A2 can mediate the in vivo uptake and clearance of docetaxel. Int J Cancer,2015, 136(1): 225 ~ 233.
[24]Durmus S, Naik J, Buil L,et al. In vivo disposition of doxorubicin is affected by mouse Oatp1a/1b and human OATP1A/1B transporters. Int J Cancer, 2014, 135(7):1700 ~ 1710.
[25]Gong IY, Kim RB. Impact of Genetic Variation in OATP Transporters to Drug Disposition and Response. Drug Metabolism and Pharmacokinetics, 2013, 28(1): 4 ~ 18.
[26]Lee W, Glaeser H, Smith LH,et al. Polymorphisms in Human Organic Anion-transporting Polypeptide 1A2(OATP1A2): implications for altered drug disposition and central nervous system drug entry. J Biol Chem,2005, 280(10): 9610 ~ 9617.
[27]张文. 基于OATPs/oatps介导的麦冬皂苷D肝脏转运的分子学机制研究. 南昌大学, 2014.
ORGANIC ANION-TRANSPORTING POLYPEPTIDE 1A2 MEDIATES THE TRANSPORT OF FENTANYL*
YANG Hui-Wen1, ZHANG Fan1, HUANG Li-Hua2, HAN Rui1, OUYANG Wen1, XIANG Hong2, LIAO Qin1△
(1Department of Anesthesiology, Third Xiangya Hospital, Central South University, Changsha 410013, China;2Center for Medical Experiments, Third Xiangya Hospital, Central South University, Changsha 410013, China)
Objective: To establish human embryonic kidney (HEK293) cell line stably expressing human OATP1A2, and to explore whether the uptake of fentanyl can be mediated by OATP1A2 in vitro.Methods: HEK293 cells were transfected with the plasmid pIRES2-ZsGreen1-OATP1A2 using a Liposome transfection reagent LipofectamineTM2000. After geneticin (G-418; 600 mg/ml) treatment, single colonies were selected and characterized. Western blot analysis and real-time PCR were used to verify the success of transfection. Different concentrations of probe drug fexofenadine was used to verify HEK293-OATP1A2 transport function. The cells were incubated with different concentrations of fentanyl. HEK293-OATP1A2 uptake experiment was performed with inhibitor naringenin. Results: Fexofenadine and fentanyl showed a significantly increased uptake (P< 0.05) into the HEK293-OATP1A2 compared with the HEK293-VC cells. The uptake value of Fexofenadine at 100 nM was 2.8-fold to that of control. The OATP1A2 inhibitor naringenin at a concentration of 100 µg/mL signi fi cantly reduced the cellular fexofenadine and fentanyl net uptake to 66.8±0.6% and 86.5±0.5% of control (fexofenadine uptake without inhibitor), respectively (P<0.05). Conclusion: HEK293 cell line with overexpression of OATP1A2 was successfully constructed, and OATP1A2 mediating fentanyl transport in vitro has been con fi rmed.
OATP1A2; Fentanyl; Substrate; Transport function; Overexpression
10.3969/j.issn.1006-9852.2017.07.004
湖南省自然科学基金(16JJ2158)
△通讯作者 zhanghaoliaoqin@163.com
