溶血磷脂酸对背根神经髓鞘相关糖蛋白表达的影响及机制的研究
2017-11-20陈素昌彭良玉王喜连周忠群
陈素昌 彭良玉 王喜连 周忠群 唐 杰 谢 斌
(南华大学附属第一医院 1疼痛科;2麻醉科,衡阳 421001)
溶血磷脂酸对背根神经髓鞘相关糖蛋白表达的影响及机制的研究
陈素昌1△彭良玉2王喜连1周忠群1唐 杰1谢 斌1
(南华大学附属第一医院1疼痛科;2麻醉科,衡阳 421001)
目的:探讨单次鞘内注射溶血磷脂酸 (lysophosphatidic acid, LPA)对背根神经髓鞘相关糖蛋白(myeline-associated glycoprotein, MAG)表达的影响以及其作用机制;方法:实验1:C56雄性小鼠随机分为人造脑脊液(arti fi cial cerebralspinal fl uid, aCSF)组和LPA组,在注射后24小时、3天和7天处死小鼠取其背根神经(dorsal root, DR),采用原位杂交(western blot, WB)方法测定DR中MAG的表达。实验2:C56雄性小鼠随机分为aCSF组,LPA组,钙蛋白酶抑制剂X (calpain inhibitor X,CalX) + LPA组和aCSF + CalX组,在注射后0天、24小时、3天、7天和14天测定小鼠机械性阈值及热阈值。实验3: C56雄性小鼠随机分为aCSF组,aCSF+LPA组和CalX+LPA组,在注射后24小时处死小鼠取其背根神经,采用WB和免疫荧光的方法观察CalX对MAG的影响。结果:①与aCSF组对比,LPA注射后24小时MAG显著降低,持续到第3天,第7天降低不明显;②与aCSF组和aCSF + CalX组对比,LPA组在术后1~7天有明显的热痛敏和机械痛敏;与LPA组对比,CalX+LPA组热痛敏和机械痛敏明显减轻;③与aCSF组和aCSF+LPA组对比,CalX+LPA组WB结果显示CalX能完全阻止LPA诱导DR中 MAG的下调,免疫荧光和WB结果是一致的。结论:单次鞘内注射LPA可以诱导背根神经MAG的下调,且是通过钙蛋白酶激活介导的。
溶血磷脂酸;背根神经;髓鞘相关糖蛋白;钙蛋白酶抑制剂
LPA是一种重要的信号分子,其广泛分布于血清、血浆、其它生物活性液体、组织以及脑[1]。前期研究发现,LPA启动神经病理性疼痛的其中一个机制是诱导外周神经的脱髓鞘。髓鞘(myelin)分别是由少突胶质细胞 (oligodendrocyte cells)和施旺细胞 (Schwann cells) 胞膜沿着中枢和外周神经的轴突螺旋包裹而成的。组成髓鞘的相关蛋白包括髓鞘碱性蛋白(myelin basic protein, MBP)、髓鞘蛋白0 (myelin protein zero, MPZ)、外周髓鞘蛋白22 (peripheral myelin protein 22, PMP22)、蛋白脂质蛋白(proteolipid protein, PLP)和髓鞘相关糖蛋白(myelin-associated glycoprotein, MAG)等。Fujita[2]等证实在在体内和体外实验中,LPA1受体的激活介导了髓鞘蛋白MBP、PMP22、和MPZ的下调。MAG是一种跨膜的糖蛋白,选择性的固定于外周施旺细胞和中枢少突胶质细胞髓磷脂鞘的轴突外周(结旁区 paranode), 因此认为其介导胶质细胞和轴突之间的信号传递[3]。Päiväläinen[4]等人在离体实验当中证实了MAG在髓鞘形成当中的表达要早于MBP,因此MAG在髓鞘的形成和维持中发挥着重要的作用。钙蛋白酶(calpain)是一种广泛分布的钙离子敏感性的蛋白酶。calpain的激活在神经系统疾病中对于神经细胞的凋亡以及髓鞘蛋白、骨架蛋白的降解发挥了重要的上游通路调节作用[5,6]。本研究将探讨LPA对背根神经MAG表达的影响及机制来进一步阐述神经病理性疼痛脱髓鞘的外周机制。
方 法
1.实验动物
本实验采用C56雄性小鼠(体重20~24 g),动物由南华大学动物中心提供。室温保持在22±2℃和50%~60%的湿度,12~12 h 白天-黑夜循环照明。动物在安静环境中分笼饲养,能自由摄取食水。所有实验步骤都尽量减轻动物的痛苦并按照有关实验动物的使用原则操作。实验1:将小鼠随机分为对照组及LPA组,于LPA注射后不同时间点(24 h、3 d、7 d)处死小鼠,取其背根神经采用western blot方法测定DR MAG的表达变化,每组3只。实验2:将小鼠随机分为aCSF组,LPA组,CalX+LPA组及aCSF+CalX组,每组在不同时间点(注射后0 d、24 h、3 d、7 d、14 d)测定小鼠机械性阈值及热阈值,每组8只。实验3:将小鼠随机分为aCSF组,aCSF+LPA组和CalX+LPA组,在注射24 h后处死小鼠,取其背根神经采用western blot和免疫荧光的方法测定DR MAG的表达变化,每组6只。
2.动物行为学测试
(1)机械性阈值测定
机械痛敏测试装置为透明的有机玻璃箱,无底,箱底为金属网制成(网格为6 mm×6 mm)。为了消除心理因素,首先把小鼠放入有机玻璃箱适应一个小时,直至小鼠洗脸、搔抓、行走等活动完全停止,处于安静状态时止。用传感器指针(美国IITC电子 Von Frey测痛仪 1601)通过网格垂直刺激小鼠右后肢的足心部。引起小鼠右后肢回缩的压力值即定义为疼痛的机械性阈值。设定20 g的压力值为分界点,避免组织损伤。以10 min的间隔对右后肢重复测量3次,3次的均值用于最后的统计学分析。
(2)热阈值测定
热痛敏的测试装置为有机玻璃箱,无底,箱底为可以加热的玻璃平板。为了消除心理因素,首先把小鼠放入有机玻璃箱适应一个小时,直至小鼠洗脸、搔抓、行走等活动完全停止,处于安静状态时止。用热刺激器(美国IITC)放在玻璃平板的下面,投射光源的焦点正对着小鼠的右后肢的足心部。通过热刺激器上的镜子可以看到小鼠的脚底面。设定20 s为界点,避免组织损伤。以10 min的间隔对右后肢重复测量3次,3次的均值用于最后的统计学分析。
3.给药方法
LPA和CalX由人工脑脊液(arti fi cial CSF aCSF;125 mM NaCl, 3.8 mM KCl, 1.2 mM KH2PO4, 26 mM NaHCO3, 10 mM glucose, pH 7.4).溶解。鞘内注射是采用Hylden和Wilcox[7]等人描述的方法。以左掌压住鼠身,拇、中指按住腰骶部两侧固定,食指按在双侧骶骨前缘连线正中点(可触及L5棘突)指示进针点, 以微量注射器自L5和L6之间的间隙进针。CalX在LPA鞘内注射30分钟之前注射。
4.标本检测
(1)Western印迹法测定MAG蛋白表达
取出不同时段或不同药物处理后的小鼠L4-5双侧的DR,切割成四等份,分别按重量加入Tris裂解缓冲液(50mM Tris-Hcl,PH6.8; 2%SDS; 10%甘油;ddH2O。使用前要加蛋白酶抑制剂), 低温匀浆,超声破碎,15 000 rpm低温离心,取上清液。用Micro-BCA(Micro BCA Protein Assay Kit pierce)法测定蛋白浓度。取等量蛋白样品(20 µg)加入2µl上样缓冲液,混匀后,沸水煮沸10 min。取煮沸后的等量蛋白样品约30 µl,加入SDS-PAGE胶孔中,于80 V恒压,进行聚丙烯酰胺凝胶电泳,浓缩胶电泳60 min,再100 V恒压,分离胶电泳90 min。将完整的凝胶取下,转移到铺着海绵和滤纸转移夹中组成“三明治”结构,将事先在转移缓冲液中浸泡10 min的PVDF膜(Millpore Japan)紧贴其上,排除气泡,在转移缓冲液中380 mA恒流转移90 min。取出PVDF膜,在TBS中轻摇5 min,用封闭液(TBST, 5%w/v脱脂奶粉) 25℃封闭2 h在10 ml一抗anti-MAG (Chemicon USA) 1:500稀释液中(TBST, 5%w/v BSA)把PVDF膜和一抗共同轻摇孵育,4度过夜。次日,用TBST清洗PVDF膜3次,每次10 min。然后用10 ml过氧化物酶标记的二抗anti-MAG (Chemicon USA) 1:500孵育,25℃2个小时。用TBST清洗PVDF膜,洗脱3次, 每次10 min,后用1ml ECL (Pierce chemical, USA)室温孵育3 min。排出过量液体,在暗室中使其与X光片(Kodak, Rochester, NY)紧密接触,使X光片感光数秒到数分钟。显影,定影,冲洗,晾干,扫描并进行计算机图象分析。PVDF膜用strip液50℃洗脱30 min后重新封闭及加一抗二抗,以β-tubulin,rabbit anti-ß-tubulin polyclonal antibody (Santa cruz USA) 1:500作为内参确认上样量基本相同。
(2)免疫荧光法测定MAG的表达
用异戊巴比妥钠(50 mg/kg, i.p.)深麻醉小鼠,暴露心脏,灌流针插入左心室,剪开右心房,先快速灌注4℃的K+-free PBS (NaCl; NaH2PO4;Na2HPO4; CaCl2;MgCl2 PH7.4),然后用4%的多聚甲醛灌注,解剖小鼠并取L4-5背根神经,4%的多聚甲醛后固定3 h后,转入25%蔗糖中脱水4℃过夜,然后包埋进行冰冻切片(leica CM3050,德国),切片厚度为10 µm,收集切片于放有0.01 M K+-freePBS的24孔板内,4℃短暂保存。免疫荧光组织化学操作按照Ji[8]等人报道的方法进行。本研究中所使用的是间接法的免疫荧光组织化学技术。即先用特异性抗体与相应的抗原结合,洗去未结合的抗体,再用荧光素标记的抗特异性抗体(间接荧光抗体)与特异性抗体相结合,形成抗原一特异性抗体一间接荧光抗体的复合物。本实验用的荧光素为Alexa Fluor 488。Alexa Fluor 488激发光源为蓝色,呈绿色荧光。收集的DRG冰冻切片立即用0.01 M K+-free PBS洗3次,洗片时动作轻柔,避免损伤切片。每次5 min,然后在室温下用配好的封闭液(脱脂牛奶/BSA溶于TBST中,配成5%)作用于切片,一般每孔用200 µl配置好的封闭液,以封闭非特异性结合位点。1 h 后吸去封闭液并加入小鼠 anti-MAG antibody(Chemicon USA)(1:300),摇床一个小时后放在4℃冰箱过夜,吸去一抗,用PBST 洗3次,加入标记Alexa Fluor 488的anti-mouse IgG二抗(1:300),避光室温下作用1 h,再用PBST洗3次,随机挑选切片贴于载玻片上,立即于自动荧光显微镜(Bio-Zero Japan)下观察并拍照。背根神经免疫染色结果的定量,参照Ji[9]等人的方法通过计数每张切片上的免疫阳性细胞而获得。随机挑取4张实验小鼠的脊髓切片,在荧光显微镜下计数每张切片上的阳性细胞的百分比,从而可得到每只小鼠的阳性细胞百分比的均数。每个实验组至少4 只,最后计算出每组阳性细胞百分比的均数±标准误(±SEM)。背根神经则用计算机软件(ImageJ)统计阳性面积比例。结果阳性面积百分比也用均数±标准误(±SEM)记录。
5. 统计学方法
行为学测试结果均采用非参数检验进行分析。数据用均数±标准差 (±SD)表示,P< 0.05 认为差异有显著性。四组之间的分析采用单因素方差分析,然后用Tukey post hoc test检测组间差异。免疫荧光染色结果先用单因素方差分析处理数据,然后用Tukey post hoc test检测组间差异。统计学分析通过SPSS进行,所有数据用均数±标准误(x±SME)表示,P< 0.05 认为差异有显著。Western-blotting的结果:胶片用计算机辅助图像处理系统(Germany,KONTRON IBAS 2.0)进行条带密度分析,实验结果用SPSS 10.0 统计软件处理,所有数据以均数±标准误(±SEM)表示,不同时间点条带密度的差异用Student's t-test进行检验。P< 0.05认为差异有统计学意义。
结 果
1. LPA单次鞘内注射背根神经MAG蛋白的表达变化
在单次鞘内注射LPA (10 nmol) 24 h之后,我们观察到背根神经MAG的表达明显下降,第3天的时候还是下降,但是第7天的时候与Vehicle组比未有明显变化。与LPA组比,Vehicle组背根神经的MAG表达未变化(n= 3,见图1)。

图1 A:用ß-tubulin标准化和表示为Vehicle处理组的百分比之后的统计图; B:MAG不同时段western blot的标准图;*P < 0.05,与 Vehicle组比Fig.1 A: Diagram of percentage of Vehicle group standardized by ßtubulin; B: The level of MAG receptor protein at different time points. *P < 0.05, compared with Vehicle group
2.小鼠机械性阈值及热阈值的变化
鞘内注射LPA组注射后第1天,立即出现了机械性痛敏和热痛敏,一直持续到术后第7天,第14天时恢复到正常,但在预先给予CalX组(n=5),机械刺激撤足阈值和热缩足潜伏期均明显的升高,但没有完全逆转。而在2个对照组Vehicle-aCSF和CalX-aCSF未出现机械性痛敏和热痛敏(n=8,见图2)。
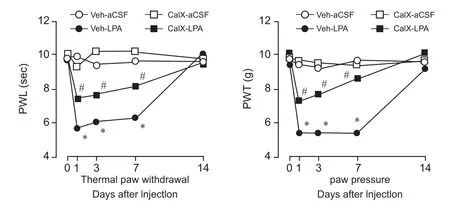
图2 A:比较不同组之间的热缩足潜伏期的变化;B:是比较不同组之间的机械刺激撤足阈值的变化*P < 0.05,与Vehicle-aCSF组对比;#P < 0.05,与Vehicle-LPA组对比Fig.2 A: The alterations of paw withdrawal thermal latency in different groups; B: The alterations of paw withdrawal mechanical threshold in different groups*P < 0.05, compared with Vehicle-aCSF group; #P < 0.05, compared with Vehicle-LPA group.
3. CalX注射后LPA诱导的背根神经MAG表达的变化
预先鞘内给予钙蛋白酶抑制剂X CalX,然后鞘内注射LPA(10 nmol),western blot结果显示背根神经MAG的表达与Vehicle + LPA组比是升高的,完全能阻止其下降;免疫荧光染色结果显示,背根神经MAG的表达比Vehicle + LPA组也是上调的。但在Vehicle组背根神经MAG的表达未有明显变化(n=3,见图 3、4)。
讨 论
神经病理性疼痛的发病机制复杂,包括解剖结构改变和功能受损,常由多种机制引起。包括外周敏化、中枢敏化[10]。在外周的机制当中,背根神经的脱髓鞘发挥着非常重要的作用。前期研究显示,LPA受体1 (LPA1)对于外周神经受损引起的神经病理性疼痛的启动是关键的[11]。单次鞘内注射LPA可以模拟神经神经病理性疼痛。而LPA发挥这样的作用,部分是因为LPA介导的背根神经脱髓鞘的作用[12],鞘内注射LPA (1 nmol), 24小时内可以引起背根神经的脱髓鞘,这与在坐骨神经部分结扎模型中观察到的结果一样,但是预先给予鞘内BoTN/C3可以阻止其发生。同时在离体培养背根神经元的实验当中,已经证实给予LPA之后可以通过破坏施旺细胞引起A纤维的脱髓鞘,这样就导致A纤维直接与Remark纤维束中的C纤维接触[13]。在鞘内注射LPA和部分坐骨神经部分结扎小鼠中只有背根神经脱髓鞘,而脊神经没有,说明在体内脱髓鞘只特定的发生在背根,靠近入髓地方。另外,在在体损伤模型和离体培养中,LPA1受体的激活介导了髓鞘蛋白的下调,比如MBP、PMP 22、和MPZ[13]但关于LPA诱导脱髓鞘的与MAG的关系不清楚。本研究从LPA对MAG这样的蛋白来更进一步研究LPA诱导的背根神经脱髓鞘的机制。

图3 A:用ß-tubulin标化和表示为Vehicle处理组的百分比之后的统计图;B:MAG的western blot结果 *P < 0.05,与Vehicle组对比;#P < 0.05,与Vehicle+LPA处理组对比Fig.3 A: Diagram of percentage of Vehicle group standardized by ßtubulin;B: The level of MAG receptor protein at different groups.*P < 0.05, compared with Vehicle group; #P < 0.05, compared with Vehicle+LPA group.

图4 A, B, C:MAG的免疫荧光染色结果A:aCSF对照组;B:单纯LPA对照组,MAG的表达下降;C:预先给予CaIX完全阻止了MAG的表达减少;D图是用内参ß-tubulin标化和表示为Vehicle处理组的百分比之后的统计图 *P < 0.05,与Vehicle组对比;#P < 0.05,与Vehicle+LPA组对比 Scale bar =20 µm.Fig.4 A, B, C:immuno fl uorescence staining in different groups A:aCSF group; B:LPA group, the expression of MAG decreased; C:The decrease of MAG totally inhibited by CaIX pretreatment;D:Diagram of percentage of Vehicle group standardized by ß-tubulin. *P < 0.05, compared with Vehicle group; #P < 0.05, compared with Vehicle+LPA group. Scale bar = 20 µm.
在本研究中,单次鞘内注射LPA24小时后背根神经MAG明显的下降,一直持续到第3天,这说明MAG的降解参与了LPA1受体诱导的背根神经脱髓鞘。而且,我们的研究中MAG下调的结果与Fujita[2]等人在背根神经培养实验中证实的LPA诱导髓鞘蛋白MBP下调的结果在时间点上存在明显的相似性。除此之外,MAG只是髓鞘蛋白中的一种,髓鞘蛋白还包括MBP、PMP22和MPZ等,这些蛋白对于髓鞘的形成和维持髓鞘的完整性都很重要[14],但是它们的作用又不尽相同。MBP、PMP22和MPZ主要是位于致密髓鞘,而MAG主要是位于非致密髓鞘(比如说结旁区)和施旺细胞胞膜外周轴突,在髓鞘上的位置不同使MAG可以调节胶质细胞与轴突的相互作用[3]。因此LPA诱导背根神经MAG的下调从结构和功能上减少了髓鞘的完整性而导致长期的背根神经脱髓鞘。另一方面,MAG通过与Nogo受体、神经节苷脂和配对的免疫球蛋白受体B相互作用被认为是一种神经生长的抑制剂[15-18]。因此LPA诱导的MAG的下调可能导致轴突牙生,而产生神经病理性疼痛的时候不同神经纤维之间的交叉相互作用,这样可能导致传导正常触觉的纤维而产生疼痛(触觉诱发痛)和中枢神经的敏化。我们的研究还进一步发现预先30分钟鞘内注射calpain抑制剂CalX能阻止LPA诱导的MAG的下调和明显减轻LPA模拟的神经病理性疼痛症状。
Calpain是一种细胞质的半胱氨酸蛋白酶,在神经系统生理和病理情况下都发挥重要的作用[19,20]。calpain激活的时候能够与许多的底物相互作用,包括MBP和MAG[21,22]。在实验过敏性的脑脊髓炎(脱髓鞘疾病多发性硬化的一种动物模型)模型中,钙蛋白酶可以介导MBP、PLP和MAG等蛋白的降解。而且,在多发性硬化疾病中中炎症因子比如肿瘤坏死α(TNF-α)和INF-γ 的激活可以增强calpain的表达和活性[23,24]。我们的实验证实了LPA诱导的MAG下调是Calpain的激活介导的。然而,对于LPA是怎么样诱导calpain的激活还需要进一步的研究。基于calpain在病理性神经系统的广泛作用,因此calpain抑制剂对于脱髓鞘的神经系统性疾病是一个重要的新的治疗靶点。我们的实验证实,对于单次鞘内注射LPA诱导的神经病理性疼痛行为,calpain抑制剂CalX能明显的减轻,但是不能完全逆转。这说明在LPA诱导产生的神经病理性疼痛行为中还存在LPA诱导的其他机制。在慢性坐骨神经压迫性损伤模型中,calpain可以介导神经受损以后背根神经早期的细胞因子,包括TNF-α和白介素1β(IL-β)的表达[25],而这些前炎症因子对于神经病理性疼痛的行为是非常重要的。因此我们得到的结论是:LPA可以诱导背根神经MAG的下调且是通过calpain激活介导的。这可以为进一步明确calpain抑制剂的镇痛机制提供依据。
[1]Kyoko Noguchi, Deron Herr, Tetsuji Mutoh,et al.Lysophosphatidic acid (LPA) and its receptors. Curr Opin Pharmacol, 2009, 9(1): 15 ~ 23.
[2]Ryousuke Fujita, Norikazu Kiguchi, Hiroshi Ueda. LPA-mediated demyelination in ex vivo culture of dorsal root.Neurochem Int, 2007, 50(2): 351 ~ 355.
[3]Quarles R.H. Myelin-associated glycoprotein (MAG):past, present and beyond. J Neurochem, 2007,100(6):1431 ~ 1448.
[4]Paivalainen S. Heape AM. Myelin-associated glycoprotein and galactosylcerebroside expression in Schw-ann cells during myelination. Mol Cell Neurosci, 2007, 35(3):436 ~ 446.
[5]Kieran D, Greensmith L. Inhibition of calpains, by treatment with leupeptin, improves motoneuron survival and muscle function in models of motoneuron degeneration.Neuroscience, 2004, 125(2):427 ~ 439.
[6]Ray SK, Hogan EL, Banik NL. Calpain in the pathophysiology of spinal cord injury: neuroprotection with calpain inhibitors.Brain Res Rev, 2003, 42(2): 169 ~ 185.
[7]Hylden JL, Wilcox GL. Intrathecal serotonin in mice:analgesia and inhibition of a spinal action of substance P.Life Sci, 1983, 33(8):789 ~ 795.
[8]Ji RR, Befort K, Brenner GJ,et al. ERK MAP kinase activation in superficial spinal cord neurons induces prodynorphin and NK-1 upregulation and contributes to persistent in fl ammatory pain hypersensitivity. J Neurosci,2002, 22(2): 478 ~ 485.
[9]Ji RR, Zhang Q, Pettersson RF,et al. aFGF, bFGF and NGF differentially regulate neuropeptide expression in dorsal root ganglia after axotomy and induce autotomy.Regul Pept, 1996, 66(3): 179 ~ 189.
[10]神经病理性疼痛诊疗专家组. 神经病理性疼痛诊疗专家共识.中国疼痛医学杂志, 2013, 19(12):705 ~ 710.
[11]Makoto Inoue, Harunor Rashid, Ryousuke Fujita,et al.Initiation of neuropathic pain requires lysophosphatidic acid receptor signaling. Nat Med. 2004, 10(7), 712 ~ 718.
[12]Makoto Inoue, Md Harunor Rashid, Ryousuke Fujita,et al.Initiation of neuropathic pain requires lysophosphatidic acid receptor signaling. Nat Med, 2004, 10(7): 712 ~ 718.
[13]Ryousuke Fujita, Norikazu Kiguchi, Hiroshi Ueda. LPA-mediated demyelination in ex vivo culture of dorsal root.Neurochem Int, 2007, 50(2):351 ~ 355.
[14]Garbay B, Heape AM, Sargueil F,et al. Myelin synthesis in the peripheral nervous system. Prog. Neurobiol, 2000,61(3): 267 ~ 304.
[15]Schnaar RL, Lopez PH. Myelin-associated glycoprotein and its axonal receptors. J Neurosci Res, 2009, 87(15):3267 ~ 3276.
[16]Atwal JK, Pinkston-Gosse J, Syken J,et al. PirB is a functional receptor for myelin inhibitors of axonal regeneration. Science, 2008, 322(5903): 967 ~ 970.
[17]Quarles RH. A hypothesis about the relationship of myelinassociated glycoprotein's function in myelinated axons to its capacity to inhibit neurite outgrowth. Neurochem Res, 2009, 34(1): 79 ~ 86.
[18]Filbin MT. PirB a second receptor for the myelin inhibitors Of axonal regeneration Nogo66, MAG, and OMgp: implications for regeneration in vivo. Neuron,2008, 60(5):740 ~ 742.
[19]Antoni Camins , Ester Verdaguer, Jaume Folch,et al.Involvement of Calpain Activation in neurodegenerative Processes. CNS Drug Reviews, 2006, 12(2): 135 ~ 148.
[20]Vosler PS, Brennan CS. Chen J. Calpain-mediated signaling mechanisms in neuronal injury and neurodegeneration. Mol Neurobiol, 2008, 38(1): 78 ~ 100.
[21]Inuzuka T, Sato S, Baba H,et al. Neutral protease in cerebrospinal fl uid from patients with multiple sclerosis and other neurological diseases. Acta Neurol Scand, 1987,76(1):18 ~ 23.
[22]Shields DC, Banik NL. Pathophysiological role of calpain in experimental demyelination. J Neurosci Res,1999, 55(5):533 ~ 541.
[23]Han Y, Weinman S, Boldogh I,et al. Tumor Necrosis Factor-a-Inducible IkBa proteolysis mediated by cytosolicm-calpain. J Biol Chem, 1999, 274(2):787 ~ 794.
[24]Deshpande RV, Goust JM. Calpain expression in lymphoid cells. J Biol Chem, 1995, 270(6):2497 ~ 2505.
[25]Nurcan Uceyler, Andreas Tscharke, Claudia Sommer.Early cytokine expression in mouse sciatic nerve after chronic constriction nerve injury depends on calpain.Brain Behavior and Immunity, 2007, 21(5): 553 ~ 560.
THE STUDY OF EFFECT AND MECHANISM OF LYSOPHOSPHATIDIC ACID ON EXPRESSION OF MYELINE-ASSOCIATED GLYCOPROTEIN IN DORSAL ROOT
CHEN Su-Chang1, PENG Liang-Yu2, WANG Xi-Lian1, ZHOU Zhong-Qun1, TANG Jie1, XIE Bin1
(1Department of Pain Management;2Department of Anesthesiology, The First Af fi liated Hospital of Nanhua University, Hengyang 421001, China)
Objectives: To investigate the effects and mechanism of lysophosphatidic acid (LPA) on expression of myeline-associated glycoprotein (MAG) in dorsal root (DR). Methods: Experiment 1: Male C56 mice were randomly divided into artificial cerebralspinal fluid (aCSF) group and LPA group. Western blot was used to observe the MAG expression in the DR at different time points (on post-injection 24 hours, day 3, day 7). Experiment 2: Male C56 mice were randomly divided into aCSF group, LPA group, calpain inhibitor X(CaIX) + LPA group and aCSF + CalX group. We tested mechanical hyperalgesia and thermal hyperalgesia at different time points (post-injection day 1, day 3, day 7, day 14) by using Von Frey fi lament test and thermal test. Experiment 3: Male C56 mice were randomly divided into aCSF group,aCSF+LPA group and CalX+LPA group. Immuno fl uorescence technique and western blot were used to test the effect of CalXafter post-injection 24 hours. Results:①Compared with aCSF group, we found that intrathecal injection of LPA down-regulates MAG in the DR. The most obvious reduction in MAG levels occurred at 24 hour post-injection and it also decreased on day 3, but it was not signi fi cant on day 7; ②Compared with aCSF group and aCSF+CalX group,it showed that LPA induced thermal hyperalgesia and mechanical allodynia during post-injection day 1 to day 7. Compared with LPA group, it showed a significant inhibition of LPA-induced thermal hyperalgesia and mechanical allodynia in CalX+LPA group during post-injection day 1 to day 7. ③Compared with aCSF group and aCSF + LPA group, it could completely blocked MAG decreased and similar results were obtained with immuno fl uorescence in CalX + LPA group. Conclusion: The expression of MAG in DR was decreased after the treatment of LPA , and it was mediated by the activation of calpain.
Lysophosphatidic acid; Dorsal root; Myeline-associated glycoprotein; Calpain inhibitor
△通讯作者 cscbruce@163.com
10.3969/j.issn.1006-9852.2017.05.005
