108例脑胶质瘤患者的预后影响因素分析
2017-11-17吕凤琼黄伟林爱国周忠惠梅丽华魏厚禄
吕凤琼, 黄伟, 林爱国, 周忠惠, 梅丽华, 魏厚禄
629000 四川 遂宁,遂宁市中心医院 全科医学科(吕凤琼、周忠惠、梅丽华),脑外科(黄伟);629000 四川 遂宁,遂宁市第一人民医院 脑外科(林爱国、魏厚禄)
•临床经验与技术交流•
108例脑胶质瘤患者的预后影响因素分析
吕凤琼, 黄伟, 林爱国, 周忠惠, 梅丽华, 魏厚禄△
629000 四川 遂宁,遂宁市中心医院 全科医学科(吕凤琼、周忠惠、梅丽华),脑外科(黄伟);629000 四川 遂宁,遂宁市第一人民医院 脑外科(林爱国、魏厚禄)
目的分析脑胶质瘤患者的存活、预后的影响因素。方法对本院2006~2014年手术治疗的108例脑胶质瘤患者进行回顾性分析,运用COX回归模型分析患者的性别、年龄、手术前的KPS评分、病理分级、是否完全切除肿瘤、术后放射治疗等因素对预后的影响。结果全部患者1年、2年及3年生存率分别92%、84%、67%,中位生存时间49个月。全部患者的COX回归模型结果显示年龄、病理类型、KPS评分、放射治疗以及Ki-67及EGFR表达情况是患者生存的独立影响因素。病理高级别患者中,KPS评分、同步化疗为患者生存的独立影响因素。结论中等年龄、低病理类型、高KPS评分、进行放疗以及Ki-67及EGFR低表达的胶质瘤患者生存情况较好,而高病理级别患者中,高KPS评分以及进行同步化疗的患者生存情况较好。
脑胶质瘤; 预后因素; 生存分析
脑胶质瘤是最常见的神经上皮组织来源肿瘤,侵袭性强,容易复发,病死率高,是公认的恶性肿瘤中预后较差的肿瘤之一,手术切除是治疗的首选方式[1]。脑胶质瘤好发于青年,随着同步放疗、辅助化疗以及单抗类药物的应用,本病的生存率虽然有一定提高[2-4],但仍然不容乐观,有效的病情及预后评估对于社会家庭至关重要。表皮生长因子受体(epidermal growth factor receptor,EGFR)是一种具有酪氨酸蛋白激酶活性的细胞膜受体,其与配体生长因子结合后自身磷酸化激活,进而通过多条信号转导功能,促进内皮细胞分裂增殖。Ki-67为人类细胞核抗原,在细胞增殖周期中表达,在G0期缺如,在G1期首次出现。其在识别增殖细胞方面更加特异,已经广泛应用于脑胶质瘤的评价。本文收集了108例脑胶质瘤患者的个体特征、病理以及实验室免疫组化等资料,对其临床特征及影响预后的因素进行综合分析,为临床医疗预后判定提供决策支持。
1 资料与方法
1.1 一般资料
选取2006年3月至 2014年10月本院收治108例手术治疗并经病理组织学以及免疫组织化学法诊断为脑胶质瘤患者为研究对象,其中男性55(50.9%)例,女性53(49.1%)例;病理类型中,星形胶质细胞瘤86(79.6%)例,少突胶质细胞瘤11(10.2%)例,室管膜瘤7(6.5%)例,胶质母细胞4(3.7%)例。术前CT 或MRI测量胶质瘤直径(多个病灶时,以各病灶最大单径之总和进行计算)为1. 0 ~9. 0 cm,中位直径为4.8cm。本研究获得了本医院医学伦理委员会的批准,符合国际以及国内的医学研究相关法律及伦理学原则。
1.2 手术方法及病理分级
手术方式包括全切除术77例和次全切除术31例,按照WHO中枢神经系统分级方法,低级别胶质瘤(Ⅰ、Ⅱ级)60例,高级别胶质瘤(Ⅲ、Ⅳ级)48例。
1.3 术后辅助治疗
术后对患者进行身体状况评估后进行放化疗,多在术后 2~4周开始。①术后行放射治疗者80例,其中55例给予整颅放疗,25例给予局部大野照射,其中照射靶区根据CT或MRI所观察的病灶范围外放 2~3 cm,根据术后影像学检查确定的手术后残留肿瘤的剂量范围16~72.8Gy,亚临床病灶区域的剂量范围是16~68Gy。②50例患者均接受化疗,共 4~6 个周期。
1.4 免疫组化
利用术中切除的肿瘤组织标本经甲醛固定、石蜡包埋然后切片,采用Envision法免疫组化染色检测Ki-67、EGFR在肿瘤组织的表达。Ki-67的阳性表达为细胞核染色呈黄色或棕黄色,随机观察5个高倍镜视野(400倍),计算阳性细胞所占计数细胞总数百分比,判定标准:阳性细胞<1%为(-),1%~10%为(+),10%~20%为(++),>20%为(+++)。而EGFR 阳性信号定位在肿瘤细胞胞质内,染色为棕黄色颗粒。阳性判定方法:阳性细胞百分率<10%为0分;10%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分;染色强度评为无色记0分,淡黄色记1分,棕黄色记2分,棕色或棕褐色记3分,计分和染色强度评分乘积>4分定义为阳性。
1.5 随访方法
生存时间为从手术日期到死亡或最后随访日期之间时间间隔,删失数据包括随访过程因非胶质瘤因素死亡、患疾病需要参加可能影响本病生存的治疗、随访结束存活者,研究随访截止日期为2016年12月31日。
1.6 统计分析
2 结 果
2.1 单因素生存分析
随访截止2016年12月31日,随访时间为8~94个月,中位随访时间32个月,患者1年、2年及3年生存率分别92%、84%、67%,中位生存时间49个月。生存分析的单因素分析结果显示患者的年龄、病理分级、手术前KPS评分、肿瘤直径、肿瘤切除情况、放疗情况、同步化疗以及Ki-67、EGFR表达情况是影响脑胶质瘤的预后因素(P<0.05),详见表1。

表1 脑胶质瘤的单因素生存分析结果(Log-rank法)
(续下表)
(接上表)
2.2 多因素COX分析
2.2.1 全部胶质瘤患者 将单因素分析有统计学
意义的年龄、病理分级、放射治疗等指标纳入多因素COX模型多因素分析,结果显示年龄、病理类型、KPS评分、放射治疗以及Ki-67及EGFR表达情况是患者生存的独立影响因素。见表2。
2.2.2 病理高级别胶质瘤患者 选取病理类型为III~IV级高级别胶质瘤患者进行COX回归分析,结果显示KPS评分、同步化疗为影响高级别患者生存的影响因素。见表3。
3 讨 论
脑胶质瘤是颅内最常见的恶性肿瘤,其具有发病率高、治疗难度大、预后差的特点,一直都是神经外科领域研究的难点和热点。由于不同医院在病例特征、手术水平、放化疗方案、病理技术等方面的差异,相关研究报道的胶质瘤预后的因素也不同。目前国内外学者一致公认病理分级越高、高龄或者低龄的脑胶质瘤患者预后较差[5],但其他因素如手术切除程度、放疗、化疗方案,尤其是免疫组化的指标等因素是否会对预后造成影响目前仍不明确[6]。近年来胶质瘤手术全切成功率逐渐提高, 手术效果随着肿瘤切除程度的提高也得到明显提高, 但由于胶质瘤具有的浸润性生长特点, 即使术中肉眼和CT、MRI等影像学证实全切, 最终的仍有可能复发,如果有效监测复发、延长生存时间是目前的研究热点[7]。目前国内外公认的胶质瘤治疗策略为手术配合术后综合治疗,其他有助于延缓复发、改善预后[8]。因此了解可能影响胶质瘤预后的因素,将会对提高临床治疗效果有着重要的影响。

表2 108例脑胶质瘤患者生存的多因素分析(COX回归)
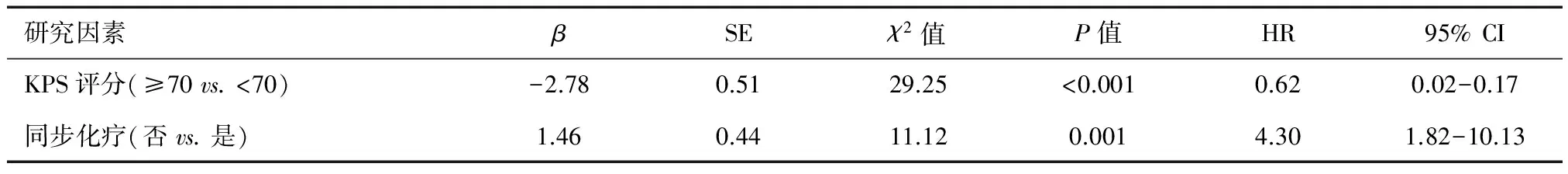
表3 病理类型为高级别胶质瘤患者生存的多因素分析(COX回归)
多项研究均显示不同病理分级的脑胶质瘤预后不同,病理分级是影响脑胶质瘤的预后独立因素,病理分级越高,肿瘤的恶性程度越高,预后越差[5, 9-10]。本次研究结果与国内外结果一致,单因素分析以及多因素COX回归分析均显示病理分级是影响脑胶质瘤预后的独立因素,高级别肿瘤患者死亡风险是低级别者的5.52倍,提示高级别肿瘤生物学上更加恶性,但同时研究结果也显示高级别肿瘤患者也具有生存时间较长的个体,提示存在其他影响预后的因素。本次研究同样显示低龄或者高龄患者的死亡风险较中间年龄组高,也与既往研究结果相似。另外一项预后重要影响因素为术前机体功能的KPS(Karnofsky Performance Status)评分,本次研究显示KPS评分≥70是预后良好的一个独立因素,原因可能为该部分患者身体状况好,能耐受各项治疗所带来的副作用,从而更容易接受全面的综合治疗。而且KPS评分高者,可能提示肿瘤尚未波及功能区,利于手术全切肿瘤。而KPS评分低者也从侧面提示肿瘤恶性程度高、进展快或患者病程较长[11]。
目前胶质瘤生物、细胞因子研究显示多种因子可能是判断预后的良好指标。肿瘤生长、侵袭能力与细胞增殖程度密切相关,通过石蜡标本免疫组化检测多种分子指标,为从基因水平上探讨胶质瘤的生物学行为、预后及治疗提供新的思路。Ki-67是一种核蛋白质由MKI-67基因编码,已经成为研究细胞的增殖活跃程度的重要依据[12-13]。由于Ki-67在细胞增生间期不表达,被认为是胶质瘤治疗效果预测的良好指标。研究显示Ki-67阳性指数越高,胶质瘤越容易复发,患者的死亡风险越高[14]。本次研究显示Ki-67高表达者的死亡风险是低表达者的2.77倍,进一步高级别肿瘤的影响因素分析其无统计学意义,因此考虑该因子可能与肿瘤的恶性程度相关。EGFR是表皮生长因子受体家族成员之,其在细胞增殖过程中发挥重要的调节作用。研究显示EGFR表达与肿瘤恶性程度密切相关[15],但其对预后的影响目前还不明确。谢欣等研究显示[15],EGFR的表达对患者预后存在一定影响,但不可作为预后独立危险因素。而本次研究COX回归显示EGFR表达是预后的独立因素,表达阳性患者的死亡风险是阴性者的2.69倍。
WHO分级为Ⅲ级及Ⅳ级的胶质瘤统称为高级别脑胶质瘤,当前治疗的主要方式为手术、放疗及放化疗的联合治疗,但大部分患者仍在首次治疗后短期内出现肿瘤进展或复发,复发性高级别胶质瘤患者的预后极差。国内外的诸多研究显示,术后化疗能够提高脑胶质瘤特别是高分级脑胶质瘤的治疗效果,并有可能与放射治疗有协同作用,尤其是替莫唑胺(TMZ)在胶质瘤化疗中占有越来越重要的地位[16]。研究显示TMZ化疗较6周期TMZ化疗延长高级别胶质瘤患者生存期,且未明显增加药物的不良反应[17-18]。本次研究显示高级别胶质瘤患者中,没有进行化疗者的死亡风险是接受者的4.30倍。
综上所述,年龄、病理类型、KPS评分、放射治疗以及Ki-67及EGFR表达情况是影响脑胶质瘤预后的独立因素。高病理级别患者中,患者的机体状态以及术后化学治疗可以提高高级别脑胶质瘤的远期生存率。
作者声明:本文第一作者对于研究和撰写的论文出现的不端行为承担相应责任;
利益冲突:本文全部作者均认同文章无相关利益冲突;
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统学术不端检测;
同行评议:经同行专家双盲外审,达到刊发要求。
[1] 林昌海,李丽仙,冉静,等. 脑胶质瘤血液循环肿瘤标志物研究进展[J]. 重庆医学,2016,45(30):4293-4296.
[2] 陈辉,蒋传路. 贝伐单抗治疗高级别脑胶质瘤研究进展[J]. 哈尔滨医科大学学报,2014,48(3):260-262.
[3] 杭春华. 脑胶质瘤的治疗进展[J]. 中国微侵袭神经外科杂志,2011,16(9):429-432.
[4] 蒋华勇,王雅棣. 高级别脑胶质瘤的放疗进展[J]. 中华放射肿瘤学杂志,2015,24(5):577-580.
[5] Szopa W, Burley TA, Kramer-Marek G, et al. Diagnostic and Therapeutic Biomarkers in Glioblastoma: Current Status and Future Perspectives[J]. Biomed Res Int,2017,2017:8013575.
[6] 张光涛,李鹏亮,姚广明,等. 人脑胶质瘤中巢蛋白的表达与预后关系的Meta分析[J]. 中华神经医学杂志,2015,14(9):874-878.
[7] Zhao H, Wang S, Song C, et al. The prognostic value of MGMT promoter status by pyrosequencing assay for glioblastoma patients′ survival: a meta-analysis[J]. World J Surg Oncol,2016,14(1):261.
[8] 姚瑜,毛颖,周良辅. 规范脑恶性胶质瘤治疗的几点建议—有感于《中国中枢神经系统恶性胶质瘤诊断和治疗共识(简化版)》[J]. 中华医学杂志,2010,90(15):1079-1080.
[9] 陈思群,柳先锋,舒小镭. 恶性胶质瘤患者术后同期推量调强放疗的疗效及预后因素分析[J]. 中国肿瘤临床与康复,2016,23(8):959-962.
[10] 彭世义,邬蒙. 89例术后高度恶性脑胶质瘤预后影响因素分析[J]. 中国肿瘤临床,2013,40(1):50-54.
[11] 金卫星,祝斐,谢联斌,等. 脑胶质瘤术后放疗疗效及预后影响因素分析[J]. 实用癌症杂志,2013,28(6):750-752.
[12] 饶翔,杨丞. HSP27、E-cadherin及Ki-67在星型胶质细胞肿瘤中的表达及意义[J]. 海南医学,2016,27(10):1579-1581.
[13] Ai Z, Li L, Fu R, et al. Integrated Cox's model for predicting survival time of glioblastoma multiforme[J]. Tumour Biol,2017,39(4):1393395090.
[14] 曾剑平,刘青,林志雄,等. 脑胶质瘤患者预后相关影响因素分析[J]. 临床神经外科杂志,2015,12(6):410-414.
[15] 谢欣,褚明亮,陈祎,等. IMP3、EGFR和P53蛋白在神经胶质瘤组织中的表达[J]. 贵州医药,2016,40(8):794-797.
[16] 王健,贾永森,赵喜庆,等. 替莫唑胺对胶质瘤侵袭性的影响及可能机制[J]. 临床与实验病理学杂志,2014,30(11):1259-1262.
[17] 徐维林,王强,张宏伟,等. 长周期替莫唑胺治疗高级别胶质瘤生存期观察[J]. 解放军医学院学报,2016,37(7):725-727.
[18] 唐红,吴伟莉,金风,等. 调强放疗联合替莫唑胺治疗高级别脑胶质瘤的长期疗效分析[J]. 肿瘤预防与治疗,2016,29(5):260-266.
PrognosticFactorsAnalysisof108PatientswithBrainGlioma
Lv Fengqiong1, Huang Wei2, Lin Aiguo3, Zhou Zhonghui1, Mei Lihua1, Wei Houlu3△
(1.DepartmentofGeneralMedicine,SuiningCentralHospital,Suining629000,Sichuan,China; 2.DepartmentofCerebralSurgery,SuiningCentralHospital,Suining629000,Sichuan,China;3.DepartmentofCerebralSurgery,SuiningFirstPeople'sHospital,Suining629000,Sichuan,China)
Objective: To explore the related factors of survival and prognosis of brain glioma.Methods108 patients who have been confirmed with brain glioma during surgery from 2006 to 2014 were included for analysis retrospectively. The factors including sex, age, and Karnosky Performance Scale (KPS) score before surgery, surgical excision of part or all of the tumor, radiation treatment and so on were recorded. The COX regression was performed for the prognostic analysis.ResultsThe 1-, 2- and 3- year survival rate was 92%, 84% and 67%, respectively; the median survival time was 49 months. The COX regression analysis showed age, pathological grading, KPS score, radiotherapy and the level of Ki-67/EGFR were independently related to prognosis. In high pathological grading population, the result showed the KPS score and chemotherapy were the independently prognostic factors.ConclusionBetter prognostic glioma patients was depending on median age, low pathological grading, high KPS score, radiotherapy and low expression of Ki-67/EGFR. In the patients with high pathological grading, high KPS scores and chemotherapy were positively related to better survival outcome.
Brain glioma; Prognostic factors; Survival analysis
2017- 01- 03
2017- 06- 20
△魏厚禄,E-mail:weihoulu@163.com
R739.41
A
10.3969/j.issn.1674- 0904.2017.05.007
Lv FQ, Huang W, Lin AG, et al. Prognostic factors analysis of 108 patients with brain glioma [J]. J Cancer Control Treat, 2017,30(5): 359-363.[吕凤琼,黄伟,林爱国,等. 108例脑胶质瘤患者的预后影响因素分析[J]. 肿瘤预防与治疗,2017, 30(5): 359-363]
