恶性肿瘤患者并发脑梗死相关危险因素的病例对照研究
2017-11-17刘莉陈秋吕凤琼胡然青绍华
刘莉, 陈秋, 吕凤琼, 胡然, 青绍华
629000 四川 遂宁,遂宁市中心医院 神经内科(刘莉、陈秋、青绍华),全科医学科(吕凤琼),检验科(胡然)
•临床研究•
恶性肿瘤患者并发脑梗死相关危险因素的病例对照研究
刘莉, 陈秋, 吕凤琼, 胡然, 青绍华△
629000 四川 遂宁,遂宁市中心医院 神经内科(刘莉、陈秋、青绍华),全科医学科(吕凤琼),检验科(胡然)
目的探讨恶性肿瘤患者并发脑梗死的临床特点及相关危险因素。方法采用病例对照研究,将86例恶性肿瘤并发脑梗死患者作为病例组,按照年龄、性别以1:1比例匹配单纯脑梗死患者和单纯恶性肿瘤患者作为对照组,对相关临床资料进行比较,分析恶性肿瘤患者并发脑梗死的临床特点及相关危险因素。结果恶性肿瘤合并脑梗死组中不明原因的缺血性卒中是最常见的病因分型(占37.2%),单纯脑梗死组则主要为大动脉粥样硬化性卒中(占48.8%)。43.0%的患者在确诊恶性肿瘤3月内发生脑梗死,23.3%的患者在3月~6月内发生脑梗死。与单纯脑梗死患者相比,恶性肿瘤合并脑梗死组患者的D-二聚体水平明显提高(486.3±201.4vs. 325.8±213.5,P<0.001),且MRI表现中病灶数>2个的比例明显高于单纯脑梗死患者(χ2=43.914,P<0.001)。与单纯恶性肿瘤患者相比,恶性肿瘤合并脑梗死组患者的D-二聚体水平明显提高(486.3±201.4vs. 278.4±198.7,P<0.001),且发生远处转移的比例明显高于单纯恶性肿瘤患者(χ2=9.313,P=0.002)。结论恶性肿瘤患者在确诊半年内是发生脑梗死的高危时期,凝血-纤溶功能改变及发生远处转移可能与恶性肿瘤患者发生脑梗死有关。
恶性肿瘤; 脑梗死; 危险因素
目前脑血管疾病和恶性肿瘤已成为我国居民的主要死亡原因[1-3],其发病率均越来越高,且具有较高的致残率和致死率,严重危害人类健康。传统观念认为,年龄、高血压、糖尿病、高血脂等是发生脑梗死的高危因素。但临床观察发现恶性肿瘤与脑血管事件亦有密切关系,不少研究发现在无高血压、糖尿病等传统危险因素的恶性肿瘤患者中脑梗死发病风险亦明显增高[4-7]。Nilsson等[8]发现乳腺癌患者脑卒中发病率高达7.0%,在另一项研究中Selvik等[9]发现脑梗死患者中恶性肿瘤患病率明显高于普通人群,最常见的肿瘤类型为结肠癌(20.2%)、前列腺癌(15.6%)、乳腺癌(12.7%)等。脑血管事件可严重影响恶性肿瘤患者的生存质量和生存时间,因此恶性肿瘤与脑梗死的相关研究引起越来越多的关注[10]。本研究采用病例对照研究,旨在探讨恶性肿瘤患者并发脑梗死的临床特点,分析恶性肿瘤患者合并脑梗死的影响因素,为恶性肿瘤患者合并脑梗死的防治提供参考依据。
1 对象与方法
1.1 研究对象
本研究选择2008年1月至2015年12月确诊恶性肿瘤并在本院神经内科住院治疗的急性脑梗死患者作为病例组。纳入标准:①突发偏瘫、失语、肢体麻木、共济失调等神经功能缺失的症状和体征,经临床诊断为脑梗死,头颅CT和(或)MRI确诊;②经病理学诊断为恶性肿瘤患者。排除标准:①颅内肿瘤患者;②有严重合并症如心肌梗死、精神障碍等疾病;③患有严重心肝肺肾功能不全。同时,以1:1的比例选择年龄(±3岁)、性别、肿瘤类型相匹配且入院时间相近(±3月)的单纯恶性肿瘤患者作为对照组A,恶性肿瘤诊断标准及排除标准与病例组相同;以1∶1的比例选择年龄、性别相匹配且入院时间相近的单纯脑梗死患者作为对照组B,脑梗死诊断标准与病例组相同。最终共纳入86例恶性肿瘤并发脑梗死患者,包含14种常见肿瘤,包括肺癌31例、结直肠癌19例、胃癌10例、肝癌8例、乳腺癌6例、鼻咽癌4例、淋巴癌1例、子宫内膜癌1例、食道癌1例、胰腺癌1例、前列腺癌1例、膀胱癌1例、甲状腺癌1例、膀胱癌1例。同时,纳入86例恶性肿瘤患者进入单纯恶性肿瘤组,86例单纯脑梗死患者进入单纯脑梗死组。
1.2 研究方法
收集患者的相关资料,包括一般人口学资料(年龄、性别、高血压史、糖尿病史、高血脂史、吸烟史、饮酒史)及血栓事件史等。同时,收集患者住院时血常规、凝血功能、电解质、肿瘤相关标志物、肿瘤类型等相关资料。
1.3 统计学方法
本研究采用SPSS 20.0统计分析软件进行数据分析,定性资料采用频数、百分比进行统计描述,定量资料采用均数±标准差进行统计描述;定性资料组间比较,采用χ2检验;定量资料采用配对t检验或方差分析比较组间差异;采用条件Logistic回归模型筛选恶性肿瘤患者脑梗死的影响因素。检验水准α=0.05。
2 结 果
2.1 一般资料的比较
恶性肿瘤合并脑梗死组共纳入86例患者,其中男性51例(59.3%),女性35例(40.7%)。恶性肿瘤合并脑梗死组、单纯脑梗死组、单纯恶性肿瘤组的平均年龄分别为(61.5±10.9)岁、(58.2±11.4)岁、(62.1±10.5)岁,差异无统计学意义(P>0.05)。恶性肿瘤合并脑梗死组共涉及14种肿瘤类型,其中肺癌、结直肠癌、胃癌最常见,分别占36.0%(31/86)、22.1%(19/86)、11.6%(10/86)。在传统脑血管因素中,三组患者的糖尿病史、高血脂史比例差异有统计学意义,两两分析发现单纯脑梗死组的糖尿病史、高血脂史比例明显高于其他两组(P<0.05)。恶性肿瘤合并脑梗死组中高血压史和吸烟史是常见的脑血管风险因素。见表1。
2.2 恶性肿瘤合并脑梗死与单纯脑梗死病因学分型比较
根据TOAST分型标准,两组患者的病因分型差异有统计学意义(χ2=23.736,P<0.001)。恶性肿瘤合并脑梗死组中不明原因的缺血性卒中是最常见的病因分型,占37.2%,其次是大动脉粥样硬化性卒中,单纯脑梗死组则主要为大动脉粥样硬化性卒中(48.8%)。见表2。

表1 三组患者一般情况的比较

表2 恶性肿瘤合并脑梗死组与单纯脑梗死病因学分型
2.3 恶性肿瘤合并脑梗死患者脑梗死发生与肿瘤确诊时间间隔
本研究中恶性肿瘤合并脑梗死组肺癌、结直肠癌、胃癌分别占36.0%、22.1%、11.6%,对这三类肿瘤的患者的脑梗死发生与恶性肿瘤确诊的时间间隔进行分析,结果见表3。17.4%的患者在确诊恶性肿瘤前以脑梗死为首发表现,43.0%的患者在确诊恶性肿瘤3月内发生脑梗死,23.3%的患者在3~6月内发生脑梗死。见表3。

表3 脑梗死发生与肿瘤确诊时间间隔
2.4 恶性肿瘤合并脑梗死与单纯脑梗死临床资料的比较
与单纯脑梗死患者相比,恶性肿瘤合并脑梗死组患者的D-二聚体水平明显提高(486.3±201.4vs. 325.8±213.5,P<0.001),且MRI表现中病灶数>2个的比例明显高于单纯脑梗死患者(χ2=43.914,P<0.001)。见表4。

表4 恶性肿瘤合并脑梗死组与单纯脑梗死患者临床资料比较
2.5 恶性肿瘤合并脑梗死与单纯恶性肿瘤临床资料的比较
与单纯恶性肿瘤患者相比,恶性肿瘤合并脑梗死组患者的D-二聚体水平明显提高(486.3±201.4vs. 278.4±198.7,P<0.001),且发生远处转移的比例明显高于单纯恶性肿瘤患者(χ2=9.313,P=0.002),发生脑转移的比例亦高于单纯恶性肿瘤患者(χ2=4.976,P=0.026)。见表5。

表5 恶性肿瘤合并脑梗死组与单纯恶性肿瘤患者临床资料比较
2.6 恶性肿瘤患者发生脑梗死的危险因素分析
采用Logistic回归对恶性肿瘤患者发生脑梗死的危险因素进行分析,病例组为恶性肿瘤合并脑梗死患者,对照组为单纯恶性肿瘤患者,以是否发生脑梗死为因变量,将影响因素纳入方程中,结果显示D-二聚体水平、是否存在转移、是否存在脑转移有统计学意义。见表6。
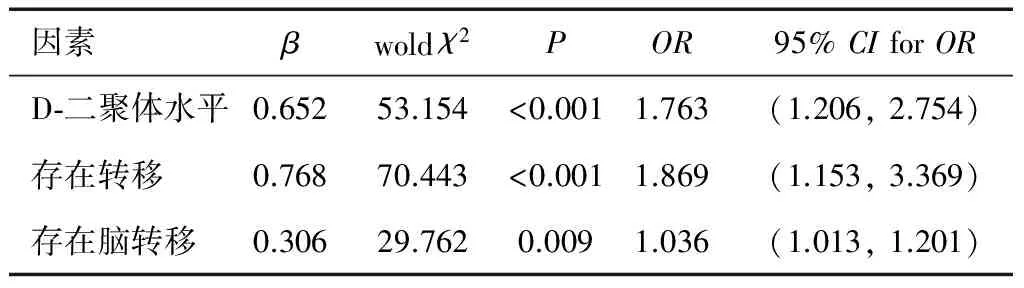
表6 恶性肿瘤患者发生脑梗死的危险因素分析
3 讨 论
目前越来越多的研究发现恶性肿瘤与脑血管事件亦有密切关系[4-7],恶性肿瘤罹患脑血管事件的风险明显高于正常人群,且脑血管事件可严重影响恶性肿瘤患者的生存质量和生存时间。本研究中肺癌、结直肠癌、胃癌是发生脑梗死最常见的恶性肿瘤类型,与以往的研究结果相似[6,11-12],这可能与恶性肿瘤的发病率有关,肺癌、胃癌、结直肠癌分别是发病顺位的第1位、第2位和第4位[2],由于本研究为回顾性病例对照研究,无法分析恶性肿瘤发生脑梗死的发生率,有待进一步的研究。本研究中恶性肿瘤合并脑梗死组中17.4%的患者在确诊恶性肿瘤前以脑梗死为首发表现,43.0%的患者在确诊恶性肿瘤3月内发生脑梗死,23.3%的患者在3月~6月内发生脑梗死。Zoller等[13]对癌症登记中心的数据进行分析发现对于恶性肿瘤患者,从确诊肿瘤到发生脑梗死,在6个月内的发生率为1.6%,6个月至1年内的发生率为1.1%,1年至5年的发生率为1.1%。提示脑梗死的发生与恶性肿瘤的发生时间存在一定的时间关系,确诊恶性肿瘤后的半年内是脑梗死发生的高风险时期,这可能与患者的治疗手段有关。杨轶等[14]研究发现接受手术治疗的肺癌患者发生静脉血栓栓塞事件的OR值为9.867,Hung等[15]调查发现采取放疗措施的肺癌患者发生脑梗死的风险明显提高。因此,是否有必要在围手术期或治疗期间采取预防脑血管事件的措施值得更深入的研究。
本研究中与单纯脑梗死的患者相比,恶性肿瘤合并脑梗死患者的糖尿病史和高血脂史比例明显较低,且恶性肿瘤合并脑梗死组中不明原因的缺血性卒中是最常见的病因分型,而单纯脑梗死组则主要为大动脉粥样硬化性卒中,说明在传统的脑血管意外高危因素以外,可能有其他发病机制参与脑梗死的发生,可能与恶性肿瘤有关,也有可能与恶性肿瘤的治疗有关。而本研究中37.2%的恶性肿瘤合并脑梗死患者表现为不明原因的缺血性脑卒中,且有18.3%的患者在确诊恶性肿瘤前以脑梗死为首发表现,提示临床上应提高恶性肿瘤合并脑梗死的认识。Kim等[16]发现161例恶性肿瘤合并脑梗死患者中39.8%患者无传统脑血管意外高危因素,而这些患者的MRI多表现为多发病灶且D-二聚体水平明显高于有传统脑血管意外高危因素的患者,与本研究的结果一致。D-二聚体水平主要反映纤维蛋白溶解功能,是交联纤维蛋白在纤溶酶的作用下产生的一种产物。大量研究显示恶性肿瘤与凝血-纤溶系统异常有密切关系[17-18]。同时,结果显示是否存在转移、是否存在脑转移是恶性肿瘤患者发生脑梗死的高危因素,Kato等[19]发现发生脑部转移的进展期非小细胞肺癌患者罹患脑梗死的概率(66.6%)高于未发生脑部转移的患者(30.0%),提示临床医生应警惕发生远处转移的恶性肿瘤患者罹患脑梗死的可能。
本研究为回顾性研究,存在一定的局限性,且由于每种恶性肿瘤的样本量较小,故纳入多种恶性肿瘤,有一定的混淆因素,造成研究结果存在一定的偏倚。故需应采用大样本及前瞻性研究对单个恶性肿瘤患者发生脑梗死的流行病学现状和恶性肿瘤患者发生脑梗死的可能机制进行进一步的调查。
作者声明:本文第一作者对于研究和撰写的论文出现的不端行为承担相应责任;
利益冲突:本文全部作者均认同文章无相关利益冲突;
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统学术不端检测;
同行评议:经同行专家双盲外审,达到刊发要求。
[1] 宇传华,季洁,张干深,等. 中国人寿命、死因与健康危险因素—全球疾病负担研究最新结果[J]. 中国卫生统计,2015,32(1):181-182.
[2] 高婷,李超,梁锌,等. 中国癌症流行的国际比较[J]. 中国肿瘤,2016,25(6):409-414.
[3] 李沃林,帅志勇,罗秀芳,等. 2013~2015年广东省东莞市桥头镇居民死因监测及恶性肿瘤死亡特征分析[J]. 肿瘤预防与治疗,2016,29(6):327-331.
[4] Hung SK, Lee MS, Chiou WY, et al. High incidence of ischemic stroke occurrence in irradiated lung cancer patients:a population-based surgical cohort study[J]. PLoS One,2014,9(4):e94377.
[5] Chen PC, Muo CH, Lee YT, et al. Lung cancer and incidence of stroke: a population-based cohort study[J]. Stroke,2011,42(11):3034-3039.
[6] Cestari DM, Weine DM, Panageas KS, et al. Stroke in patients with cancer: incidence and etiology[J]. Neurology,2004,62(11):2025-2030.
[7] Chu CN, Chen PC, Bai LY, et al. Young nasopharyngeal cancer patients with radiotherapy and chemotherapy are most prone to ischaemic risk of stroke: a national database, controlled cohort study[J]. Clin Otolaryngol,2013,38(1):39-47.
[8] Nilsson G, Holmberg L, Garmo H, et al. Increased incidence of stroke in women with breast cancer[J]. Eur J Cancer,2005,41(3):423-429.
[9] Selvik HA, Thomassen L, Logallo N, et al. Prior cancer in patients with ischemic stroke: the Bergen NORSTROKE study[J]. J Stroke Cerebrovasc Dis,2014,23(5):919-925.
[10] 高思睿,郭阳. 恶性肿瘤与脑梗死相关性的研究进展[J]. 中风与神经疾病杂志,2014,31(8):766-768.
[11] Schwarzbach CJ, Schaefer A, Ebert A, et al. Stroke and cancer: the importance of cancer-associated hypercoagulation as a possible stroke etiology[J]. Stroke,2012,43(11):3029-3034.
[12] Kuan AS, Chen SC, Yeh CM, et al. Risk of Ischemic Stroke in Patients With Gastric Cancer: A Nationwide Population-Based Cohort Study[J]. Medicine (Baltimore),2015,94(37):e1336.
[13] Zoller B, Ji J, Sundquist J, et al. Risk of haemorrhagic and ischaemic stroke in patients with cancer: a nationwide follow-up study from Sweden[J]. Eur J Cancer,2012,48(12):1875-1883.
[14] 杨轶,周箴,艾星浩,等. 肺癌术后并发静脉血栓栓塞症的临床分析[J]. 肿瘤,2012,32(5):361-367.
[15] Hung SK, Lee MS, Chiou WY, et al. High incidence of ischemic stroke occurrence in irradiated lung cancer patients:a population-based surgical cohort study[J]. PLoS One,2014,9(4):e94377.
[16] Kim SG, Hong JM, Kim HY, et al. Ischemic stroke in cancer patients with and without conventional mechanisms: a multicenter study in Korea[J]. Stroke,2010,41(4):798-801.
[17] Rickles FR, Levine MN. Epidemiology of thrombosis in cancer[J]. Acta Haematol,2001,106(1-2):6-12.
[18] Lee AY, Levine MN, Baker RI, et al. Low-molecular-weight heparin versus a coumarin for the prevention of recurrent venous thromboembolism in patients with cancer[J]. N Engl J Med,2003,349(2):146-153.
[19] Kato M, Shukuya T, Mori K, et al. Cerebral infarction in advanced non-small cell lung cancer: a case control study[J]. BMC Cancer,2016,16:203.
TheClinicalFeaturesandInfluencingFactorsofCerebralInfarctioninCancerPatients:ACaseControlStudy
Liu Li1, Chen Qiu1,Lv Fengqiong2, Hu Ran3, Qin Shaohua1△
(1.DepartmentofNeurology,SuiningCentralHospital,Suining629000,Sichuan,China;2.DepartmentofGeneralSurgery,SuiningCentralHospital,Suining629000,Sichuan,China;3.DepartmentofLaboratory,SuiningCentralHospital,Suining629000,Sichuan,China)
Objective: To investigate the clinical features and influencing factors of cerebral infarction in cancer patients.MethodsA case control study was conducted and 86 patients diagnosed with cancer and cerebral infarction were collected as the case group, while 86 cancer patients without cerebral infarction and 86 non-cancer patients with cerebral infarction were collected and matched according to age and gender. Clinical data were compared among groups.ResultsAmong cancer patients with cerebral infarction, stroke of other undemonstrated etiology was the most common type of stroke (37.2%), while for non-cancer patients with cerebral infarction group was large-artery atherosclerotic stroke (48.8%). 43.0% of cancer patients developed cerebral infarction within 3 months since the diagnosis of cancer, and 23.3% of patients developed cerebral infarction between 3 to 6 months. Compared with non-cancer patients with cerebral infarction, the level of D-dimer and percentage of multiple infarction regions were higher in cancer patients without cerebral infarction. Compared to cancer patients without cerebral infarction, the level of D-dimer and percentage of distant metastasis were higher in cancer patients without cerebral infarction.ConclusionsFor cancer patients, within the first 6 months were the high risk period of developing cerebral infarction. The change of coagulation and fibrinolysis function and distant metastasis may be associated with cerebral infarction in cancer patients.
Cancer; Cerebral infarction; Influencing factors
2017- 02- 21
2017- 07- 16
△青绍华,E-mail:354968106@qq.com
R730.231
A
10.3969/j.issn.1674- 0904.2017.05.005
Liu L , Chen Q,Lv FQ, et al. The clinical features and influencing factors of cerebral infarction in cancer patients: a case control study[J]. J Cancer Control Treat, 2017,30(5): 348-352. [刘莉,陈秋,吕凤琼,等. 恶性肿瘤患者并发脑梗死的相关危险因素的病例对照研究[J]. 肿瘤预防与治疗,2017, 30(5): 348-352]
