中性粒细胞对肺癌血管生成的影响及机制研究*
2017-11-17韩露露周晓琬冯倩吕艳芳李慧忠王刚郑骏年
韩露露, 周晓琬, 冯倩, 吕艳芳, 李慧忠, 王刚, 郑骏年
221002江苏 徐州,徐州医科大学 肿瘤研究所,肿瘤生物治疗实验室 (韩露露、周晓琬、冯倩、吕艳芳、李慧忠、王刚、郑骏年);221002 江苏 徐州,江苏省肿瘤生物治疗协同创新中心,徐州医科大学附属医院 肿瘤中心(郑骏年)
•应用基础研究•
中性粒细胞对肺癌血管生成的影响及机制研究*
韩露露, 周晓琬, 冯倩, 吕艳芳, 李慧忠, 王刚, 郑骏年△
221002江苏 徐州,徐州医科大学 肿瘤研究所,肿瘤生物治疗实验室 (韩露露、周晓琬、冯倩、吕艳芳、李慧忠、王刚、郑骏年);221002 江苏 徐州,江苏省肿瘤生物治疗协同创新中心,徐州医科大学附属医院 肿瘤中心(郑骏年)
目的探讨中性粒细胞活化对肺癌血管生成的影响及其分子机制。方法以人早幼粒白血病细胞系HL-60为基础,利用DMSO诱导其分化为中性粒细胞样细胞,利用慢病毒感染手段建立低表达PARP-1中性粒细胞系,利用LPS刺激、与肺癌细胞共培养方式活化中性粒细胞,收集中性粒细胞活化上清后进行血管生成实验,应用Realtime-PCR、Western blot和明胶酶谱实验检测血管生成影响因子VEGF和MMP-9的表达情况。结果中性粒细胞活化产物显著增强肺癌血管生成能力,Western Blot结果显示,低表达PARP-1中性粒细胞构建成功,低表达PARP-1中性粒细胞对肺癌血管生成的促进作用减弱,明胶酶谱实验和Western Blot实验结果显示,MMP-9蛋白的活性及表达量与PARP-1表达量呈负相关,Realtime-PCR结果表明低表达PARP-1中性粒细胞VEGF和MMP-9表达明显减少。结论中性粒细胞通过PARP-1基因调控MMP-9和VEGF表达促进肺癌血管生成,PARP-1基因可能成为肺癌治疗的新靶点。
肺癌; 中性粒细胞; PARP-1; 血管生成
肿瘤微环境对肿瘤的发生发展具有重要影响,瘤体内往往伴随着大量炎症细胞浸润[1],如中性粒细胞、巨噬细胞等,其在肿瘤细胞的生存、增殖、血管生成和转移过程中扮演着重要角色[2]。中性粒细胞是一种多形核白细胞,占白细胞总数的55%~70%,处于机体防御的前线,是天然免疫的重要组成部分。多年来,肿瘤微环境中中性粒细胞的作用一直未被重视,然而,近年来炎症在肿瘤起始和进展中的作用引起广泛兴趣,作为重要的炎性细胞,中性粒细胞在肿瘤进展中的作用也越来越被研究人员所关注[2]。
研究表明,非小细胞肺癌(NSCLC)患者肿瘤浸润CD66b+中性粒细胞增加,且与NSCLC复发密切相关[3];另一方面外周血中性粒细胞/淋巴细胞比例可以直接作为诊断预后的指标[4];与巨噬细胞类似,中性粒细胞包含一个被称为肿瘤相关中性粒细胞的细胞亚群,肿瘤相关中性粒细胞在包括肺癌在内的多种肿瘤瘤体内大量浸润。在肺癌早期,肿瘤浸润的中性粒细胞可以刺激T细胞增殖[5],并扮演抗原提呈的角色来激活T细胞[6],然而中性粒细胞在肺癌进展中的作用机制缺乏系统研究。
新生血管生成是肿瘤生长的关键步骤,也是肿瘤浸润和转移的必要前提[7],肿瘤微环境中炎症细胞的聚集可释放炎症因子对血管生成发挥调节作用[8],抑制血管生成成为现今肺癌治疗的重要方向[9-10],目前关于中性粒细胞对肺癌新生血管形成的影响机制尚未见报道。本研究旨在探讨中性粒细胞对肺癌血管生成的影响,并初步探明相关分子机制。
1 材料和方法
1.1 材料
人早幼粒白血病细胞系HL-60细胞、HUVEC细胞、A549细胞、293T细胞购自ATCC公司并保存于本实验室;DMEM培养基、1640培养基购自Gibco公司;胎牛血清购自Thermo公司;蛋白浓度测定试剂盒购自碧云天公司;兔抗人MMP-9抗体和兔抗人Actin抗体购自Cell Signaling公司;蛋白印迹化学发光试剂盒购自Thermo公司;脂多糖(Lipopolysaccharide, LPS)购自Sigma公司;Matrigel胶购自CORNING公司;羊抗人PARP-1抗体、对照shRNA和PARP-1 shRNA质粒购自Santa Cruz公司。
1.2 细胞培养和转染
HL-60细胞培养于含10%FBS和100u/mL青霉素/链霉素的1640培养基中,将细胞置于37℃、5% CO2培养箱中培养,用含有1.3% DMSO的完全培养基诱导HL-60细胞5~7天使其分化成中性粒细胞样细胞[11]。肺腺癌A549细胞和人脐静脉内皮细胞HUVEC细胞均用DMEM培养基培养。
将对照shRNA或PARP-1 shRNA质粒和pMD2.G、psPAX2质粒共转293T细胞进行病毒包装,48h后收集上清,经离心、过滤后感染HL-60细胞,感染48h后加嘌呤霉素进行筛选,连续筛选3天后,Western blot检测PARP-1敲除效果。
1.3 中性粒细胞活化产物制备
上述方法使HL-60细胞分化后,用含有1μg/mL LPS的无血清培养基活化中性粒细胞(1×107/mL)4小时,0h作为未活化对照组。期间为防止细胞下沉于EP管底部影响活化,每间隔10min轻弹EP管一次,最后1 000rmp,离心5min,取上清及细胞以备后续实验,上清即为中性粒细胞活化产物。
1.4 共培养
A549细胞接种于六孔板,当细胞生长融合约90%时,PBS清洗2遍后接种诱导分化的中性粒细胞(1×107/mL,无血清1640培养基重悬),共孵育4h后收集上清及活化的中性粒细胞备用。
1.5 血管生成实验
利用HUVEC细胞小管生成实验体外模拟血管生成,内皮细胞在基质胶上培养时能形成管状结构,接近人体内血管生成过程[12-13]。提前将100uL Matrigel胶铺在48孔板中,置细胞培养箱孵育1h。胰酶消化HUVEC细胞并计数,用中性粒细胞活化产物或对照培养基重悬细胞至1.5×105/mL,每孔加200μL细胞悬液,置于细胞培养箱中培养,随后HUVEC细胞聚合成管状结构,5h后显微镜下观察并拍照,形成的小管数目即代表促血管生成能力。随机挑选五个视野进行小管形成数量统计分析,
1.6 Realtime-PCR实验
用Trizol法提取活化后中性粒细胞RNA,反转录成cDNA后利用VEGF和MMP-9引物进行Realtime-PCR检验,反应条件为:95℃,10min;95℃,10s;60℃,34s;40个循环。GAPDH作为内参。
1.7 明胶酶谱实验
取中性粒细胞活化产物与不含有还原剂的上样缓冲液混合,然后用10%的SDS-PAGE胶电泳分离。电泳结束后,用洗脱液(2.5% Triton X-100)震荡洗脱后置孵育液(50 mM Tris-HCl、5mM CaCl2、1μM ZnCl2,pH 7.4)37℃孵育36h,结束后用考马斯亮蓝染色4h,然后用脱色液(50%甲醇、40%双蒸水、10%冰乙酸)振荡洗脱直至显示透亮条带。拍照后进行统计学分析。
1.8 Western blot实验
收集活化的中性粒细胞于EP管中,加入300μL含有蛋白酶抑制剂的RIPA裂解液,提取总蛋白。蛋白浓度测定定量后SDS-PAGE凝胶电泳分离,恒流200mA转移至NC膜。5%脱脂牛奶封闭1h,加入MMP-9抗体,4℃摇床孵育过夜。次日TBST洗膜3次,二抗室温孵育1h,TBST振荡洗膜3次。用化学发光法显色,凝胶成像系统采集成像。
1.9 统计学分析
实验数据以均数±标准差(Mean±SD)呈现,统计分析采用t检验,P<0.05认为差异具有统计学意义。数据处理均利用SPSS20.0软件进行。
2 结 果
2.1 中性粒细胞活化产物促进肺癌新生血管生成
首先利用LPS或A549细胞共培养激活中性粒细胞,收集活化产物,用活化产物重悬HUVEC细胞后接种于预先铺过Matrigel胶的48孔板中,5h后显微镜下观察并记录小管生成情况,小管数目即代表血管生成能力,结果显示,图1A可见,LPS活化中性粒细胞刺激HUVEC细胞形成的小管数为(13.8±3.7)个,对照组形成的小管数为(5.6±2.5)个;图1B可见,与A549共培养活化中性粒细胞组形成的小管数为(24.6±6.1)个,对照组形成小管数为(9.8±4.9)个,结果具有统计学意义(P<0.01),说明中性粒细胞活化产物显著增强肺癌血管生成能力。
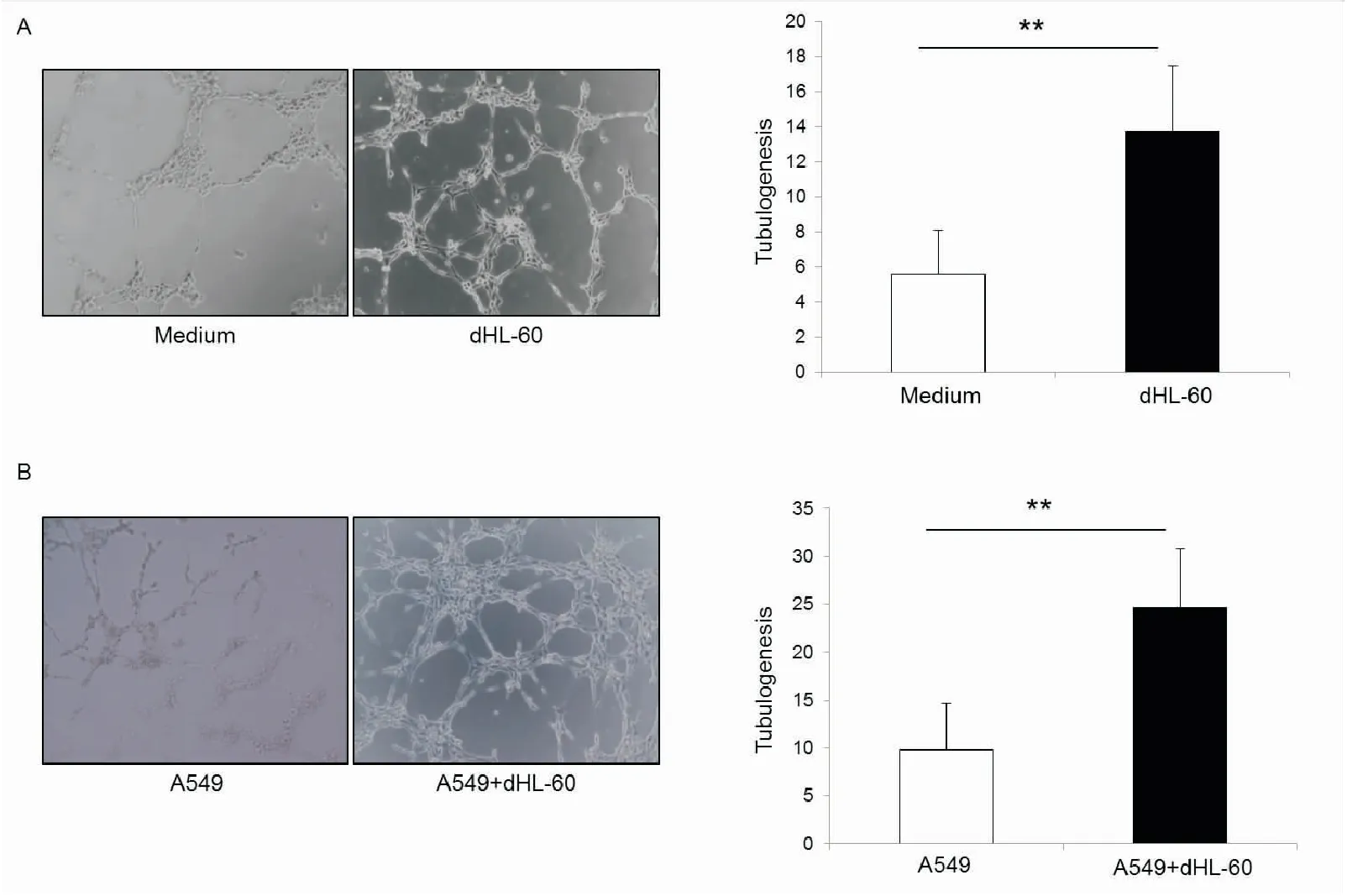
图1 中性粒细胞促进血管生成能力检测
A:中性粒细胞活化产物刺激,Medium为培养基对照组,dHL-60为中性粒细胞组B:中性粒细胞和肺癌细胞A549共培养上清刺激(×200)
2.2 构建PARP-1kd中性粒细胞稳定细胞株
利用包装的慢病毒感染HL-60细胞来构建对照和PARP-1低表达人中性粒细胞系(命名为PARP-1kd),经嘌呤霉素筛选后利用Western blot检测对照组和PARP-1kd中性粒细胞中PARP-1表达情况。结果显示PARP-1kd中性粒细胞中PARP-1蛋白表达显著低于对照组(图2),说明PARP-1低表达人中性粒细胞细胞系被成功构建。
2.3 PARP-1敲除抑制中性粒细胞对肺癌新生血管生成的促进作用
进一步利用LPS或A549细胞共培养激活PARP-1kd中性粒细胞和对照中性粒细胞,收集活化产物,重复上述血管生成实验,结果显示,由图3A可见,LPS活化PARP-1kd中性粒细胞刺激HUVEC细胞形成的小管数为(5.8±0.4)个,对照组形成的小管数为(14±3.4)个;由图3B可见,与A549共培养活化PARP-1kd中性粒细胞组形成的小管数为(5.2±1.9)个,对照组形成小管数为(23.6±5.4)个,结果具有统计学意义(P<0.01),表明降低中性粒细胞PARP-1表达显著减弱了中性粒细胞促进肺癌新生血管的生成能力。

图2 Western blot 检测转染后中性粒细胞的PARP-1表达情况

图3 PARP-1kd中性粒细胞促进血管生成能力检测
2.4 PARP-1通过调控中性粒细胞VEGF和MMP-9表达促进肺癌血管生成
血管内皮生长因子(vascular endothelial growth factor,VEGF)和基质金属蛋白酶9(matrix metalloprotein-9, MMP-9)在肿瘤组织新生血管的生成中发挥重要作用[14-15],实验中我们利用Realtime-PCR检测中性粒细胞VEGF和MMP-9的mRNA表达情况,结果显示,PARP-1kd中性粒细胞VEGF和MMP-9的表达明显低于对照组(图4),结果具有统计学意义。

图4 RT-PCR检测PARP-1低表达对中性粒细胞中VEGF、MMP-9表达的影响
然后利用明胶酶谱法和Western blot实验检测中性粒细胞活化产物中MMP-9的活性及蛋白表达情况,由图5可见,活化后中性粒细胞产生的MMP-9的活性及表达量都显著高于PARP-1kd中性粒细胞组。在共培养体系做了同样检测,结果表明,肺癌细胞激活的PARP-1kd中性粒细胞产生的MMP-9的活性及表达量均明显少于对照组(图6)。
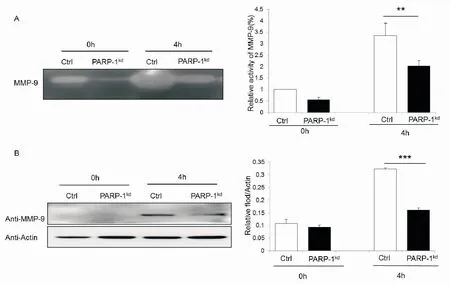
图5 PARP-1低表达对LPS活化中性粒细胞MMP-9表达的影响

图6 A549细胞和中性粒细胞共培养后,PARP-1低表达对中性粒细胞MMP-9表达的影响
以上结果分析表明,中性粒细胞活化可以促进肺癌血管生成,而PARP-1可以调控中性粒细胞VEGF和MMP-9表达,进而影响肺癌新生血管生成。
3 讨 论
肺癌的治疗手段不断进步,从手术治疗、化疗、放疗、免疫治疗到多种疗法联合应用已取得一定成效[16],但总体效果仍不令人满意。尽管目前许多针对肺癌的靶向药物的有效性不断提高,但是针对肺癌细胞的转移多无明显效果,因此建立在肿瘤微环境的理论表明针对癌灶非肿瘤细胞的靶向治疗将会是一个十分具有发展前景的新治疗方案[17]。研究肿瘤微环境中炎性细胞对肺癌进展的影响具有重要理论和现实意义。
研究发现,作为肿瘤微环境中重要的炎症细胞,中性粒细胞释放的各种炎症因子对于肿瘤的进展发挥重要的作用[18-19]。Kowanetz提出中性粒细胞可以早于肿瘤细胞在肺部聚集,形成早期转移灶,靶向清除中性粒细胞可以减少肿瘤肺转移[20]。癌症转移往往由新生血管形成的脉管系统导致,除了营养供应外,还能够提供用于肿瘤细胞传播的通道[21]。研究表明肿瘤相关中性粒细胞能够释放血管生成因子促进肿瘤血管生成,肺癌、头颈部肿瘤以及肝细胞癌中的MMP-9主要来源于中性粒细胞,且中性粒细胞能够分泌VEGF参与血管生成的调控[22-25]。为进一步探明中性粒细胞促进肺癌血管生成的分子机制,在我们的研究中,通过血管生成实验证实了中性粒细胞活化能够促进肺癌血管生成,进一步利用Realtime-PCR、明胶酶谱以及Western Blot证实了中性粒细胞活化后MMP-9及VEGF表达均升高,说明中性粒细胞通过MMP-9及VEGF表达促进肺癌血管生成,因此,中性粒细胞与肺癌血管生成相关,靶向中性粒细胞可能减弱肺癌血管生成。
聚腺苷酸二磷酸核糖转移酶-1[poly(ADP-ribose)polymerase-1,PARP-1]是真核细胞中催化聚ADP核糖化的细胞核酶,在DNA损伤修复和细胞凋亡中发挥重要作用[26]。有文章提出,PARP-1高表达肺癌患者预后较差,尤其针对肺腺癌患者[27]。近期研究发现PARP-1在组织炎症的维持与调控中发挥重要作用,阻断PARP-1能够通过抑制NF-κB途径抑制中性粒细胞的活化[28-29],且中性粒细胞在组织中的活化和滞留会加重组织损伤、抑制免疫反应,促进肿瘤进展[30]。根据以上研究报道,我们推测PARP-1可能调控中性粒细胞活化进而影响肺癌血管生成,为了验证这一猜想,实验中我们利用慢病毒手段降低中性粒细胞PARP-1基因表达,结果发现,与对照中性粒细胞组比较,降低PARP-1表达后可以显著减弱中性粒细胞对肺癌血管生成的促进作用,进一步检测发现中性粒细胞VEGF和MMP-9表达均随着PARP-1表达降低而降低,因此中性粒细胞活化促进肺癌血管生成可能是通过PARP-1调控MMP-9和VEGF方式实现。
目前,PARP-1调控中性粒细胞VEGF和MMP-9表达尚未见报道,对进一步阐明中性粒细胞促进肺癌血管生成的分子机制具有一定意义。肺癌患者自身已经存在免疫缺陷的特点,因此完全靶向消除中性粒细胞的作用弊大于利,因此鉴于前人研究及本实验研究结果,可以提出靶向中性粒细胞中PARP-1基因表达的治疗策略,从而减弱中性粒细胞对肺癌进展的促进作用。
总之,本研究表明,中性粒细胞通过PARP-1调控VEGF和MMP-9表达促进肺癌血管生成,敲除中性粒细胞PARP-1基因表达可显著减弱中性粒细胞对肺癌血管生成的促进作用。在后续的研究中我们将继续探讨完善中性粒细胞对肺癌影响的作用及其分子机制,为靶向非肿瘤细胞治疗肺癌策略提供靶点和理论依据。
作者声明:本文第一作者对于研究和撰写的论文出现的不端行为承担相应责任;
利益冲突:本文全部作者均认同文章无相关利益冲突;
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统学术不端检测;
同行评议:经同行专家双盲外审,达到刊发要求。
[1] Grivennikov SI, Greten FR, Karin M. Immunity, inflammation, and cancer[J]. Cell, 2010, 140(6): 883-899.
[2] Coussens LM, Zitvogel L, Palucka AK. Neutralizing tumor-promoting chronic inflammation: a magic bullet?[J].Science, 2013, 339(6117): 286-291.
[3] Ilie M, Hofman V, Ortholan C, et al. Predictive clinical outcome of the intratumoral CD66b-positive neutrophil-to-CD8-positive T-cell ratio in patients with resectable nonsmall cell lung cancer[J]. Cancer, 2012, 118(6): 1726-1737.
[4] Go SI, Lee A, Lee US, et al. Clinical significance of the neutrophil-lymphocyte ratio in venous thromboembolism patients with lung cancer[J]. Lung Cancer, 2014, 84(1): 79-85.
[5] Eruslanov EB, Bhojnagarwala PS, Quatromoni JG, et al. Tumor-associated neutrophils stimulate T cell responses in early-stage human lung cancer[J]. J Clin Invest, 2014, 124(12): 5466-5480.
[6] Singhal S, Bhojnagarwala PS, O'Brien S, et al. Origin and Role of a Subset of Tumor-Associated Neutrophils with Antigen-Presenting Cell Features in Early-Stage Human Lung Cancer[J]. Cancer Cell, 2016, 30(1): 120-135.
[7] Weis SM, Cheresh DA. Tumor angiogenesis: molecular pathways and therapeutic targets[J]. Nat Med, 2011, 17(11): 1359-1370.
[8] Carmeliet P, Jain RK. Molecular mechanisms and clinical applications of angiogenesis[J]. Nature, 2011, 473(7347): 298-307.
[9] 喻璟瑞,尹序德. 非小细胞肺癌靶向治疗相关研究进展[J].肿瘤预防与治疗, 2012, 25(6): 383-388.
[10] Schwaederle M, Lazar V, Validire P, et al. VEGF-A Expression Correlates with TP53 Mutations inNon-Small Cell Lung Cancer: Implications for Antiangiogenesis Therapy[J]. Cancer Res, 2015, 75(7): 1187-1190.
[11] Le Cabec V, Calafat J, Borregaard N. Sorting of the specific granule protein, NGAL, during granulocytic maturation of HL-60 cells[J]. Blood, 1997, 89(6): 2113-2121.
[12] Donovan D, Brown NJ, Bishop ET, et al. Comparison of three in vitro human 'angiogenesis' assays with capillaries formed in vivo[J]. Angiogenesis, 2001, 4(2): 113-121.
[13] Auerbach R, Lewis R, Shinners B, et al. Angiogenesis assays: a critical overview[J]. Clin Chem, 2003, 49(1): 32-40.
[14] Cao Y, EG, Wang E, et al. VEGF exerts an angiogenesis-independent function in cancer cells to promote their malignant progression[J]. Cancer Res, 2012, 72(16): 3912-3918.
[15] Kahari VM, Saarialho-Kere U. Matrix metalloproteinases and their inhibitors in tumour growth and invasion[J]. Ann Med, 1999, 31(1): 34-45.
[16] Dempke WC. Targeted Therapy for NSCLC--A Double-edged Sword?[J].Anticancer Res, 2015, 35(5): 2503-2512.
[17] Quail DF, Joyce JA. Microenvironmental regulation of tumor progression and metastasis[J].Nat Med, 2013, 19(11): 1423-1437.
[18] Di Carlo E, Forni G, Lollini P, et al. The intriguing role of polymorphonuclear neutrophils in antitumor reactions[J].Blood, 2001, 97(2): 339-345.
[19] Jakobisiak M, Lasek W, Golab J. Natural mechanisms protecting against cancer[J].Immunol Lett, 2003, 90(2-3): 103-122.
[20] Kowanetz M, Wu XM, Lee J, et al. Granulocyte-colony stimulating factor promotes lung metastasis through mobilization of Ly6G+Ly6C+ granulocytes[J].Proc Natal Acad Sci USA, 2010, 107(50): 21248-21255.
[21] Weinberg RA. Mechanisms of malignant progression[J].Carcinogenesis, 2008, 29(6): 1092-1095.
[22] Dumitru CA, Fechner MK, Hoffmann TK, et al. A novel p38-MAPK signaling axis modulates neutrophil biology in head and neck cancer[J].J Leukoc Biol, 2012, 91(4): 591-598.
[23] Kuang DM, Zhao Q, Wu Y, et al. Peritumoral neutrophils link inflammatory response to disease progression by fostering angiogenesis in hepatocellular carcinoma[J].J Hepatol, 2011, 54(5): 948-955.
[24] Nozawa H, Chiu C, Hanahan D. Infiltrating neutrophils mediate the initial angiogenic switch in a mouse model of multistage carcinogenesis[J].Proc Natl Acad Sci USA, 2006, 103(33): 12493-12498.
[25] Deryugina EI, Zajac E, Juncker-Jensen A, et al. Tissue-infiltrating neutrophils constitute the major in vivo source of angiogenesis-inducing MMP-9 in the tumor microenvironment[J].Neoplasia, 2014, 16(10): 771-788.
[26] Bouchard VJ, Rouleau M, Poirier GG. PARP-1, a determinant of cell survival in response to DNA damage[J].Exp Hematol, 2003, 31(6): 446-454.
[27] Yu P, Liu YP, Zhang JD, et al. Correlation between PARP-1 Val762Ala polymorphism and the risk of lung cancer in a Chinese population[J].Tumour Biol, 2015, 36(1): 177-181.
[28] Hong SJ, Dawson TM, Dawson VL. Nuclear and mitochondrial conversations in cell death: PARP-1 and AIF signaling[J].Trends Pharmacol Sci, 2004, 25(5): 259-264.
[29] Wang XH, Yongjin L, Guo K, et al. PARP-1 inhibitor, DPQ, attenuates LPS-induced acute lung injury through inhibiting NF-kB-mediated inflammatory response[J].Plos one, 2013, 8(11): 1-10.
[30] Gregory AD, Houghton AM. Tumor-associated neutrophils: new targets for cancer therapy[J].Cancer Res, 2011, 71(7): 2411-2416.
TheRoleandMechanismofNeutrophilinLungCancerAngiogenesis*
Han Lulu, Zhou Xiaowan, Feng Qian, Lv Yanfang, Li Huizhong, Wang Gang, Zheng Junnian△
(1.LaboratoryofBiologicalCancerTherapy,CancerInstitute,XuzhouMedicalUniversity,Xuzhou221002,China; 2.JiangsuCenterfortheCollaborationandInnovationofCancerBiotherapy,CancerInstitute,XuzhouMedicalUniversity,TheAffiliatedHospitalofXuzhouMedicalUniversityCancerCenter,Xuzhou221002,Jiangsu,China)
Objective: To detect the relationship between neutrophil activation and lung cancer angiogenesis.MethodsNeutrophils, differentiated from HL-60 by DMSO, were activated by LPS and co-culture with lung cancer cell. Low expression of PARP-1 neutrophil line was constructed by lentivirus infection. Angiogenesis assay was detected after stimulation with neutrophils activation products. Realtime-PCR, Western blot and gelatin zymography were used to detect the expression of the main angiogenesis factors including VEGF and MMP-9.ResultsThe neutrophil activation products significantly enhanced the angiogenesis ability of lung cancer. Western Blot assay suggested that PARP-1kdneutrophils were successfully constructed and the ability of low expression of PARP-1 neutrophils on the promotion of lung cancer angiogenesis was weakened. The results of gelatin zymography and Western Blot assay showed that the activity and the expression of MMP-9 protein was negatively correlated with PARP-1 expression. Realtime-PCR results showed that the expression of VEGF and MMP-9 in PARP-1kdneutrophils was significantly decreased.ConclusionNeutrophils promote the angiogenesis of lung cancer by regulating the expression of MMP-9 and VEGF through PARP-1 gene.
Lung cancer; Neutrophil; PARP-1; Angiogenesis
2017- 03- 16
2017- 08- 22
国家自然科学基金(编号:81400055),江苏省自然科学基金(编号:BK20140242)
△郑骏年,E-mail: jnzheng@xzhmu.edu.cn
R734.2;R730.4
A
10.3969/j.issn.1674- 0904.2017.05.002
Han LL, Zhou XW, Feng Q,et al. The role and mechanism of neutrophil in lung cancer angiogenesis [J]. J Cancer Control Treat, 2017,30(5):330-336.[韩露露,周晓琬,冯倩,等. 中性粒细胞对肺癌血管生成的影响及机制研究[J].肿瘤预防与治疗,2017,30(5):330-336.]
