东北林蛙PDK1基因的克隆及生物信息学分析
2017-11-16巩珊珊曲俐俐柴龙会张晶钰肖向红
巩珊珊 邵 婕 曲俐俐 柴龙会 张晶钰 肖向红
(东北林业大学野生动物资源学院,哈尔滨,150040)稿件运行过程
东北林蛙PDK1基因的克隆及生物信息学分析
巩珊珊 邵 婕 曲俐俐 柴龙会 张晶钰 肖向红*
(东北林业大学野生动物资源学院,哈尔滨,150040)稿件运行过程
东北林蛙;PDK1基因;基因克隆;生物信息学分析
PDK1是PI3K/Akt信号通路中的一个重要的激酶。在哺乳动物中,PI3K/Akt信号通路是一条保守的通路,通过激活下游的因子对糖代谢、脂肪代谢以及蛋白质代谢,细胞的增殖、分化、凋亡等起调节控制作用。本研究基于东北林蛙转录组数据,从中鉴定出PDK1基因3条Unigene序列,并通过RACE法克隆了PDK1基因的全长cDNA,命名为rdPDK1,其全长为1 990 bp,开放阅读框长1 674 bp,编码557个氨基酸。进行生物信息学分析,推测该基因编码的蛋白质相对分子质量63.7 kD,等电点为7.21。该蛋白第82~344个和443~549个氨基酸是2段保守结构域STKc激酶域和PH调节结构域。同源性分析表明rdPDK1蛋白与HsPDK1蛋白氨基酸序列一致率为79%,相似率为100%;与MmPDK1蛋白氨基酸序列一致率为80%,相似率为100%。本研究结果有望为进一步研究东北林蛙PI3K/Akt信号通路中PDK1基因的特性及功能奠定基础。
各种生长因子与细胞膜受体结合时,如胰岛素,IGF1、PDGF等,与受体相联系的磷脂酰肌3激酶(phosphatidylinositol-3 kinase,PI3K)会被激活,内膜脂成分PIP2被PI3K磷酸化转化成PIP3,PIP3作为第二信使与蛋白的PH(pleckstrin homology)结构域结合控制一系列的信号转导[1-2]。PDK1((3-phosphoinositide dependent protein kinase1)与PKB(Protein Kinase B or Akt)均具有PH结构域与之结合并被激活。PDK1通过与 PIP3或PIP2结合,招募PKB转移至细胞膜上,PKB完全活化,激活下游因子,如GSK3β、S6K、叉头转录因子等,从而调节糖、脂肪、蛋白质代谢,细胞增殖分化、生存与凋亡,引起糖原合成、葡萄糖转运、蛋白合成、细胞生长、扩散和抗凋亡等效应[2-5]。随着深入的了解,PDK1已被人们广泛关注,成为研究的热点。
PDK1是第一个从组织中提取纯化的通过PIP3磷酸化PKB活化环(T环,Thr308)的酶[1]。作为AGC蛋白激酶家族中的一员,丝氨酸/苏氨酸激酶PDK1需要磷酸化Ser241残基才能被激活,同理与其他AGC家族成员,但其结构和功能却有所不同[6-7]。在哺乳动物中,PDK1编码556个氨基酸,分子量约63 kD,是单体多肽酶,拥有2个保守结构域,激酶活化结构域和PH调节结构域,而其他AGC激酶除PKB外均不具PH结构域,且PDK1与PKB的PH结构域位置不同,PDK1的PH结构域位于C末端,而PKB的PH结构域位于N末端的催化结构域中[7]。在PDK1的激酶结构域中还存在一个疏水基团PIF袋,用于调节其他底物,如S6K、RSK、SGK等[8-9]。
在免疫沉淀反应中发现,生长因子或胰岛素不能直接激活PDK1,而化学计量法发现,PDK1可以通过分子间作用介导其自身磷酸化。然而只有当存在某些刺激时,PDK1才能完全活化激活下游底物,在无任何刺激时,其活性保持在阈值以下,因其存在的2个结构域:PIF疏水基团和PH结构域,导致了PDK1激活下游底物的机制不一致[6]。因PKB拥有PH结构域,在PIP3存在的情况下,PDK1与PKB的PH结构域结合,从细胞质中转移至细胞膜,从而在膜上定位,构象发生改变,PDK1迅速磷酸化激活PKB,使之具有活性,发生一系列反应[10-12]。因AGC激酶家族其他成员不具有PH结构域,因此是否存在PIP3对其活化没有影响,而是通过控制疏水基序磷酸化而促进S6K和SGK活化[3]。
除了PI3K信号通路外,PDK1在很多信号通路中都具有关键性作用。其在病理状态下,会导致Ⅱ型糖尿病及癌症的发生。在胰岛素信号通路中,胰岛素传导受损会造成胰岛素抵抗,降低糖耐受,导致Ⅱ型糖尿病。研究发现,特异性PDK1的激动剂可以提高治疗糖尿病的效率,同样特异性PDK1的抑制剂则可大大提高癌症治疗的可能性[3]。因此,人们越来越关注对于PDK1的研究。
东北林蛙(Ranadybowskii)属于无尾目(Anura)、蛙科(Ranidae)、林蛙属,主要分布于中国东北部(黑龙江、吉林、辽宁)、内蒙古、俄罗斯(远东地区)、蒙古(东部)、日本、韩国及朝鲜半岛等地,东北林蛙是一种经济价值很高的两栖动物,由其雌性输卵管干制成的哈士蟆油是我国传统的中药材,在市场上供不应求,其作为重要的经济动物,具有较高的经济研究价值[13-15]。现如今在世界范围内两栖类的数量呈锐减趋势[16-17],东北林蛙作为中国东北部的优势物种同样面临濒临的危险,给养殖业带来巨大损失[18-19]。有研究显示温度的变化及生态环境的破坏是造成两栖类数量下降的主要原因之一[15,17]。本实验室已有研究显示,在低温状态下,东北林蛙体内葡萄糖含量会大量积累,作为抗冻保护物质抵制细胞外液结冰,维持生命[20]。PI3K/PKB信号通路具有多种功能,包括调控细胞生长分化,细胞生存凋亡,糖代谢,脂肪代谢,蛋白质代谢等,且PDK1是PI3K/PKB信号通路中一个关键性的激酶[6,21],也有研究证实,在PDK1缺乏的脂肪细胞中,胰岛素诱导激活PKB及S6K的作用被抑制,从而抑制糖原合成及跨膜蛋白葡萄糖转运蛋白4(GLUT4)的转位[7]。但其在东北林蛙抵抗温度变化中的作用未知。
我们根据对东北林蛙皮肤的转录组测序克隆了rdPDK1的基因全长,分析其编码氨基酸结构、信号肽以及功能位点,与其他物种的同源性比较,对其进行进化树构建。本实验目的在于揭示rdPDK1的基因功能特性,为更深一步研究奠定基础,且希望通过对东北林蛙PDK1的研究能为我们针对PI3K信号通路在东北林蛙抗低温机理的研究提供理论依据。
1 实验材料与方法
1.1 实验材料
本实验的实验动物为健康的雄性东北林蛙,2~3龄,2015年9月采自于黑龙江省伊春市友好林场,平均体重(20±2)g。首先准备数个通风容器,将东北林蛙低密度放置于通风容器中,4℃通风橱中培养2~3周后用于实验,培养期间2 d换1次经活性炭过滤的水,除去容器中水总体积的2/3,保留1/3,其他期间不可随意移动容器。
1.2 主要试剂
试剂:RNA提取试剂TRIzol®Reagent(Ambion,美国);PrimeScriptTMRTase、样品保存液、pMD18-T(TaKaRa,日本);Biowest Agarose琼脂糖(Biowest,美国);rTaqDNA聚合酶、dNTPs、D2 000Mrker、DNA胶回收试剂盒(天根生化科技有限公司,北京)。
1.3 mRNA 序列和引物
东北林蛙的PDK1 mRNA(Messenger RNA)来自于东北林蛙皮肤的基因组序列(数据尚未发表),the Beijing Genomics Institution(BGI,China)有注释。引物设计使用软件Primer Premier 5,用于扩增cDNA片段和末端(RACE法)PCR。
1.4 RNA提取和cDNA合成
取实验动物东北林蛙双毁髓处理固定于蛙板上,提取心脏、肝脏、肌肉、肾脏等组织于RNA样品保存液中,放置于液氮中迅速冷冻,然后转移至-80℃冰箱中备用。待提取RNA时,将样品保存液吸出,加入1 mL Trizol试剂,匀浆机匀浆,RNA提取实验过程按照Trizol试剂说明书进行,最后将获得的RNA沉淀溶于超纯水中,经1%的琼脂糖凝胶电泳定性检验其浓度、纯度及其有无蛋白质等杂质,经分光光度计定量检测其浓度和纯度。将RNA溶液保存于-80℃以备后续试验。按照逆转录试剂盒说明书操作步骤进行cDNA合成,取3 μL 总RNA进行反转录,cDNA保存于-20℃,用于克隆rdPDK1基因的中间片段。按照RACE法说明书使用P5′RT引物合成cDNA用于5′末端克隆;按照RACE法说明书用3′CDS引物合成cDNA用于3′末端快速扩增。
1.5 东北林蛙PDK1基因中间片段、3′末端、5′末端的克隆
引物设计:基于我们实验室对东北林蛙皮肤转录组进行高通量测序,我们获得了3条rdPDK1的Unigene序列,分别为Unigene97712(480 bp)、Unigene105918(915 bp)、Unigene100407(556 bp)。通过Unigene序列,我们使用Primer Premier 5软件对扩增rdPDK1的中间片段进行了特异性引物的上设计,PDK1S和PDK1A。P3′S及RACE法说明书中3′CDS引物用于扩增3′末端,P5′RT、P5′S和P5′A引物用于扩增5′末端(表1)。首先我们进行了最普通的多聚酶链式反应,利用特异性引物PDK1S和PDK1A进行中间片段扩增,程序为:94℃变性2 min;94℃变性30 s,55℃退火30 s,72℃延伸1 min30 s,30个循环;72℃延伸2 min,4℃无限循环结束扩增。3′末端扩增:94℃变性2 min;94℃变性30 s,52℃退火30 s,72℃延伸2 min,30个循环;72℃延伸2 min,4℃无限循环结束扩增。5′末端扩增:首先将cDNA环化,然后将环化cDNA进行PCR,94℃变性2 min;94℃变性30 s,53℃退火30 s,72℃延伸1 min30 s,30个循环;72℃延伸2 min,4℃无限循环,扩增结束。将所有PCR所获产物经2%琼脂糖凝胶电泳,获取与预测碱基数相近的单一条带,经DNA胶回收试剂盒回收产物,送生工基因科技股份有限公司进行测序。
1.6 生物信息学分析
东北林蛙PDK1cDNA全长序列被递交到NCBI,(http://www.ncbi.nlm.nih.gov/gorf/gorf.html)用于获得可能的开放阅读框和氨基酸序列;(http://blast.ncbi.nlm.nih.gov/Blast.cgi)用于蛋白同源序列比对;(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)用于获得蛋白的保守区域;软件ExPASy(http://web.expasy.org/protparam/)用于预测蛋白的理论分子式、分子量、等电点等;跨膜结构通过TMHMM在线服务器(http://cbs.dtu.dk/services/TMHMM-2.0)进行预测;Predict Protein(http://www.predictprotein.org/)用于预测蛋白质的二级结构,使用NetPhos 2.0(http://www.cbs.dtu.dk/services/NetPhos/)检测氨基酸可能的磷酸化位点;软件Clustalx用于进行各个物种间的氨基酸序列的多重序列比对;软件MEGA用于进化树构建;其他物种的氨基酸序列从GenBank中获得(http://www.ncbi.nlm.nih.gov/protein)。
2 结果与分析
2.1 东北林蛙PDK1基因的克隆
首先对3条Unigene序列进行BLAST分析,预测已知片段所在位置,经BioEdit分析,发现Unigene105918和Unigene100407为反向互补序列,对Unigene100407进行反向互补得到正义链,且与Unigene105918进行拼接。
表1 本实验所用到的引物
Tab.1 The primers used in the experiment
采用经Prime Primer 5设计的特异性引物(PDK1S、PDK1A)进行多聚酶链式反应,扩增产物进行2%琼脂糖凝胶电泳,电泳获得与预计分子量大小相符的特异性条带(图1a),经测序获得578个碱基片段,该片段序列经BioEdit分析与已知Unigene97712的下游和Unigene105918的上游序列都有部分重叠,将其输入NCBI中进行BLAST,结果显示其与非洲爪蟾(Xenopuslaevis)的PDK1的同源性最高,可确定其为同一序列。由特异性引物P3′S利用RACE法进行多聚酶链式反应,同样将产物经2%琼脂糖凝胶电泳,获得与预计分子量大小相符的特异性条带(图1b),经测序获得290个碱基片段,分析该片段,与Unigene100407下游序列一致。由特异性引物P5′RT、P5′S和P5′A进行PCR扩增,得到与预计大小分子量相符的特异性条带(图1c),克隆后测序得到1条466 bp的片段,该片段序列经序列比对分析与Unigene97712序列一致。
将所得片段与已知Unigene序列拼接后得到PDK1的cDNA全长序列(图2),全长共包含1 990 bp,其中开放阅读框为1 674 bp,编码557个氨基酸。该序列5′非翻译区(5′UTR)为90 bp,3′非翻译区(3′UTR)为226 bp,序列如图所示依次从左至右排列。

图1 东北林蛙PDK1基因中间片段(a)、3′端(b)和5′端(c)扩增结果Fig.1 Cloning of PDK1 in Rana dybowskii,Intermediate(a)、3′(b)、5′(c)注:M.D 2 000 DNA 标准Note:D 2 000 DNA Marker

图2 东北林蛙的PDK1核苷酸序列Fig.2 PDK1 of nucleotide sequence in Rana dybowskii
2.2 东北林蛙PDK1基因的生物信息学分析
2.2.1 东北林蛙PDK1基因编码氨基酸的一级结构预测分析
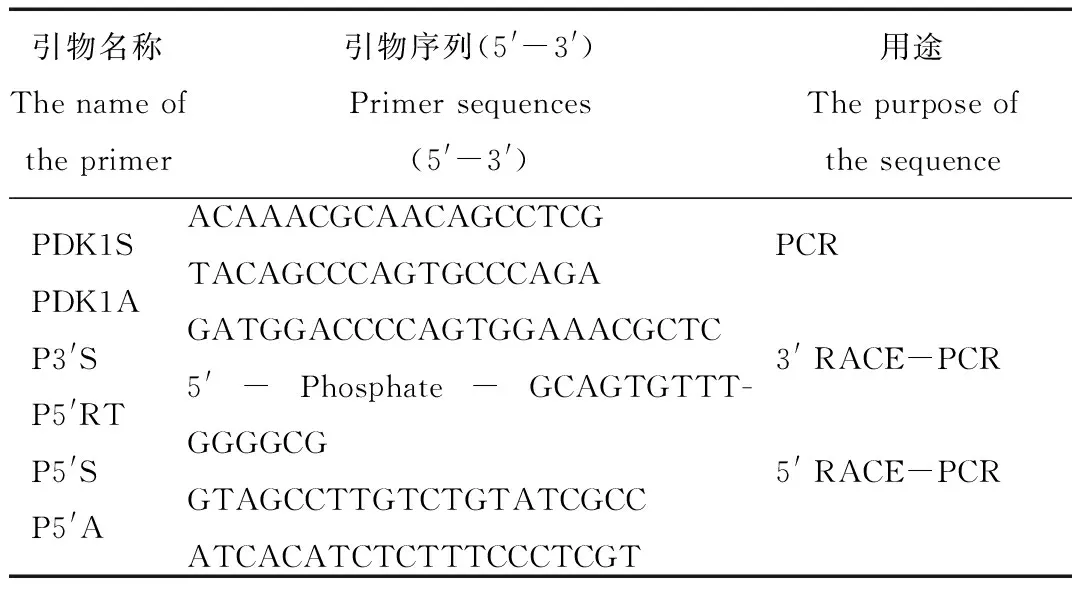
利用ExPASy软件,对rdPDK1基因编码氨基酸进行预测,结果显示rdPDK1的分子式为C2858H4438N770O844S20,分子量为63.7 kD,等电点为7.21,亲水性为-0.497,证明rdPDK1为亲水性蛋白(图3),不稳定系数为54.6,说明其为不稳定蛋白。
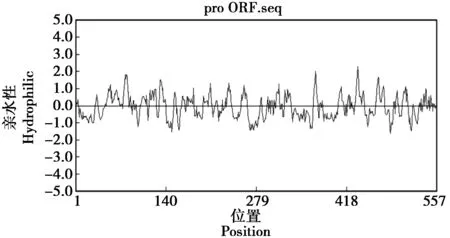
图3 东北林蛙PDK1氨基酸亲水性/疏水性分析Fig.3 The hydrophilic/ hydrophobic analysis of PDK1 in Rana dybowskii
2.2.2 东北林蛙PDK1蛋白的结构分析
通过NCBI分析东北林蛙PDK1蛋白有2个保守功能区,分别为STKc激酶结构域和PH调节结构域。STKc(a.a.82~344,E=3.38e-171)和PH(a.a.443~549,E=1.16e-67)(图4)。
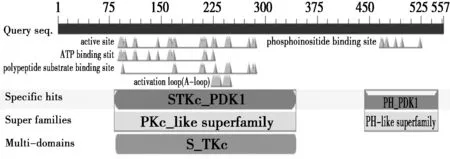
图4 PDK1蛋白的结构域分析图Fig.4 Protein structure domain distribution of PDK1
2.2.3 东北林蛙PDK1蛋白的二级结构预测
PredictProtein对东北林蛙PDK1氨基酸二级结构的预测呈现结果如下(图5),无规则卷曲为该蛋白二级结构中的主要构成部分,约为61.0%,α螺旋和β折叠分别占20.8%和18.1%。其次,软件TMHMM-2.0结果显示链延伸(Extended strand)范围内无跨膜结构域的存在。
2.2.4 东北林蛙PDK1蛋白序列与其他物种PDK1蛋白序列多重比对
使用ClustalX软件对东北林蛙PDK1蛋白的氨基酸序列与HsPDK1(Homospecies)蛋白的氨基酸序列,MmPDK1(Musmouse)进行多重比对,结果如图6。
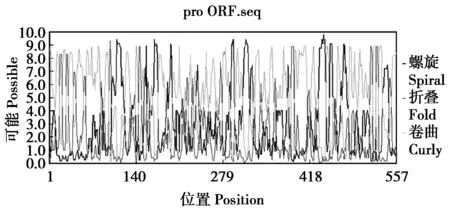
图5 东北林蛙PDK1氨基酸的二级结构预测Fig.5 The secondary structure domain predictionof PDK1 in Rana dybowskii

图6 东北林蛙与其他物种间PDK1蛋白序列的多重比对Fig.6 Multiple alignment of PDK1 amino sequences and other species 注:东北林蛙(Rd)、人(Hs,AAC51825.1)和鼠(Mm,AAC96115.1),*表示相同氨基酸 Note:Rana dybowskii(Rd)、Homo sapiens(Hs,AAC51825.1)and Mus musculus(Mm,AAC96115.1),*and represents the same amino acid
2.2.5 东北林蛙PDK1蛋白磷酸化位点预测
使用NetPhos2.0预测RdPDK1可能的磷酸化位点(表2),苏氨酸(Thr)位点13个,丝氨酸(Ser)位点32个,酪氨酸(Tyr)位点9个。
表2 东北林蛙PDK1氨基酸的磷酸位点预测

Tab.2 Prediction of phosphate sites of PDK1 amino acids in Rana dybowskii
2.2.6 东北林蛙PDK1蛋白进化树构建
使用MEGA5.1软件对各物种氨基酸序列进行比对构建进化树,分析各个物种间PDK1蛋白序列的系统发育关系。如图7所示,东北林蛙与爪蟾(Xenopus)类亲缘关系最近,与人(Homosapiens)、黑猩猩(Pantroglodytes)等哺乳动物的亲缘关系较远。

图7 不同物种的PDK1氨基酸序进化树构建Fig.7 Phylogenetic relationship of PDK1 proteins in different species 氨基酸序列来源于GenBank,人(Homo sapiens):AAC51825.1;家鼠(Mus musculus):AAC96115.1;原鸡(Gallus gallus):NP_001012547.1;褐家鼠(Rattus norvegicus):NP_112343.1;斑马鱼(Danio rerio):NP_991262.1;黑猩猩(Pan troglodytes):JAA29491.1;非洲爪蟾(Xenopus laevis):XP_018094630.1;热带爪蟾(Xenopus tropicalis):XP_002938460.2;亚洲水牛(Bubalus bubalis):XP_006059775.1;土拨鼠(Cavia porcellus):XP_012997135.1;中华鳖(Pelodiscus sinensis):XP_014429204.1;西洋鲑(Salmo salar):XP_014014409.1.
3 讨论
我们首先利用东北林蛙转录组序列获得了东北林蛙的PDK1全长(rdPDK1),然后对其序列进行分析。其全长为1 990 bp,开放阅读框1 674 bp,编码557个氨基酸,氨基酸结构中存在2个保守结构域,1个是位于第443~549个氨基酸的C末端的PH结构域,1个是位于N末端的第82~344个氨基酸STKc激酶结构域。证实rdPDK1属于PDK1蛋白家族。
对其进行同源性分析,rdPDK1蛋白与人的PDK1蛋白(Homosapiens,HsPDK1)一致率为100%和79%;与原鸡的PDK1蛋白(Gallusgallus,GgPDK1)一致率为99%和81%;与家鼠的PDK1蛋白(Musmusculus,MmPDK1)一致性为100%和80%;与野猪的PDK1蛋白(Susscrofa,SsPDK1)一致性为100%和79%。且在进行多重序列比对时,rdPDK1的氨基酸与人和鼠的PDK1氨基酸一致性极高,证明在进化过程中PDK1蛋白相对保守,并没有发生过多的突变。使用MEGA5.1软件进行进化树构建,发现rdPDK1蛋白与XlPDK1、XtPDK1蛋白亲缘关系最近,可见两栖类动物之间差距较小,与哺乳动物人、黑猩猩等之间的亲缘关系相对较远。
自1997年发现的这个AGC激酶家族的新成员丝氨酸/苏氨酸激酶PDK1,到目前为止已被公认为是一个PI3K信号通路上的一个重要的关键分子,PDK1通过调节各种激酶调控细胞代谢、细胞应答,具有调节细胞生长分化、生存凋亡等功能[21]。在对PDK1的进一步研究过程中发现,PDK1除了可以激活Akt以外,还可以激活PKA、PKC、p70S6-K、RSK、PAK、PRK等23种下游分子;因PDK1拥有自我磷酸化激活功能,可持续拥有活性,从而使底物构象持续发生改变,被磷酸化激活,露出锚定位点,被PDK1捕捉到并与之结合,增强结合能力;作为一种适用于遗传分析的单拷贝基因,在转基因小鼠模型中已取得了一定的研究成果[6,22]。由于其重要的地位及在各种疾病中的作用,人们越来越关注对PDK1的研究。本实验室已经有大量研究显示,在低温胁迫下东北林蛙体内葡萄糖浓度会大幅度增长,且冬眠恢复期后生理机能恢复正常,无任何病历产生,如糖尿病等。PDK1是丝氨酸/苏氨酸Akt被完全激活的首要分子,以至于控制糖原合成激酶GSK3β及糖原合成酶GS的活性,控制葡萄糖代谢。我们希望可以通过我们的实验来解析两栖类冬眠期的生理状态,为低温生理学带来理论数据支持以及可以发现合理的方式来治疗诸如糖尿病等疾病。
[1] Cantrell D A.Phosphoinositide 3-kinase signalling pathways[J].Journal of Cell Science,2001,114(8):1439 -1445.
[2] 王平章,王欣,罗楹,等.3-磷酸肌醇依赖性蛋白激酶-1激活AGC家族激酶的机制研究进展[J].中国生物化学与分子生物学报,2005,21(6):723-31.
[3] Mora A,Komander D,Van Aalten D M,et al.PDK1,the master regulator of AGC kinase signal transduction[J].Seminars in Cell & Developmental Biology,2004,15(2):161-170.
[4] 申力,郝友进,罗钱春,等.葱蝇PDK1基因的克隆及生物信息学分析[J].重庆师范大学学报:自然科学版,2014,31(1):30-36.
[5] Sarbassov D D,Guertin D A,Ali S M,et al.Phosphorylation and regulation of Akt/PKB by the rictor-mTOR complex[J].Science,2005,307(5712):1098-1101.
[6] 李欣.PDK1结构与功能研究进展[J].攀枝花学院学报,2014,31(2):92-95.
[7] 刘革修.3-磷酸肌醇依赖性蛋白激酶1结构和功能[J].生命科学,2005,17(5):387-391.
[8] Biondi R M,Cheung P C,Casamayor A,et al.Identification of a pocket in the PDK1 kinase domain that interacts with PIF and the C-terminal residues of PKA[J].The Embo Journal,2000,19(5):979-988.
[9] Bayascas J R.PDK1:the major transducer of PI 3-kinase actions[M]//Phosphoinositide 3-kinase in Health and Disease.Springer Berlin Heidelberg,2010:9-29.
[10] Dunn E F,Connor J H.Dominant inhibition of Akt/protein kinase B signaling by the matrix protein of a negative-strand RNA virus[J].Journal of Virology,2011,85(1):422-431.
[11] Stockman B J,Kothe M,Kohls D,et al.Identification of allosteric PIF-pocket ligands for PDK1 using NMR-based fragment screening and 1H-15N TROSY experiments[J].Chemical Biology & Drug Design,2009,73(2):179-188.
[12] Calleja V,Ameer-Beg S M,Vojnovic B,et al.Monitoring conformational changes of proteins in cells by fluorescence lifetime imaging microscopy[J].Biochemical Journal,2003,372(1):33-40.
[13] 谢锋,叶昌缓,费梁,等.中国东北地区林蛙属物种的分类学研究(两栖纲:蛙科)[J].动物分类学报,1999,24(2):224-231.
[14] Niu Shudong,Shi Xuecan,Zhang Jingyu,et al.Cloning,characterization,and expression analysis of MyD88 inRanadybowskii[J].Applied Bochemistry and Biotechnology,2016,179(2):294-306.
[15] 赵文阁.黑龙江省两栖爬行动物志[M].北京:科学出版社,2008.
[16] Whittaker K,Koo M S,Wake D B,et al.Global declines of amphibian[J].Encyclopedia of Biodiversity,2013,691-699.
[17] Rohr J R,Raffel T R,Romansic J M,et al.Evaluating the links between climate,disease spread,and amphibian declines[J].Proceedings of the National Academy of Sciences of the United States of America,2008,105(45):17436-17441.
[18] Xu Kai,Zhu Dongze,Wei Ying,et al.Broad distribution of ranavirus in free-rangingRanadybowskiiin Heilongjiang,China[J].EcoHealth,2010,7(1):18-23.
[19] Lau M W N,Stuart S N,Chanson J S,et al.Conservation needs of amphibians in China:a review[J].Science in China(Series C:Life Sciences),2007,50(2):265-276.
[20] 李秀峰.低温胁迫下东北林蛙血糖和相关酶的研究[D].哈尔滨:东北林业大学,2012.
[21] Toker A,Newton A C.Cellular signaling:pivoting around PDK-1[J].Cell,2000,103(2):185-188.
[22] 李晓艳.神经节苷脂联合依达拉奉对局灶性脑缺血再灌注大鼠PI3K、Akt、PDK1和GSK3β蛋白表达的影响[D].合肥:安徽医科大学,2015.
Ranadybowskii;PDK1 gene;Gene cloning;Bioinformatics analysis
Cloning and Bioinformatics Analysis of PDK1 Gene in Rana dybowskii
Gong Shanshan Shao Jie Qu Lili Chai Longhui Zhang Jingyu Xiao Xianghong*
(College of Wildlife Resources,Northeast Forestry University,Harbin,150040,China)
PDK1 is an important kinase in the PI3K/Akt signal pathway.The PI3K/Akt signal pathway is a conserved pathway in mammals which,by activating downstream factors,regulates the metabolism of sugar,fat,and protein as well as cell differentiation,proliferation,and apoptosis.In this study,we identified three Unigene sequences of PDK1 gene according to the transcriptome database and cloned the full-length cDNA of PDK1 gene by RACE.The full-length cDNA of PDK1 was named rdPDK1. The full-length cDNA sequence was 1 990 bp and the open reading frame was 1 674 bp,which encoded a protein of 557 amino acids.Bioinformatics analysis showed that the protein encoded by this gene had a relative molecular mass of 63.7 kD and an isoelectric point of 7.21.The amino acids 82 to 344 and 443 to 549 of the protein are two conserved domains STKc and PH,respectively.The identity of RaPDK1 protein with HsPDK1 protein was 79%,and the similarity rate was 100%.The identity of RaPDK1 protein with MmPDK1 protein was 80% and the similarity rate was 100%.The results may provide a basis for the further study of the characterization and function of PDK1 gene inRanadybowskiiPI3K/Akt signal pathway.
2017-03-14
修回日期:2017-05-17
发表日期:2017-11-10
Q959.5
A
2310-1490(2017)04-641-07
国家自然科学基金项目(31672309)
巩珊珊,女,26岁,硕士研究生;主要从事野生动物生理生态学研究。
*通讯作者:肖向红,E-mail:xiaoxh2010@sina.com
