烟碱与胃蛋白酶相互作用机理初步研究
2017-11-16韩敬美廖晓祥雷萍袁大林郑绪东尚善斋李志强汤建国李晖陈永宽
韩敬美,廖晓祥,雷萍,袁大林,郑绪东,尚善斋,李志强,汤建国,李晖,陈永宽
1 云南中烟工业有限责任公司技术中心,昆明 650231;
2 四川大学化学工程学院,成都 610064
烟碱与胃蛋白酶相互作用机理初步研究
韩敬美1,廖晓祥1,雷萍1,袁大林1,郑绪东1,尚善斋1,李志强1,汤建国1,李晖2,陈永宽1
1 云南中烟工业有限责任公司技术中心,昆明 650231;
2 四川大学化学工程学院,成都 610064
为了探究口含烟烟碱(NIC)在人体胃部的吸收特性,配制了特定浓度的柠檬酸-柠檬酸钠缓冲溶液使其pH=2.0,并在该条件下配制不同浓度的烟碱溶液样品,随后用该样品作用于胃蛋白酶,利用多种光谱学方法(分子荧光光谱、紫外光谱、红外光谱、圆二色谱)和分子模拟对接技术观察添加不同浓度烟碱前后胃蛋白酶的光谱学变化,初步研究了NIC与胃蛋白酶(Pepsin)相互作用机理。光谱学与分子模拟对接结果表明:1)NIC与Pepsin之间为静态荧光猝灭机制;2)NIC与Pepsin之间通过氢键和范德华力自发的发生相互作用;3)NIC与Pepsin之间存在着一个高亲和力的结合位点;4)NIC和Pepsin之间的相互作用不仅使Pepsin中氨基酸残基的微环境极性增加,同时使得Pepsin多肽链的C=O、C-N和N-H发生了变化,进而导致Pepsin的构象和空间结构发生变化,同时NIC的加入对Pepsin活性呈明显的增强效应。以上研究结果对口含烟产品开发、质量控制和安全评价具有重要理论意义。
烟碱;胃蛋白酶;光谱学;分子对接;作用机理
烟碱(NIC),又名尼古丁,是烟草重要成分之一,进入人体后经由血液传送,并通过血脑屏障,可到达脑部,起到兴奋、镇静等作用,从而致使人们吸烟上瘾[1-2]。研究表明,无论是动物还是人类都会对烟碱产生耐受性、依赖性和明显的戒断症状[3-4]。口含烟作为一种重要的无烟烟草制品类型,不同于传统卷烟烟气的口腔-肺呼吸道吸收模式,主要为口腔-胃肠消化道吸收模式(图1),口含烟烟碱由口腔摄入后,一部分通过口腔释放和吸收,一部分经胃肠道进一步吸收及代谢。当烟碱含量超过一定浓度时易引起人体胃肠道反应,如打嗝、恶心等生理效应,这种烟碱摄入模式的改变必然导致烟碱释放、渗透及吸收等作用形式的变化,必然也会带来机体口腔-胃肠道微环境及烟碱的药效学改变,因此研究烟碱的胃部吸收特性对口含烟产品开发非常必要。

图1 烟碱口腔-胃肠道吸收及作用途径Fig.1 Oral-gastrointestinal absorption and function pathway of NIC
胃蛋白酶(Pepsin)是人胃肠道中重要的多肽水解酶,长期以来被认为是胃部疾病的攻击因子之一[5]。烟碱自口腔摄入以后,部分进入人体胃部,可能与胃蛋白酶发生作用,目前烟碱与胃蛋白酶的相互作用研究尚未见报道,本文在前期研究基础上[6-7],在pH=2.0的条件下,利用分子荧光光谱、紫外光谱、红外光谱、圆二色谱及分子模拟对接等多种方法和技术,从分子结构层面分析烟碱对人胃蛋白酶空间结构及氨基酸残基微环境的影响,探讨烟碱与胃蛋白酶之间的作用机理,旨在进一步揭示口含烟烟碱在人体内的转运过程及吸收特性,为口含烟产品开发提供理论基础。
1 实验部分
1.1 仪器与试剂
Cary Eclipse荧光分光光度计(美国Varian公司);傅里叶变换近红外光谱仪(Thermo Scienti fi c公司);TU1901双光束紫外可见分光光度计(北京普析通用仪器有限公司);400圆二色谱仪(美国AVIV公司);DZF-6050真空干燥箱(上海精宏实验设备公司);BS224S型电子天平(北京赛多利斯仪器系统有限公司);PHS-3C pH 计(成都世纪方舟科技有限公司)。
胃蛋白酶(美国Sigma-Aldrich生物技术公司,纯度大于99%):用柠檬酸-柠檬酸钠缓冲溶液配成5.0×10-4mol/L的储备液,于4℃下保存;牛血红蛋白(美国Sigma-Aldrich生物技术公司,纯度大于99%):用柠檬酸-柠檬酸钠缓冲溶液配成0.5 wt.%的储备液,于4℃下保存;烟碱(加拿大TRC公司,纯度大于99%):用柠檬酸-柠檬酸钠缓冲溶液配成0.249 mol/L的储备液,于4℃下保存。无水柠檬酸、柠檬酸三钠(二水)、三氯乙酸均为分析纯;实验用水为三次去离子水。
1.2 实验方法
1.2.1 荧光光谱测定
配置Pepsin溶液,加入不同体积的NIC溶液,用柠檬酸-柠檬酸三钠缓冲溶液定容至5mL,使Pepsin溶液浓度为4.0×10-5mol/L,NIC最终浓 度 为0、0.498、0.966、1.494、1.992、2.490、2.988×(10-3)mol/L,并在298K、303K和308K下平衡30min。设定激发波长为280 nm,扫描波长范围为300-500 nm,激发与发射的狭缝分别为5 nm和10 nm。测定荧光寿命时,荧光激发波长为280 nm,发射波长为345 nm。同步荧光光谱扫描方法为固定Δλ(荧光发射与激发波长差)为15 nm和60 nm。三维荧光激发波长范围为200-400 nm,间隔5 nm,发射波长范围为200-500 nm。同步荧光、三维荧光及荧光寿命测定均室温(298 K)下进行,所有测定均重复六次。
1.2.2 傅里叶变换红外光谱(FT-IR)测定
固定Pepsin溶液最终浓度为4.0×10-5mol/L,加入NIC溶液,使其最终浓度为2.490×10-3mol/L,同时配制等摩尔浓度的空白Pepsin和空白NIC溶液。在温度298 K,分辨率4cm-1,扫描次数64下分别扫描柠檬酸-柠檬酸三钠缓冲溶液、空白Pepsin溶液、空白NIC溶液以及Pepsin-NIC混合液的红外光谱,测定范围为4000-600cm-1。
1.2.3 圆二色谱(CD)测定
在室温条件下,分别测定Pepsin和Pepsin-NIC在200-260 nm下的圆二色谱,其中Pepsin和NIC的最终浓度分别为5×10-6mol/L和2.49×10-4mol/L,所有数据均测量三次后取平均值。
1.2.4 分子对接
对接过程是由Discovery Studio 3.1完成。其中胃蛋白酶单晶模型,从蛋白数据库(Protein Data Bank,PDB,ID:5PEP)获得。NIC的初始结构由ChemiDraw11.0分子模拟软件包生成后,利用Discovery Studio 3.1进行优化处理。
1.2.5 胃蛋白酶活性测定
配置Pepsin溶液,加入不同体积的NIC溶液,使Pepsin浓度为2.0×10-5mol/L,NIC最终浓度分别为0、0.498、0.966、1.494、1.992、2.490、2.988、3.486(×10-3)mol/L。将配制好的不同浓度样品在310 K下恒温20min,分别加入2mL的牛血红蛋白(0.5 wt.%),310 K下恒温反应20min。20min后,向以上所有样品中分别加入2mL的三氯乙酸终止反应,12000 rpm离心30min,过滤上清液,测量上清液在275 nm下的紫外吸收光谱值。
2 结果与讨论
2.1 荧光光谱及猝灭机理
胃蛋白酶中色氨酸残基的存在,使其在340 nm处有最大发射峰。当药物与胃蛋白酶结合时,会改变其内部氨基酸残基所处的微环境,从而会引起蛋白荧光光谱的变化。因此,通过加入药物前后蛋白荧光光谱的变化,可以初步判断药物与胃蛋白酶是否发生作用[6]。图2为298K时Pepsin与不同浓度NIC相互作用时的荧光光谱图。从图中可看出,随着NIC浓度的增加,Pepsin最大发射峰(在340 nm左右)强度逐渐降低,由此说明NIC与Pepsin发生了结合。
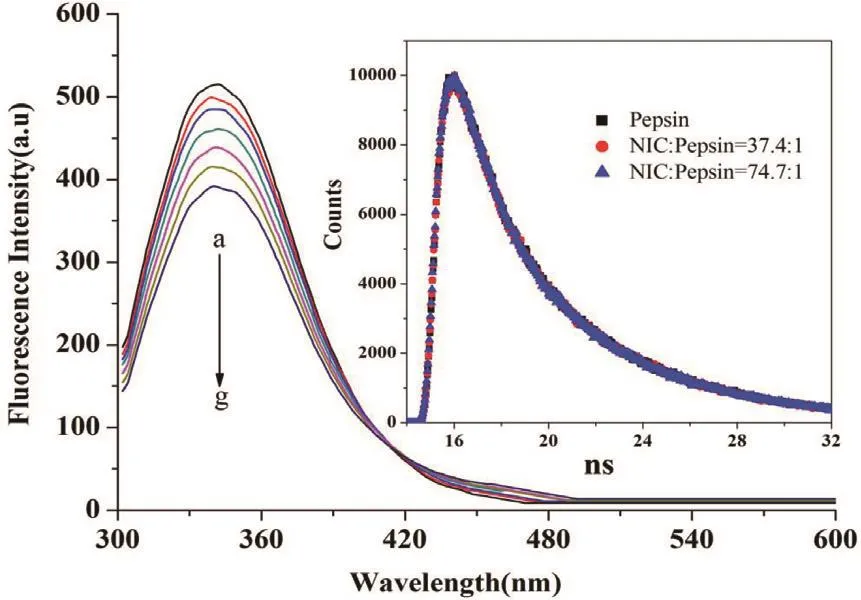
图2 不同NIC浓度条件下Pepsin的荧光强度及加入NIC 前后的Pepsin的荧光衰减图(CPepsin=4×10-5 mol/L;CNIC=0-2.988×10-3 mol/L(a→g);pH=2.0;T=298K;λex=280 nm.)Fig.2 The fluorescence intensity of pepsin with different NIC concentrations at 298 K(λex=280 nm); CPepsin=4×10-5 mol L-1;CNIC=0-2.988×10-3 mol L-1(a → g)
荧光猝灭机制分为静态猝灭和动态猝灭两种类型[9-10]。对于静态猝灭,处于基态的荧光分子与猝灭剂生成了不发光的复合物,导致其蛋白荧光强度改变;对于动态猝灭,处于激发态的荧光分子与猝灭剂接触时发生碰撞,碰撞接触后荧光分子又返回基态而引起荧光强度改变[11-12]。无论是静态猝灭还是动态猝灭,均可以通过Stern-Volmer方程来判断[13]:

式中F0为猝灭剂不存在时蛋白的荧光强度;F为加入猝灭剂后的荧光强度;[Q]为猝灭剂浓度;Ksv为Stern-Volmer猝灭常数。
从图3可看出,不同温度下的Stern-Volmer曲线线性关系良好。根据拟合结果(表1)发现,随着温度的升高,Ksv值逐渐下降,说明NIC与Pepsin之间的荧光猝灭机制为静态猝灭。

图3 不同NIC浓度、不同温度条件下Stern-Volmer线性方程图;pH=2.0,T=298,303,308KFig.3 Stern–Volmer curves of pepsin at different temperatures.pH=2.0,T=298,303,308K

表1 NIC-pepsin体系在不同温度下的结合常数及热力学参数Tab.1 Binding constants of the NIC–Pepsin system at different temperatures
应用瞬态时间分辨荧光法来进一步判断Pepsin与NIC相互作用的猝灭类型。Pepsin和Pepsin-NIC的荧光衰减图见图2,拟合结果见表2。据图2可知,加入NIC并未使Pepsin的荧光衰减曲线发生明显变化。根据公式(2),考虑误差范围内,加入NIC后Pepsin的平均荧光寿命<τ>几乎不变(表2),由此可以说明Pepsin与NIC相互作用为静态基态复合物的形成过程。
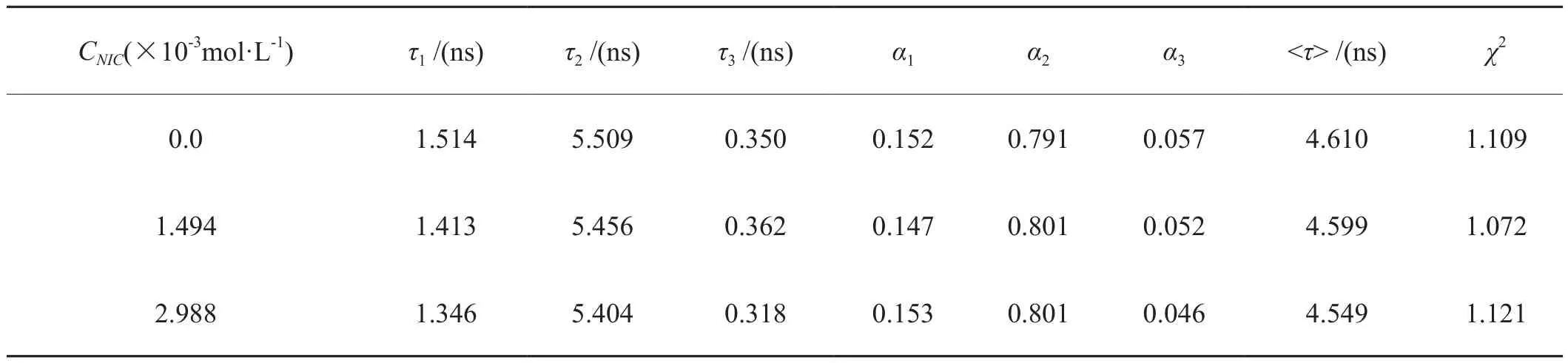
表2 不同NIC浓度下Pepsin的荧光寿命Tab.2 Fluorescence lifetime(τ)of pepsin at different NIC concentrations
对于静态猝灭过程,根据下面的双对数方程可以计算得到结合常数Ka与结合位点数n:

其中,F0为猝灭剂不存在时蛋白的荧光强度;F为加入猝灭剂后的荧光强度;[Q]为猝灭剂浓度;Ka为结合常数;n为结合位点数。根据方程(3)计算的不同温度下Ka值以及n值列于表1。从表中结果可看出,不同温度下的结合位点数n都约等于1,表明NIC与Pepsin之间存在着一个高亲和力的结合位点。此外,不同温度下的Ka值变化较小,表明随着温度升高,NIC-Pepsin复合物稳定性较好。
2.2 NIC与Pepsin相互作用力类型
药物与蛋白之间相互作用力类型有四种,即氢键、范德华力、静电引力和疏水作用力[14],以下Vanr Ho ff方程用于计算不同温度下的热力学参数[15]。

不同温度下的热力学参数列于表1。根据生物大分子以及小分子的结合力性质和系统中热力学参数的关系[16]可知:ΔG<0,说明NIC与Pepsin之间的相互作用过程是一个自发过程;ΔH<0,ΔS<0,表明NIC与Pepsin间的相互作用过程主要由氢键和范德华力主导。
2.3 Pepsin构象变化
2.3.1 同步荧光光谱学研究
同步荧光法因其选择性好,有利于单独分析随着药物浓度的升高,酪氨酸(Tyr)残基(Δλ=15 nm)和色氨酸(Trp)残基(Δλ=60 nm)微环境的变化,因此常被用于研究蛋白构象的变化[17,18]。图4为NIC和pepsin体系的同步荧光光谱图。由图可知,随着NIC浓度增大,pepsin荧光强度都随之降低,且Δλ=15 nm和Δλ=60 nm的最大发射波长均发生了红移,说明加入NIC使Tyr和Tpr残基所处的微环境极性增强,这是由于疏水性减小,增加了蛋白质肽链的伸展程度所致[19]。

图4 NIC与Pepsin相互作用的同步荧光光谱图。(A)Δλ=15 nm ;(B)Δλ=60 nm;CPepsin=4×10-5 mol/L;CNIC=0-2.988×10-3 mol/L(a→g),T=298K,pH=2.0.Fig.4 The synchronous fluorescence spectra of pepsin.(A)Δλ=15 nm;(B)Δλ=60 nm;CPepsin=4×10-5 mol L-1;CNIC=0-2.988×10-3 mol L-1(a → g),T=298K,pH=2.0.
2.3.2 三维荧光光谱研究
三维荧光光谱法常用于研究蛋白构象变化,可为NIC对Pepsin构象的影响提供更多有效信息。图5为Pepsin(A)和NIC-Pepsin(B)的三维荧光光谱图。从图中可看出,Pepsin最强的荧光峰在λex/λem=280/340 nm处,这是由Pepsin中芳香族氨基酸的π―π*跃迁所引起[20]。加入NIC后,Pepsin最强荧光峰迁移至λex/λem=280/344 nm处,即最强荧光峰峰位发生略微红移。此外,加入NIC使Pepsin的最大荧光峰强度明显降低(567→467)。这些结果表明,NIC和Pepsin之间的相互作用,使Pepsin中氨基酸残基的微环境极性增加,进而导致Pepsin的构象变化,此结果与同步荧光光谱研究结果基本吻合。
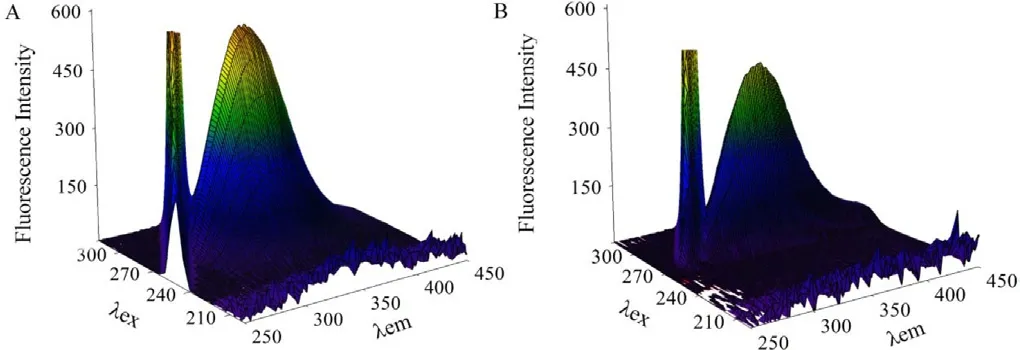
图5 Pepsin(A)和NIC-Pepsin(B)体系三维荧光光谱图;CPepsin=4.0×10-5 mol/L;CNIC=2.988×10-3 mol/L.Fig.5 The 3D fluorescence spectra of Pepsin(A)and NIC-Pepsin(B).CPepsin=4.0×10-5 mol L-1;CNIC=0,2.988×10-3 mol L-1.
2.3.3 红外光谱(FT-IR)研究
蛋白的FT-IR光谱图主要反映蛋白分子酰胺带振动偶极矩的变化,在药物与蛋白结合的研究中应用较多[21]。蛋白质在中红外区主要有NH伸缩共振(~3300cm-1),一级酰胺Ⅱ带(~3100cm-1),酰胺Ⅰ带的C=O伸缩振动(1700~1600cm-1),酰胺Ⅱ带的N-H弯曲振动和C-N伸缩振动(1600~1500cm-1)[22,23]。本文利用能灵敏反应蛋白二级结构变化的酰胺Ⅰ和酰胺Ⅱ带来考察Pepsin的结构变化。
图6为Pepsin的红外光谱图。从图中可看出,加入NIC使Pepsin酰胺Ⅰ带的C=O伸缩振动从1645.25cm-1红移至1638.12cm-1;使Pepsin酰胺Ⅱ带的N-H弯曲振动和C-N伸缩振动(1600~1500cm-1)从1541.07cm-1蓝移至1548.87cm-1。此结果表明,NIC与Pepsin发生相互作用使得Pepsin多肽链的C=O、 C-N 和N-H发生了变化,进而改变了Pepsin的空间结构。

图6 Pepsin(A)和Pepsin-NIC(B)体系的FT-IR谱图Fig.6 The FT-IR spectra of Pepsin(A)and NIC-Pepsin(B).CPepsin=4.0×10-5 mol L-1;CNIC=0,2.490×10-3 mol L-1.
2.3.4 圆二色谱(CD)研究
圆二色谱法是监测蛋白二级结构变化的有用工具。由于基态和激发态之间存在着电子转换,因此200 nm-260 nm被视为测量蛋白构象变化的有效范围[24,25]。图7显示加入NIC前后Pepsin圆二色谱图的变化。在约200 nm处Pepsin有一个很强的负峰,加入NIC前,Pepsin峰型几乎没有变化,说明Pepsin依然保持较高的β-折叠[15]。但是加入NIC后Pepsin圆二色谱峰强度明显增加,说明NIC一定程度上改变了Pepsin的二级结构。

图7 NIC对Pepsin二级结构的影响;CPepsin=5.0×10-6 mol/L;CNIC=2.49×10-4 mol/L.Fig.7 The CD spectra of Pepsin with and without NIC.CPepsin=5.0×10-6 mol L-1;CNIC=0,2.49×10-4 mol L-1
2.4 分子对接
本实验应用Discovery Studio 3.1中的CDOCKER对接程序[26]来研究NIC与Pepsin之间的活性位点。对接之前,先将受体Pepsin进行加氢预处理,给配体分子(NIC)赋力场。在pH=2.0的条件下,选中在受体Pepsin周围2.5Å 之内的所有氨基酸,然后用CDOCKER对接。图7显示的是最优的对接结果。2D图中的紫色基团代表此氨基酸基团与配体之间的作用力为氢键作用力,绿色基团代表此氨基酸基团与配体之间的作用力为范德华力。从图中可看出,NIC与Pepsin中Glu13 氨基酸残基之间的作用力为氢键作用力,与Thr218、Gly76、Tyr75、Ile30等氨基酸残基之间的作用力为范德华力。对接结果与热力学参数推测的结果相吻合。

图8 NIC与Pepsin相互作用的分子对接图Fig.8 Molecular docking results of pepsin with NIC
2.5 酶活性测定
根据Anson等[27]方法,利用牛血红蛋白水解产物在275 nm下的吸光度来比较酶活性的高低。不同浓度NIC下的Pepsin活性可由下列公式计算得到[28]:

图9为不同浓度NIC对Pepsin活性的影响,从图中可以看出,随着NIC浓度的增加,Pepsin的活性呈线性增加。此结果表明,当NIC进入到胃部后,对Pepsin活性呈明显的增强效应。
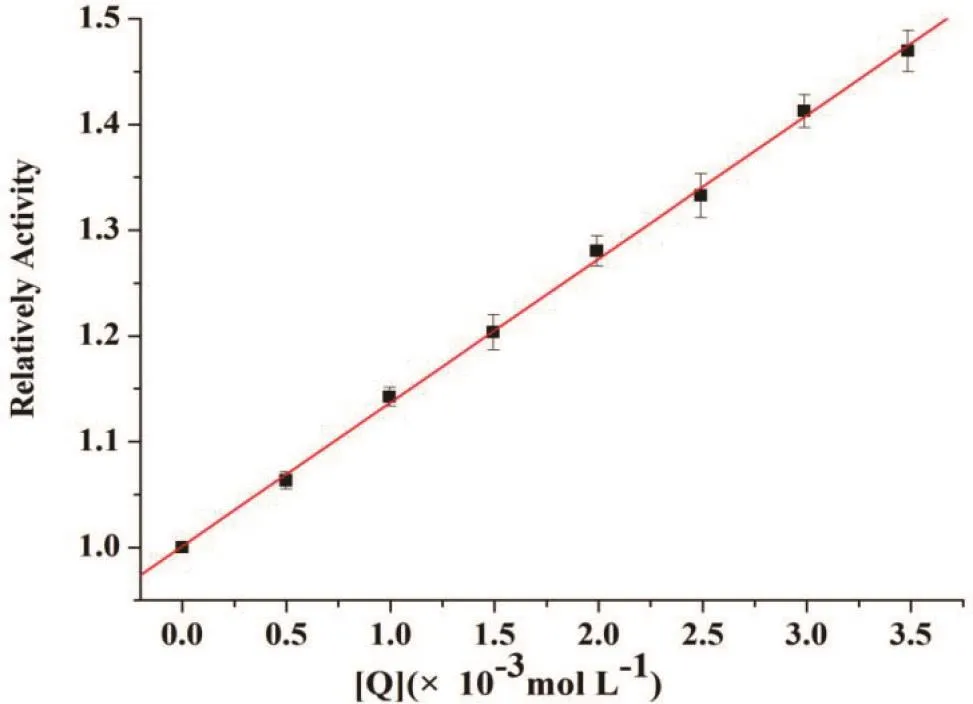
图9 不同浓度的NIC对Pepsin活性的影响;CPepsin=2.0×10-5 mol/L;CNIC=0-3.486×10-3 mol/LFig.9 The relative activity of pepsin at different NIC concentrations.CPepsin=2.0×10-5 mol L-1;CNIC=0-3.486×10-3 mol L-1.
3 结论
本文采用了荧光光谱、红外光谱、圆二色谱等多种光谱学方法和分子模拟对接技术,研究了烟碱与胃蛋白酶之间的相互作用机理。研究方法可靠、合理,易于实现,有别于传统卷烟烟碱摄入研究方法。光谱学与分子对接研究结果显示:1)烟碱与胃蛋白酶的结合过程为自发进行,其主要作用力为氢键和范德华力,猝灭类型为静态猝灭;2)烟碱与胃蛋白酶之间存在着一个高亲和力的结合位点;3)烟碱会导致胃蛋白酶构象发生变化,同时对胃蛋白酶活性有明显的增强效应。在pH=2.0的条件下,从分子层面上分析了烟碱对胃蛋白酶空间结构的影响,探讨了烟碱与胃蛋白酶之间的作用机理,揭示了口含烟烟碱在人体胃部的转运过程和吸收特性,为口含烟产品的开发、质量控制和安全评价工作提供了理论基础。
在本研究的基础上,未来还将对口含烟烟碱通过胃部吸收的渗透方式以及与人体血清蛋白相互作用等过程中的关键问题进行系统研究,进一步可为口含烟烟碱在人体内分布情况以及相关动力学研究提供基础研究,为我国口含烟制品研制提供基础数据和理论依据。
[1]Chen H,Sharp BM,Matta,SG,Wu QL(2011)Social Interaction Promotes Nicotine Self-Administration with Olfactogustatory Cues in Adolescent Rats.Neuropsychopharmacology 36:2629–2638.
[2]Viverosa MP,Marco EM,File SE(2006)Nicotine and cannabinoids:Parallels,contrasts and interactions.Neuroscience and Biobehavioral Reviews 30:1161–1181.
[3]Hughes JR,Hatsukami DK,Pickensl RW,Krahn D,Malin S,Luknic A(1984)Effect of nicotine on the tobacco with drawal syndrome .Psychopharmacology 83:82-87.
[4]Kono J,Miyata H,Ushijima S,Yanagita T,Miyasato K,Ikawa G,Hukui K(2001)Nicotine,alcohol,methamphetamine,and inhalant dependence:a comparison of clinical features with the use of a new clinical evaluation form .Alcohol 24:99 – 106.
[5]Zeng HJ,Yang R,Liang HL,Qu LB(2015)Molecular interactions of fl avonoids to pepsin:Insights from spectroscopic and molecular docking studies.Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy 151:576–590.
[6]X.X.Liao,J.G.Tang,J.W.He,D.L.Yuan,B.Liang,Q.Chen,H.Li.A New Perspective on Probing the Interaction of Nicotine with Human Serum Albumin[J].Current Analytical Chemistry,12(5):450-456.
[7]Liao XX,Yuan DL,Tang JG,Yang HQ,Liang B,Cheng Q,Li H(2016)Probing into the Interaction of Nicotine and Bovine Submaxillary Mucin:NMR,Fluorescence,and FTIR Approaches.Journal of Spectroscopy 4:1-9.
[8]Kortüm G,Wilski H(1955)The mechanism of quenching of fluorescence.Transactions of the Faraday Society 51:1620-1623.
[9]Gokoglu E,Kipcak F,Seferoglu Z(2014)Studies on the interactions of 3,6-diaminoacridine derivatives with human serum albumin by fluorescence spectroscopy,Luminescence.the journal of biological and chemical luminescence 29:872-877.
[10]Zeng HJ,You J,Liang HL,Qi T,Yang R,Qu LB(2014)Investigation on the binding interaction between silybin and pepsin by spectral and molecular docking,International journal of biological macromolecules 67:105-111.
[11]Wang Q,Zhang SR,Ji X(2014)Investigation of interaction of antibacterial drug sulfamethoxazole with human serum albumin by molecular modeling and multi-spectroscopic method.Spectrochimica acta.Part A,Molecular and biomolecular spectroscopy 124:84-90.
[12]Xiao D,Zhang L,Wang Q,Lin X,Sun J,Li H(2014)Investigations of the interactions of peimine and peiminine with human serum albumin by spectroscopic methods and docking studies.Journal of Luminescence.146:218-225.
[13]Hu YJ,Liu Y,Wang JB,Xiao XH,Qu SS(2004)Study of the interaction between monoammonium glycyrrhizinate and bovine serum albumin.Journal of pharmaceutical and biomedical analysis 36:915-919.
[14]Chandrasekaran S,Sameena Y,Enoch IV(2014)Tuning the binding of coumarin 6 with DNA by molecular encapsulators:e ff ect of beta-cyclodextrin and C-hexylpyrogallol[4]arene.Journal of molecular recognition 27:640-652.
[15]Zeng HJ,Yang D,Hu GZ,Yang R,Qu LB(2016)Studies on the binding of pepsin with three pyrethroid insecticides by multispectroscopic approaches and molecular docking.Journal of molecular recognition 29:476-484.
[16]Fan Y,Zhang S,Wang Q,Li J,Fan H,Shan D(2013)Investigation of the interaction of pepsin with ionic liquids by using fluorescence spectroscopy.Applied spectroscopy 67:648-655.
[17]Ying M,Huang F,Ye H,Xu H,Shen L,Huan T,Huang S,Xie J,Tian S,Hu Z,He Z,Lu J,Zhou K(2015)Study on interaction between curcumin and pepsin by spectroscopic and docking methods.International journal of biological macromolecules 79:201-208.
[18]Fan Y,Zhang S,Wang Q,Li J,Fan H,Shan D(2013)Interaction of an amino-functionalized ionic liquid with enzymes:a fluorescence spectroscopy study,Spectrochimica acta.Part A.Molecular and biomolecular spectroscopy 105:297-303.
[19]Li XR,Yang ZJ(2015)Dissection of the binding od L-ascorbic acid to trypsin and pepsin using isothermal titration calorimetry,equilibrium microdialysis and spectro fl uorimetry.RSC Advance 5:35487-35496.
[20]Zeng HJ,Qi T,Yang R,You J,Qu LB(2014)Spectroscopy and molecular docking study on the interaction behavior between nobiletin and pepsin.Journal of fluorescence 24:1031-1040.
[21]Yan J,Wang Q,Pan Q,Rao Z,Su,Li H(2013)Assessment of the interaction between fraxinellone and bovine serum albumin by optical spectroscopy and molecular modeling methods.Journal of Luminescence 137:180-185.
[22]Roy D,Dutta S,Maity SS,Ghosh S,Roy KS,Ghosh,Dasgupta S(2012)Spectroscopic and docking studies of the binding of two stereoisomeric antioxidant catechins to serum albumins.Journal of Luminescence 132:1364-1375.
[23]Li X,Ni T(2015)Binding of glutathione and melatonin to pepsin occurs via different binding mechanisms.European Biophysics Journal 45:165-174.
[24]Wu G,Robertson DH,Brooks CL,Vieth M(2003)Detailed analysis of grid-based molecular docking:A case study of CDOCKER—A CHARMm-based MD docking algorithm.Journal of computational chemistry 24:1549-1562.
[25]Vieth M,Hirst JD,Dominy BN,Daigler H,Brooks CL(1998)Assessing search strategies for flexible docking,Journal of computational chemistry 19:1623-1631.
[26]Wang Y Q,Zhang H M(2015)Exploration of binding of CI Food Red 9 with pepsin by optical spectroscopic and molecular docking methods.Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy 149:822-829.
[27]Guo L,Ma X,Yan J,Xu K,Wang Q,Li H(2015)Interaction Behavior Between Niclosamide and Pepsin Determined by Spectroscopic and Docking Methods.Journal of fluorescence 25:1681-1693.
Preliminary investigation on interaction mechanism between nicotine and pepsin
HAN Jingmei1,LIAO Xiaoxiang1,LEI Ping1,YUAN Dalin1,ZHENG Xudong1,SHANG Shanzhai1,LI Zhiqiang1,TANG Jianguo1*,LI Hui2,CHEN Yongkuan1
1 Centre for R&D,China Tobacco Yunnan Industrial CO.,Ltd.,Kunming 650231,China;
2 School of Chemical Engineering,Sichuan University,Chengdu 610064,China
In order to investigate absorption characteristics of human stomach to nicotine(NIC)in tobacco products for oral use,certain concentration of citric acid and sodium citrate bu ff er solution(pH=2.0)were prepared for simulating gastric conditions and di ff erent levels of nicotine solutions were prepared by using bu ff er solution.After interaction of pepsin with di ff erent levels of nicotine,spectrum changes of the pepsin before and after addition of di ff erent levels of nicotine were observed by various spectroscopic methods i.e.fluorescence spectrum,ultraviolet spectrum,infrared spectrum,circular dichroism spectrum and molecular docking simulation technology.Action mechanism between nicotine and pepsin was studied.Research of spectroscopy and molecular docking simulation indicated that:1)the quenching mechanism of NIC on pepsin was static fluorescence; 2)NIC and pepsin interacted spontaneously via hydrogen bonding and van der Waals forces; 3)there existed a single high-affinity binding site between NIC and pepsin; 4)interaction between NIC and pepsin increased polarity of microenvironment of amino-acid residues in pepsin,and changed C=O,C-H and N-H of polypeptide chain of pepsin,resulting variation of conformation and spatial structure of pepsin.In the mean time,NIC promoted activity of pepsin when it was added into pepsin at di ff erent concentrations.Results of this research can provide references for development,quality control and health risk evaluation of tobacco products for oral use.
nicotine; pepsin; spectroscopy; molecular-docking; interaction mechanism

韩敬美,廖晓祥,雷萍,等.烟碱与胃蛋白酶相互作用机理初步研究[J].中国烟草学报,2017,23(5)
中国烟草总公司科技重大专项项目“基于外周加热方式的电加热新型烟草制品的研究与开发(11020151003(XX-03))”;云南省青年自然科学基金项目“电子烟中烟碱形态分析及迁移规律研究(2015FD097)”
韩敬美(1986—),硕士研究生,研究方向:烟草化学、新型烟草制品技术研究,Email:hanjingmei@126.com
汤建国(1976—),博士研究生,研究方向:烟草化学和新型烟草制品技术研究,Email:jgtang@163.com
2017-04-26;< class="emphasis_bold">网络出版日期:
日期:2017-09-29
:HAN Jingmei,LIAO Xiaoxiang,LEI Ping,et al.Preliminary investigation on interaction mechanism between nicotine and pepsin[J].Acta Tabacaria Sinica,2017,23(5)
*Corresponding author.Email:jgtang@163.com
