口含烟中羰基化合物检测
2017-11-16毕艳玖刘鸿戚大伟郑赛晶吴达顾文博
毕艳玖,刘鸿,戚大伟,郑赛晶,吴达,顾文博
上海烟草集团有限责任公司,技术研发中心,上海市长阳路717号 200082
烟草和烟气化学
口含烟中羰基化合物检测
毕艳玖,刘鸿,戚大伟,郑赛晶,吴达,顾文博
上海烟草集团有限责任公司,技术研发中心,上海市长阳路717号 200082
为测定口含烟中甲醛、乙醛和巴豆醛,采用O-(2,3,4,5,6-五氟苄基)羟胺(PFBHA)衍生化GC-MS的方法,将口含烟经水萃取,与PFBHA反应生成相应的O-(2,3,4,5,6-五氟苄氧基)肟衍生产物,正己烷萃取后利用GC-MS分析正己烷相测定相应物质含量。甲醛、乙醛以D4-乙醛为内标,巴豆醛以D5-丁酮为内标,甲醛、乙醛检出限为0.010μg/g,巴豆醛检出限为0.001μg/g,各组分回收率为91.7%~104.1%,日内相对标准偏差≤5.3%,日间相对标准偏差≤9.6%。通过该方法测试的35个不同规格国外品牌口含烟,甲醛含量0.275~2.397μg/g,乙醛含量0.383~8.010μg/g,巴豆醛含量0.003~0.027μg/g。该方法前处理简单,灵敏度高,干扰少,结果准确,易于推广应用。
羰基化合物;口含烟;O-(2,3,4,5,6-五氟苄基)羟胺;衍生化;GC-MS
口含烟是一类重要的无烟气烟草制品,市场上主流口含烟类型为瑞典式口含烟(snus)、美式口含烟(snuff)[1]。目前,世界卫生组织烟草控制框架公约对传统烟草制品的发展造成较大冲击[2],口含烟等新型烟草制品已经成为国际烟草行业一个重要发展方向[3-4]。美国食品与药品监督管理局(FDA)于2012年建立烟草和烟气中有害和潜在有害物质清单(FDA HPHCs),羰基化合物是其中一类重要有害物质,挥发性强,反应活性大,具有致癌、吸入危险、成瘾性。口含烟中羰基化合物主要来源于烟叶原料本身及调制加工过程中的化学变化。目前国内对卷烟烟气中羰基化合物研究较多,但未见口含烟中羰基化合物研究报道[5-6]。
传统卷烟烟气中羰基化合物普遍采用2,4-二硝基苯肼(DNPH)衍生化高效液相色谱-紫外检测器(HPLC-UV)方法测定[7-8]。羰基化合物与DNPH反应生成相应的2,4-二硝基苯腙,检测相应的苯腙可对羰基化合物进行定量。相较于传统卷烟烟气,口含烟中羰基化合物含量低,传统DNPH衍生化HPLCUV方法存在灵敏度低和基质干扰严重等缺点,无法满足检测需求。目前改进的DNPH衍生化HPLC-UV方法,要么因为前处理需采用固相萃取(SPE)净化富集,导致操作复杂;要么采用高效液相色谱-质谱(HPLC-MS)分析,导致对仪器设备和操作人员要求高[9-12];要么采用气相色谱-质谱(GC-MS)分析,则因DNPH衍生产物热不稳定而产生一定干扰[13]。
文献报道O-(2,3,4,5,6-五氟苄基)羟胺(PFBHA)衍生化GC-MS方法普遍应用于环境空气、水中羰基化合物测定[14-18]。羰基化合物与PFBHA反应生成相应的O-(2,3,4,5,6-五氟苄氧基)肟衍生产物,测定相应的肟衍生产物可对羰基化合物进行定量,反应如图1所示。PFBHA衍生产物比DNPH衍生产物更易溶于有机溶剂,便于有机相萃取分析;PFBHA衍生产物热稳定性好,适于GC-MS分析。针对口含烟中羰基化合物含量低、基质复杂的特点,GC-MS方法灵敏度高,选择性好,能够满足分析要求。
本文针对口含烟(snus和snuff)中重点关注的甲醛、乙醛、巴豆醛三类羰基化合物[19-20],建立PFBHA衍生化GC-MS方法。该方法前处理简单,灵敏度高,选择性好,采用GC-MS仪器分析,易于推广应用。

图1 羰基化合物与PFBHA反应方程式Fig.1 Reaction of carbonyls with PFBHA
1 材料与方法
1.1 材料、试剂和仪器
国外市售口含烟19个品牌,35个规格样品,种类包括Swedish Snus和American Snuff。
O-(2,3,4,5,6-五氟苄基)羟胺盐酸盐(纯度≥98%,TCI)、1mg/mL甲醛、乙醛、巴豆醛混标溶液(标准品,乙腈溶剂,AccuStandard),D4-乙醛(纯度99.8%,百灵威)、D5-丁酮(纯度99%,CDN)、正己烷(色谱纯,TEDIA)、葡萄糖、浓硫酸(分析纯,上海凌峰),水(超纯水仪一级水)。
安捷伦7890C,5975C气质联用仪、Milli-Q Advantage A10超纯水仪,美国安胜VM-2500涡旋混合仪、瑞江RJ-LDL-50G离心机、METTLER TOLEDO天平(感重0.0001g)。
1.2 方法
1.2.1 溶液配制
准确称取相应质量D4-乙醛、D5-丁酮,以水溶解稀释定容,得112μg/mL D4-乙醛、9.75μg/mL D5-丁酮混合内标溶液。
准确移取相应体积1mg/mL甲醛、乙醛、巴豆醛混标,用水稀释定容,分别得到0.002μg/mL、0.005μg/mL、0.010μg/mL、0.050μg/mL、0.100μg/mL、0.500μg/mL、1.000μg/mL、5.000μg/mL、10.000μg/mL混标溶液。
取相应质量PFBHA,以水溶解定容,得20mg/mL PFBHA衍生化试剂水溶液。
1.2.2 样品前处理与分析
称取1g口含烟,置于50mL样品管中,加入10mL一级水,100μLD4-乙醛、D5-丁酮混合内标溶液,甲醛、乙醛内标为D4-乙醛,巴豆醛内标为D5-丁酮[18],涡旋混合提取40min。提取的样品以3000rpm离心5min,取5mL上清液置于15mL样品管中,加入100μL 20mg/mLPFBHA衍生化试剂水溶液,混匀,静置反应2h。加入2mL正己烷,0.05mL浓硫酸,涡旋混合10min。萃取的样品以3000rpm离心5min,取1mL上清液,GC-MS分析。
色谱条件:色谱柱:DB-WAX(30m×0.25mm,0.25μm);载气:He;柱流量:1mL;进样口温度:250℃;进样量:1μL,不分流进样;程序升温:初始温度50℃,5℃/min升温至110℃,继续以35℃/min升温至220℃,维持5min。
质谱条件:离子源:EI;电离能:70eV;离子源温度:230℃;四级杆温度:150℃;溶剂延迟:3min;检测模式:选择离子检测(SIM),待测物、内标衍生产物定量、定性离子见表1。
1.2.3 标准曲线的建立
分别取1mL不同浓度混标溶液(0.002μg/mL、0.005μg/mL、0.010μg/mL、0.050μg/mL、0.100μg/mL、0.500μg/mL、1.000μg/mL、5.000μg/mL、10.000μg/mL),采用与口含烟同样的前处理方式,进样分析,得到标准曲线数据。
标准曲线与测试样品采用同样的前处理方式,测试数据更可靠,可避免前处理中衍生化效率不一致、操作环境的干扰等。
2 结果与讨论
2.1 色谱柱选择
分 别 考 察 DB-WAX、DB-5、DB-17、DB-35、DB-1701不同型号色谱柱,DB-5、DB-17、DB-35、DB-1701甲醛衍生产物均有干扰峰,影响甲醛定量,DB-WAX甲醛无干扰,故采用DB-WAX为分析柱。0.500μg/mL醛酮标样PFBHA衍生化提取离子气质色谱图如图2所示,口含烟衍生化提取离子色谱图如图3所示。D4-乙醛、乙醛、巴豆醛PFBHA肟衍生产物存在异构体,分析时将异构体合并积分,计算相应总量。
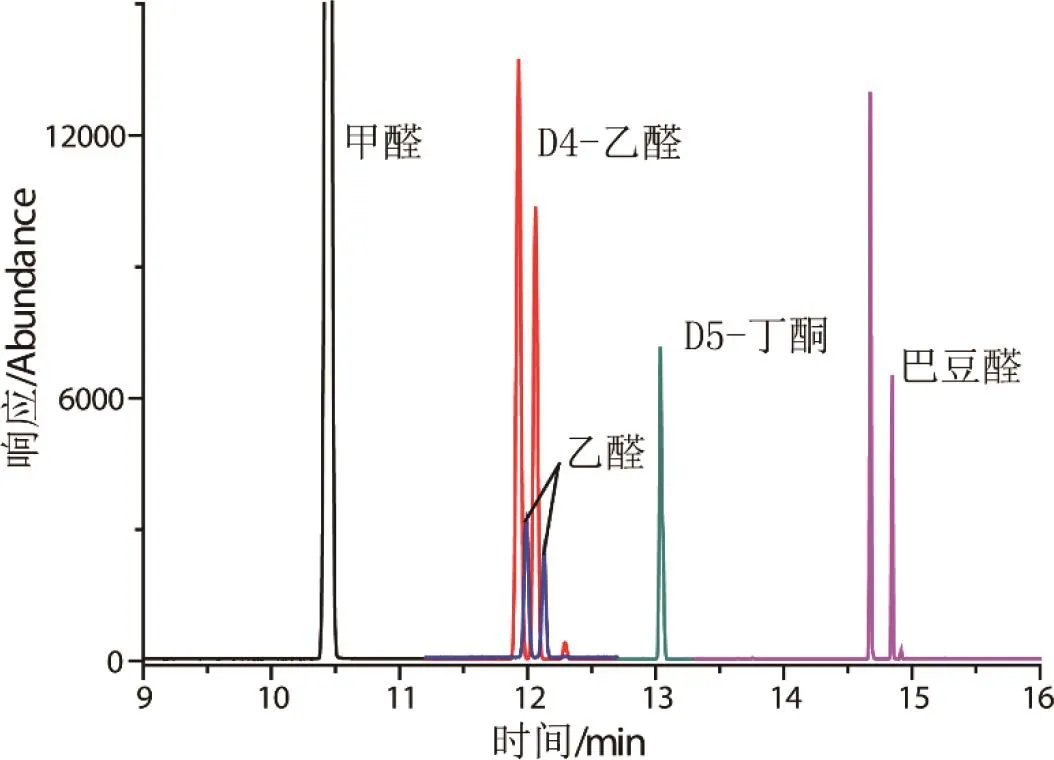
图2 标样PFBHA衍生化提取离子气质色谱图Fig.2 Selected ion chromatograms of carbonyls and internal standards
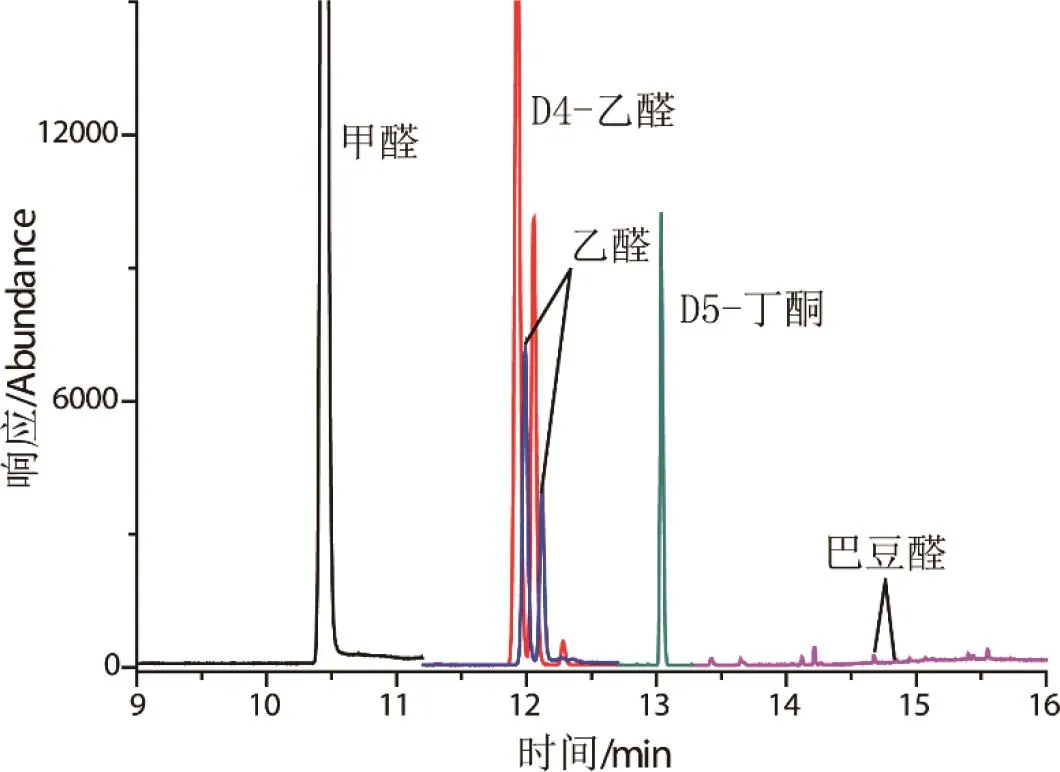
图3 口含烟PFBHA衍生化提取离子气质色谱图Fig.3 Selected ion chromatograms of snus&snuff sample
2.2 质谱条件确定
分别测定甲醛、乙醛、巴豆醛混标和D4-乙醛、D5-丁酮内标衍生产物,对照标准品衍生物质谱图和质谱数据库,选择离子丰度高且无干扰的离子做定量离子、定性离子,最终确定的特征离子如表1所示。
2.3 PFBHA衍生条件优化
2.3.1 反应温度和反应时间优化
取1mL 1.000μg/mL甲醛、乙醛、巴豆醛混标溶液,分别考察在室温和35℃条件下0.5h、1h、2h、3h、4h的反应情况,结果如图4所示。
文献报道[17-18]PFBHA衍生化反应温度条件为室温,实验结果表明,甲醛、巴豆醛35℃条件下响应略高于室温,乙醛不同温度下响应差别不大,不同温度下响应无明显差异,因此参照文献条件,确定室温为衍生化反应条件。不同反应时间对比,随着反应时间的增加,反应产物响应无明显增加,说明在实验条件下,PFBHA与甲醛、乙醛、巴豆醛反应速度较快。考虑到操作便利性和实验效率,最终选择室温下2h反应条件。

图4 反应温度和反应时间优化结果Fig.4 Optimization of reaction temperature and time
2.3.2 PFBHA浓度优化
口含烟中甲醛、乙醛、巴豆醛含量均在μg/g级别,参照文献[15,18]中PFBHA衍生化试剂用量,拟采用浓度为20mg/mL的PFBHA进行衍生化反应,衍生化试剂量为羰基化合物1000倍,为确保衍生化效率,同时考察更高浓度(40mg/mL)对衍生化反应的影响。
取1mL 1μg/mL混标溶液,分别加入20mg/mL、40mg/mLPFBHA衍生化试剂,考察不同浓度下的反应情况,结果如图5所示。20mg/mL、40mg/mL PFBHA衍生化试剂响应差别不大,因此参照文献条件,采用20mg/mL作为反应衍生化浓度。
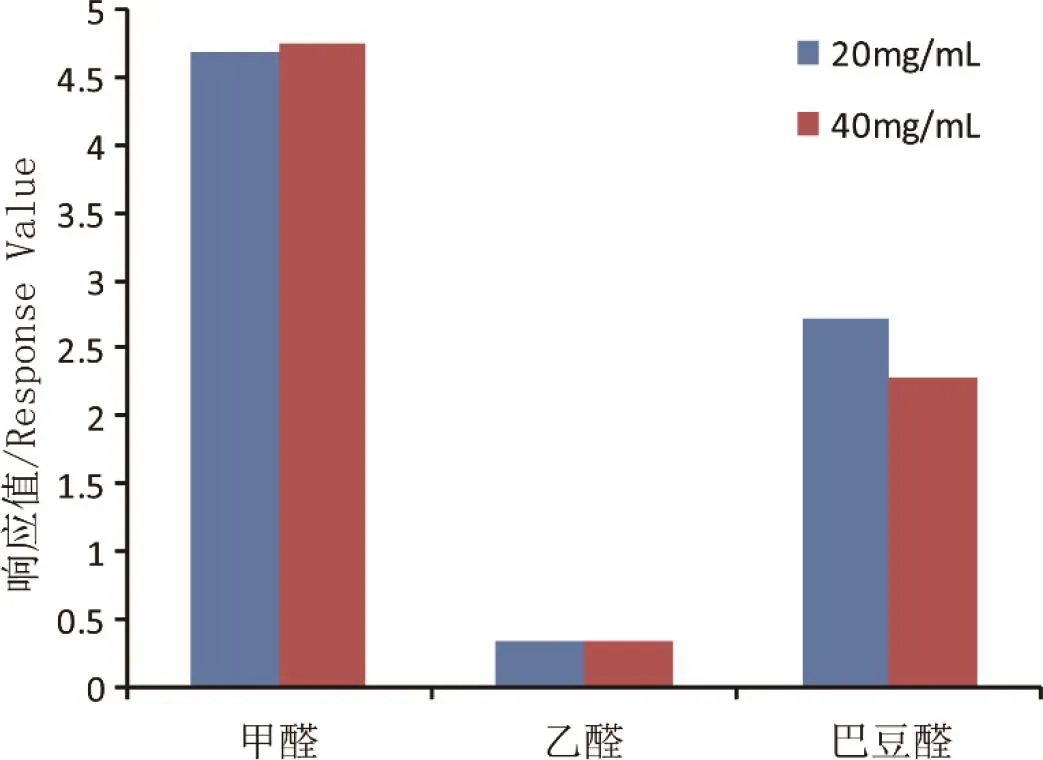
图5 PFBHA浓度优化结果Fig.5 Optimization of PFBHA concentration
口含烟中的糖所含羰基可能对目标化合物的衍生化反应产生竞争,因此有必要考察不同含糖量样品衍生化反应情况。结果如图6所示,20mg/mL PFBHA衍生化试剂能排除糖的干扰,满足衍生化反应要求。
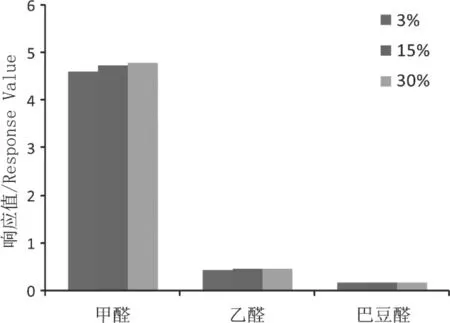
图6 不同含糖量样品影响考察Fig.6 In fluence of the carbohydrates in the samples
2.4 前处理条件优化
2.4.1 前处理方式选择
称取1g口含烟,分别考察超声、涡旋混合、振荡提取方式,结果如图7所示。甲醛、乙醛涡旋混合提取响应最高,巴豆醛响应超声>涡旋混合>振荡,综合考虑采用涡旋混合提取方式。

图7 前处理方式优化结果Fig.7 Optimization of different pretreatment
2.4.2 前处理时间优化
称取1g口含烟,涡旋混合分别提取10min、20min、30min、40min、50min、60min,考察不同时间提取效率,结果如图8所示。随着反应时间的增加,甲醛、乙醛响应逐渐增加;40min后甲醛响应略有降低,乙醛响应变化不大;不同反应时间下巴豆醛响应差别不大。40min条件下甲醛、巴豆醛响应最高,40min~60min乙醛响应稳定,选择40min作为提取时间。

图8 前处理时间优化结果Fig.8 Optimization of extraction time
2.4.3 提取溶剂体积优化
分别采用10mL、20mL、30mL水作为提取溶剂提取口含烟,考察不同体积提取效率,结果如图9所示。随着提取溶剂量的增加,甲醛测定结果逐渐下降,乙醛测定结果差异不大,巴豆醛20mL测定结果最高。考虑提取溶剂体积增加会降低待测物质绝对响应,不同条件测定结果无较大差异的情况下,采用10mL作为提取溶剂体积。
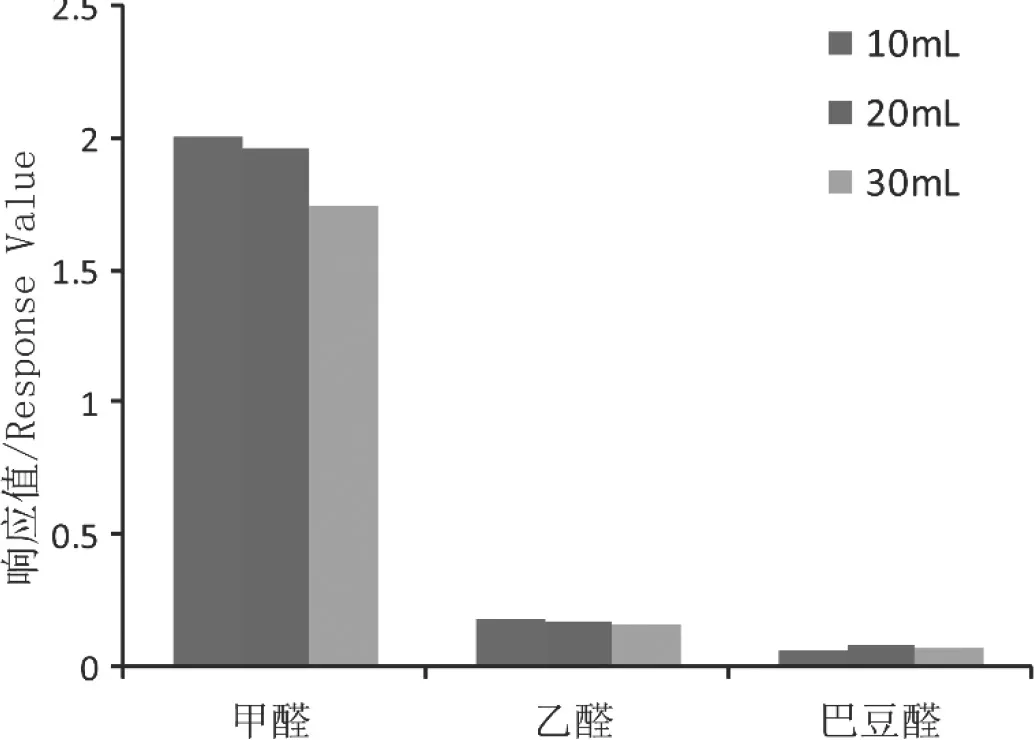
图9 提取溶剂体积优化结果Fig.9 Optimization of extraction solvent volume
2.5 方法验证
2.5.1 工作曲线、检出限、定量限
测定相应标准溶液,以标准溶液浓度(μg/mL)为横坐标x,待测物定量离子与内标物定量离子峰面积比值为纵坐标y,线性回归得标准曲线。以不低于3倍性噪比为检出限,以不低于10倍性噪比为定量限,结果如表2所示。

表2 3种羰基化合物标准曲线、检出限和定量限Tab.2 Linear equations,correlation coef fi cients,limits of detection(LOD)of 3 carbonyls
2.5.2 方法重复性
取口含烟,同一天测定6次,考察方法日内重复性;对同样的口含烟,连续测定3天,每天测定3次,考察方法日间重复性,结果如表3所示。
2.5.3 方法回收率
取已知含量口含烟,低、中、高3个浓度水平考察加标回收率,低浓度加标量为样品含量0.5倍,中浓度加标量为样品含量1倍,高浓度加标量为样品含量2倍,结果如表4。
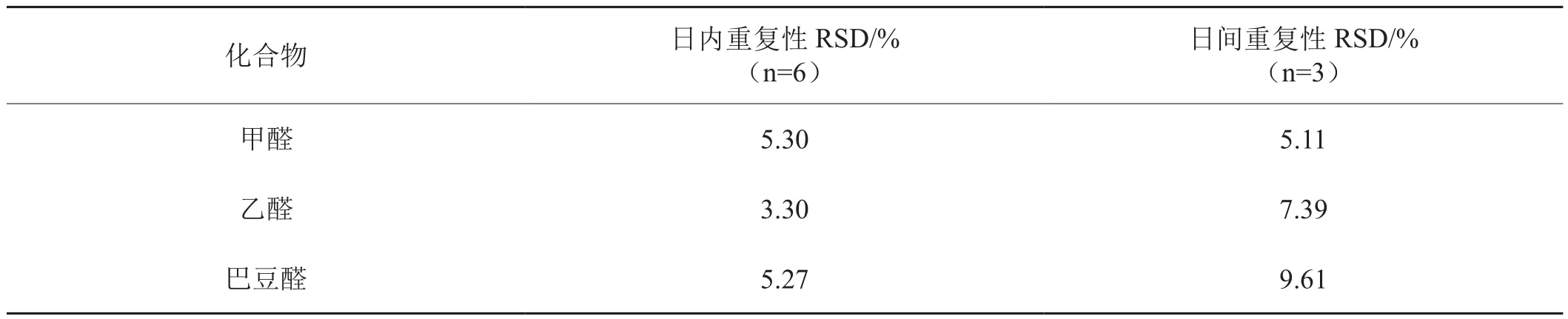
表3 3种羰基化合物日内重复性和日间重复性Tab.3 Intra-day relative standard deviation(RSD)and the inter-day relative standard deviation(RSD)of 3 carbonyls

表4 3种羰基化合物检测的方法回收率Tab.4 Recoveries of 3 carbonyls
2.6 环境背景中羰基化合物对分析结果影响分析
实验用水中最可能含有痕量甲醛、乙醛;将实验用水暴露于紫外灯下或在高锰酸钾条件下重蒸可有效去除水中的羰基化合物,采用一级水也可满足羰基化合物分析要求。实验室环境气体中可能含有甲醛或者其他少量的羰基化合物,实验过程要一次完成,中间不能停止,以免加重环境背景影响;实验中应避免使用乳胶手套(Latex),其可能释放乙醛,可使用氰基手套(Nitril);实验中应避免使用酚醛树脂,其可能释放甲醛,可使用聚丙烯材料[15]。采用如上措施可将环境气体和水的影响降到最小,空白对照样中甲醛、乙醛含量可以控制在0.1μg/g以下。
工作曲线与测试样品采用同样的前处理步骤,工作曲线测试结果已经包括环境空气和水中的痕量羰基化合物的影响,故样品测试结果无需再扣除空白。低、中、高3个浓度回收率结果良好,表明环境空气和水中的痕量羰基化合物对测试结果无明显影响。
2.7 口含烟分析
分析国外市售口含烟19个品牌,35个规格样品,测定结果如表5。甲醛含量0.275~2.397μg/g,平均含量 1.068μg/g;乙醛含量 0.383~8.010μg/g,平均含量3.224μg/g;巴豆醛含量 0.003~0.027μg/g,平均含量0.011μg/g。

表5 国外市售口含烟甲醛、乙醛、巴豆醛测定结果Tab.5 Concentration of the carbonyls in foreign snus&snuff
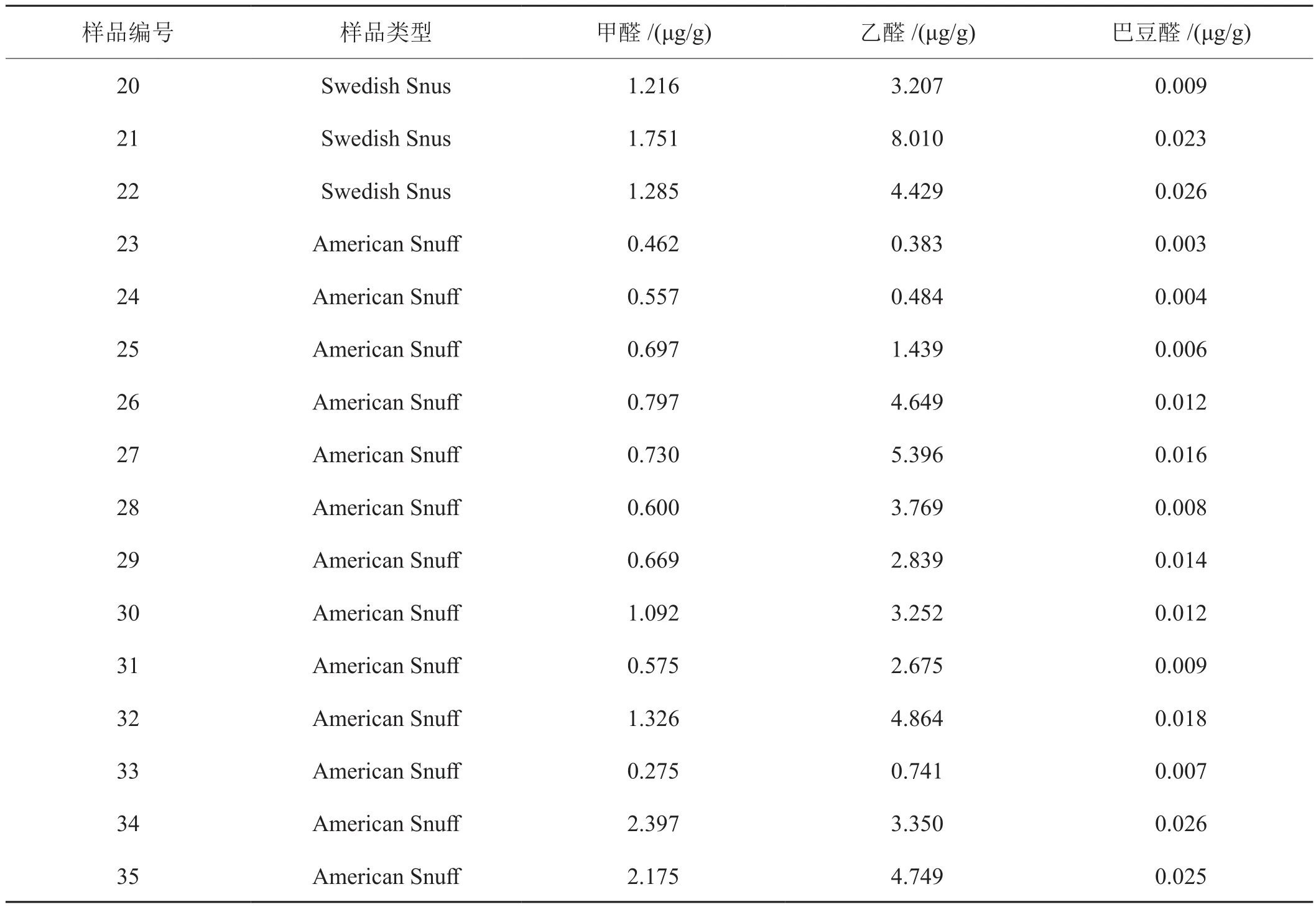
续表5
3 结论
以PFBHA为衍生化试剂,D4-乙醛为甲醛、乙醛内标,D5-丁酮为巴豆醛内标,建立口含烟中甲醛、乙醛、巴豆醛的GC-MS衍生化分析方法。该方法前处理简单,灵敏度高,干扰少,结果准确,易于推广应用。用该方法分析国外市售品牌口含烟中甲醛、乙醛、巴豆醛含量,结果表明甲醛含量0.275~2.397μg/g,乙醛含量 0.383~8.010μg/g,巴豆醛含量 0.003 ~0.027μg/g。
[1]窦玉青,沈轶,张继旭,等.口含烟发展现状及原料研究进展[J].贵州农业科学,2016,44(12):133-136.DOU Yuqing,SHEN Yi,ZHANG Jixu,et al.Research progress on development status and raw materials of oral tobacco[J].Guizhou Agricultural Sciences,2016,44(12):133-136.
[2]2010 global progress report on the implementation of the WHO Framework Convention on Tobacco Control,FCTC,1,2010.
[3]刘亚丽,洪群业,郑路,等.无烟气烟草制品技术发展现状及趋势研究[J].中国烟草学报,2014,21(3):134-136.LIU Yali,HONG Qunye,ZHENG Lu,et al.Technological development of smokeless tobacco products status quo and trend[J].ActaTabacariaSinica,2014,21(3):134-136.
[4]陈敏,王申,张浩博,等.无烟气烟草制品研究进展[C]//2012年度优秀学术论文集(工程技术类).上海:上海市烟草学会,2012:248-284.
[5]Food and Drug Administration.Harmful and potentially harmful constituents in tobacco products and tobacco smoke; Established List[J].Federal Register,2012/Notices,77(64):20034-20037.
[6]谢复炜,吴鸣,王昇,等.卷烟主流烟气中羰基化合物的改进分析方法[J].中国烟草学报,2006,12(5):15-24.XIE Fuwei,WU Ming,WANG Sheng,et al.An improved method for the determination of major carbonyls in mainstream cigarette smoke[J].ActaTabacariaSinica,2006,12(5):15-24.
[7]Szulejko J,Kim K.Derivatization techniques for determination of carbonyls in air[J].Trends in Analytical Chemistry,2015,64:29-31.
[8]姚伟,冯学伟.卷烟烟气中挥发性羰基化合物检测方法研究[J].华东理工大学学报(自然科学版),2005(1):14-23.YAO Wei,FENG Xuewei.Determination of volatile carbonyl compounds in cigarette mainstream smoke[J].Journal of East China University of Science and Technology(Natural Science Edition),2005(1):14-23.
[9]Carvalho A,Kato M,Rezende M,et al.Determination of carbonyl compounds in the atmosphere of charcoal plants by HPLC and UV detection[J].Journal of Separation Science,2008,31(10):1686-1693.
[10]US Environmental Protection Agency.EPA Method 554,Determination of carbonyl compounds in drinking water by dinitrophenylhydrazine derivatization and high performance liquid chromatography[S].USA:US EPA,1992.
[11]US Environmental Protection Agency.EPA Method 8315A,Determination of carbonyl compounds by high performance liquid chromatography(HPLC)[S].USA:US EPA,1996.
[12]CHI Yuguang,FENG Yanli,WEN Sheng,et al.Determination of carbonyl compounds in the atmosphere by DNPH derivatization and LC-ESI-MS/MS detection[J].Talanta,2007,72(2):539–545.
[13]DONG Jizhou,Moldoveanu S.Gas chromatography–mass spectrometry of carbonyl compounds in cigarette mainstream smoke after derivatization with 2,4-dinitrophenylhydrazine[J].Journal of Chromatography A,2004,1027(1-2):25-35.
[14]Cancilla D,Que S.O-(2,3,4,5,6-pentafluorophenyl)methylhydroxylamine hydrochloride:a versatile reagent for the determination of carbonyl-containing compounds[J].Journal of Chromatography A,1992,627(1-2):1-16.
[15]US Environmental Protection Agency.EPA Method 556,Determination of carbonyl compounds in drinking water by pentafluorobenzylhydroxylamine derivatization and capillary gas chromatography with electron capture detection[S].USA:US EPA,1998.
[16]Cancho B,Ventura F,Galceran M,et al.Determination of aldehydes in drinking water using penta fl uorobenzylhydroxylamine derivatization and solid-phase microextraction[J].Journal of Chromatography A.2001,943(1):1–13.
[17]Bao M,Pantani F,Griffini O,et al.Determination of carbonyl compounds in water by derivatization–solid-phase microextraction and gas chromatographic analysis[J].Journal of Chromatography A.1998,809(1-2):75–87.
[18]Bao M,Joza P,Master A,et al.Analysis of selected carbonyl compounds in tobacco samples by using pentafluorobenzylhydroxylamine derivatization and gas chromatography-mass spectrometry[J].Contributions to Tobacco Research.2014,26(3):86-97.
[19]Oldham M,DeSoi D,Rimmer L,et al.Insights from analysis for harmful and potentially harmful constituents(HPHCs)in tobacco products[J].Regulatory Toxicology and Pharmacolo gy,2014,70(1):138-148.
[20]Food and Drug Administration.FDA–2011–N–0271.FDA,2011d.Harmful and potentially harmful constituents in tobacco products and tobacco smoke; Request for comments.US:US FDA,2011.Fed.Regist.76,50226-50230.
Determination of carbonyl compounds in tobacco products for oral use
BI Yanjiu,LIU Hong,QI Dawei,ZHENG Saijing,WU Da,GU Wenbo*
Shanghai Tobacco Group CO.,LTD,Shanghai 200082,China
A derivatization gas chromatography-mass spectrometry(GC/MS)method with o-(2,3,4,5,6-penta fl uorobenzyl)-hydroxylamine hydrochloride(PFBHA)was developed for the determination of formaldehyde,acetaldehyde and crotonaldehyde in tobacco products for oral use.Sample was extracted with water and part of aqueous extract was derivatizated with PFBHA.The PFBHA derivatives of carbonyls were extracted with hexane and analyzed by gas chromatography-mass spectrometry.The limits of detection ranged from 0.001-0.010μg/g,with recoveries ranged from 91.7% to 104.1%.Results showed good inter-day repeatability(RSD≤9.6%)and intra-day repeatability(RSD≤ 5.3%).35 main brand products sold in European and American markets were analyzed,formaldehyde(0.275-2.397μg/g),acetaldehyde(0.383-8.010μg/g)and crotonaldehyde(0.003-0.027μg/g)were detected in all these tested products.This method was simple,accurate and suitable for the analysis of formaldehyde,acetaldehyde and crotonaldehyde in tobacco products for oral use.
Carbonyl compounds; tobacco products for oral use; O-(2,3,4,5,6-pentafluorobenzyl)-hydroxylamine hydrochloride;Derivatization; GC-MS

毕艳玖,刘鸿,戚大伟,等.口含烟中羰基化合物检测[J].中国烟草学报,2017,23(5)
毕艳玖(1987—),硕士,工程师,主要从事烟草化学成分研究,Tel:021-61668425,Email:biyanjiu@163.com
顾文博(1976—),Tel:021-61669461,Email:guwb@sh.tobacco.com.cn
2016-12-16;< class="emphasis_bold">网络出版日期:
日期:2017-07-18
:BI Yanjiu,LIU Hong,QI Dawei,et al.Determination of carbonyl compounds in tobacco products for oral use[J].Acta Tabacaria Sinica,2017,23(5)
*Corresponding author.Email:guwb@sh.tobacco.com.cn
