TGF-β1、BMP-7 及 Gremlin 在小鼠肝纤维化组织中的表达*
2017-11-16徐靖宇帅张丽谢远龙从风石国庆
徐靖宇 ,帅张丽 ,谢远 ,龙从风 ,石国庆
(1.遵义医学院附属医院 消化内科,贵州 遵义 563000;2.遵义医学院药学院,贵州 遵义 563003)
TGF-β1、BMP-7 及 Gremlin 在小鼠肝纤维化组织中的表达*
徐靖宇1,帅张丽1,谢远2,龙从风2,石国庆1
(1.遵义医学院附属医院 消化内科,贵州 遵义 563000;2.遵义医学院药学院,贵州 遵义 563003)
目的研究四氯化碳(CCl4)诱导小鼠肝纤维化组织中转化生长因子β1(TGF-β1)、骨形态发生蛋7(BMP-7)及Gremlin的表达,探讨其在肝纤维化发生机制中的作用。方法 雄性C57小鼠40只,分为实验组和对照组,每组20只。实验组给予腹腔注射40%CCl4橄榄油溶液,10 ml/kg;对照组腹腔注射橄榄油溶液,10 ml/kg,2次/周,持续8周。苏木精-伊红染色后观察肝纤维化程度,免疫组织化学法染色后分析TGF-β1、BMP-7及Gremlin在肝纤维中组织中的表达和分布,实时荧光定量聚合酶链反应和Western blot检测TGF-β1、BMP-7及Gremlin在正常和纤维化肝组织中mRNA和蛋白的表达。结果 TGF-β1和Gremlin在肝纤维化组织中mRNA和蛋白表达增强(P<0.05),而BMP-7在肝纤维化组织中表达降低(P<0.05)。结论 TGF-β1、Gremlin的表达与肝纤维化呈正相关,BMP-7与肝纤维呈负相关(P<0.05)。Gremlin可能通过下调BMP-7的表达,诱导肝纤维化的发生。
转化生长因子β1;骨形态发生蛋白7;Gremlin;肝纤维化
肝纤维化发生的关键是肝星状细胞(hepatie stellate cells,HSC)的激活,产生大量间质胶原,导致细胞外基质(extracelluar matrix,ECM)过度沉积[1]。目前认为,转化生长因子β1(transforming growth factor-β1,TGF-β1)是 HSC 激活最重要的细胞因子[2]。研究发现,骨形态发生蛋白7(Bone morphogenetic protein7,BMP-7)和BMP拮抗蛋白Gremlin参与肝纤维化的发生[3-4],但其作用机制仍不清楚。本文通过研究四氯化碳CCl4诱导小鼠肝纤维化组织中TGF-β1、BMP-7及Gremlin的表达,进一步探讨其在肝纤维化发生、发展中的作用及其相互关系。
1 材料与方法
1.1 实验动物
SPF级C57小鼠,体质量20~40 g,由重庆第三军医大学实验动物中心提供,实验动物生产许可证号:SCXK(渝)2012-2016。正常喂养,自由饮水,自然采光,室温15~25℃,实验前适应环境1周。
1.2 主要药品与试剂
CCl4(济南云翔化工有限公司),橄榄油(上海阿拉丁试剂公司),Gremlin多克隆抗体(美国Santa Cruz公司),BMP-7和TGF-β1多克隆抗体(美国Abcam公司),RIPA蛋白裂解液(北京索莱宝生物科技公司),BCA蛋白定量试剂盒(上海捷瑞生物工程公司),蛋白分子 Marker、Trans Zol Up、逆转录试剂盒及PCR扩增酶均购自北京全式金公司。
1.3 方法
1.3.1 动物模型复制 健康雄性C57小鼠40只,随机分为对照组和实验组,每组20只,实验组给予腹腔注射50%CCl4橄榄油溶液,10 ml/kg,2次/周,模型复制8周;对照组腹腔注射橄榄油溶液,10 ml/kg。8周后处死动物,剖腹取肝组织2块,用甲醛固定、石蜡包埋备用。其余肝组织于-80℃冰箱保存备用。
1.3.2 苏木精 -伊红染色法(hematoxylin-eosin staining,HE)染色 石蜡包埋的小鼠肝脏标本连续切片,厚4 μm,常规脱蜡至水;苏木精溶液染色数分钟,酸水和氨水中分色各数秒钟,流水冲洗1 h后入蒸馏水片刻,70%和90%酒精中脱水各10 min,伊红染色液染色2~3 min,纯酒精脱水,二甲苯透明,中性树胶封片,显微镜下观察。
1.3.3 免疫组织化学法染色 石蜡包埋的小鼠肝脏标本连续切片,厚4 μm,常规脱蜡至水;3%过氧化氢溶液室温培育10 min以封闭非特异性抗原,抗原修复;PBS液冲洗3次,3 min/次;滴加一抗,置37℃温箱孵育1 h;PBS液冲洗3次,3 min/次;滴加二抗,置37℃温箱孵育30 min;PBS液冲洗3次,3 min/次;滴加 DAB 显色剂(1∶50),1~2 min;自来水冲洗,苏木素复染;梯度酒精脱水,二甲苯透明,中性树胶封片,显微镜下观察。随机选择5个视野,使用Image J分析视野下的阳性部位面积,然后取平均值。
1.3.4 实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR) 采用qRT-PCR检测小鼠正常肝组织和肝纤维化组织中TGF-β1、BMP-7及Gremlin mRNA的表达。取小鼠肝组织剪碎、研磨、离心,按Trizol试剂盒说明书抽取总RNA。PCR反应体系为20μl,扩增条件:95℃预变性3 min,60℃变性30 s,共40个循环;65℃退火10 s,65℃延伸10 s,共61个循环,每次PCR反应均以无菌双蒸水代替cDNA模板作为阴性对照。扩增后的产物在4℃用于PCR琼脂凝胶电泳。所有引物由上海生工生物工程股份有限公司合成,引物序列见表1。

表1 qRT-PCR引物序列
1.3.5 Western blot检测 采用Western blot检测小鼠正常肝组织和肝纤维化组织中TGF-β1、BMP-7及Gremlin蛋白的表达,取小鼠肝组织剪碎,经匀浆、裂解、离心,提取蛋白质,然后经电泳、转膜、封闭,分别用 Gremlin(1∶100)、BMP-7(1∶200)、TGF-β1(1∶400)、β-actin(1∶5000)4℃孵育过夜,二抗(1∶5 000)室温 1 h,ECL 曝光显影,用 Quantity One软件对印迹条带进行灰度测定。以β-actin表达水平作为内参。
1.4 统计学方法
数据分析采用SPSS 19.0统计软件,计量资料以均数±标准差(±s)表示,用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 小鼠肝组织病理观察
HE染色证明CCl4诱导的肝纤维化模型复制成功。镜检观察显示,对照组小鼠肝脏无异常病理改变,肝细胞排列整齐,结构清晰,大小均匀,且细胞核位于细胞中央,细胞无坏死,水肿,无炎症细胞浸润(见图1A);实验组小鼠肝脏炎症明显,肝细胞广泛变性坏死,细胞肿胀,汇管区大量纤维组织增生,伴大量炎症细胞浸润(见图1B)。
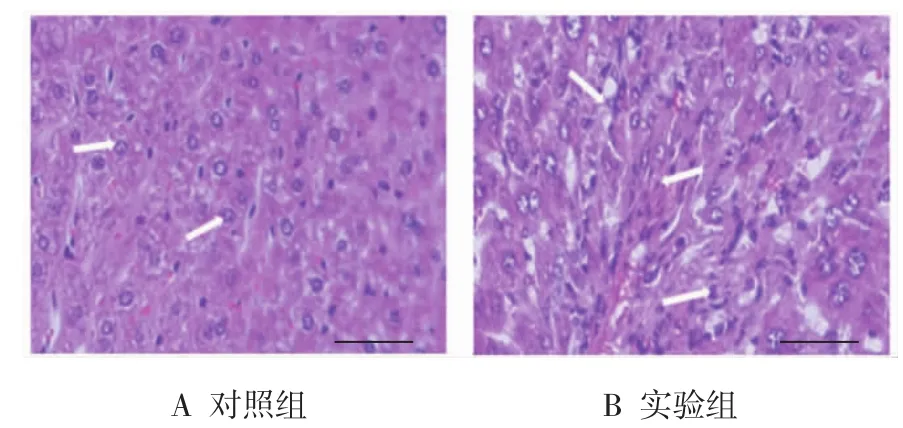
图1 两组小鼠肝脏组织病理形态改变(HE染色,标尺50μm)
2.2 两组小鼠肝组织中 TGF-β1、BMP-7及Gremlin蛋白表达
TGF-β1在对照组小鼠肝组织中呈弱表达,在实验组中表达增强(P<0.05);Gremlin在对照组小鼠肝组织中无表达,在实验组中表达增强(P<0.05),在细胞胞质和胞膜均有表达;而BMP-7在对照组小鼠肝组织中表达较强,在实验组中表达减弱(P<0.05)。见表2和图2。
表2 两组小鼠肝组织中TGF-β1、BMP-7及Gremlin蛋白表达的比较 (n=20,±s)
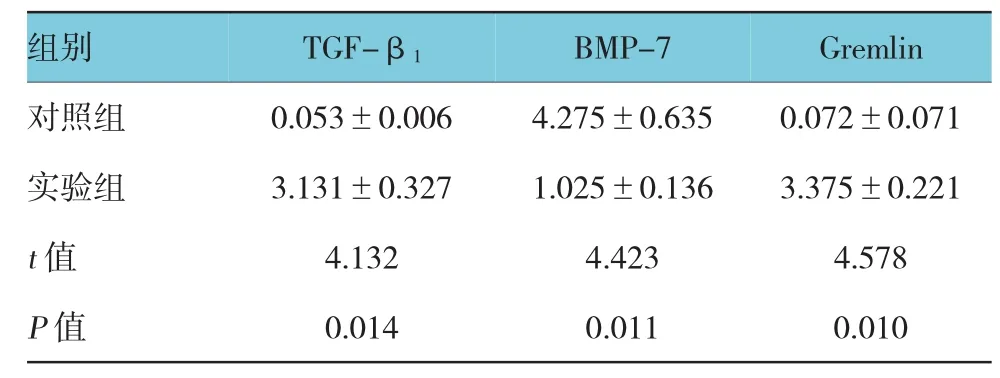
表2 两组小鼠肝组织中TGF-β1、BMP-7及Gremlin蛋白表达的比较 (n=20,±s)
组别 TGF-β1 BMP-7 Gremlin对照组 0.053±0.006 4.275±0.635 0.072±0.071实验组 3.131±0.327 1.025±0.136 3.375±0.221 t值 4.132 4.423 4.578 P值 0.014 0.011 0.010
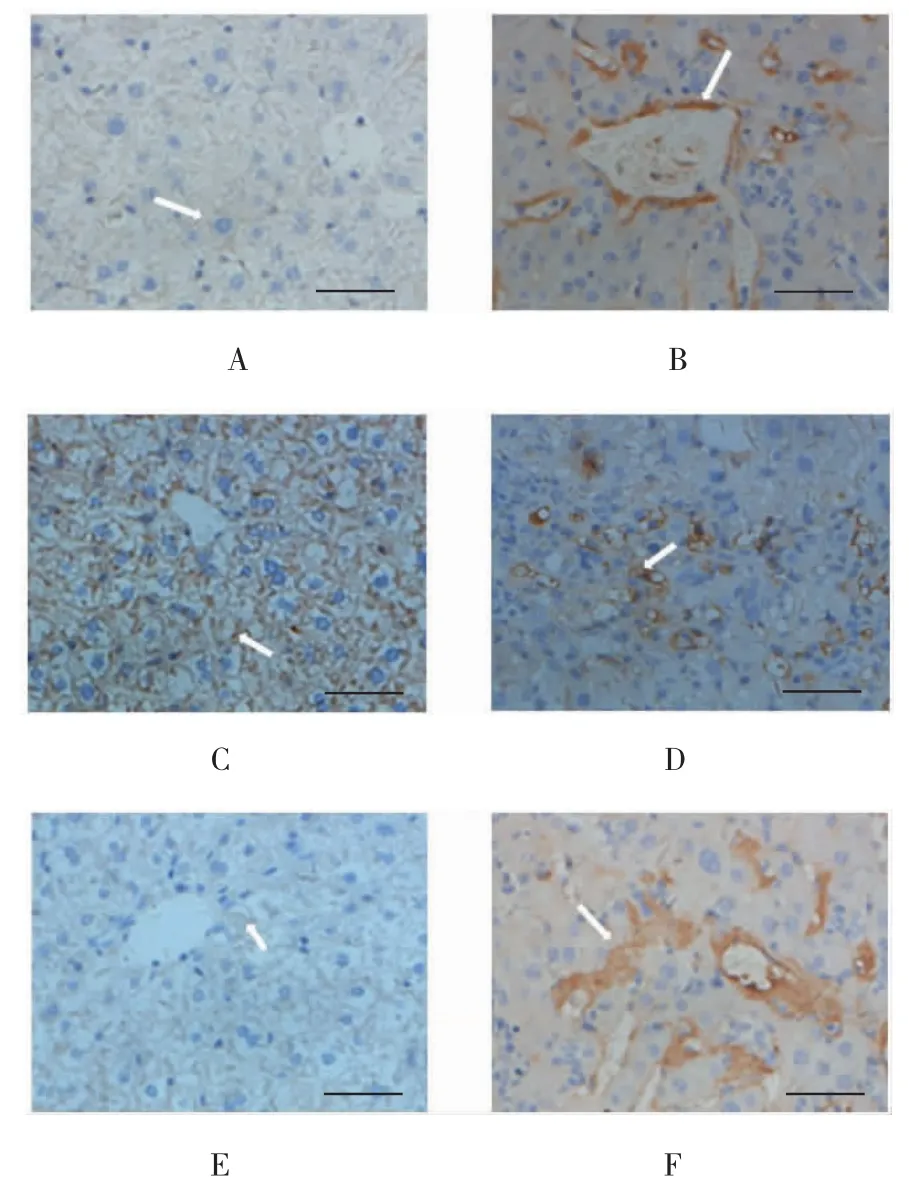
图2 两组小鼠肝组织中TGF-β1、BMP-7及Gremlin蛋白的表达 (免疫组织化学法染色,标尺50μm)
2.3 两组小鼠肝组织中 TGF-β1、BMP-7和Gremlin mRNA的表达
实验组小鼠肝组织中TGF-β1mRNA表达量为(1.733±0.120),对照组为(1.006±0.0433),两组小鼠肝组织中TGF-β1mRNA表达水平比较,经t检验,差异有统计学意义(t=5.500,P=0.005),实验组较对照组升高。实验组小鼠肝组织中Gremlin mRNA表达量为(1.950±0.180),对照组为(1.021±0.051),两组小鼠肝组织中Gremlin mRNA表达水平比较,经 t检验,差异有统计学意义(t=5.019,P=0.007),实验组较对照组升高。实验组小鼠肝组织中BMP-7 mRNA 表达量为(0.533±0.120),对照组为(1.055±0.063),两组小鼠肝组织中BMP-7 mRNA表达水平比较,经 t检验,差异有统计学意义(t=3.500,P=0.024),实验组低于对照组。见图3。
2.4 两组小鼠肝组织中 TGF-β1、BMP-7及Gremlin蛋白表达的Western blot结果
实验组小鼠肝组织中TGF-β1蛋白相对表达量为(1.610±0.201),对照组为(1.012±0.058),两组小鼠肝组织中TGF-β1蛋白表达水平比较,经t检验,差异有统计学意义(t=2.916,P=0.043),实验组较对照组升高。实验组小鼠肝组织中Gremlin蛋白相对表达量为(1.833±0.260),对照组为(1.008±0.058),两组小鼠肝组织中Gremlin蛋白表达水平比较,经t检验,差异有统计学意义(t=3.125,P=0.035),实验组较对照组升高。实验组小鼠肝组织中BMP-7蛋白相对表达量为(0.567±0.120),对照组为(1.021±0.050),两组小鼠肝组织中BMP-7蛋白A表达水平比较,经t检验,差异有统计学意义(t=3.250,P=0.031),实验组低于对照组。见图4。
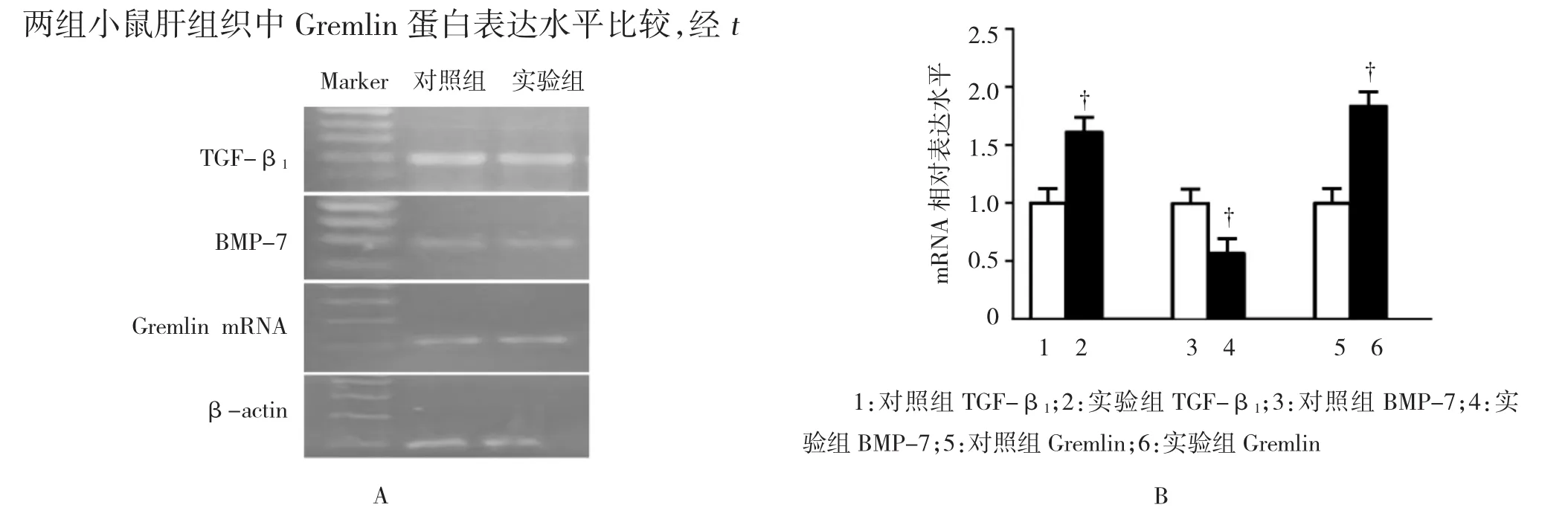
图3 两组小鼠肝组织中TGF-β1、BMP-7及Gremlin mRNA的表达

图4 两组小鼠肝组织中TGF-β1、BMP-7及Gremlin蛋白的表达 (Western blot)
3 讨论
肝纤维化是各种慢性肝病损伤的共同结果,也是各种慢性肝病向肝硬化发展的重要中间环节[5]。目前研究认为,肝纤维化形成的重要诱因是肝组织损伤后分泌大量的促肝纤维化细胞因子,该促肝纤维化因子表达增强,最终诱导肝纤维化发生,但其具体机制仍不清楚。
TGF-β1分泌增多是诱发肝纤维化的一个重要诱因,肝脏中的TGF-β1合成主要通过自分泌和旁分泌2种方式。文献报道,TGF-β1在肝纤维化时含量高,并促使成纤维细胞的活化、增生级表型转化[6]。本研究结果发现,CCl4诱导的小鼠肝纤维化模型中TGF-β1mRNA和蛋白表达均增高。在肝纤维化形成过程中大量TGF-β1在胞外被激活,并与活化的HSC等细胞胞膜上特异受体Ⅰ、Ⅱ结合,继而激活Smads,介导胞内信号转导,促使ECM等目的基因转录并高表达,导致纤维化形成[7]。同时本实验结果进一步发现,在CCl4诱导的小鼠肝纤维化组织中BMP-7的核酸及蛋白表达降低。BMP-7是一种分泌性多功能蛋白,是TGF-β超家族成员,在胚胎的发生、发育,组织及细胞的分化、增生等方面都发挥重要作用[8]。激活BMP-7能够阻断TGF-β1的信号通路,抑制纤维细胞上皮细胞间质化,逆转TGF-β1的促肝纤维细胞纤维化[9]。BMP-7对肝脏有一定保护作用,该保护不仅取决于自身,也与在肝纤维形成过程中BMP-7激动剂和拮抗剂的平衡有关,TGF-β1和BMP-7在肝纤维化的过程中相互拮抗。研究证实,TGF-β诱导上皮间质转化主要由于激活Smad-2/3发挥作用的过程中,BMP-7也通过激活Smad-1/5/8的磷酸化,抑制TGF-β/Smad信号通路的作用[10]。目前,BMP-7/Smads信号通路是公认的抑制肝纤维化形成过程中的重要信号通路,但是TGF-β1本身并非BMP-7受体的配体,不具备调节BMP-7表达及其相关的信号传导的作用。有文献指出,TGF-β1是通过调节其下游信号因子Gremlin,并拮抗BMP-7的表达及活性,促使肝纤维化的形成[11]。Gremlin是一种分泌型蛋白,Gremlin基因最早从爪蟾中枢神经脊中克隆出来,主要存在于细胞内质网和高尔基体管腔中,也存在于细胞表面,以非共价键形式与细胞膜相连[12]。在成骨细胞分化过程中,Gremlin作为BMP的拮抗剂在成骨细胞中表达,具有拮抗BMP对成骨细胞分化的功能[13]。免疫共沉淀发现Gremlin可以与BMP2、BMP4、BMP7 等直接相互作用[14]。本实验结果证实,在CCl4诱导的小鼠肝纤维化组织中Gremlin的核酸及蛋白表达升高,与TGF-β1表达呈正相关,该结果提示TGF-β1可以正向促进Gremlin的表达,拮抗BMP-7的抗纤维化作用。
综上所述,本研究通过CCl4诱导小鼠肝纤维化模型,同时检测TGF-β1、BMP-7及Gremlin在小鼠肝纤维化和正常小鼠肝组织中的表达。结果显示,TGF-β1和Gremlin在纤维化肝组织中的mRNA和蛋白表达均增强,而BMP-7在纤维化肝组织中的mRNA和蛋白表达均减弱。说明TGF-β1、BMP-7及Gremlin与肝纤维化的发生、发展密切相关,其机制可能是TGF-β1在肝纤维化组织中过表达,进而激活其下游的信号因子Gremlin,活化的Gremlin进一步拮抗BMP-7的生理功能,抑制BMP-7/Smad信号通路,从而诱导肝纤维化的发生。
[1]MOREIRA R K.Hepatic stellate cells and liver fibrosis[J].Arch Pathol Lab Med,2007,131(11):1728-1734.
[2]DOOLEY S,DIJKE P T.TGF-β in progression of liver disease[J].Cell Tissue Res,2012,347(1):245-256.
[3]YANG T,CHEN S L,LU X J,et al.Bone morphogenetic protein 7 suppresses the progression of hepatic fibrosis and regulates the expression of gremlin and transforming growth factor β1[J].Mol Med Rep,2012,6(1):246-252.
[4]GUIMEI M,BADDOUR N,ELKAFFASH D,et al.Gremlin in the pathogenesis of hepatocellular carcinoma complicating chronic hepatitis C:animmuno histochemical and PCR study of human liver biopsies[J].BMC Res Notes,2012,5:390.
[5]Ramón Bataller and David A.Brenner liver fibrosis[J].J Clin Invest,2005,115(2):209-218.
[6]CHEN Y L,LV J,YE X L,et al.Sorafenib inhibits transforming growth factor β1-mediated epithelial-mesenchymal transition and apoptosis in mouse hepatocytes[J].Hepatology,2011,53(5):1708-1718.
[7]XU F,LIU C,ZHOU D,et al.TGF-β/SMAD pathway and its regulation in hepatic fibrosis[J].J Histochem Cytochem,2016,64(3):157-167.
[8]WANG L P,DONG J Z,XIONG L J,et al.BMP-7 attenuates liver fibrosis via regulation of epidermal growth factor receptor[J].Int J Clin Exp Pathol,2014,7(7):3537-3547.
[9]ZHAO Y L,ZHU R T,SUN Y L.Epithelial-mesenchymal transition in liver fibrosis[J].Biomed Rep,2016,4(3):269-274.
[10]HASEBE T,TANAKA H,SAWADA K,et al.Bone morphogenetic protein-binding endothelial regulator of liver sinusoidal endothelial cells induces iron overload in a fatty liver mouse model[J].J Gastroenterol,2017,52:341-351.
[11]ZHAO X K,CHENG M L,WU R M,et al.Effect of Danshao Huaxian capsule on Gremlin and bone morphogenetic protein-7 expression in hepaticfibrosis in rats[J].World J Gastroenterol,2014,20(40):14875-14883.
[12]HSU D R,ECONOMIDES A N,WANG X,et al.The Xenopus dorsalizing factor Gremlin identifies a novel family of secreted proteins that antagonize BMP activities[J].Mol Cell,1998,1(5):673-683.
[13]GAZZERRO E,PEREIRA R C,JORGETTI V,et al.Skeletal overex-pression of gremlin impairs bone formation and causes os-teopenia[J].Endocrinology,2005,146:655-665.
[14]MERINO R,RODRIGUEZ-LEON J,MACIAS D,et al.The BMP antagonist Gremlin regulates outgrowth,chondrogenesis and programmed cell death in the developing limb[J].Development,1999,126(23):5515-5522.
Expressions of TGF-β1,BMP-7 and Gremlin in CCl4-induced liver fibrosis tissue of mice*
Jing-yu Xu1,Zhang-li Shuai1,Yuan Xie2,Cong-feng Long2,Guo-qing Shi1
(1.Department of Gastroenterology,the Affiliated Hospital of Zunyi Medical College,Zunyi,Guizhou 563000,China;2.Department of Physiology,Zunyi Medical College,Zunyi,Guizhou 563003,China)
Objective To study the expressions of transforming growth factor-beta 1 (TGF-β1),bone morphogenetic protein 7 (BMP-7)and Gremlin in the liver fibrosis induced by carbon tetrachloride (CCl4)in mice,and to investigate their roles in the pathogenesis of hepatic fibrosis.Methods Forty male C57 mice were randomly divided into control group and experimental group.In the experimental group,acute liver injury of mice was induced by intraperitoneal injection of 40%CCl4olive oil solution,10 ml/kg,while the control group was injected with olive oil,twice a week for 8 weeks.After 8 weeks the mice were sacrificed,and the liver tissue was fixed.Hematoxylin-eosin (HE)staining was used to observe the degree of liver fibrosis.The expressions and distribution of TGF-β1,BMP-7 and Gremlin in the control and experimental groups were detected through immunohistochemical staining.qR-PCR detecting system and Western blot were utilized for detection of mRNA and protein expressions of TGF-β1,BMP-7 and Gremlin in the normal and fibrotic liver tissues.Results In the experimental group,both mRNA and protein expressions of TGF-β1and Gremlin in the liver fibrosis tissue were significantly enhanced (P<0.05).However,the expression of BMP-7 in the liver fibrosis tissue was significantly decreased(P<0.05).The expression levels of TGF-β1and Gremlin were positively related to hepatic fibrosis,while BMP-7 was negatively correlated to hepatic fibrosis(P<0.05).Conclusions Gremlin may induce the occurrence of liver fibrosis by down-regulation of BMP-7 expression.
TGF-β1;BMP-7;Gremlin;hepatic fibrosis
R575.2
A
10.3969/j.issn.1005-8982.2017.26.003
1005-8982(2017)26-0013-05
2016-09-21
贵州省科学技术基金[No:黔科合J字(2012)2359号]
石国庆,E-mail:sgqing973@sina.com;Tel:13885286069
(童颖丹 编辑)
