大气颗粒物PM10对小鼠泪膜功能和角膜上皮组织结构的影响*
2017-11-16李娟谭钢吴安花杨启晨叶蕾王亚虹邵毅
李娟 ,谭钢 ,吴安花 ,杨启晨 ,叶蕾 ,王亚虹 ,邵毅
(1.陕西省西安市第四医院 眼科,陕西 西安 710004;2.南华大学第一附属医院 眼科,湖南 衡阳 421001;3.厦门大学眼科研究所,福建 厦门 361102;4.南昌大学第一附属医院 眼科,江西 南昌 330006;5.陕西省西安市环境监测站,陕西 西安 710054)
大气颗粒物PM10对小鼠泪膜功能和角膜上皮组织结构的影响*
李娟1,谭钢2,吴安花2,杨启晨3,叶蕾4,王亚虹5,邵毅4
(1.陕西省西安市第四医院 眼科,陕西 西安 710004;2.南华大学第一附属医院 眼科,湖南 衡阳 421001;3.厦门大学眼科研究所,福建 厦门 361102;4.南昌大学第一附属医院 眼科,江西 南昌 330006;5.陕西省西安市环境监测站,陕西 西安 710054)
目的 研究大气颗粒物PM10对小鼠泪膜功能和角膜上皮组织结构的影响。方法 24只雄性6~8周龄BALB/c小鼠,随机分为A、B组,每组12只。空白对照组6只不作处理。B组采用5 mg/ml PM10点眼,A组采用无菌PBS点眼,3次/d。分别在干预前及干预第1、4和7天进行实验小鼠泪膜功能相关检查,包括采用酚红棉线法检查泪液分泌量、泪膜破裂时间(BUT)、荧光素染色及荧光素染色评分(FL)。根据分组于相应时间点收集其角膜组织,行苏木精-伊红染色及透射电子显微镜下观察角膜上皮组织结构变化。结果 干预4和7 d后,A组泪液分泌量、BUT、FL较干预前无明显变化(P>0.05),而B组泪液分泌量减少、BUT、FL较干预前恶化(P<0.05)。点眼7 d后,A组上皮细胞为(5±1)层,B组为(7±1)层,差异有统计学意义(P<0.05)。电镜观察可见A组角膜上皮微绒毛呈指状突起,微绒毛数量多,排列整齐;而B组角膜上皮微绒毛减少、变短、排列紊乱。结论 PM10会影响小鼠泪膜功能,小鼠泪液量分泌减少,泪膜稳定性下降;小鼠角膜上皮组织结构损坏。
PM10;泪膜功能;角膜上皮
空气污染已成为世界许多地区一个重要的公共卫生问题。越来越多的流行病学和临床证据表明,污染物使人群各种疾病的患病率增加[1]。大气颗粒物(particular matter,PM)是不同大小和化学特征的液体和固体材料的混合物,包括释放到空气中的灰尘、污垢、烟尘、吸烟及液滴等。颗粒物依据其动力学直径,将空气动力学直径≤10μm的固体颗粒物称为PM10,主要由含碳物质、有机质、元素碳的总和、有机物组成[2]。PM10主要来源于人为燃烧、排放等过程。因为PM10是目前雾霾的主要成分,可能对人体健康产生负面影响,因此对PM10的监测和研究很重要。眼球作为机体的一个重要器官,眼表直接暴露于外界。本研究旨在探究PM10滴眼液对正常小鼠泪膜功能和角膜上皮组织结构的影响,为临床防治提供一定的理论基础。
1 材料与方法
1.1 材料
1.1.1 实验动物 选取30只BALB/c雄性小鼠(18~22 g,西安交通大学医学院实验动物中心),为无特定病原体级实验动物(SPF级动物)。使用裂隙灯显微镜及眼底镜检查眼前节、眼底无异常。30只小鼠置于标准环境:室温(25±1)℃,湿度(60±10)%,12 h 昼 /夜循环照明(8∶00~20∶00)[3]。所有小鼠都给予相同的水量和食物。本研究所涉及的研究方法均遵循《赫尔辛基宣言》,动物实验符合视觉与眼科协会规定的对动物眼科和视觉研究的使用,同时获得西安交通大学医学院动物伦理委员会批准[4]。
1.1.2 主要试剂及仪器 TH-16A 4通道大气颗粒物智能采样仪(武汉天虹仪表有限责任公司),聚四氟乙烯滤膜(美国Whatman公司),酚红棉线(天津晶明医用器材公司),荧光素钠(广州白云山明兴制药有限公司)。H-7650透射电子显微镜(德国HITACHI公司),裂隙灯显微镜(苏州66视觉科技股份有限公司),游标卡尺(上海仪器一厂)。
1.2 方法
1.2.1 PM10混悬液的制备 ①PM10的采集:PM10由西安环境监测站提供(2015年10月1日-2015年10月31日,于西安市某超级站采用智能采样仪,切割粒径为10μm,采用聚四氟乙烯滤膜进行采样。采样时间为当天10∶30至次日8∶30,22 h/d连续采样)。将载有PM10的聚四氟乙烯滤膜裁剪为1.0 cm×1.0 cm,浸入蒸馏水中,超声振荡45 min/次,共3次,用6层纱布滤过,真空下冷冻干燥、称重,4℃冰箱保存备用;②PM10混悬液的制备:使用前,PM10稀释于无菌的PBS中,浓度为5 mg/ml,用超声漩涡处理。加入保存剂苯扎溴铵,其浓度控制在0.005%,4℃冰箱保存备用。
1.2.2 实验分组 24只雄性6~8周龄BALB/c小鼠,随机分为A、B两组,每组12只,均为右眼。A组采用PBS点眼,B组采用5 mg/ml PM10混悬液点眼,3次/d,空白对照组6只不点眼,作为正常对照组。分别在干预前及干预后1、4和7 d各时间检测并观察实验小鼠的泪液分泌量、泪膜破裂时间(break-up time,BUT)、荧光素染色(fluorescein stain test,FL)及其评分。干预7 d后,行角膜苏木精-伊红染色(hematoxylin-eosin staining,HE)观察小鼠角膜上皮情况,以及透射电子显微镜下观察小鼠角膜上皮组织超微结构变化下的角膜上皮情况。
1.2.3 酚红棉线试验 取酚红棉线,一端置于小鼠右眼外眦中外1/3处,计时60 s。用游标卡尺测量酚红棉线红色部分的长度,计算泪液分泌量。进行每次检查时应注意控制变量,应由同一人在相同的时间、地点,相同的照明亮度、湿度及温度下操作[5]。
1.2.4 BUT检测 参照文献[3],使用1滴1%荧光素钠滴眼,使其瞬目,在裂隙灯显微镜钴蓝光下观察记录角膜染色区出现第1个破裂点的时间[6]。每次检查时应注意控制变量,由同一人在相同的时间、地点,相同的照明亮度、湿度及温度下操作。
1.2.5 FL及评分 使用1滴1%荧光素钠滴眼,使其瞬目,参考国家眼科研究临床干眼评分系统[7],分为0~3级:<30个轻微点状染色斑点为0级;<30个非分散点状染色斑点为1级;严重弥漫性染色,而无阳性斑块为2级;荧光素斑块为3级。
1.2.6 透射电子显微镜 参照文献[8],角膜标本经2.5%戊二醛前固定2 h,1%锇酸后固定1 h,乙醇梯度脱水、包埋。经枸橼酸铅和醋酸双氧铀双重染色后于透射电子显微镜下观察并拍照。
1.3 统计学方法
数据分析采用SPSS 17.0统计软件,计量资料以均数±标准差(±s)表示,多组比较用方差分析或重复测量设计的方差分析,两两比较用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组干预前后各项干眼检测指标比较
2.1.1 泪液分泌量 两组干预前、干预后1、4和7 d泪液分泌量比较,采用重复测量设计的方差分析,结果:①不同时间泪液分泌量有差异(F=12.658,P=0.004);②两组泪液分泌量有差异(F=23.852,P=0.001),B组较A组泪液分泌量低,泪液分泌破坏明显;③A组与B组的泪液分泌量变化趋势有差异(F=10.452,P=0.002)。两组干预前泪液分泌量比较,经LSD-t检验,差异无统计学意义(P>0.05)。干预后1d,两组泪液分泌量比较,经LSD-t检验,差异无统计学意义(P>0.05);干预后4和7 d,A组泪液分泌量较干预前无变化(t=0.432和 0.547,P=0.486和 0.336),而B组泪液分泌量较干预前恶化(t=3.781和6.453,P=0.001和0.000);干预后4和7 d,两组泪液分泌量比较,经LSD-t检验,差异有统计学意义(t=2.064和 4.596,P=0.002 和 0.000)。见表 1。
表1 两组干预前后不同时间泪液分泌量比较(n=12,mm/min,±s)

表1 两组干预前后不同时间泪液分泌量比较(n=12,mm/min,±s)
注:†与A组、干预前比较,P<0.05
组别 干预前 干预后1 d 4 d 7 d A 组 6.01±0.96 5.95±1.01 6.01±0.98 6.02±0.91 B 组 5.92±1.02 5.89±1.12 4.61±1.23† 2.89±1.42†
2.1.2 BUT 两组干预前、干预后1、4和7 d BUT比较,采用重复测量设计的方差分析,结果:①不同时间BUT有差异(F=11.612,P=0.002);②两组的 BUT有差异(F=31.521,P=0.000),B组较A 组BUT低,泪膜破坏明显;③两组的BUT变化趋势有差异(F=9.214,P=0.003)。两组干预前BUT比较,经LSD-t检验,差异无统计学意义(P>0.05)。干预后1 d,两组BUT比较,经LSD-t检验,差异无统计学意义(P>0.05);干预后4和7 d,A组BUT较干预前无变化(t=0.432和0.527,P=0.227和0.261),而B组BUT较干预前恶化(t=5.232和 6.715,P=0.009和 0.000);干预后 4和7 d,两组BUT比较,经LSD-t检验,差异有统计学意义(t=4.498和 6.196,P=0.002和 0.001)。见表2。
表2 两组干预前后不同时间BUT比较 (n=12,s,±s)

表2 两组干预前后不同时间BUT比较 (n=12,s,±s)
注:†与A组、干预前比较,P<0.05
组别 干预前 干预后1 d 4 d 7 d A 组 6.24±0.76 6.74±1.89 6.55±1.16 6.53±1.23 B 组 6.53±0.88 6.62±2.04 5.23±1.73† 3.47±1.19†
2.1.3 FL评分 A组与B组干预前及干预后1、4和7 d FL评分比较,采用重复测量设计的方差分析,结果:①不同时间FL评分有差异(F=7.319,P=0.006);②两组的 FL评分有差异(F=19.218,P=0.001),B 组较A组FL评分高,角膜上皮破坏明显;③两组的FL评分变化趋势有差异(F=8.251,P=0.004)。A组干预前与干预后1、4和7 d FL评分比较,经LSD-t检验,差异无统计学意义(P>0.05);B组干预前与干预后1 d FL评分比较,经LSD-t检验,差异无统计学意义(P>0.05)。干预7 d后,A组FL评分较干预前无变化(t=0.772,P=0.702),而 B 组 FL评分较干预前恶化(t=6.432,P=0.002);两组 FL 评分比较,经LSD-t检验,差异有统计学意义(t=6.121,P=0.007)。见表3。
表3 两组干预前后不同时间FL评分比较(n=12,分,±s)

表3 两组干预前后不同时间FL评分比较(n=12,分,±s)
注:1)与 A 组比较,P <0.05;2)与干预前比较,P<0.05
组别 干预前 干预后1 d 4 d 7 d A 组 0.00±0.00 0.48±0.31 0.45±0.41 0.62±0.37 B 组 0.00±0.00 0.51±0.471) 0.77±0.631)2) 5.73±2.011)2)
2.2 两组小鼠角膜HE染色情况
HE染色显示,正常小鼠角膜上皮由整齐排列的4~6层上皮细胞组成,基底细胞为一单层柱状上皮细胞层,排列紧密整齐(见图1A)。PBS滴眼液点眼7 d后角膜上皮层数未见增加,基底细胞仍为一单层柱状上皮细胞层,角膜上皮厚度基本未改变,表层上皮较为完整(见图1B),而经过PM10混悬液点眼7 d后角膜上皮细胞层数开始增多,上皮厚度增加,翼状细胞及基底细胞排列紊乱,同时伴有表层上皮细胞损伤、脱落,角膜表面欠光滑(见图1C)。正常对照组上皮细胞为(5±1)层,治疗 7 d后,A 组为(5±1)层,B组为(7±1)层,经方差分析,差异有统计学意义(F=31.809,P=0.007),A、B 两组比较差异有统计学意义(t=7.541,P=0.007)(见图 2)。

图1 3组小鼠用不同滴眼液处理7 d后角膜染色情况 (HE染色×400)
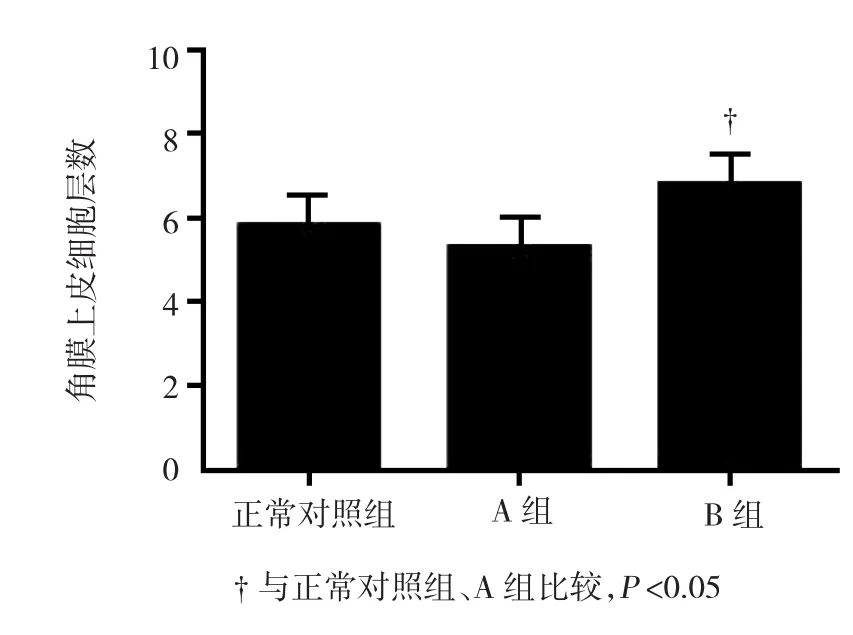
图2 3组小鼠用不同滴眼液处理7 d后角膜上皮细胞层数比较
2.3 两组小鼠角膜上皮细胞超微结构的变化
正常角膜上皮细胞会向外伸出许多微绒毛和微皱襞,排列整齐。A组用PBS点眼7 d后,透射电镜下可见表层上皮细胞有丰富的微绒毛,呈指状突起,排列规则(见图3A)。B组使用PM10点眼7 d后,小鼠角膜上皮微绒毛明显减少,微绒毛形态也与A组有很大差别,偶见指状突起,大部分微绒毛变短,且排列不规则(见图3B)。

图3 两组小鼠用不同滴眼液处理7 d后角膜上皮细胞微绒毛形态 (醋酸双氧铀和枸橼酸铅染色×30 000)
3 讨论
PM10是我国主要空气污染物之一[5],其对人类健康的影响一直是讨论的热点[9]。PM10不仅直径小,可以通过呼吸道进入体内[10],而且吸附的有毒物质,如多环芳烃类(包括萘、蒽、菲、芘等)[11]、元素碳等[12],也会对人体健康造成损害。有研究报道,PM10可以引起呼吸系统和循环系统的症状,如慢性阻塞性肺气肿、呼吸衰竭、动脉粥样硬化、心率不齐、心肌梗死等[13-14]。PM10对眼的影响也引起人们越来越多的关注。CHANG等[15]通过对2007年~2009年非特异性结膜炎门诊患者进行统计分析后认为,空气中PM10的浓度升高,会增加患者就诊的概率,可能会造成非特异性结膜炎。WIWATANADATE等[16]发现PM10与视力模糊呈正相关。
眼部微环境稳态维持着眼的正常生理功能。作为与外界直接接触的泪膜,对维持视力及眼睛的健康至关重要。泪膜分为3层:黏蛋白层、水液层、脂质层。黏蛋白层约为2.5~5.0 μm,附着于角膜表面;水液层约为4μm,含有水溶性离子、蛋白质等;最外层的脂质层,其厚度受到外界环境的影响,约为0.015~0.160μm[17]。TORRICELLI等[18]认为,空气污染对眼表的影响是因为造成泪液高渗透压和泪膜的不稳定。泪液高渗透压会使泪液中炎症因子的释放增多,从而进一步影响上皮细胞,对上皮细胞造成损伤,导致上皮细胞凋亡、杯状细胞丢失,以及黏蛋白表达失调。而这些变化又进一步导致泪膜不稳定,继续加重泪液的高渗透压,形成一个恶性循环。有研究表明,当人暴露于污染的环境中时,不仅泪膜的稳定性会降低,而且光滑的折光系统也被破坏,导致视力降低[19]。泪膜不稳定引起的各种眼部不适的总称,被认为是干眼综合症(dry eye syndrome,DES)[20]。常见的干眼症状包括:眼部不适、疼痛感、异物感、视疲劳、眼睛发红肿胀、眼睛发痒、眼皮抽搐等[21-22]。DES还可能导致角膜严重侵蚀和继发感染,甚至视力丧失[23]。
本实验中采用PM10混悬液点眼,模拟空气中PM10对泪液和角膜上皮的作用,得出一部分实验数据。本研究结果发现,用PM10混悬液干预4和7 d后,SIT、BUT、FL较干预前恶化,整个角膜荧光素染色增加,角膜上皮细胞层增厚,角膜表面微绒毛变短,以及数量减少,进一步说明PM10会损伤小鼠角膜上皮。而使用PBS滴眼4和7 d后,泪液分泌量、BUT较干预前无明显变化,两组结果对比后说明滴用PM10可能破坏泪膜的稳定性,从而使有害化学物质和病原体侵袭,进一步损伤角膜上皮细胞,导致干眼的形成。目前,治疗干眼病一方面是通过增加泪膜的湿润度,来弥补丢失的眼泪成分,以及降低泪膜的渗透压和蒸发,从而减少干眼的相关症状[24]。另一方面,对于DES的某些患者,虽然眼表面微环境被破坏,但是可通过增加上皮细胞来提高眼部自身防御力,维持一个相对良好的状态来防止感染。
综上所述,PM10会损伤小鼠泪膜功能,影响小鼠角膜上皮组织结构。今后笔者将进一步研究PM10损伤眼表是否与结膜杯状细胞的黏蛋白分泌、眼睑腺体(包括睑板腺和泪腺)形态变化而导致的泪膜黏蛋白层和脂质层成分改变等有关。同时笔者还将积极寻找有效地防护和治疗方法,以减少PM10对眼部的损害,促进人们的眼部健康。
[1]FENG C,LI J,SUN W,et al.Impact of ambient fine particulate matter (PM2.5)exposure on the risk of influenza-like-illness:a time-series analysis in Beijing,China[J].Environmental Health:a Global Access Science Source,2016,15(1):1-12.
[2]ROGULA-KOZLOWSKA W,KLEJNOWSKI K,ROGULA-KOPIEC P,et al.Spatial and seasonal variability of the mass concentration and chemical composition of PM2.5in Poland[J].Air Quality,Atmosphere,Health,2014,7(1):41-58.
[3]LIN Z,LIU X,ZHOU T,et al.A mouse dry eye model induced by topical administration of benzalkonium chloride[J].Molecular Vision,2011,17(17):257-264.
[4]YU Y,ZOU J,HAN Y,et al.Effects of intravitreal injection of netrin-1 in retinalneovascularization ofstreptozotocin-induced diabetic rats[J].Drug Design Development and Therapy,2015,9(63):6363-6377.
[5]环境保护部机动车排污监控中心.环境保护部发布《2013年中国机动车污染防治年报》[J].环境与可持续发展,2014,39(1):9-10.
[6]邵毅,余静,余瑶,等.无缝线骨髓间充质干细胞羊膜移植预防角膜缘干细胞缺乏的实验研究[J].眼科新进展,2013,33(11):1011-1015.
[7]LEMP M A.Report of the national eye institute/industry workshop on clinical trials in dry eyes[J].Eye Contact Lens,1995,21(4):221-232.
[8]LIN Z,HE H,ZHOU T,et al.A mouse model of limbal stem cell deficiency induced by topical medication with the preservative benzalkonium chloride[J].Investigative Ophthalmology Visual Science,2013,54(9):6314-6325.
[9]SHAH A S,LANGRISH J P,NAIR H,et al.Global association of air pollution and heart failure:a systematic review and metaanalysis[J].Lancet,2013,382(9897):1039-1048.
[10]BROWN J S,GORDON T,PRICE O,et al.Thoracic and respirable particle definitions for human health risk assessment[J].Particle and fibre Toxicology,2013,10(1):12.
[11]TUTINO M,DI GILIO A,LARICCHIUTA A,et al.An improved method to determine PM-bound nitro-PAHs in ambient air[J].Chemosphere,2016,161:463-469.
[12]SONG X,YANG S,SHAO L,et al.PM10mass concentration,chemical composition,and sources in the typical coal-dominated industrial city of Pingdingshan,China[J].The Science of the Total Environment,2016,571(1):1155-1163.
[13]张亮,王子军.大气污染中可吸入颗粒对人类健康的影响[J].中国公共卫生管理,2016,(1):47-49.
[14]BLOEMSMA L D,HOEK G,SMIT L A.Panel studies of air pollution in patients with COPD:systematic review and metaanalysis[J].Environ Res,2016,151:458-468.
[15]CHANG C J,YANG H H,CHANG C A,et al.Relationship between air pollution and outpatient visits for nonspecific conjunctivitis[J].IOVS,2012,53(1):429-433.
[16]WIWATANADATE P.Acute air pollution-related symptoms among residents in Chiang Mai,Thailand[J].Journal of Environmental Health,2014,76(6):76-84.
[17]CWIKLIK L.Tear film lipid layer:a molecular level view[J].Biochimica Biophysica Acta,2016,1858(10):2421-2430.
[18]TORRICELLI A A,MATSUDA M,NOVAES P,et al.Effects of ambient levels of traffic-derived air pollution on the ocular surface:analysis of symptoms,conjunctival goblet cell count and mucin 5AC gene expression[J].Environmental Research,2014,131(3):59-63.
[19]BERRA M,GALPERIN G,DAWIDOWSKI L,et al.Impact of wildfire smoke in buenos aires,argentina,on ocular surface[J].Arq Bras Oftalmol,2015,78(2):110-114.
[20]LI L,BRAUN R J,MAKI K L,et al.Tear film dynamics with evaporation,wetting,and time-dependent flux boundary condi-tion on an eye-shaped domain[J].Physics of Fluids,2014,26(5):69-87.
[21]TORRICELLI A A,NOVAES P,MATSUDA M,et al.Correlation between signs and symptoms of ocular surface dysfunction and tear osmolarity with ambient levels of air pollution in a large metropolitan area[J].Cornea,2013,32(4):e11-e15.
[22]邵毅,余瑶,黄国栋,等.鬼针草叶治疗更年期女性中重度干眼症临床研究[J].中国中药杂志,2012,37(19):2985-2989.
[23]LU H,WANG M R,WANG J,et al.Tear film measurement by optical reflectometry technique[J].Journal of Biomedical Optics,2014,19(2):DOI:10.1117/1.JBO.19.2.027001.
[24]DIENES L,KISS H J,PERENYI K,et al.The effect of tear supplementation on ocular surface sensations during the interblink interval in patients with dry eye[J].PLoS One,2015,10(8):DOI:10.1371/journal.pone.0135629.
Influence of air pollutant PM10on tear film and corneal epithelium in mice*
Juan Li1,Gang Tan2,An-hua Wu2,Qi-chen Yang3,Lei Ye4,Ya-hong Wang5,Yi Shao4
(1.Department of Ophthalmology,Xi'an Fourth Hospital,Xi'an,Shaanxi 710004,China;2.Department of Ophthalmology,the First Affiliated Hospital of University of South China,Hengyang,Hunan 421001,China;3.Eye Institute of Xiamen University,Xiamen,Fujian 361102,China;4.Department of Ophthalmology,the First Affiliated Hospital of Nanchang University,Nanchang,Jiangxi 330006,China;5.Environmental Monitoring Station of Xi'an City,Xi'an,Shaanxi 710054,China)
Objective To investigate the influence of PM10on tear film functions and corneal epithelium in mice.Method Totally 30 male BALB/c mice at the age of 6-8 weeks (30 eyes)were divided into 3 groups:group A (PBS eye drops,n=12),group B (PM10eye drops,n=12)and blank control group (n=6).The group B used 5 mg/ml PM10eye drops,50 μl each time,3 times a day,for 7 consecutive days.The group A used sterile PBS as eye drops,3 times a day,for 7 consecutive days.The tear film function tests including tear secretion level,breakup time of tear film (BUT)and fluorescein staining and fluorescein staining score(FL)were performed before therapy and 1,4 and 7 d after treatment.On the 7th d after treatment,the corneas of all the mice were collected for HE staining and ultrastructural examination under transmission electron microscope.Results On the 1st,4th and 7th d after treatment,there was no statistical change in tear secretion level,BUT or FL in the group A (P>0.05);but there were statistical changes in all items in the group B (P<0.05).On the 7th d after therapy,the mean layers of corneal epithelial cells in the group A were significantly fewer than those in the group B (P<0.05).Under electron microscope,the microvilli of corneal epithelium in the group A were finger-like and in regular arrangement;in contrast,a cluster of disordered,shorter and fewer microvilli was observed in the group B.Conclusions PM10can influence tear film functions and damage corneal epithelial structure in mice.
particular matter 10;tear film function;corneal epithelium
R772
A
10.3969/j.issn.1005-8982.2017.26.002
1005-8982(2017)26-0007-06
2016-08-30
国家自然科学基金(No:81400424);陕西省科学技术研究发展计划(No:2014K11-03-07-04);2017年陕西省创新人才推进计划-青年科技新星项目(No:2017KJXX-87)
邵毅,E-mail:freebee99@163.com
(童颖丹 编辑)
