乌司他丁对坏死性小肠结肠炎新生大鼠小肠结肠的保护作用研究
2017-11-16赖盼建徐洁李小兵包云光
赖盼建 徐洁 李小兵 包云光
●论著
乌司他丁对坏死性小肠结肠炎新生大鼠小肠结肠的保护作用研究
赖盼建 徐洁 李小兵 包云光
目的探讨乌司他丁对坏死性小肠结肠炎(NEC)新生大鼠小肠结肠的保护作用。方法将60只3日龄SD大鼠随机分为正常对照组、NEC模型组、乌司他丁治疗组、乌司他丁对照组,每组15只。先采用综合应激法建模,即3日龄SD大鼠离开母鼠后,采用肠内配方奶喂养、缺氧(100%CO2灌饲养箱10min)-高氧(97%O2灌饲养箱5min)暴露和冷应激(4℃环境中5min)的方法,2次/d,连续3d,并加腹膜腔注射0.9%氯化钠溶液。造模成功后取肠管组织切片,HE染色光镜下观察并作Shiou评分,免疫荧光法检测自噬因子(Beclin-1)和自噬相关蛋白(LC3A/B)表达水平,Elisa法检测TNF-α、IL-1β和IL-6水平。结果NEC模型组和正常对照组相比较炎症反应明显改善,Shiou评分有统计学差异;Beclin-1和LC3A/B荧光强度显著增强;TNF-α、IL-1β、IL-6水平明显升高,差异均有统计学意义(均P<0.05)。乌司他丁治疗组和NEC模型组相比较炎症反应明显改善,Shiou评分有统计学差异;Beclin-1和LC3A/B水平可见荧光强度表达显著下降;TNF-α、IL-1β、IL-6水平明显下降,差异均有统计学意义(均P<0.05)。结论乌司他丁对NEC新生大鼠小肠结肠有保护与治疗作用。
坏死性小肠结肠炎乌司他丁Shiou评分自噬与凋亡炎性因子
新生儿坏死性小肠结肠炎(necrotizing enterocolitis,NEC)具有高发病率、病死率及致残率的特点[1]。其发病机制尚未完全阐明,早产儿免疫功能及调节能力低下,缺血再灌注、氧自由基、感染等所诱导的异常炎症反应是共同损伤通路,最终导致胃肠道黏膜屏障功能障碍。乌司他丁为蛋白酶抑制剂(Ulinary trypsininhibitor,UTI),具有抑制炎症介质释放的作用[2]。动物实验证明乌司他丁能减少脓毒性休克动物的死亡[3],但目前关于是否能保护肠黏膜细胞的报道甚少。笔者采用人工喂养、缺氧和冷刺激建立新生大鼠NEC模型,研究乌司他丁对NEC所致的肠道炎症、坏死和细胞凋亡的保护作用,为探讨NEC的发生机制,寻求有效预防和治疗NEC的新策略提供依据。
(正文见第1735 页)
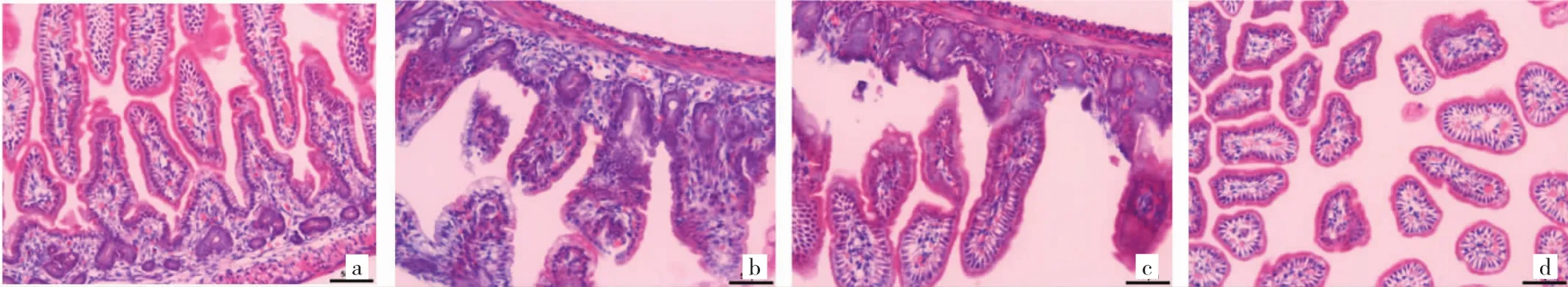
图1 各组大鼠肠道组织HE染色光镜观察(a:正常对照组;b:NEC模型组;c:乌司他丁治疗组;d:乌司他丁对照组;HE染色,×200)
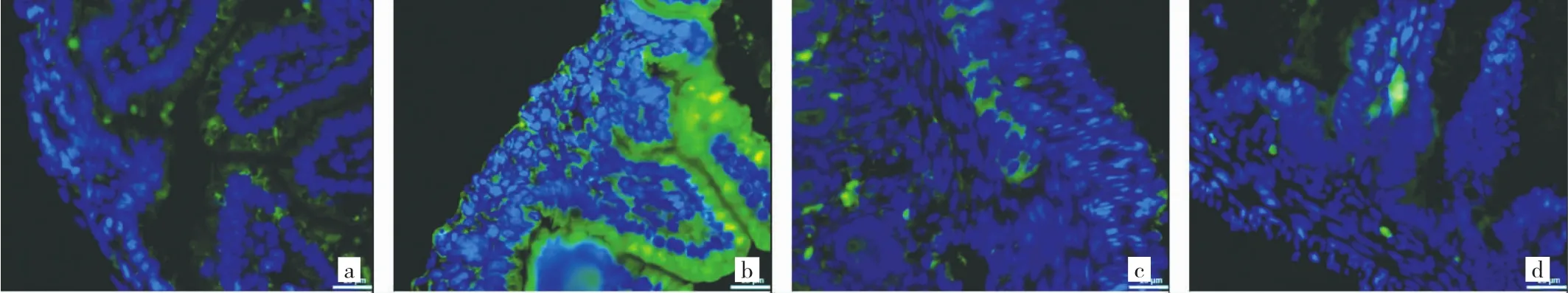
图2 大鼠肠道组织Beclin-1荧光强度表达(a:正常对照组;b:NEC模型组;c:乌司他丁治疗组;d:乌司他丁对照组;免疫荧光法,×400)

图3 大鼠肠道组织LC3II荧光强度表达(a:正常对照组;b:NEC模型组;c:乌司他丁治疗组;d:乌司他丁对照组;免疫荧光法,×400)
1 材料和方法
1.1 材料和仪器健康清洁级SD大鼠60只,雌雄不限,3日龄,购自浙江省实验动物中心[动物生产许可证号:scxk(浙)20140001],饲养及实验环境为浙江省金华市实验动物中心[动物使用许可证号:syxk(浙)20140008]SPF动物房。主要试剂:二甲苯(成都市科龙化工试剂厂);伊红(上海迈坤化工有限公司);苏木精(美国Sigma公司);Beclin-1抗体、LC3抗体(英国Abcam公司);驴抗兔二抗(Life Technology,激发/吸收波长:488nm/525nm);TNF-α Elisa试剂盒(武汉华美生物,货号:CSB-E11987r);IL-1β Elisa试剂盒(武汉华美生物,货号:CSB-E08055r);IL-6 Elisa试剂盒(武汉华美生物,货号:CSB-E04640r)。主要仪器:轮转式切片机(RM2235型,德国LEICA公司);病理组织漂烘仪(tec 2500型,常州市郝思琳仪器设备有限公司);显微镜(BX43型,日本OLYMPUS公司);隔水式恒温培养箱(PYX-DHS500BS-Ⅱ型,上海跃进医疗器械有限公司);酶标仪(BIO-RAD Model680);洗板机(Mindray MW-12A);恒温箱(DHG-9140A型,扬州鸿都电子);高速离心机(Thermo ST16R)。
1.2 方法
1.2.1 分组及建模将SD大鼠随机分为4组,每组15只:(1)正常对照组:常规喂养,不给予任何干预与刺激;(2)NEC模型组:离开母鼠后,采用肠内配方奶喂养、缺氧-高氧暴露和冷应激的方法,即新生大鼠在100%CO2中10min,4℃环境中5min,97%O2中5min,2次/d,连续3d,并在腹膜腔中注射0.9%氯化钠注射液0.1ml;(3)乌司他丁治疗组:在NEC模型成功基础上,乌司他丁腹膜腔注射1次/d,剂量10 000U/(kg·d),连续3d;(4)乌司他丁对照组:新生大鼠离开母鼠后常规喂养,乌司他丁腹膜腔注射1次/d,剂量10000 U/(kg·d),连续3d。第7天,处死4组所有大鼠,取胃肠道组织(十二指肠末端至回盲部肠管)。
1.2.2 大鼠肠道组织HE染色病理学检测取肠道头端组织0.5cm,于4%甲醛溶液中固定3~5d,经80%、90%、95%、100%乙醇Ⅰ、100%乙醇Ⅱ、100%乙醇Ⅲ进行脱水处理,二甲苯2次各30min透明,浸蜡包埋,待蜡块冷却凝固后置于-20℃冷藏,行环状切片(厚4μm);常规HE染色,细胞核呈蓝色,细胞质呈粉红色,红细胞呈较鲜艳的红色。肠道病理组织采用Shiou等[4]新的标准双盲法评分,即0分:肠黏膜绒毛完整,组织结构正常;1分:轻微黏膜下和(或)固有层肿胀分离;2分:中度黏膜下和(或)固有层分离,黏膜下和(或)肌层水肿;3分:重度黏膜下和(或)固有层分离,黏膜下和(或)肌层水肿,局部绒毛脱落;4分:肠绒毛消失伴肠坏死。病理评分≥2分者视为NEC。
1.2.3 免疫荧光法检测自噬与凋亡肠道组织常规切片;免疫荧光检测大鼠小肠组织Beclin-1和LC3A/B的表达:(1)二甲苯脱蜡,梯度乙醇复水;(2)抗原修复;(3)滴加一抗(Beclin-1抗体、LC3抗体),4℃孵育过夜,PBS水洗3×3min,并设PBS作为阴性对照;(4)滴加二抗(驴抗兔二抗),37℃孵育60min,PBS冲洗3×5min;(5)DAPI染核,室温10min;(6)甘油PBS封片,荧光显微镜观察。结果分析:绿色荧光所示为Beclin-1和LC3A/B,蓝色为细胞核。
1.2.4 Elisa法检测TNF-α、IL-1β、IL-6水平使用前将所有试剂和样本平衡至室温;根据试剂盒说明配制标准品;每孔依次加入100μl标准品和样本,复孔,锡纸密封,37°孵育2h,吸弃孔内液体,在干净的纸上拍干;每孔依次加入100μl抗体,锡纸密封,37°孵育1h;使用洗板机洗涤,每孔洗涤液200μl,洗涤时间2min,总共洗涤3次;每孔依次加入100μl辣根过氧化物酶(HRP),锡纸密封,37°孵育1h;再次使用洗板机洗涤,每孔洗涤液200μl,洗涤时间2min,总共洗涤5次;每孔依次加入90μl四甲基联苯胺(TMB);锡纸密封,37°避光孵育30min;加终止液50μl,显色;5min内使用酶标仪在450nm读数,校正波长540nm或570nm。计算结果:标准品和样本的OD值减去零标准的OD值,取2个复孔的均值;建立标准曲线和公式,根据所测OD值计算出各样本的浓度。
1.3 统计学处理应用SPSS19.0统计软件,计量资料以表示,多组间比较采用单因素方差分析。
2 结果
2.1 各组大鼠肠道组织HE染色病理学检测各组大鼠肠道组织HE染色在光镜下可见:正常对照组:肠黏膜上皮完整、连续,细胞与腺体排列规则,黏膜及黏膜下层无炎症细胞浸润;NEC模型组:肠绒毛水肿,黏膜固有层及黏膜下层大量炎症细胞浸润(以中性粒细胞和嗜酸性粒细胞为主),肠腔毛细血管充血,甚至可见肠上皮坏死。乌司他丁治疗组:肠黏膜上皮完整、连续,细胞与腺体排列规则,部分可见肠绒毛水肿和肠腔毛细血管充血,部分可见固有层少量炎细胞浸润;乌司他丁对照组:未见明显炎症性病变,见图1(见插页)。乌司他丁治疗组和正常对照组及乌司他丁对照组相比较无统计学差异,见表1。

表1 肠道病理组织Shiou评分比较(分)
2.2 免疫荧光法定性检测LC3II和Beclin 1的荧光强度相同曝光时间下,可见NEC模型组Beclin-1和LC3A/B荧光强度表达较其他3组强,乌司他丁治疗组和正常对照组及乌司他丁对照组相比荧光强度未见差异。见图2、3(见插页)。
2.3 各组大鼠肠道组织炎性因子水平的比较给予乌司他丁治疗的两组炎性因子TNF-α、IL-1β、IL-6水平显著低于NEC模型组,差异均有统计学意义(均P<0.05)。详见表2。

表2 各组大鼠肠道组织炎性因子水平的比较
3 讨论
目前NEC的发病机制仍不清楚,其治疗仍以对症处理为主,疗效不确切,急需寻求有效的防控措施。本研究采用人工喂养、缺氧和冷刺激建立新生大鼠NEC模型,探讨NEC的发病可能机制,并寻求乌司他丁的干预效果。结果发现,乌司他丁治疗可明显改善炎症反应,炎性因子TNF-α、IL-1β和IL-6水平明显下降,Beclin-1和LC3A/B水平显著下降;提示乌司他丁对NEC新生大鼠有保护与治疗作用。
NEC肠道损伤机制复杂,炎症反应在其中发挥了重要作用。其中TNF-α、IL-1β及IL-6是重要的炎症细胞因子,在全身性炎症的发生、发展中起着主导作用,不仅可以引起其他细胞因子的释放,而且可以促进中性粒细胞和内皮细胞之间的黏附以及中性粒细胞的移行,释放的炎症介质增加,进一步加重组织脏器的损伤。本实验发现,与NEC组相比,乌司他丁干预组肠道组织炎症反应较轻,炎细胞浸润减少,炎性因子TNF-、IL-1β、IL-6水平亦显著下降,提示乌司他丁可通过抑制TNF-α等细胞因子和氧自由基产生,稳定溶酶体和细胞膜及调控细胞因子和炎症介质等而发生抑制炎症反应和保护肠黏膜屏障的作用[4-5]。临床Meta分析显示,乌司他丁抑制与心脏手术相关的TNF-α、IL-8、IL-等水平增加,支持本研究结果[6]。同样,动物实验研究也证明,乌司他丁能显著改善缺血再灌注及肺挫伤诱发的急性肺损伤中的炎症和氧应激[4-5]。但鲜见有关乌司他丁对NEC肠黏膜保护的相关研究,仅在烧伤或脓毒血症研究中发现乌司他丁对小肠免疫屏障没有直接的保护作用,但能有效降低血浆炎症因子水平,可能改善炎症抑制治疗的效果[6-7]。本实验结果提示,乌司他丁对NEC大鼠的炎症抑制是有价值的,具有潜在治疗效应及应用前景,需要更多研究以提供乌司他丁的作用机制及效果的证据。
细胞凋亡可能是最初肠黏膜细胞的主要死亡方式,已明确肠黏膜通透性增加是早产儿NEC发病的早期事件,且发现其过程存在细胞凋亡及自噬现象[8]。我们进一步研究也发现,NEC模型组Beclin-1和LC3Ⅱ荧光强度表达较正常对照组及乌司他丁组强。提示乌司他丁可降低自噬与凋亡水平,从而表现出其肠道保护作用。细胞自噬与凋亡作为相互联系的细胞过程,目前认为具有相同的诱导、调控及信号转导过程。在NEC临床病例与实验大鼠模型的回肠上皮细胞均有自噬的激活。自噬体由ATG12-Atg5的-Atg16复合体和微管相关蛋白轻链3(LC3Ⅰ)-磷脂缀合物(LC3Ⅱ)介导形成[9],因而LC3II被认为是自噬的标志。而Beclin-1为Ⅲ型PI3-激酶复合物的成分,参与自噬泡的成核过程,是另一种自噬标记物[10]。另一方面,细胞凋亡可能是最初肠黏膜细胞的主要死亡方式,这种细胞凋亡作用可能是通过TNF-α等因子诱导线粒体功能障碍和激活线粒体凋亡级联反应来实现的。在实验性NEC模型中证实,细胞自噬和凋亡均被活化,且细胞自噬先于细胞凋亡发生,继而细胞凋亡后发生肠道组织的坏死,体外研究表明补充细胞生成素可显着降低自噬和凋亡红[8]。当然,乌司他丁的保护肠上皮细胞作用是否通过免受过度自噬和细胞凋亡而实现尚待进一步的研究。
总之,乌司他丁可通过降低TNF-α、IL1-β、IL-6等炎症介质的表达来抑制肠道的炎症级联反应,并能抑制肠黏膜上皮细胞的自噬与凋亡,对NEC新生大鼠肠损伤起保护作用。
[1] Kong X,Xu F,Wu R,et al.Neonatal mortality and morbidity among infants between 24 to 31 complete weeks:a multicenter survey in China from 2013 to 2014[J].BMC Pediatr,2016,16(1):174.
[2] Cao YZ,Tu Y Y,Chen X,et al.Protective effect of Ulinastatin against murine models of sepsis:inhibition of TNF-α and IL-6 and augmentation of IL-10 and IL-13[J].Exp Toxicol Patho,2012,64(6):543-547.
[3] Wang N,Liu X,Zheng X,et al.Ulinastatin is a novel candidate drug for sepsis and secondary acute lung injury,evidence from an optimized CLP rat model[J].Int Immunopharmacol,2013,17(3):799-807.
[4] Wang S,Wang J,Chen X,et al.Does urinary trypsin inhibitor have a role in acute lung injury induced by pulmonary contusion:a basic research in a modelofrats[J].Am J Ther,2014,21(6):447-452.
[5] Yu L,Luo Q,Fang H.Mechanism of ulinastatin protection against lung injury caused by lower limb ischemia-reperfusion[J].Panminerva Med,2014,56(1):49-55.
[6] He Q L,Zhong F,Ye F,et al.Does intraoperative ulinastatin improve postoperative clinical outcomes in patients undergoing cardiac surgery:a meta-analysis of randomized controlled trials[J].Biomed Res Int,2014,2014:630835.
[7] Jiang L,Yang L,Zhang M,et al.Beneficial effects of ulinastatin on gut barrier function in sepsis[J].Indian J Med Res,2013,138(6):904-11.
[8] Yu Y,Shiou S R,Guo Y,et al.Erythropoietin protects epithelial cells from excessive autophagy and apoptosis in experimental neonatalnecrotizing enterocolitis[J].PLoS One,2013,8(7):e69620.
[9] Maynard AA,Dvorak K,Khailova L,et al.Epidermalgrowth factor reduces autophagy in intestinal epithelium and in the rat model of necrotizing enterocolitis[J].Am J Physiol Gastrointest Liver Physiol,2010,299(3):G614-622.
[10] Walczak M,Martens S.Dissecting the role of the Atg12-Atg5-Atg16 complex during autophagosome formation[J].Autophagy,2013,9(3):424-425.
[11] Myung Park J,Huang S,Wu T T,et al.Prognostic impact of Beclin 1,p62/sequestosome 1 and LC3 protein expression in colon carcinomas from patients receiving 5-fluorouracil as adjuvant chemotherapy[J].Cancer BiolTher,2013,14(2):100-107.
Protective effects of ulinastatin on necrotic enterocolitis in neonatal rats
LAI Panjian,XU Jie,LI Xiaobing,et al.
Department of Pediatrics,Jinhua Central Hospital,Jinhua 321000,China
Objective To investigate the effects of ulinastatin on necrotic enterocolitis(NEC)in neonatal rats.Methods Sixty Sprague-Dawley rats aged of 3 days were randomly divided into four groups with 15 in each group:control,NEC model,NEC+Ulinastatin,and Ulinastatin.When experiments completed the intestinal samples were harvested and stained with hematoxylin and eosin(HE),the samples were observed under light microscope and scored according to the method of Shiou et al.Immun of luorescence was used to detect beclin-1 and LC3A/B to evaluate the autophagy and apoptosis.The inflammatory factors TNF-α,IL-1β,and IL-6 were determined by enzyme-linked immunosorbent assay.ResultsHE staining revealed that the inflammatory response in NEC+Ulinastatin group was significantly attenuated compared with that in the NEC model group.The pathological examination showed a significant difference in Shiou scores among 4 groups.The expression of beclin-1 and LC3A/B levels in intestinal tissue of NEC+Ulinastatin group were significantly decreased;and the levels of inflammatory factors TNF-α,IL-1β,and IL-6 were also significantly decreased(P<0.05).Conclusion Ulinastatin exerted protective and therapeutic effects on NEC in neonatal rats.
Necrotizing enterocolitis Ulinastatin Shiou score Autophagy and apoptosis In flammatory factors
10.12056/j.issn.1006-2785.2017.39.20.2017-770
浙江省科技计划实验动物项目(2014C37024);金华市科技计划项目(2015-3-010)
321000金华市中心医院小儿科(赖盼建、徐洁、李小兵、包云光)
李小兵,E-mail:327283825@qq.com
2017-04-07)
(本文编辑:严玮雯)
