响应面试验优化超声波辅助提取长红枣多糖及其抗氧化活性
2017-11-14李福帅李国峰王麒雄王占一
李福帅,李国峰,张 璐,王麒雄, 戴 博,王占一
(1. 枣庄学院生命科学学院,山东枣庄 277160;2. 空军总医院药学部,北京 100142)
响应面试验优化超声波辅助提取长红枣多糖及其抗氧化活性
李福帅1,李国峰1,张 璐1,王麒雄1, 戴 博2,*王占一1
(1. 枣庄学院生命科学学院,山东枣庄 277160;2. 空军总医院药学部,北京 100142)
以鲁南地区长红枣为原料,长红枣多糖得率为考查指标,在单因素试验的基础上,通过三因素三水平的响应面优化试验,得出长红枣多糖最佳的提取工艺条件为料液比1∶16(g∶mL),超声温度50 ℃,超声时间30 min;在此条件下,长红枣多糖得率达15.12%。采用·O2-,·OH和NO2-的清除试验,研究了长红枣多糖的体外抗氧化活性。结果表明,当长红枣多糖质量浓度为2 mg/mL时,对·OH和·O2-清除率分别达到53%和56%;在pH值2~3的酸性条件下,对NO2-清除率达40%以上。
长红枣;多糖;超声波辅助提取;响应面优化;抗氧化活性
(1. College of Life Science, Zaozhuang University, Zaozhuang, Shandong 277160, China;2. Department of Medicine Air Force General Hospital, Beijing 100142, China)
枣(ZiziphusjujubeMill.)是鼠李科(Rhamnaceae)枣属植物枣树的果实,在我国有悠久的栽种历史,被民间列入“五果”已久。而长红枣作为鲁南地方名产果品,因肉多核小、营养丰富、含糖量高,有着较高的滋补和药用价值,被誉为“天然维生素丸”。长红枣富含多糖、黄酮类化合物、香豆素等多种成分,其中尤以多糖活性最佳。长红枣多糖兼具治疗肺热咳嗽、化痰和影响淋巴细胞分裂过程等作用,在改善免疫力和抗衰老等方面具有潜在价值[1-2]。同时,长红枣多糖可以清除体外多种功能因子[3]。依据黄杰等人[4-5]试验表明,超声空化效应可缩短提取时间,但没有探究长红枣多糖提取的最佳优化工艺。试验以鲁南长红枣为原料,采用超声空化原理辅助提取长红枣多糖,并通过体外抗氧化试验测定其抗氧化能力,为鲁南地区长红枣资源进入产业化生产提供参考依据。
1 材料与方法

长红枣,采自鲁南地区长红枣培育园区;对氨基苯磺酸,无极宏通化工有限责任公司提供;盐酸萘乙二胺,长沙市裕丰化玻器械有限公司提供;葡萄糖、三氯乙酸、邻苯三酚、浓硫酸等,均为国产AR级。

SB25-12DTN型超声波清洗机,宁波新芝生物科技股份有限公司产品;DHG-9246A型电热恒温鼓风干燥箱,上海精宏试验设备有限公司产品;XFB-200型小型多功能粉碎机,永康市小宝电器有限公司产品;U-3900型紫外-可见分光光度计,日本日立公司产品;JA5003B型电子分析天平,上海精科仪器有限公司产品;RE52CS-2型旋转蒸发器,上海亚荣生化仪器厂产品;PHS-2F型pH计,上海仪电科学仪器厂产品。

1.3.1 标准曲线的制定
(1) 长红枣总糖测定依据苯酚-硫酸法[6]。精密称量50 mg烘干至恒质量葡萄糖,取水补至50 mL,量取10 mL移至100 mL容量瓶,定容即得0.1 mg/mL葡萄糖溶液,分别吸取0,0.1,0.2,0.3,0.4,0.5,0.6,0.7 mL至试管,纯水补至1.0 mL,加6%苯酚(由80%苯酚现配) 1.0 mL和5.0 mL浓硫酸,于40 ℃条件下水浴30 min,放冷10 min后于波长490 nm处测量吸光度。
苯酚-硫酸法得标准试液质量浓度X(mg/mL)与吸光度Y回归方程为:Y=71.08X+0.008 6,R2=0.999 3, 总糖质量浓度范围为0~10 μg/mg。
(2) 长红枣还原糖测定依据3,5 -二硝基水杨酸(DNS) 法[7]。配制0.5 mg/mL葡萄糖标准溶液,分别吸取0, 0.3,0.4, 0.5, 0.6, 0.7, 0.8,0.9 mL至试管,纯水补至1.0 mL,添加2.0 mL DNS显色剂,开水中水浴5 min后,冷水冲至室温,纯水补至10.0 mL,于波长540 nm处测量吸光度。
DNS法标准工作曲线回归方程为:Y=16.664X-0.008 7, R2=0.999 5,还原糖质量浓度为 0~45 μg/mg。
1.3.2 长红枣多糖含量的测定[8]
将5 g长红枣粉的提取液抽滤后减压精炼定容至100 mL,制成供试液。吸取0.4 mL供试液定容在100 mL容量瓶中,以苯酚-硫酸法测得总糖,再吸取0.9 mL供试液补水至25 mL容量瓶,以DNS法测得还原糖,二者相减得多糖含量。公式如(1):

式中:W——长红枣多糖得率,%;
c——测定多糖质量浓度,mg/mL;
V——供试液的体积,mL;
n——稀释倍数;
m——长红枣多糖的质量,g。

将净制的长红枣于烘箱中,于60 ℃条件下烘至恒质量,摊开晾凉,粉碎并过60目筛,长红枣粉以石油醚为提取溶剂,应用索氏提取器回流处理2次(第1次1.0 h,第2次0.5 h),脱脂[9-10],脱脂后的粉末于通风处自然阴干。将5 g处理后长红枣粉置于150 mL锥形瓶中,封口膜密封,皮筋拴紧。调节超声波提取器输出功率为500 W,在设定温度下反应至设定的时刻,取出后抽滤,浓缩并定容。每70 mL粗多糖试液加10 g处理好的吸附树脂于500 mL烧杯中,用磁力搅拌器搅动0.5 h(120 r/min),静置1 h,脱色[11],抽滤。处理液采用Sevage辅助酶法脱除杂蛋白[12],重复脱杂2次,得脱蛋白液[13]。将所得的处理液中添加约3倍体积的无水乙醇,于4 ℃条件下静置8 h,纱布滤得沉淀,冷冻干燥,得到粗多糖。

1.5.1 单因素试验
称取粉碎至规定粒度的长红枣干粉5 g,分别设定料液比 1∶8, 1∶12, 1∶16, 1∶20, 1∶24(固定超声温度50 ℃,超声时间30 min),超声时间20, 25,30,35, 40 min(固定料液比1∶16,超声温度50 ℃),超声温度30,40,50,60,70 ℃(固定料液比1∶16,超声时间30 min),测定多糖得率,考查各个因素对于试验结果的作用。
1.5.2 响应面试验设计
以料液比(A)、超声温度(B)、超声时间(C)3个因素作为考查对象,在单因素试验的基础上,利用Design Expert 8.0.6软件设计模型开展响应面分析,获取最适工艺参数。
响应面模型因素与水平设计见表1。

表1 响应面模型因素与水平设计

1.6.1 溶液的配制
以长红枣粗多糖为样品,以VC为对照品。配制方法:精确称取样品及VC各0.2 g,分别用超纯水补至100 mL,即配成质量浓度为2 mg/mL的水溶液,然后依次倍数稀释共得到6个质量浓度的样品溶液,分别为 2, 1, 0.5, 0.25, 0.125, 0.062 5 mg/mL, 用于后续的抗氧化试验。
1.6.2 长红枣多糖对O2-自由基清除力的测定
准确移取5 mL Tris-HCl缓冲液(pH值8.2) 于10 mL具盖刻度试管中,滴加对应浓度的待测供试液,用超纯水补至9.7 mL,于25 ℃恒温水浴反应20 min,移出后滴加同温水浴的3 mmol/L邻苯三酚试液0.3 mL,立刻振匀,移入比色皿中,以10 mmol/L的HCl作对照液,于波长325 nm处以30 s为一区间测吸光度A,共测5.5 min,制作吸光度A与作用时间t相关联的线性图。用超纯水代替样品液,所得的关联图中纵横坐标比值即为邻苯三酚的自氧化速率V0[14]。
待测样品清除·O2-的测定:由上述自氧化速率关联图,求出纵横坐标比值即为加入样品后的自氧化速率Vt。以VC作为标准对照,按照公式(2) 计算红枣多糖对·O2-的清除率[15]。

式中:Vt——样品的自氧化速率;
V0——邻苯三酚的自氧化速率。
1.6.3 长红枣多糖对·OH清除率的测定
在10 mL具盖刻度试管中滴加0.75 mmol/L邻二氮菲试液1 mL,0.2 mol/L磷酸缓冲溶液(pH值7.4)和超纯水1 mL,振荡混匀,滴加浓度为0.75 mmol/L的FeSO41 mL,振荡摇匀后加入3%H2O21 mL启动反应,于37 ℃条件下保温1 h,于波长511 nm处测定吸光度A1。将H2O2置换成样品溶液1 mL,按前述流程测定A2。另取等同体积样品液代替超纯水,按前述流程测定A3。采用抗坏血酸对位对照,各组试验平行3次,按照公试(3) 计算结果并取平均值[16]。

式中:A1——不加样品所测吸光度;
A2——不加H2O2所测吸光度;
A3——样品液所测吸光度。
1.6.4 长红枣多糖在体外模拟不同pH值胃环境对NO2-清除率的测定
(1) NO2-清除率的测定。配置25 μg/mL的多糖样品液,并依据李志洲等人的方法测定NaNO2含量。NO2-清除率计算按公式(4)。

另取pH值2,3,4,5,6,7缓冲液配制的多糖溶液1.0 mL,每管滴加10 μg/mL NO2-对照液2 mL,以适宜pH值(即2,3,4,5,6,7) 的缓冲液补至相同体积(剩余步骤同上),作用10,20,30,40,
50,60 min后取出,测定对NO2-的清除率。
2 结果与分析

2.1.1 不同料液比对长红枣多糖得率的作用
料液比对长红枣多糖得率的作用见图1。
由图1可知,长红枣多糖得率伴随料液比的减小而呈现出先增长后减少的趋向,在料液比1∶16处有明显的峰值,即在一定范围内长红枣得率达到最大值;当料液比大于1∶16时,则长红枣多糖得率显著下降。这说明了在料液比达到1∶16后,再持续增加溶剂量不会持续增加多糖得率,相反呈现出多糖得率减少的情况。从试验工艺和经济成本考虑,确定料液比为1∶12 ~ 1∶20。

图1 料液比对长红枣多糖得率的作用
2.1.2 不同超声温度对长红枣多糖得率的作用
超声温度对长红枣多糖得率的作用见图2。

图2 超声温度对长红枣多糖得率的作用
由图2可知,当超声温度较小时,伴随超声温度的增大,长红枣多糖得率提高;当超声温度为50 ℃时,长红枣多糖得率达峰值;大于50 ℃后,伴随超声温度的提高,长红枣多糖得率会下降。可能的原因是长红枣多糖在50 ℃时会局部产生糊化,以致长红枣多糖得率降低。因此,确定超声温度为40~60 ℃。
2.1.3 不同超声时间对长红枣多糖得率的作用
超声时间对长红枣多糖得率的作用见图3。

图3 超声时间对长红枣多糖得率的作用
由图3可知,在20~30 min范围内,伴随超声时间的增长,长红枣多糖得率上升;30 min时,达最高值;30 min过后,长红枣多糖得率降低。这说明长红枣多糖得率与超声时间紧密关联,超声时间少,多糖溶出的不完全;超声时间过多,可能导致多糖构造水解,并浪费能量。因此,确定超声时间为25~35 min。

2.2.1 回归方程的建立及方差分析
依据单因素试验分析结果,以料液比(A)、超声温度(B)、超声时间(C) 为设计因素,以长红枣多糖得率(Y) 为响应值,采用Design Expert 8.0.6软件对三因素三水平的Box-Behnken试验进行响应面分析设计。
Box-Behnken试验设计与结果见表2,BBD设计方差分析结果见表3。

表2 Box-Behnken试验设计与结果
采用Design Expert V.8.0.6统计分析软件,对所得数据采取回归分析,对3个因素拟合,得到长红枣多糖得率(Y) 的回归方程为:
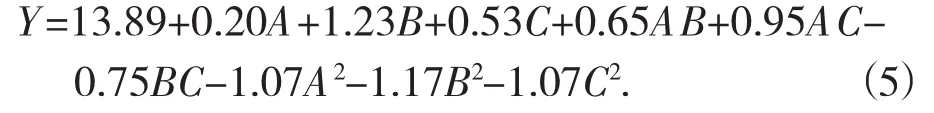
对表3中的数据进行分析可以看出,整个回归模型极显著 (p=0.001 8<0.01), R2=0.938 8; 失拟性检验不显著(p=0.092 0>0.05),说明该模型的拟合性较好,用于长红枣多糖的提取试验是可行的。其中,一次项B,二次项及A2,B2,C2对长红枣多糖得率响应值影响均极显著;一次项C,交互相AC,BC对长红枣多糖得率响应值影响均显著;各因素对多糖得率影响顺序为超声温度>超声时间>料液比。

表3 BBD设计方差分析结果
2.2.2 响应面分析
响应曲面图和等高线图是响应值对试验因素A,B,C所组成的三维空间曲面立体图,从响应面图中可以直观的看出各个试验因素及两两因素之间的交互作用对响应面值的影响。
各因素交互作用对长红枣多糖得率影响的响应面和等高线见图4。

图4 各因素交互作用对长红枣多糖得率影响的响应面和等高线
由图4(a) 可知,等高线图中超声温度的等高线比料液比密集,超声温度比料液比对长红枣多糖得率的作用大;从曲面图可以看出,当超声温度一定时,伴随料液比的提高,长红枣多糖得率呈现先增长后降低的趋向,而且增长趋向平缓,降低的趋向陡峭。这可能由于料液比提高会使料液变稀薄,增大了料液浓度差,从而减小了多糖溶出阻力,利于多糖提取,但过高的料液比使料液过度稀薄,可能引起后续试验中多糖的破损。
由图4(b) 可知,等高线图中超声时间的等高线比料液比密集,超声时间比料液比对长红枣多糖得率的影响大。当料液比到达一恒定值时,长红枣多糖得率也呈先增长后降低的趋向。
由图4(c) 可知,等高线图中超声温度的等高线比超声时间密集,伴随超声时间的改变,长红枣多糖得率先升高后降低。超声作用时间过长对多糖也有一定的分解作用,即超声时间越久多糖得率不一定越大。当超声时间一定时,随着超声温度的提高,长红枣多糖得率也呈先增长后降低的趋向,这是由于升高温度有促于长红枣粉溶胀充分,加快了多糖分子传质过程和溶散速度,但温度偏高可能导致多糖裂解而被破坏。
2.2.3 多糖提取工艺的验证结果
应用Design Expert V.8.0.6统计分析软件,通过响应面试验预测最优值,得到最佳工艺参数为料液比1∶17.4(g∶mL),超声温度55.6 ℃,超声时间32.1 min,在此优化工艺前提下长红枣多糖得率为14.32%。因为试验因素的限制,为了便于可行,将最优条件工艺修正为料液比1∶17(g∶mL),超声温度56 ℃,超声时间32 min,采取3次平均试验测得长红枣多糖平均得率为14.23%,说明该提取工艺响应面优化条件试验结果可靠,可重复性好。

2.3.1 长红枣多糖对O2-自由基清除能力的测定结果
不同质量浓度的长红枣多糖溶液与VC对·O2-的清除作用见图5。

图5 不同质量浓度的长红枣多糖溶液与VC对·O2-的清除作用
由图5可知,长红枣多糖和VC对·O2-均有一定的清除作用,并且清除率随供试液质量浓度的提高逐渐增长。在质量浓度为0~0.25 mg/mL时,长红枣多糖和VC对·O2-清除率随供试液质量浓度的提高上升不太明显;在质量浓度为0.25~4.00 mg/mL时,VC对·O2-的清除率高达89%,长红枣多糖对·O2-的清除率仅为56%,说明长红枣多糖对·O2-有一定的清除作用,但其去除效果比同质量浓度的VC低。
2.3.2 长红枣多糖对·OH清除能力的测定结果
不同质量浓度的长红枣多糖溶液与VC对·OH的清除作用见图6。

图6 不同质量浓度的长红枣多糖溶液与VC对·OH的清除作用
由图6可知,长红枣多糖和VC对·OH 均有一定的清除作用,并且清除率随供试液质量浓度的增高而逐渐增长。当长红枣多糖质量浓度为0.125 mg/mL时,其抗氧化水平与VC几乎相近;大于此值后,VC对·OH的清除率明显高于长红枣多糖,说明长红枣多糖对·OH有一定的清除作用,但其清除效果低于同质量浓度的VC。
2.3.3 不同pH值下长红枣多糖对NO2-清除率的测定结果
不同pH值下长红枣多糖对NO2-的清除作用见图7。

图7 不同pH值下长红枣多糖对NO2-的清除作用
由图7可知,在pH值2~3的环境下,多糖试液对NO2-的清除率在18 min时达到最高值(为50%),在40 min后变化程度不是很大,清除率在43%处浮动;在pH值4~5的环境下,多糖试液对NO2-的清除率在50 min后趋于稳定,清除率在36%前后浮动;在pH值7的环境下,多糖试液对NO2-的清除率在30 min时达最高值,此后伴随反应时间的进行在30%前后浮动。结果表明,在pH值2~5环境下,多糖试液对NO2-的清除率高于pH值6~7环境处。说明在酸性环境下,长红枣多糖富有良好的抗氧化活性。
3 结论
试验以单因素分析考查试验为基础,采用Box-Behnken试验设计优化超声波辅助提取长红枣多糖的最佳参数。结果表明,在料液比1∶17(g∶mL),超声温度56 ℃,超声时间32 min试验前提下,长红枣多糖得率为14.23%,与预测值接近。长红枣多糖具有一定的抗氧化能力,且抗氧化能力随供试液质量浓度的升高而升高。当多糖质量浓度为4 mg/mL,对·OH的清除率为53%,对·O2-的抑制率为56%。在体外模拟不同pH值的胃环境清除NO2-试验中,在pH值2~3环境下,长红枣多糖对NO2-的清除率接近50%。试验结果为长红枣多糖提取的工艺放大提供了理论依据,也为鲁南地区长红枣资源的开发利用提供了广阔空间。
[1]唐洁.植物多糖生物活性功能的研究进展 [J].食品研究与开发, 2006, 27(5): 130-132.
[2]顾有方,董策龙,陈会良,等.大枣多糖对大鼠血清自由基代谢的影响 [J].中国中医药科技,2007,14(5):347-348.
[3]李小平,陈锦屏,邓红,等.红枣多糖沉淀特性及抗氧化作用 [J].食品科学,2005,26(10):214-216.
[4]黄杰,孙桂菊,李恒,等.茶多糖提取工艺研究 [J].食品研究与开发,2006,27(6):77-79.
[5]王伟华,韩占江,陈晓静.普洱茶茶多糖的提取及含量测定 [J].安徽农业科学,2006,34(6):1 115-1 116.
[6]冯慧,洪家敏.索氏抽提法测定大豆粉中脂肪含量方法改进研究 [J].中国食物与营养,2009,12(8):50-51.
[7]山瑛.索氏抽提法检测脂肪应注意的问题 [J].中国卫生检验杂志,2007,17(6):1 138-1 139.
[8]杨悦文,胡晓,杨义芳,等.响应面分析法优化紫芝多糖的脱色工艺 [J].中国医药工业杂志,2013,44(4):348-351.
[9]张强,牟雪姣,正义.洋葱多糖的提取及其抗氧化活性研究 [J].食品与发酵工业,2007,33(1):138-141.
[10]朱胤龙,陈萍,张亚.环稀针嗜蓝孢孔菌多糖分析方法研究 [J].中国实验方剂杂志,2008,14(9):1-3.
[11]陈钧辉,李俊,张太平,等.生物化学实验 [M].北京:科学出版社,2008:20-22.
[12]王丽华,段玉峰,马艳丽,等.槐花多糖的提取工艺及抗氧化活性研究 [J].西北农林科技大学学报,2008,6(8):213-217.
[13]周小玲.茶多糖的定量、定性及生物活性研究 [D].青岛:中国海洋大学,2007.
[14]徐金瑞,张名位,刘兴华.黑大豆种皮花色苷体外抗氧化活性研究 [J].营养学报,2007,29(1):54-57.
[15]邱松山,周天,姜翠翠.无花果粗多糖提取工艺及抗氧化活性研究 [J].食品与机械,2011,27(1):40-42.
[16]张敏,刘刚,张雁南.等.响应面法优化蓝靛果花色苷提取工艺研究 [J].北方园艺,2014(23):113-116.◇
R284.2
A
10.16693/j.cnki.1671-9646(X).2017.10.002
1671-9646(2017) 10a-0005-06

2017-08-07
李福帅(1995— ),男,在读本科,研究方向为制药工程。
*通讯作者:王占一(1980— ),男,硕士,讲师,研究方向为天然药物活性成分提取与分离。
