生防菌SF1103、SF1104对黄瓜枯萎病菌的拮抗作用
2017-11-13赵文娟徐升运
赵文娟,付 博,徐升运,任 平
(陕西省生物农业研究所,陕西省酶工程技术研究中心,中国科学院 西北生物农业中心,西安 710600)
生防菌SF1103、SF1104对黄瓜枯萎病菌的拮抗作用
赵文娟,付 博,徐升运,任 平
(陕西省生物农业研究所,陕西省酶工程技术研究中心,中国科学院 西北生物农业中心,西安 710600)
为探明生防菌SF1103、SF1104对黄瓜枯萎病菌的拮抗作用,采用平板对峙法、菌丝混合及凹玻片孢子培养法研究其拮抗能力,采用特异平板培养法分析生防菌的产酶及次生代谢产物,并通过盆栽试验分析其对生防菌的防效。结果表明,经2株生防菌发酵液处理的病原菌的菌丝与孢子形态发生严重畸形并停止发育;2株生防菌均能分泌高活力的蛋白酶与纤维素酶,此外,SF1103具有解磷作用,SF1104能分泌嗜铁素;盆栽试验表明,使用复合菌剂处理的出苗率较对照组提高23.3%,较化学防治组提高29.4%;发病率较无防治组下降25.9%,防效达到77.8%。生防菌SF1103、SF1104对黄瓜枯萎病菌具有较强的拮抗能力,不仅能有效防治黄瓜枯萎病,并且对黄瓜的出苗生长有促进作用,有望进一步开发为生防菌剂产品。
生防菌;黄瓜枯萎病菌;拮抗作用
黄瓜枯萎病是一种严重影响黄瓜产量与品质的土传病害,在露地与保护地均可发生,特别是在保护地,特殊的环境条件与长期连作致使枯萎病的发病率更高,重发年份发病率可达80%~90%[1]。化学防治是黄瓜枯萎病防治的重要手段,但因环境污染、食品安全等问题日益严峻,环保、绿色的生物防治技术得到各国政府的普遍关注。
芽胞杆菌属的枯草芽胞杆菌(Bacillussubtilis)、蜡质芽胞杆菌(B.cereus)、解淀粉芽胞杆菌(B.amyloliquefaciens)防治黄瓜枯萎病效果明显,同时对黄瓜有明显的促生和增产作用。近些年来,芽胞杆菌属生防菌剂产品及生物有机肥的研发成为热点,并已取得诸多研究成果,国内外也有相关商品登记和应用,但在实际应用中由于活菌制剂的田间定殖和抗药等问题致使其抗病害性能大打折扣,也严重制约其在农业生产中的应用推广。因此,不断筛选拮抗能力强、抗病谱广、环境抗逆性强、田间定殖能力强的拮抗菌仍是未来开发生防制剂的主要方向[2-3]。
为进一步明确解淀粉芽胞杆菌(SF1103)和枯草芽胞杆菌(SF1104)2株生防菌对黄瓜枯萎病菌的拮抗作用,以及两者对黄瓜的协同增效防病和促生效果,本研究对这2株菌的拮抗性能、分泌的活性拮抗物质及盆栽育苗防效进行研究,以期为下一步生防菌制剂产品的产业化开发提供科学依据。
1 材料与方法
1.1 试验材料
生防菌株:解淀粉芽胞杆菌SF1103和枯草芽胞杆菌SF1104,均分离自温室黄瓜根际土壤。
病原菌:黄瓜枯萎病菌(Fusariumoxysporumf.sp.cucumerinum),分离自温室黄瓜田土壤,可引起黄瓜枯萎病。
培养基:PDA 培养基、PDA 培养液(为PDA不加琼脂);NA培养基、NB培养液(为NA不加琼脂)。培养基配方参照《微生物学实验》[4]。
黄瓜种子:‘新津杂2号’,山东宁阳县良丰种业有限公司。
多菌灵(w=90%):上海禾木药业有限公司。
化学试剂:蛋白胨、酵母粉、琼脂粉等生物试剂均购自北京奥博星生物技术有限公司;磷酸二氢铵、羧甲基纤维素钠、苯胺蓝等分析纯试剂均购自上海国药集团化学试剂有限公司。
1.2 试验方法
1.2.1 生防菌对黄瓜枯萎病菌的拮抗作用 抑菌对峙试验[5]:采用平板对峙培养法,以病原菌为指示菌,将在PDA平板上生长良好的病原菌打成直径6 mm的菌碟,将菌碟点接于新鲜PDA平板中央,同时将在试管内培养好的生防菌点接于距平板中央2.5 cm处的4个角点,以不接种生防菌为对照(CK),30 ℃培养5 d后观察并测量病原菌菌落直径,计算SF1103和SF1104对病原菌的生长抑菌率,每处理重复3次。抑菌率=(对照菌落直径-处理菌落直径)/(对照菌落直径-6)×100%,式中单位为mm。
生防菌发酵液对黄瓜枯萎病菌菌丝形态发育的影响[6]:将黄瓜枯萎病菌菌碟(直径6 mm)与生防菌用接种针挑一环一起接入50 mL PDA培养液,30 ℃、180 r/min 振荡培养2 d,吸取少量培养液,显微镜下观察真菌菌丝的生长情况。以不接生防菌的PDA培养液做对照,设置3 次重复。
生防菌的除菌体发酵滤液对黄瓜枯萎病菌孢子萌发的影响[5-7]:将待测生防菌接入100 mL NB 培养液,37 ℃、180 r/min摇床振荡培养2 d 后,10 000 r/min离心20 min收集上清液,上清液再经0.22 μm微孔滤膜除去菌体,4 ℃冰箱保存,待用。病原菌培养5~7 d,待长出孢子,用无菌水洗制成孢子数密度3×108mL-1的悬浮液。取0.05 mL孢子悬液滴加入灭菌凹玻片,再加入等量生防菌除菌体发酵滤液,于灭菌平皿30 ℃保湿培养,随时观察孢子的萌发情况。对照为孢子悬液加入等量无菌水,各处理重复3 次。
1.2.2 生防菌活性代谢产物分析[8-9]蛋白酶活性检测:将生防菌接在蛋白酶检测平板(A:脱脂奶粉8 g溶于300 mL蒸馏水,115 ℃灭菌10 min,B:琼脂8 g加蒸馏水定容至300 mL,121 ℃灭菌20 min,A 与B 分别灭菌后混合),30 ℃培养3 d后观察,产生清亮透明圈的视为能产生蛋白酶。
几丁质酶活性检测:将生防菌接种于以胶体状几丁质为唯一碳源的培养基(磷酸二氢铵1.0 g、氯化钾0.2 g、水合硫酸镁0.2 g、w=1%胶体状几丁质100 mL、琼脂20 g、蒸馏水1 000 mL,pH 7.0),30 ℃培养3 d,观察有透明圈的则能产生几丁质酶。
纤维素酶活性检测:将生防菌接种至纤维素酶活性测定平板(蛋白胨10 g、酵母粉10 g、羧甲基纤维素钠10 g、氯化钠5 g、磷酸二氢钾1 g、琼脂18 g,pH 7.0),30 ℃培养3 d 后用1 g/L刚果红染1 h,倒掉染液,再用1 mol/L的NaCl浸泡1 h,倒掉,观察有透明圈的则能产生纤维素酶。
β-1,3-葡聚糖酶活性检测:将生防菌接种至苯胺蓝葡聚糖琼脂培养基平板(葡萄糖1.0 g、茯苓粉4.0 g、K2HPO41.0 g、Na2HPO43.0 g、苯胺蓝0.06 g、FeSO4·7H2O 0.5 g、琼脂粉12 g,蒸馏水1 000 mL,pH 6.5),30 ℃培养3~5 d,观察菌落周围颜色变化,平板上产生无色水解透明圈的则能产生β-1,3-葡聚糖酶。
产吲哚乙酸活性检测:将生防菌接入10 g/L胰蛋白胨水溶液(pH = 7.2~7.6) ,培养2 d 后加入3~4滴乙醚后再加入3~5 mL吲哚试剂[二甲氨基苯甲醛8 g溶于760 mL酒精(φ=95%)和160 mL浓盐酸],液面在乙醚与吲哚试剂间产生红色环状物者则证明能产生吲哚乙酸。
产嗜铁素活性检测:将生防菌接入产嗜铁素活性测定平板[A溶液:60.5 mg铬天青S溶于50 mL去离子水+ 10 mL三价铁溶液(1 mmoL/L FeCl3·6H2O,10 mmoL/L盐酸为溶剂)+72.9 mg CTAB溶于40 mL去离子水。上述3个溶液混合定容至100 mL,pH调至中性,121 ℃灭菌20 min。 B溶液:30.24 g Pipes 加入900 mL WA培养基,pH 6.8,121 ℃灭菌20 min。A、B液混合后倒入平板],30 ℃培养3~5 d 后观察,菌落周围能产生橘黄色晕圈者则能产嗜铁素。
解磷活性检测:将生防菌接入解磷活性检测培养平板[Ca3(PO4)24 g、葡萄糖10 g、酵母粉0.5 g、KCl 0.2 g、NaCl 0.2 g、(NH4)2SO40.5 g、MnSO40.03 g、MgSO4·7H2O 0.03 g、FeSO40.002 g、琼脂20 g,定容至1 L,pH 7.0],30 ℃培养3~5 d后观察,有透明圈产生则表明该菌具有解磷作用。
1.2.3 盆栽育苗试验检测复合生防菌剂对黄瓜枯萎病的防治效果[10]病原菌制备:将m(麦麸)∶m(水)=10∶6拌匀、焖料、使充分吸收水分制成麦麸培养基,500 mL三角瓶装量200 g,121 ℃灭菌30 min,将培养好的黄瓜枯萎病菌块接入此灭菌麦麸三角瓶,30 ℃培养7~10 d,待菌丝长满长透后备用。
生防菌剂制备:分别将解淀粉芽胞杆菌SF1103与枯草芽胞杆菌SF1104接入NB培养基(500 mL三角瓶装量200 mL),37 ℃、180 r/min摇床培养48 h得到SF1103与SF1104生防菌剂;复合菌剂是将SF1103和SF1104 2种菌剂等质量混合均匀;单一与混合生防菌剂的有效活菌数均≥109cfu/mL。
黄瓜种子消毒:用50~55 ℃温开水烫种消毒10 min,期间不断搅拌以防烫伤,涝起沥干备用。
黄瓜育苗土:从盛果期的桃树园中取肥沃的表土做为试验用土,去除石子、草根等杂物,过筛,121 ℃高压灭菌1 h,晾凉,均匀拌入NH4H2PO4和(NH4)2SO4,两者的添加量均为0.28 g/kg。
带病土壤:将培养好的黄瓜枯萎病菌麦麸接种体掰细揉匀接入黄瓜育苗土,m(黄瓜枯萎病菌)∶m(育苗土)=1∶50,两者搅拌混合均匀备用。
盆栽育苗试验:于2016年3月11日播种,每个育苗盆装土样1 kg,每盆等距离播种3粒种子,每颗种子旁用牙签标记位置,然后用清水将盆土浇透。对照组:用土为黄瓜育苗土,不添加病原菌,既不进行化学防治也不进行生物防治;处理1:用土为带病土壤,既不进行化学防治也不进行生物防治;处理2、3、4:用土为带病土壤。分别于播种后第3天和第9天用100倍生防菌液(原菌液稀释100倍,有效活菌数107cfu/mL)进行灌种,每粒种子灌30 mL,播种后第33天用生防菌液(有效活菌数107cfu/mL)对出苗的黄瓜苗进行灌根与喷叶,每颗苗50 mL,其中处理2使用SF1103菌剂,处理3使用SF1104菌剂,处理4使用复合菌剂;处理5:用土为带病土壤添加多菌灵,每10 kg土样添加0.55 g。各处理按常规管理进行,例如根据土壤墒情用自来水进行灌溉,并适时进行松土。4月12日开始记录出苗率与发病率。每处理重复3次。
1.3 数据分析
采用SPSS 19.0软件统计分析数据,采用新复极差法(Duncan’s法)进行差异显著性检验。
2 结果与分析
2.1 生防菌对黄瓜枯萎病菌的抑菌作用
平板对峙试验结果显示,生防菌SF1103、SF1104对黄瓜枯萎病菌的生长具有较强的抑制作用,病原菌与生防菌间出现明显抑菌带,SF1103与SF1104的抑菌率分别为70.9%和74.5%(表1)。
2.2 生防菌发酵液对黄瓜枯萎病菌菌丝形态发育的影响
解淀粉芽胞杆菌SF1103、枯草芽胞杆菌SF1104能明显抑制黄瓜枯萎病菌菌丝的生长发育,且抑制效果显著(图1),病原菌菌丝体出现畸形、断裂,菌丝呈串珠状膨大,膨大部位内部的原生质体大量凝聚成团,透过细胞壁,细胞内含物清晰可见,菌丝不再发育。
2.3 生防菌的除菌体发酵滤液对黄瓜枯萎病菌孢子萌发的作用
生防菌解淀粉芽胞杆菌SF1103与枯草芽胞杆菌SF1104的除菌体发酵滤液与病原菌孢子共培养后,病原菌的孢子出现严重畸形,孢子膨大变形成泡囊状,孢子中出现空洞,无法形成正常的芽管和菌丝,生长发育停止(图2)。推测,菌株SF1103、SF1104能产生胞外抑制黄瓜枯萎病菌孢子萌发的活性物质,对该活性产物的鉴定有待进一步研究。
2.4 生防菌SF1103与SF1104活性代谢产物的初步分析
分析生防菌解淀粉芽胞杆菌SF1103与枯草芽胞杆菌SF1104的产酶和产次生代谢物,发现SF1103能产生胞外蛋白酶与纤维素酶,其蛋白酶与纤维素酶的产酶系数(透明圈直径/菌落直径,记作d/D)分别达到5.6与2.7,产酶能力较强;具有解磷活性,但解磷能力较弱;不产几丁质酶和β-1,3-葡聚糖酶;在嗜铁素检测平板上无法生长,不产吲哚乙酸。SF1104同样能产生胞外蛋白酶与纤维素酶,其蛋白酶与纤维素酶的产酶系数分别达到5.4与4.2,产酶能力较强;能产嗜铁素,但产嗜铁素的能力较弱;不产几丁质酶和β-1,3-葡聚糖酶;不具解磷活性,不产吲哚乙酸(表2,表3,图3)。

表1 菌株SF1103与SF1104对黄瓜枯萎病菌菌丝生长的抑制作用Table 1 Inhibition of strain SF1103 and SF1104 aganist mycelial growth of Fusarium oxysporum f.sp.cucumerinum
注:d1、d2、d3均为重复测定值。
Note:d1,d2,d3were all repeated measured value.

A.SF1103;B.SF1104;C.CK

A.SF1103;B.SF1104;C.CK
2.5 盆栽育苗防效试验
分析各处理的出苗率可知,处理4(施用复合菌剂的生防组)与其他5个试验组间均有极显著性差异,其出苗率(90.0%)比对照组(66.7%)提高23.3%,比处理1(无防治组60.0%)提高30.0%,比处理5(化学防治组60.6%)提高29.4%(表4)。处理2、3(施用单一菌剂的生防组)的出苗率与处理1和处理5间也有极显著性差异,其出苗率均提高10%左右。
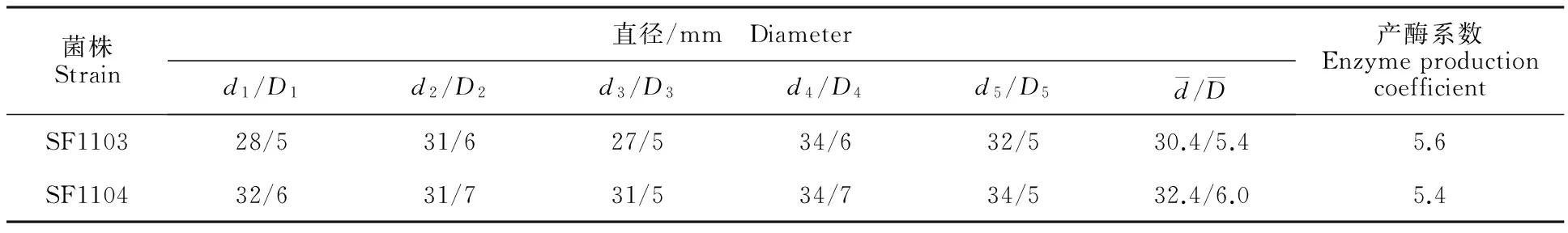
表2 菌株SF1103与SF1104产蛋白酶水平Table 2 Protease production levels of strain SF1103 and SF1104
注:d.透明圈直径;D.菌落直径。同表3.
Notes:d.Transparent circle diameter;D.Colony diameter.The same with table 3.

表3 菌株SF1103与SF1104产纤维素酶水平Table 3 Cellulase production levels of stain SF1103 and SF1104

A.蛋白酶 Protease;B.几丁质酶 Chitinase;C.纤维素酶 Cellulase;D.β-1,3葡聚糖酶 β-1,3-glucanase;E.嗜铁素 Siderophore;F.解磷活性 Acticity of decompose phosphorus;G.吲哚乙酸 IAA a.SF1103;b.SF1104
图3菌株SF1103和SF1104产水解酶与次生代谢物的活性检测
Fig.3ActivityofhydrolyticenzymesandsecondarymetabolitesproductiontestingofstrainSF1103andSF1104
分析各处理发病率可知,生防组与化学防治组的发病率均与处理1(无防治组)间存在显著性差异,发病率大幅下降,施用复合菌剂的生防组下降25.9%,施用单一菌剂的生防组分别下降23.8%与24.2%。而施用复合菌剂的生防组与化学防治组的发病率间无显著性差异。
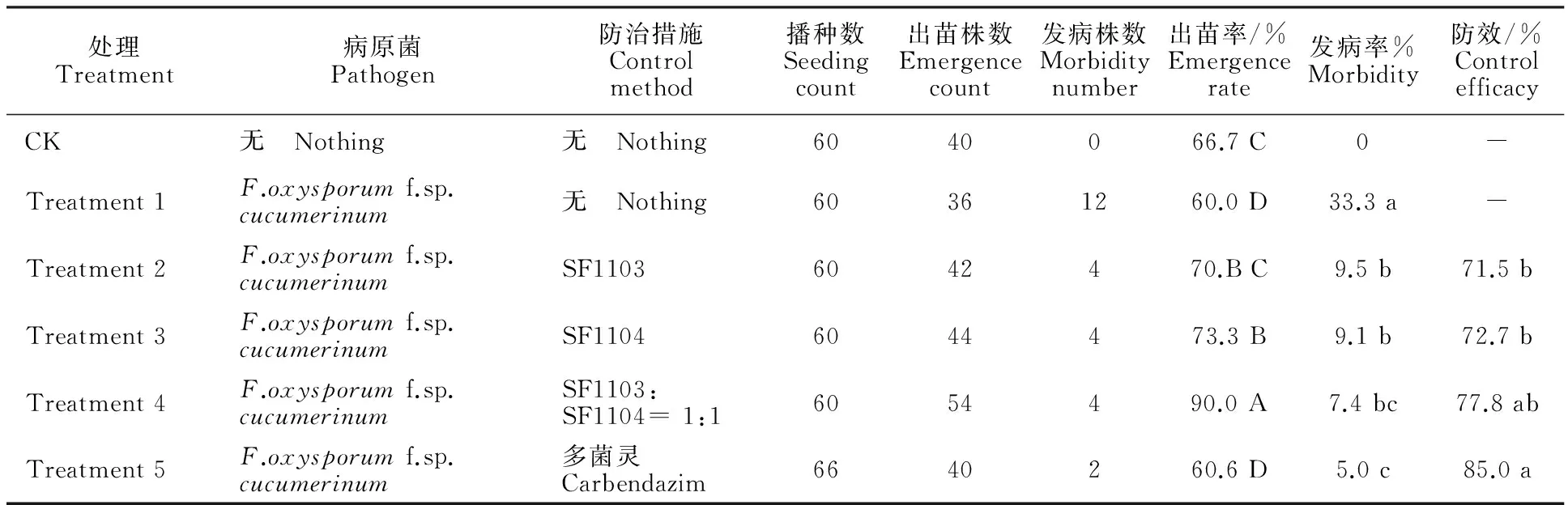
表4 生防菌防治黄瓜枯萎病的盆栽防效Table 4 Control efficacy of bio-control bacteria on F.oxysporum f.sp.cucumerinum in potted test
注:数据为3次重复试验的平均值。同列数据后不同小写字母表示经Duncan’s法检验在P<0.05水平差异显著。同列数据后不同大写字母表示经Duncan’s法检验在P<0.01水平差异极显著。
Notes:Data in the table are averages of three repeated tests.Different lowercase letters in the same column indicate significant difference atP<0.05 level by Duncan’s test.Different uppercase letters in the same column indicate significant difference atP<0.01 level by Duncan’s test.
分析盆栽防效可知,施用复合菌剂的生防组与化学防治组的防效间无显著性差异,其防效达到77.8%,比化学防治组(85.0%)低7.3%;施用单一菌剂的生防组与化学防治组的防效间均有显著性差异。
综上所述,生防菌SF1103与SF1104能有效防治黄瓜枯萎病,并对黄瓜出苗有明显促进作用;SF1103与SF1104的复合菌剂表现出比单一菌剂更优的防病与促生效果。
3 结 论
解淀粉芽胞杆菌与枯草芽胞杆菌是生防芽胞杆菌属中被研究最广泛并且被证实对多种植物病原菌具有抑制作用的2种芽胞杆菌,它们分泌的水解酶及次生代谢物是生防因子,与其生物防治效果密切相关[8],目前,美国、德国、澳大利亚、日本及中国都已有其相关的生防活菌制剂产品进行登记并商品化生产[3]。
本试验对2株防治黄瓜枯萎病的生防细菌,解淀粉芽胞杆菌(SF1103)和枯草芽胞杆菌(SF1104)进行深入研究,初步明确其拮抗方式:2株生防菌通过向胞外分泌高活力的蛋白酶与纤维素酶以及嗜铁素致使病原菌的菌丝体出现畸形、断裂,生长发育停止;致使病原菌孢子的原生质体凝聚形成颗粒和空洞,孢子严重畸形,生长发育停止,无法形成正常的芽管和菌丝。本研究结论与邢介帅等[5]、王芳等[8]、戴秀华等[11]、林东等[12]的研究结论均一致。
本研究显示,施用SF1103与SF1104复合菌剂的生物防治组的出苗率为90.0%,较对照组提高23.3%,较无防治组提高30.0%,较化学防治组提高29.4%;发病率较无防治组下降25.9%,盆栽防效达到77.8%;另外,施用复合菌剂的盆栽防效高于两个单一菌剂的防效,也说明SF1103与SF1104配合施用对黄瓜枯萎病的防治具有协同增效作用,这也与两菌株能分别分泌嗜铁素以及具有解磷活性相印证。综上所述,生防菌SF1103与SF1104能有效防治黄瓜枯萎病,并且对黄瓜的出苗生长具有促进作用,具有深入研究的价值和农业推广应用的潜力。
Reference:
[1]闫 霜,吴洪生,周晓冬,等.黄瓜枯萎病生物防治研究进展[J].山东农业科学,2011(1):86-92.
YAN SH,WU H SH,ZHOU X D,etal.Progress of biological control for cucumber fusarium wilt[J].ShandongAgriculturalSciences,2011(1):86-92(in Chinese with English abstract) .
[2]蒲子婧,张艳菊,刘 东,等.黄瓜枯萎病生物防治策略研究进展[J].中国蔬菜,2011(6):9-14.
PU Z J,ZHANG Y J,LIU D,etal.Research progress in biological control strategies forFusariumwilt of cucumber[J].ChinaVegetables,2011(6):9-14(in Chinese with English abstract).
[3]陈志谊,刘永峰,刘邮洲,等.植物病害生防芽孢杆菌研究进展[J].江苏农业学报,2012,28(5):999-1006.
CHENG ZH Y,LIU Y F,LIU Y ZH.,etal.Research progress in biocontrol ofBacillusspp.against plant diseases[J].JiangsuJournalofAgriculturalSciences,2012,28(5):999-1006(in Chinese with English abstract) .
[4]范秀容,沈 萍,李广武.微生物学实验 [M].第3版.北京:高等教育出版社,1999:214-227.
FAN X R,SHEN P,LI G W.Experiment of Microbiology [M].3rd Edition.Beijing:Higher Education Press,1999:214-227( in Chinese).
[5]邢介帅,李 然,赵 蕾,等.产蛋白酶生防细菌的筛选及其对病原真菌的拮抗作用[J].西北农业学报,2008,17(1):106-109.
XING J SH,LI R,ZHAO L,etal.Studies on identification of one high protease producing bacteria for biocontrol and the antaganism against plant pathogens[J].ActaAgriculturaeBoreali-occidentalisSinica,2008,17(1):106-109(in Chinese with English abstract).
[6]王媛媛,段玉玺,陈立杰.黄瓜根际细菌J352对大豆根腐病菌的作用[J].中国生物防治,2006,22(S1):89-93.
WANG Y Y,DUAN Y X,CHEN L J.Bacteria J352 from rhizosphere of cucumber against pathogens of soybean root rot[J].ChineseJournalofBiologicalControl,2006,22(S1):89-93(in Chinese with English abstract).
[7]方中达.植病研究方法[M].第3版.北京:中国农业出版社,1998:151-152.
FANG ZH D.Plant Disease Research Methods[M].3rd Edition.Beijing:China Agriculture Press,1998:151-152(in Chinese).
[8]王 芳,吕 顺,刘文清,等.香蕉枯萎病生防菌的筛选及生防物质分析[J].江西农业大学学报,2014,36(6):1264-1269.
WANG F,LÜ SH,LIU W Q,etal.Screening of antagonistic bacteria againstFusariumoxysporumf.sp.cubenseand analysis of the substances associated with biological control [J].ActaAgriculturaeUniversitisJiangxiensis,2014,36(6):1264-1269(in Chinese with English abstract).
[9]张 斌,乔俊卿,梁雪杰,等.番茄枯萎病菌和青枯病菌拮抗细菌的评价[J].植物保护学报,2015,42(3):353-361.
ZHANG B,QIAO J Q,LIANG X J,etal.Evaluation of antagonistic bacteria againstFusariumoxysporumf.sp.lycopersiciandRalstoniasolanacearum[J].ActaPhytophylacicaSinica,2015,42(3):353-361(in Chinese with English abstract).
[10]王玉霞,李 晶,张淑梅,等.芽孢杆菌对黄瓜根腐病的防治效果[J].生物技术,2004,14(3):57.
WANG Y X,LI J,ZHANG SH M,etal.Inhibitive effects of bacillus on cucumber wilt pathogen [J].Biotechnology,2004,14(3):57(in Chinese).
[11]戴秀华,张荣胜,陈志谊,等.解淀粉芽胞杆菌Lx-11生物学特性研究[J].中国生物防治学报,2014,30(4):573-580.
DAI X H,ZHANG R SH,CHEN ZH Y,etal.The biological characterization ofBacillusamyloliquefaciensLx-11[J].ChineseJournalofBiologicalControl,2014,30(4):573-580(in Chinese with English abstract).
[12]林 东,徐 庆,刘忆舟,等.枯草芽孢杆菌S0113分泌蛋白的抑菌作用及抗菌蛋白的分离纯化[J].农业生物技术学报,2001,9(1):77-80.
LIN D,XU Q,LIU Y ZH,etal.The antibacterial effect to the secreted peptide fromBacillussubtilisSO113 and separation and purification the antibacterial peptides [J].JournalofAgriculturalBiotechnology,2001,9(1):77-80(in Chinese with English abstract).
AntagonismofBiocontrolBacteriaSF1103andSF1104onWiltPathogeninCucumber
ZHAO Wenjuan,FU Bo,XU Shengyun and REN Ping
(Biological Agriculture Institute of Shaanxi,Enzyme Engineering Research Center of Shaanxi Province,Northwest Biological Agriculture Center,Chinese Academy of Sciences,Xi’an 710600,China)
To understand the antagonism of SF1103 and SF1104 strains on wilt pathogen in cucumber,we studied the antagonism of the two strains onFusariumoxysporumf.sp.cucumerinumvia the plate confrontation test,the hyphae mixed cultivation test,and the test of spore cultivation using the concave slide method.We analyzed the ability of secrete enzymes and secondary metabolite of the two strains using specific plate culture method,and we also analyzed the control efficacy of the two strains onF.oxysporumf.sp.cucumerinumin potted test.The results showed that the hyphae and spores ofFusariumoxysporumf.sp.cucumerinumwere severely deformed and inhibited under the treatments of the two bacteria.Both of the two strains could produce protease and cellulose.The strain (SF1103) was able to decompose phosphorus,and the strain (SF1104) could produce siderophore.The results of control effect of the potted plant showed that the emergence rate of cucumbers under the treatment of the mixed biocontrol agents increased 23.3% and 29.4% higher than that of the blank control and chemical control,respectively.The morbidity of potted plants treated with biological control agents dropped 25.9% compared with non-control group,the control efficacy was 77.8%.SF1103 and SF1104 strains not only showed strong antagonism on wilt pathogen in cucumber,but also promoted the growth of germination.These strains could be exploited so as to become effective biological agents in the future.
Bio-control bacteria; Cucumber wilt; Antagonism
2017-01-12
2017-04-17
Shaanxi Agricultural Science and Technology Innovation Projects (No.2016NY-189); Xi’an Agricultural Science and Technology Innovation Projects [No.NC1314(1)].
ZHAO Wenjuan,female,associate researcher.Research area:applied microbiology.E-mail:myszhwj@126.com
S436.421.13;Q939.92
A
1004-1389(2017)10-1537-07
日期:2017-10-18
网络出版地址:http://kns.cnki.net/kcms/detail/61.1220.S.20171018.1733.034.html
2017-01-12
2017-04-17
陕西省农业科技创新计划(2016NY-189);西安市农业科技创新计划[NC1314(1)]。
赵文娟,女,副研究员,研究方向为应用微生物。E-mail:myszhwj@126.com
徐升运,男,研究员,研究方向为生物肥料。E-mail:xshy1389@163.com
CorrespondingauthorXU Shengyun,male,research fellow.Research area:bio-fertilizer.E-mail:xshy1389@163.com
(责任编辑:郭柏寿Responsibleeditor:GUOBaishou)
