一株近平滑假丝酵母的分离、鉴定和产油的研究
2017-11-11谢鑫磊林源锋何东平
谢鑫磊 林源锋 鲁 昊 田 华 袁 博 郑 操 陈 涛 何东平
(武汉轻工大学食品科学与工程学院1,武汉 430023)(湖北天基生物能源发展有限公司2,汉川 432300)(中国科学院武汉病毒研究所3,武汉 430071)
一株近平滑假丝酵母的分离、鉴定和产油的研究
谢鑫磊1林源锋1鲁 昊2田 华1袁 博1郑 操1陈 涛3何东平1
(武汉轻工大学食品科学与工程学院1,武汉 430023)(湖北天基生物能源发展有限公司2,汉川 432300)(中国科学院武汉病毒研究所3,武汉 430071)
为了制备生物柴油而获得高产油脂的酵母,分离出1株产油酵母,利用分子生物学技术对其RNA基因内转录区(ITS区)进行了克隆测序,并与GenBank中已有的菌株基因序列进行比对;同时,对该菌株生长发育和油脂合成进行了研究;对生物量、糖氮代谢、油脂含量以及脂肪酸组分进行了检测分析。结果表明:该菌株ITS序列长度为479 bp,与GenBank中近平滑假丝酵母相比较同源率接近100%,形态结果和分子生物学鉴定表明该菌株为近平滑假丝酵母;该菌在0~12 h期间菌体数量稳定增长,糖氮消耗明显为近平滑假丝酵母的发酵适应期;12~48 h,此时菌种快速繁殖,糖氮消耗非常显著,为近平滑假丝酵母的对数期;48~120 h,菌体数量保持稳定基本不再增长,糖氮消耗稳定为近平滑假丝酵母的稳定期;120 h以后,菌体数量减少,糖氮基本消耗完毕为近平滑假丝酵母的衰退期;在120 h左右胞内油脂积累达到最大值,油脂产量为4.5 g/L,含油率约为22%,脂肪酸组成主要以油酸为主,并含有少量棕榈酸和亚油酸。因此,该菌作为油脂菌株生产生物柴油具有一定前景,为以后调整培养基含量来增加菌种油脂产量提供了参考。
近平滑假丝酵母 分离鉴定 产油
微生物油脂又称单细胞油脂,是由酵母、霉菌、细菌和藻类等微生物在一定条件下利用碳水化合物和普通油脂作为碳源在菌体内产生的大量油脂[1]。利用微生物生产油脂,与传统的油脂生产工艺相比,除具有油脂含量高外,还有许多优点。微生物细胞增殖快,生产周期短;微生物生长所需的原料丰富,价格便宜,如淀粉、糖类、甚至食品工业和造纸行业的废弃物,从而保护了环境;用微生物方法生产油脂,比农业生产油脂所需的劳动力少,同时不受季节、气候变化的限制;能连续大规模生产,生产成本低;并且可以利用细胞融合、细胞诱变等高科技方法,使微生物生产出比动、植物油脂更符合人们需要的高营养油脂或某些特定脂肪酸的油脂[2]。
近平滑假丝酵母(Candidaparapsilosis),属假丝酵母属[3],可产生多种代谢产物,如还原型谷胱甘肽[3]、氧化还原酶[4]及木糖还原酶[5]等,是具有催化能力的菌株[6-7],也可作为发酵剂用于肉制品发酵[8],因此具有较好的发展前景。目前,国内外对于近平滑假丝酵母的研究多集中于医学方面,主要是对假丝酵母感染人体造成妇科病的研究,以及对还原酶等生物催化剂方面的研究,而对于其生物量以及是否产油则研究较少。本试验通过筛选产油菌株得到1株酵母,利用分子生物学技术对其进行菌种鉴定,并对培养条件、形态学特征、生物量和产油进行了研究。
1 材料和方法
1.1 试验材料
1.1.1 菌株与试剂
近平滑假丝酵母(Candidaparapsilosis)分离于实验室其他产油菌株,保存于本实验室,菌号为20164071。
葡萄糖:天津博迪化工股份有限公司;酵母膏:北京奥博星生物技术有限责任公司;蛋白胨:天津市大茂化学试剂厂;酵母提取物、色谱级正己烷、盐酸、石油醚、乙醚:天津市科密欧化学试剂制造有限公司;50%三氟化硼-甲醇:山东西亚化学工业有限公司;无水乙醇:天津天力化学试剂有限公司;TSP101基因组抽提试剂盒:北京擎科新业生物技术有限公司。
1.1.2 培养基
固体筛选培养基(g/L):蛋白胨5,葡萄糖10,酵母膏3,麦芽提取物3,琼脂20,pH 6.5。种子培养基(g/L):蛋白胨5,葡萄糖10,酵母膏3,麦芽提取物3,pH 6.5。发酵培养基在种子培养基的基础上加大了各成分的用量。
1.1.3 仪器
Agilent SP-2560气相色谱仪:安捷伦科技(中国)有限公司;SPX-150C恒温恒湿箱、GZX-9070MBE电热鼓风干燥箱:上海博讯实业有限公司医疗设备厂;HYQ-150S全温摇床:武汉汇诚生物科技有限公司,YM75立式压力蒸汽灭菌器:上海三申医疗器械有限公司;XSP-BM-2CA光学生物显微镜:宁波永新光学有限公司;RE-52C 旋转蒸发器:上海亚荣生化仪器厂;TDZ5-WS台式低速离心机:上海安亭科学仪器厂。
1.2 试验方法
1.2.1 产油菌株的筛选
将长势良好的斜面菌种挑取1环,接种于固体筛选培养基中,培养条件27 ℃。然后经多次转接活化之后挑选生长良好的单菌落接种于种子培养基中,培养条件27 ℃,180 r/min,培养48 h,然后以10%的接种量接种于装有100mL发酵培养基的500 mL三角瓶中,培养条件27 ℃,180 r/min,培养96 h。
1.2.2 菌株鉴定方法
1.2.1.1 基因组提取
将菌株挑取到无菌的超纯水中,用移液器充分混匀,高温加热到90 ℃,释放基因组。然后通过基因组抽提试剂盒,抽提得到该菌的基因组DNA。
1.2.1.2 ITS区扩增
将扩增好的基因组样品通过特异性的鉴定引物,扩增出目的片段。体系为:TSINGKE 金牌MIX 46μL,ITS1 1 μL,ITS4 1 μL,基因组2 μL。扩增出片段大小为 500~700 bp的ITS区产物。
1.2.1.3 PCR产物纯化及测序
将PCR产物通过琼脂糖凝胶电泳后,切下目的条带。然后通过(GE0101)DNA凝胶回收试剂盒回收。然后将纯化后的产物通过ABI的测序mix,PCR纯化产物以及ITS引物,进行测序PCR扩增。将扩增后的产物通过ABI3730xl测序仪进行检测,并将检测结果整理后发送。
1.2.3 发酵过程中糖氮代谢的测定
1.2.3.1 含糖量的测定
蒽酮-硫酸法测定总糖
制定标准曲线:分别取2 mg/mL葡萄糖溶液0.2、0.4、0.6、0.8、1.0 mL,用蒸馏水补到2.0 mL,空白管吸取2 mL蒸馏水。分别加入8.0mL蒽酮试剂,迅速浸入冰水浴中冷却,各管加完后一起浸入沸水浴中10分钟,封口防政法,取出用自来水冷却,室温放置10 min,于620 nm处比色。以吸光度为纵坐标,糖含量为横坐标,得标准曲线。
样品含量测定:取样品溶液2.0 mL,加入8 mL蒽酮试剂,同标准曲线制作,比色测定记录吸光度,根据标准曲线计算糖含量。对不同时间培养液从0 h起依次进行测定,记录数据,绘制培养液的糖代谢曲线[10]。
1.2.3.2 含氮量的测定
每隔12 h从摇瓶中取适量发酵液,用四层纱布过滤后取2 mL加入到装有10 mL蒸馏水的烧杯中,再加入1滴甲基红。用0.3 mol/L的硫酸调制红色,然后以0.1 mol/L氢氧化钠溶液调制橙黄色,再加入4 mL18%中性甲醛。静置10分钟后加入8滴酚酞,用0.1 mol/L氢氧化钠滴定至微红后记录氢氧化钠使用量[11]。发酵液中氮含量的计算公式:
N= (0.1×V×0.014)/2×100
式中:N为氮含量;V为氢氧化钠消耗的体积。
1.2.4 发酵过程中pH值测定
从菌株加入发酵瓶开始计时,每隔12 h取少量发酵液用pH计测其pH值。
1.2.5 生物量测定
近平滑假丝酵母的生物量以细胞干重计。取培养好的菌体发酵液100 mL于预先称重好的离心管中以4 000 r/min离心10 min,弃上清液,沉淀的菌泥用钥匙刮出置于18 cm大平皿中,然后再往离心管中加入适量蒸馏水继续离心一次,取出剩余菌泥。将菌泥置于烘箱中于60 ℃下烘干至质量恒定,称质量。生物量(g/L)的计算公式为:

1.2.6 油脂的提取及产量的测定
油脂的提取:将近平滑假丝酵母发酵液经过离心后,去除上清液,向所得藻泥中加入100 mL 6 mol/L盐酸,震荡混匀,室温放置1 h后沸水浴加热8 min后置于-20 ℃迅速冷却30 min,倒入分液漏斗中,加入150 mL无水乙醇震荡再加150 mL乙醚与150 mL石油醚萃取,收集有机层于已称重的试管中,记录空试管质量为m1;加热使有机溶剂挥发,称重,记录此时试管质量为m2,油脂产量(g/L)和含油率计算公式为:


1.2.7 油脂成分的分析
1.2.7.1 待测样品的处理: 精密称取0.2 g油脂于20 mL试管中,加入0.5 mol/L的NAOH-CH3OH溶液2 mL,边振荡边在60 ℃水浴中保温30 min,冷却后加入50%的BF3-CH3OH溶液2 mL,边振荡边在60 ℃水浴下保温3 min,加入2 mL正己烷,混匀,以2 000 r/min离心1 min,取上清液。然后用进样针经过滤膜过滤之后注射进进样瓶中待测。
1.2.7.2 油脂脂肪酸组成分析:选用Agilent SP-2560色谱柱(100 m×25 μm,0.2 μm);升温程序:初始温度100 ℃,保持4 min,然后以3 ℃/min升温至230 ℃,保持20 min,载气(N2)流速25 mL/min,压力2.4 kPa,进样量1 μL;分流比30∶1
2 结果与分析
2.1 菌种筛选和鉴定
菌株产生的单菌落呈圆状黏稠白色如图1所示。显微镜下单细胞个体呈圆形或椭圆形,未见芽殖及假丝菌,如图2所示。
近平滑假丝酵母ITS区序列检测结果:
CTTCCGTTAGCACTTACTGCATTTTTTCTTACA-CATGTGTTTTTCTTTTTTTGAAAACTTTGCTTTGGTA-GGCCTTCTATATGGGGCCTGCCAGAGATTAAACTC-AACCAAATTTTATTTAATGTCAACCGATTATTTAAT-AGTCAAAACTTTCAACAACGGATCTCTTGGTTCTCG-CATCGATGAAGAACGCAGCGAAATGCGATAAGTAA-TATGAATTGCAGATATTCGTGAATCATCGAATCTTT-GAACGCACATTGCGCCCTTTGGTATTCCAAAGGGCA-TGCCTGTTTGAGCGTCATTTCTCCCTCAAACCCTCGG-GTTTGGTGTTGAGCGATACGCTGGGTTTGCTTGAAA-GAAAGGCGGAGTATAAACTAATGGATAGGTTTTTTC-CACTCATTGGTACAAACTCCAAAACTTCTTCCAAAT-TCGACCTCAAATCAGGTAGGACTACCCGCTGAACT-AAGCATATCAAAAA
测序结果表明所测菌ITS区序列长度为479 bp,经比对,该菌ITS区序列与GenBank中登录的已知菌株Candida parapsilosis H142B(KP674827.1),Candida parapsilosis n63b(KP675664.1),Candida parapsilosis M180A(KP675355.1),Candida parapsilosis M83A(KP675285.1),Candida parapsilosis H275B(KP674969.1),Candida parapsilosis H267C(KP674958.1),Candida parapsilosis H230B(KP674908.1)同源率均为100%。依据形态学并结合18sRNA序列比对结果,鉴定该菌为近平滑假丝酵母。

图1 菌落形态

图2 菌株显微形态
2.2 近平滑假丝酵母的生长曲线
从图3中可见,0~12 h过程中,图中曲线平滑前进,菌体数量稳定增长,可以确定为近平滑假丝酵母的发酵适应期;12~48 h过程中,曲线快速上升,此时菌种快速繁殖,可以确定此期间为近平滑假丝酵母的对数期;48~120 h过程中,菌体数量保持稳定基本不再增长,此期间为近平滑假丝酵母的稳定期;120 h以后,发现曲线有下降趋势,菌体数量减少,说明此期间为近平滑假丝酵母的衰退期。

图3 近平滑假丝酵母生长曲线图
2.3 糖氮代谢及pH值的变化
从图4可以看出,发酵液的pH值是逐渐下降的,说明近平滑假丝酵母在发酵过程中是产酸的,并且在24~84 h这一过程中pH值迅速下降之后趋于平稳,说明这一时间段内近平滑假丝酵母大量产酸,之后在摸索调配最佳培养基时我们可以在这一时间段内调节发酵液的pH值使其稳定在中性。从图5和图6可以看出,在生长期以及对数期,培养基中糖和氮的消耗都非常明显,基本都是到了84 h时全部消耗殆尽了。油脂的产生需要糖来转化,而含氮量也影响着微生物的生长,因此在后续优化培养基的过程中我们可以使适当提高含糖量以及含氮量,或者在菌种糖氮消耗完时适当补充一定的碳源和氮源,以期使得菌种个体生长的更大能产生更多的油出来。

图4 不同时期发酵液pH值

图5 不同时期发酵液糖浓度
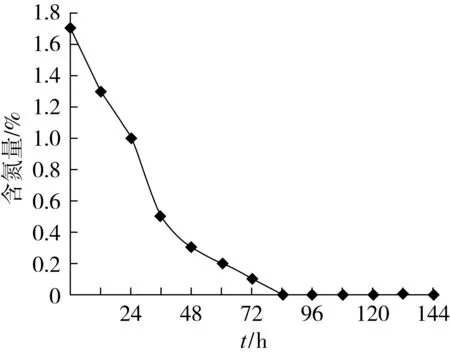
图6 不同时期发酵液氮浓度
2.4 油脂产量和得油率
通过图7和图8可以看出近平滑假丝酵母发酵120 h的时候油脂产量达到最大,而得油率也在此时达到最高。发酵120 h之后油脂产量和得油率都开始小幅度下降。所以近平滑假丝酵母最佳的发酵时间约为120 h。

图7 不同时期油脂产量

图8 不同时期得油率
2.5 近平滑假丝酵母胞内油脂脂肪酸组分测定
通过图9和表1,可以得到近平滑假丝酵母胞内油脂成分的组成结果。从结果发现脂肪酸组成与橄榄油的脂肪酸组成相似。成分组成以油酸为主,并含有少量的棕榈酸和亚油酸。
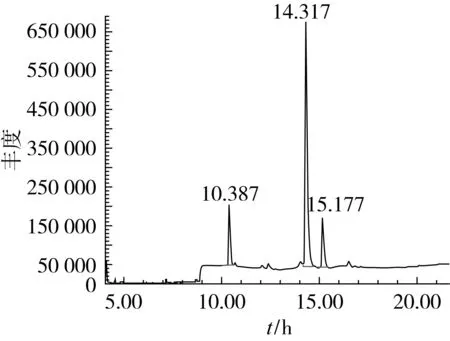
图9 近平滑假丝酵母胞内油脂脂肪酸气相-质谱联用(GC-MS)总离子流图

脂肪酸种类脂肪酸相对质量分数/%C16∶013.7C18∶173.2C18∶213.1
4 结论
经培养基培养分离、筛选的菌株,利用菌体形态、菌落特征以及通过分子生物学进行ITS区检测得出菌株为近平滑假丝酵母。对近平滑假丝酵母的生物量、糖氮代谢、pH值、油脂含量以及脂肪酸组成进行了分析,得出在120 h左右胞内油脂积累达到最大值,油脂产量为4.5 g/L,含油率约为22%。确定近平滑假丝酵母所产油脂的脂肪酸组成与橄榄油相似。该菌作为油脂菌株生产生物柴油具有一定前景,本研究为后续继续研究近平滑假丝酵母,调整发酵培养基成分以增加油脂产量提供了借鉴。
[1]颜治,陈晶,微生物油脂及其开发利用研究进展[J].粮食与油脂,2003(7):13-15
Yan Z, Chen J. Research advance on microbial oils and their exploitation and utilization[J].Cereals and Oils,2003(7):13-15
[2]薛飞燕,张栩,谭天伟.微生物油脂的研究进展及展望[J].生物加工过程,2005,3(1):23-27
Xue F Y , Zhang X , Tan T W. Research advance and prospect in microbial oils[J].Chinese Journal of Bioprocess Engineering,2005,3(1):23-27
[3]潘欣.1株近平滑假丝酵母的分离及其鉴定[J].微生物学杂志,2011,31(1):43-46
Pan X. Isolation,purification and identification of aCandidaparapsilosisstrain[J]. Journal of Microbiology, 2011, 31(1): 43-46
[4]艾丽静,饶志明,沈微,等.产还原型谷胱甘肽酵母菌的筛选与初步鉴定[J].食品与发酵工业,2006,32(3):18-21
Ai L J, Rao Z M, Shen W, et al. Isolation and primary identification of glutathion-producing yeast strains[J]. Food and Fermentation Industries,2006,32(3):18-21
[5]张荣珍.近平滑假丝酵母立体选择性还原酶表达、结构解析与改造[D].无锡:江南大学,2009
Zhang R Z. Expression, structure determination and rational design of the stereospecific reductases fromCandidaparapsilosis[D]. Wuxi:Jiangnan University,2009
[6]曲有鹏.近平滑假丝酵母木糖还原酶基因的克隆及表达研究[D].哈尔滨:哈尔滨工业大学,2007
Qu Y P. Cloning and protein expression of the XYL1 gene encoding xylose reductase fromCandidaparapsilosis[D].Haerbin:Haerbin institution of technology,2007
[7]娄文勇,郭强,郁惠蕾,等.近平滑假丝酵母细胞催化乙酰基三甲基硅烷不对称还原反应[J].催化学报,2009,30(12):1276-1280
Lou W Y, Guo Q, Yu H L, et al. Asymmetric reduction of acetyltrimethylsilane catalyzed byCandidaparapsilosis CCTCC M203011 cells[J].Chinese Journal of Catalysis,2009,30(12):1276-1280
[8]任艳秋,徐岩,穆晓清, 等.醇类物质诱导培养改善近平滑假丝酵母(Candida parapsilosis) 去消旋转化能力[J].过程工程学报,2005,5(5):554-557
Ren Y Q, Xu Y, Mu X Q, et al.Improving enantioselectivity of Candida parapsilosis for deracemization of (R,S)-1-phenyl-1,2-ethanediol by addition of alcohols during cell cultivation[J].The Chinese Journal of Process Engineering,2005,5(5):554-557
[9]赵俊仁,孔保华.自然发酵风干肠中酵母菌生产性能的研究[J].食品科技,2010,35(10):27-31
Zhao J R, Kong B H. The fermentation properties of yeast isolated from the Chinese-style naturally dry fermented sausages[J].Food Science and Technology,2010,35(10):27-31
[10]佘隽,田华,陈涛,等.高产DHA寇氏隐甲藻突变株的筛选[J].食品科学,2013,34(17):230-235
She Jun,Tian Hua,Chen Tao, et al. Screening of high-yield DHA-producing Crypthecodiumcohnii Mutant[J].Food Science,2013,34(17):230-235
[11]赵书林,何东平,陈涛,等.寇氏隐甲藻突变株的糖、氮代谢对产油的影响[J].中国粮油学报,2014,29(11):65-69
Zhao S L, He D P, Chen T, et al. The effects of sugar and nitrogen metabolism on oil production by mutant strains ofCrypthecodiniumCohnii[J]. Journal of the Chinese Cereals and Oils Association,2014,29(11):65-69.
Seperation, Identification and Oil Production of aCandidaParapsilosisStrain
Xie Xinlei1Lin Yuanfeng1Lu Hao2Tian Hua1Yuan Bo1Zheng Cao1Chen Tao3He Dongping1
(College of Food Science and Engineering, Wuhan Polytechnic University1, Wuhan 430023) (Hubei Tianji New Energy Limited by Share LTD2, Hanchuan 432300) (Wuhan Institute of Virus, Chinese Academy of Sciences3, Wuhan 430071)
In order to gain the yeast with high oil yield for preparing biodiesel and isolating one yeast strain, cloning and sequencing of its internal transcribed region (ITS region) of RNA gene was performed by molecular biology technique. Also it is compared with the existing gene sequences in GenBank. At the same time, the growth and development of this strain were studied. The biomass, carbohydrate and nitrogen metabolism, lipid content and fatty acid composition were also test and analyzed in our study. Results showed that firstly the strain ITS sequence length was 479 bp, compared with theCandidaparapsilosisin GenBank, the homology rate was close to 100%. Results of morphological and molecular biology identification showed that the strain wasCandidaparapsilosis. Secondly the number of bacteria increased steadily during 0~12 h. Sugar and nitrogen consumed obviously. It is the adaptation period ofCandidaparapsilosis; during 12~48 h the bacterias propagated rapidly. Sugar and nitrogen consumption were very significant. It is the Logarithmic phase ofCandidaparapsilosis; during 48~120 h, the number of bacteria remained stable and no longer increased. Sugar and nitrogen consumed stably. It is the stable phase ofCandidaparapsilosis; after 120 h, the number of bacteria decreased. Sugar and nitrogen were all consumed. It is the recession period ofCandidaparapsilosis; thirdly the accumulation value of intracellular oil reached the maximum at 120 h. Oil yield was 4.5 g/L, and the oil content was about 22%, the fatty acid composition was mainly oleic acid, and contained a small amount of palmitic acid and linoleic acid. It can be seen from the results that there are some prospects of this yeast for the production of bio diesel oil. This paper lays a foundation for adjusting the content of medium to increase the oil yield.
candidaparapsilosis,separation and identification,oil production
Q939
A
1003-0174(2017)10-0100-06
2017-04-27
谢鑫磊,男,1993年出生,硕士,微生物油脂
何东平,男,1957年出生,教授,粮食、油脂及植物蛋白
