绿茶醇提物对番茄红素抗紫外线保护作用的研究
2017-11-10赵秀红任建军祁冰洁公勋刘晓迪
赵秀红,任建军,祁冰洁,公勋,刘晓迪
(沈阳师范大学粮食学院,辽宁沈阳110034)
绿茶醇提物对番茄红素抗紫外线保护作用的研究
赵秀红,任建军,祁冰洁,公勋,刘晓迪
(沈阳师范大学粮食学院,辽宁沈阳110034)
紫外线可导致番茄红素降解和氧化。利用超声波提取技术,乙醇为溶剂提取绿茶中紫外线吸收剂,经L9(34)正交试验优化提取工艺,研究绿茶提取物对番茄红素抗紫外线保护作用,并通过拉曼光谱技术考察绿茶提取物对番茄红素结构的影响。结果表明:最佳提取工艺为乙醇浓度为70%,超声温度50℃,超声时间40 min,超声功率160 W,番茄红素经绿茶中紫外线吸收剂保护后紫外灯照射损失率仅为19.10%;拉曼光谱显示,绿茶中紫外线吸收剂与番茄红素的复合没有改变原番茄红素的结构,可作为番茄红素光保护剂用以提高其稳定性。
绿茶;紫外线吸收剂;番茄红素;正交试验;拉曼光谱
绿茶,又称不发酵茶,是以适宜茶树新梢为原料,经杀青、揉捻、干燥等工艺过程制成的茶叶,其干茶色泽和冲泡后的茶汤、叶底以绿色为主调。现代科学研究证实,绿茶提取液中含有大量的茶多酚、氨基酸、叶绿素等物质,且维生素等营养成分含量也较高,这些物质对预防癌症、杀菌、消炎和防衰老等方面具有特殊的功效[1-4]。除此之外,绿茶提取物还有抗紫外辐射作用,陈晓明等证明蒙山绿茶和老鹰茶提取液在长波紫外线区域有较强吸收能力,可抵抗紫外线辐射并修复受损组织细胞[5]。
番茄红素(Lycopene)又称为ψ,ψ-胡萝卜素,是类胡萝卜素(Carotenoid)的一种,具有极强的抗氧化、防癌抗癌、抑制肿瘤、预防心血管疾病活性[6-11]。目前,番茄红素对人体健康的功效越来越引起研究者的关注,与番茄红素健康相关产品的研发已成为国际上功能性食品和新药领域中的一个热点。但是番茄红素易受紫外光影响而快速氧化损失[12-14],严重影响了使用效果,因此,提高番茄红素在产品中的稳定性[15-18],扩展其应用领域具有重要意义。
本文以市售绿茶为原料,采用乙醇做溶剂超声波技术提取绿茶中紫外线吸收剂,利用正交试验,优化绿茶中紫外线吸收剂的提取工艺,确定提取条件,并通过拉曼光谱技术分析[19-20]番茄红素和保护后番茄红素的分子结构,考察绿茶提取物对番茄红素结构的影响,为进一步提高番茄红素功能利用提供依据。
1 材料与方法
1.1 材料与仪器
绿茶:广西石乳茶业有限公司;无水乙醇、乙酸乙酯(均为国产分析纯):沈阳试剂厂;番茄红素(纯度≥90%):上海晶纯生化科技股份有限公司。
DHG-9146A型电热恒温鼓风干燥箱:上海精宏实验设备有限公司;TB-114电子天平:北京赛多利斯仪器系统有限公司;KQ5200DB型数控超声波清洗器:昆山市超声仪器有限公司;T5-8W紫外灯:中山市古镇欧昂灯饰电器厂;UV-9000型紫外可见分光光度计:上海元析仪器有限公司;HR800拉曼光谱仪:法国HORIBA Jobin Yvon公司。
1.2 试验方法
1.2.1 绿茶中紫外线吸收剂的提取及测定
将绿茶粉末置于40℃电热恒温鼓风干燥箱中烘干,称取绿茶粉末1.00 g,加入70%的乙醇溶液25 mL,超声温度50℃,超声提取30 min,超声波功率140 W。提取液趁热过滤后,用相应浓度的提取溶剂定容至50 mL,再用移液管吸取1.5 mL提取液,准确稀释到50 mL。用10 mm石英比色皿测定提取液在280 nm~400 nm区域的紫外吸收光谱。
1.2.2 保护型番茄红素的制备工艺流程
番茄红素→乙酸乙酯溶解→避光与3倍体积绿茶紫外线吸收剂混合→保护型番茄红素
1.2.3 单因素试验
在其他因素保持不变的情况下,以乙醇浓度、超声温度、超声时间和超声功率为试验因素,以保护型番茄红素紫外照射损失率为试验指标,分别做单因素试验,分析各因素对保护型番茄红素紫外照射损失率的影响。
1.2.4 正交试验
在单因素试验的基础上,选取L9(34)正交表(见表1)进行试验,考察乙醇浓度、超声温度、超声时间和超声功率对绿茶中紫外线吸收剂提取工艺的影响,优化提取条件。
1.2.5 番茄红素损失率的测定方法
以乙酸乙酯为参比溶液,在472 nm处测定出未经紫外照射番茄红素混合液的吸光度A0,照射30 min后的番茄红素吸光度A1。按以下公式计算出紫外照射后番茄红素的损失率:
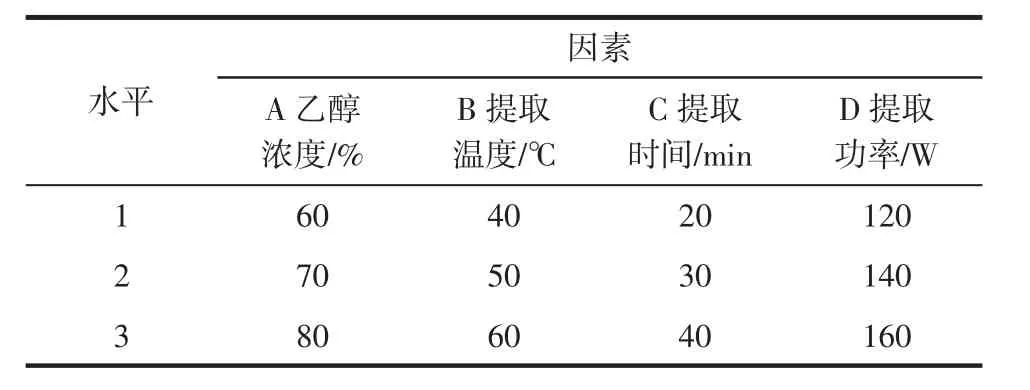
表1 绿茶中紫外线吸收剂提取正交试验因素与水平表Table 1 UV absorber in green tea extract orthogonal experimental factors and levels table
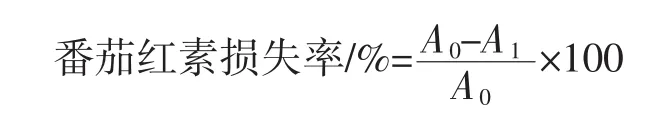
1.2.6 拉曼光谱仪分析番茄红素试验方法
采用法国HR800拉曼光谱仪,激光光源为Ar离子激光器,入射光波长为488 nm,光栅600,狭缝宽度300 μm,垂直孔径0.50,曝光时间60 s。选用olympus 50倍的放大镜头,在400 cm-1~4 000 cm-1范围内进行扫描。两次试验差为±0.1 cm-1,精度达0.01%。
2 结果与分析
2.1 绿茶中紫外线吸收剂吸收峰的测定
紫外可见分光光度计对绿茶提取液的检测结果见图1。

图1 绿茶提取液的紫外吸收光谱Fig.1 Ultraviolet absorption spectrum of green tea extract
由图1可知,绿茶中紫外线吸收剂在中长波紫外线280 nm~400 nm区域内有一最大吸收峰出现在320 nm处,此波长具有抗紫外线研究意义。
2.2 番茄红素和保护后番茄红素损失率的比较
试验将原番茄红素和复合绿茶中紫外线吸收剂的保护型番茄红素置于相同的紫外照射条件下(照射量、照射时间、照射距离均相同),番茄红素损失率比较如图2所示。
从图2可知,未经处理的原番茄红素在紫外灯下照射30 min后损失率达55.88%,而复合绿茶紫外线吸收剂的保护型番茄红素损失率为22.19%,复合处理后的番茄红素损失率明显降低。

图2 番茄红素和保护型番茄红素损失率对比图Fig.2 Loss rate of lycopene and the protection of lycopene comparison chart
2.3 单因素试验
2.3.1 乙醇浓度对保护型番茄红素紫外照射损失率的影响
在超声温度为50℃、超声波时间30 min、功率140 W及料液比1∶25(g/mL)的条件下,考察不同乙醇浓度对保护型番茄红素紫外照射损失率的影响,结果见图3。

图3 乙醇浓度对保护型番茄红素紫外照射损失率的影响Fig.3 Effect of ethanol concentration on the protection of lycopene loss rate of UV radiation
从图3分析可知,当超声温度、超声时间、超声功率和料液比相同时,随着提取剂乙醇浓度的不断增加,保护型番茄红素损失率逐渐减小。当提取剂乙醇浓度增到70%时,保护型番茄红素紫外照射损失率最小。乙醇浓度超过70%时,保护型番茄红素损失率有所增加。因此,提取剂乙醇浓度取70%为优。
2.3.2 超声温度对保护型番茄红素紫外照射损失率的影响
利用超声波提取绿茶中紫外线吸收剂,以70%乙醇为提取剂、超声30 min、功率140 W、料液比1∶25(g/mL),考察不同超声温度对保护型番茄红素紫外照射损失率的影响,结果见图4。
由图4可知,随着超声温度的升高,番茄红素紫外照射损失率呈先降低后升高的趋势。温度超过50℃时损失率升高,由于升高温度对绿茶中紫外线吸收剂产生了破坏,导致其保护番茄红素的能力降低。故本试验超声温度选择50℃。
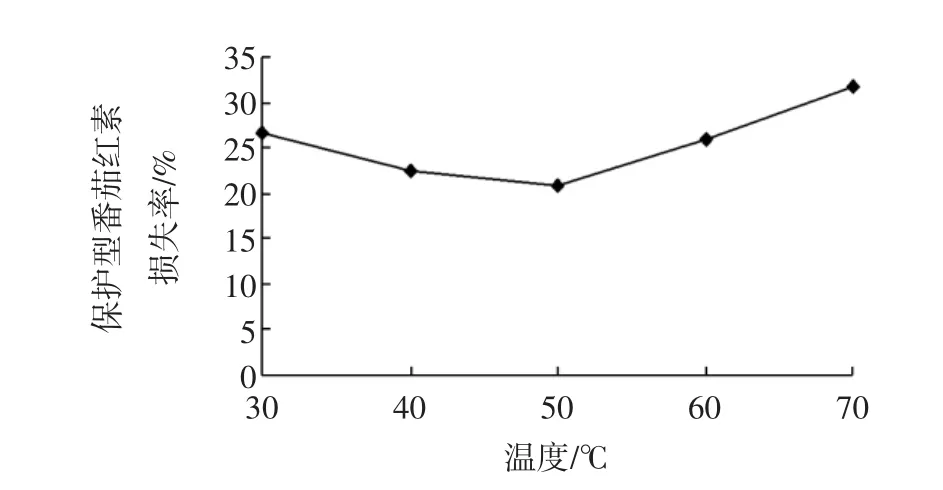
图4 超声温度对保护型番茄红素紫外照射损失率的影响Fig.4 Effect of ultrasound temperature on the lycopene loss rate of UV radiation
2.3.3 超声时间对保护型番茄红素紫外照射损失率的影响
在以70%乙醇为溶剂、超声温度50℃、超声功率140 W、料液比 1∶25(g/mL)的条件下,研究超声波提取时间对保护型番茄红素紫外照射损失率的影响,结果见图5。

图5 超声时间对保护型番茄红素紫外照射损失率的影响Fig.5 Impact of ultrasonic time on the protection of lycopene loss rate of UV radiation
通过图5可知,提取时间为30 min番茄红素紫外照射后损失率最小。30 min~50 min损失率有所升高但幅度平缓。过长的超声时间会使绿茶中的紫外线吸收剂发生降解,从而导致紫外照射后番茄红素损失率增加。
2.3.4 超声功率对保护型番茄红素紫外照射损失率的影响
在乙醇浓度为70%、提取温度50℃、超声时间30 min及料液比1∶25(g/mL)的条件下,考察超声功率对番茄红素紫外照射损失率的影响,结果见图6。
由图6可知,随着功率的增加,保护型番茄红素损失率逐渐减小,但当超声功率大于140 W时,保护型番茄红素的损失率随功率增加反而呈上升趋势,故此试验超声功率为140 W。

图6 超声功率对保护型番茄红素紫外照射损失率的影响Fig.6 Ultrasonic power to influence the protection of lycopene loss rate of UV radiation
2.4 采用正交试验优化绿茶中紫外线吸收剂的提取过程
采用超声波提取技术,以经紫外照射后保护型番茄红素损失率作为评价指标,进行L9(34)正交试验,结果见表2。
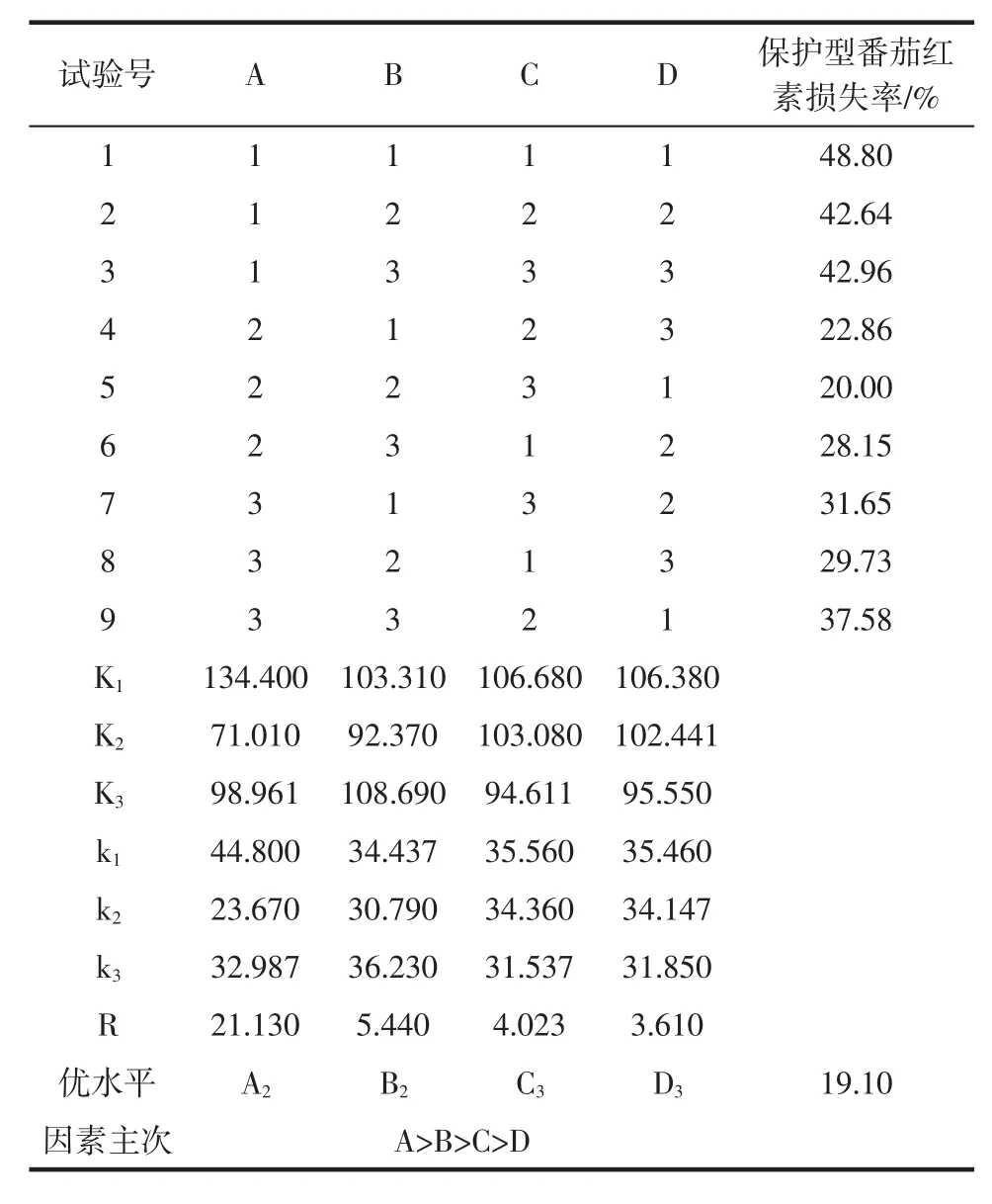
表2 L9(34)正交试验结果Table 2 The results of L9(34)orthogonal experiment
由表2极差分析可以得出,在不同的提取条件下,乙醇浓度(A)对番茄红素紫外照射损失率影响最大,超声温度(B)次之,最优组合为A2B2C3D3。经验证试验,即乙醇浓度70%、超声温度50℃、超声时间40 min、超声功率160 W条件下保护型番茄红素紫外照射损失率为19.10%。
2.5 拉曼光谱仪对番茄红素与保护型番茄红素分子结构的分析
拉曼光谱仪对番茄红素分子结构的分析结果见图7,对保护型番茄红素分子结构的分析结果见图8。

图7 番茄红素乙酸乙酯溶液的拉曼光谱Fig.7 Lycopene acetate solution Raman spectroscopy
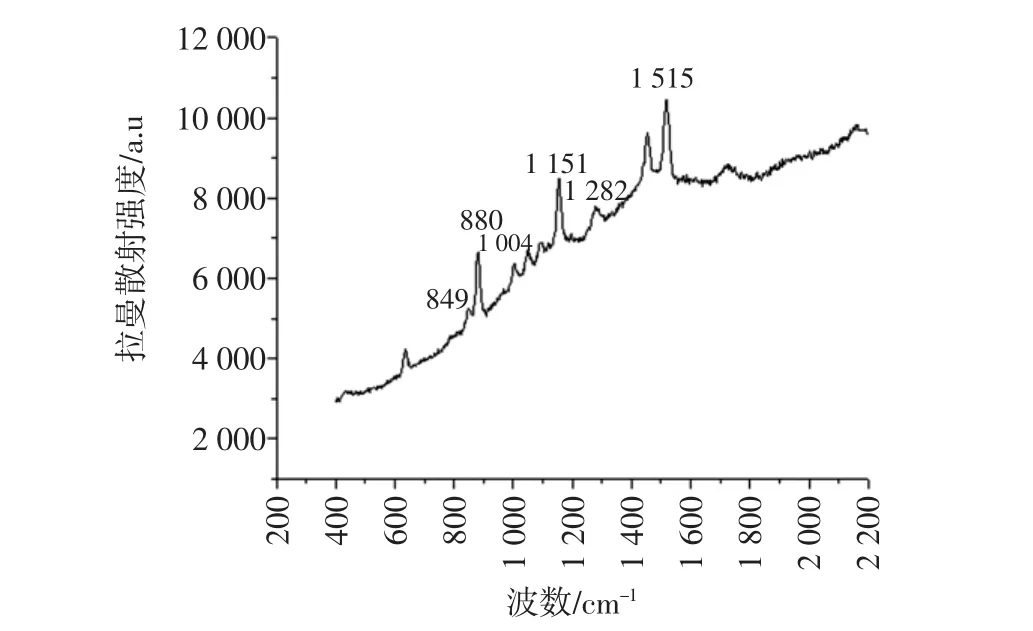
图8 保护型番茄红素乙酸乙酯溶液的拉曼光谱Fig.8 The protection of the protection of lycopene acetate solution Raman spectroscopy
如图7所示,番茄红素乙酸乙酯溶液拉曼特征峰出现的波数有 958、1 004、1 151、1 282、1 515 cm-1,与番茄红素拉曼光谱特征峰[25]出现的波数954、1 005、1 154、1 281、1 517 cm-1略有差异。这是因为波数958 cm-1的拉曼峰发生乙酸乙酯-CH3对称弯曲振动与番茄红素C-C 的相互作用。1 004、1 151、1 515 cm-1的拉曼峰是乙酸乙酯羰基伸缩振动与番茄红素-CH3甲基相互作用产生的,使拉曼散射强度增强。在波数1 282 cm-1出现的拉曼峰是乙酸乙酯-CH2亚甲基对称伸缩振动与番茄红素C-C相互作用产生的,分子振动频率较弱。保护型番茄红素乙酸乙酯溶液的拉曼光谱(如图8所示)与原番茄红素乙酸乙酯溶液的拉曼光谱特征峰相同。在拉曼波数 1 004、1 151、1 282、1 515 cm-1处依然有拉曼峰,而原在958 cm-1处的拉曼峰因加入了绿茶中的紫外线吸收剂,其中有效成分的分子基团与番茄红素基团或化学键发生相互作用,使番茄红素乙酸乙酯溶液的拉曼峰发生红移,波数降低振动强度增大。但是未对番茄红素拉曼光谱造成较大改变,故经绿茶中紫外线吸收剂复合的番茄红素的结构未有变化。绿茶中的紫外线吸收剂可以用作番茄红素的光保护剂。
3 结论
本试验所采用的超声波萃取技术是在常温、常压下进行,操作简单,省时高效。从结果看,提取剂浓度是影响紫外线吸收剂提取工艺的主要因素,适宜的浓度不仅能使紫外线吸收物质被充分的从原料中分离出来,还可以防止资源浪费。绿茶是我国常用饮品,绿茶的防癌抗癌、保健治病作用屡见报道,但绿茶防紫外线作用报道较少,仅陈晓明等[5]发现蒙山绿茶提取液在长波紫外线区域有较强吸收能力,可抵抗紫外线辐射并修复受损组织细胞。本试验研究发现,绿茶醇提物在360 nm~280 nm波长范围内都有较强的吸收峰,最高吸收峰的波长为320 nm。此吸收区域正处在长波紫外线UVA波段(400 nm~320 nm)和中波紫外线UVB波段(320 nm~290 nm)的大部分区域(被地球表面自然环境和动植物体所吸收的紫外光为UVA波段和部分UVB波段的紫外光),因此,可有效吸收此波段的紫外光,保护光敏物质。本文绿茶中紫外线吸收剂提取效果作用大小依次为:乙醇浓度、超声温度、超声时间、超声功率;最优提取条件:以70%浓度的乙醇作为提取剂,在超声温度50℃、超声功率160 W条件下超声40 min获得的提取物作为番茄红素光保护剂效果最佳,紫外光照射损失率仅为19.10%。
拉曼光谱技术是一种快速、无损、安全的检测技术,利用拉曼光谱技术选择适宜的激发光源,使被测样品的拉曼谱线强度大大增强,可使被测样品(番茄红素)的拉曼谱线从其它组分中分离出来,极大提高检测的精度和准确度。对所检测拉曼谱图,进行分峰拟合,通过检测数据分析其分子的伸缩振动、弯曲振动等作用变化,通过图谱的拉曼频移、拉曼峰峰高以及谱宽的变化,可分析影响其变化的原因。本文采用激发波长为488 nm的激光激发乙酸乙酯溶液中番茄红素,产生共振拉曼光谱,对番茄红素实现检测。保护型番茄红素乙酸乙酯溶液的拉曼光谱与原番茄红素乙酸乙酯溶液的拉曼光谱特征峰相同。拉曼波数1 004、1 151、1 282、1 515 cm-1处依然有拉曼峰,拉曼波数958 cm-1处的拉曼峰因绿茶紫外线吸收剂中有效成分的分子基团与番茄红素基团或化学键发生相互作用,使此拉曼峰发生红移,波数降低振动强度增大。因此,可知绿茶紫外线吸收剂对番茄红素拉曼光谱未造成较大改变,番茄红素结构未有变化,绿茶紫外线吸收剂对番茄红素具有紫外光保护作用。本研究可为提高紫外光照射条件下番茄红素稳定性提供参考依据,同时也可为其他光敏物质提高稳定性提供一定的参考。
[1] 赵熙,黄怀生,粟本文,等.不同茶树品种制绿茶贮藏过程中品质变化规律[J].茶叶通讯,2014(12):18-22
[2] 刘盼盼,邓余良,尹军峰,等.绿茶滋味量化及其与化学组分的相关性研究[J].中国食品学报,2014(12):173-181
[3] Fujiki H,Suganuma M,Imai K,et al.Green tea:cancer preventive beverage and/or drug[J].Cancer Letters,2002,18(1):9-13
[4] Cabrera C,Artacho R,Gimenez R,et al.Beneficial effects of green tea:a review[J].Journal of the American College of Nutrition,2006,25(2):79-99
[5] 陈晓明,任正隆,张怀渝,等.蒙山绿茶和老鹰茶的防紫外作用研究[J].辐射研究与辐射工艺学报,2005,23(5):278-282
[6] 张玉江,马李杰,杨水清,等.番茄红素对人肺癌H520细胞侵袭和迁移能力的影响[J].现代肿瘤医学,2016(1):885-888
[7]Han J,Ling Z Q.Anti-tumor activity and its mechaninsm of lycopene[J].J Int Oncol,2013,40(4):264-267
[8] Upaganlawar A,Gandhi H,Balaraman R.Effect of vitamin E alone and in combination with lycopene on biochemical and histopathological alterations in isoproterenol-induced myocardial infarction in rats[J].J Pharmacol Pharmacother,2010,1(1):24-31
[9] Bonvissuto G,Minutoli L,Morgia G,et al.Effect of Serenoa repens,lyocopene,and selenium on proinflammatory I(kappa)B-(alpha)phenotype activation:An in vitro and in vivo comparison study[J].Urology,2011,77(1):248-256
[10]朋汤义,郑书国.番茄红素对低密度脂蛋白氧化的影响[J].中国医药科学,2012,2(2):27-28,43
[11]春玉虎,党宏伟,闫业军.番茄红素对大鼠心脏缺血再灌注的保护作用及其机制研究[J].现代药物与临床,2014,29(9):974-979
[12]Lee MT,Chen BH.Stability of lycopene during heating and illumination in a model system[J].Food Chemistry,2002,78:425-432
[13]Calvo MM,Santa G.Effect of illumination andchlorophylls on stability of tomato carotenoids[J].Food Chemistry,2007,107:1365-1370
[14]赵建国,柳雪姣,肖春玲.圣女果番茄红素稳定性研究[J].陕西农林学,2010(3):82-85
[15]袁翠英,江发寿.微乳体系中番茄红素的稳定性研究[J].首都医药,2010(22):38-39
[16]胡琳琳.复合凝聚法制备番茄红素纳米胶囊[D].无锡:江南大学,2014
[17]欧春凤,叶盛英,张静,等.薄膜—均质法制备番茄红素脂质体的工艺研究[J].南方农业学报,2012,43(4):511-514
[18]时慧,敬思群,纵伟,等.均匀设计和正交设计法优化番茄红素微胶囊制备工艺[J].食品工业科技,2014(5):238-243
[19]王天晓.溶剂对番茄红素拉曼光谱影响的研究[D].长春:长春理工大学,2014
[20]申鹏飞,李硕,徐胜楠,等.溶液相变对β胡萝卜素分子构型变化特征能的影响[J].光谱学与光谱分析,2016,36(1):6-10
Effect of the Green Tea Alcohol Extraction on Protecting Anti Ultraviolet Radiation of the Lycopene
ZHAO Xiu-hong,REN Jian-jun,QI Bing-jie,GONG Xun,LIU Xiao-di
(College of Grain,Shenyang Normal University,Shenyang 110034,Liaoning,China)
Ultraviolet radiation(UV)could lead to lycopene degradation and oxidation.The ultrasonic extraction technology were used to extract the absorbers in green tea,the technology were also modified by L9(34)orthogonal experiment and observed the effect on structure of green tea extract on lycopene by Raman spectroscopy technique.The result of orthogonal test showed that when the alcohol concentration was 70%,ultrasonic temperature was 50℃,ultrasonic time continued 40 min,and the ultrasonic power was 160 W could make the loss of lycopene by ultraviolet declined into 19.10%.Raman spectroscopy showed that the original lycopene structure was not changed by green tea UV absorbers and complex of lycopene,and lycopene could be light protective agents to improve the stability of lycopene.
green tea;UV absorbers;lycopene;orthogonal experiment;Raman spectroscopy
10.3969/j.issn.1005-6521.2017.22.005
辽宁省高等学校优秀人才支持计划(LJQ2013113);辽宁省自然科学基金项目(20170540822)
赵秀红(1976—),女(汉),副教授,博士,研究方向:活性物质的提取及功能研究。
2016-11-14
